梅香鱼发酵菌株的筛选及对品质的影响
朱雯娟,安俊莹,张雪梅,刘 颖*,孙力军,王雅玲,刘唤明
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东 湛江 524088)
摘 要:为有效控制产品的品质,从自然发酵的梅香鱼中分离筛选适合作为发酵剂的菌株,并研究不同菌种之间的配比对发酵产品品质的影响。结果表明,筛选出的嗜盐四联球菌(Tetragenococcus halophilus)、木糖葡萄球菌(Staphylococcus xylosus)及腐生葡萄球菌(Staphylococcus saprophyticus)符合发酵要求。与单菌株发酵及未接菌的对照组相比,3株菌制得的混合发酵剂(比例为1∶1∶1)制备的发酵鱼感官上总体可接受程度最优,其咀嚼性和弹性也最高,并且组胺和挥发性盐基氮(total volatile basic nitrogen,TVB-N)的产生得到了有效抑制。该研究可为实现定向接种、人工控制以及规模化工业生产提供参考。
关键词:梅香鱼;发酵;菌株筛选;品质
发酵鱼是一种具有独特的风味与口感以及良好耐贮性的传统发酵食品,受到中国、日本、朝鲜等亚洲人民的喜爱。由于乳酸菌、微球菌、霉菌、酵母菌等微生物在发酵过程中产生的醛类、酮类、烯烃类等芳香代谢物质
[1-3],赋予了发酵食品特殊的风味与色泽
[4-5],甚至有的微生物还可以产生有机酸、细菌素及过氧化氢等抑菌物质,从而抑制了食品腐败菌和致病菌的产生
[6-9]。不同类型的微生物发酵产品具有各自的特点,Gelman等
[10]利用戊糖片球菌(Pediococcus pentosaceus)、肠膜明串珠菌(Leuconostoc mesenteroides)和植物乳杆菌(Lactobacillus plantarum)进行混合发酵,发酵的腌鲔鱼不仅表现出多汁的质构风味,而且腐败菌的生长得到了很好抑制,有效地延长了货架期。Riebory等
[11]用植物乳杆菌(Lactobacillus plantarum)、乳酸片球菌(Pediococcus acidilactici)和葡萄球菌BT52(Staphylococcus BT52)在30 ℃条件下混合发酵黄笛鲷,不仅缩短了生产周期,而且增加了鱼肉的弹性、咀嚼性,明显改善了鱼的质构和口感。用于接种发酵的微生物通常是从传统发酵产品中分离优势微生物这一策略获得的
[12-13]。梅香鱼(又名酶香鱼)是广东、福建等气温较高地区的一种盐渍自然发酵制品,由于在盐渍过程中利用鱼体内源酶类的自溶作用以及微生物的发酵作用,产生复杂的生物化学反应,最终形成特殊的梅香气味而得名
[14-15]。本研究从自然发酵的梅香鱼中筛选分离出适合作为发酵剂的微生物,继而研究不同菌种之 间的配比对发酵产品的影响。为实现定向接种、人工控制以及规模化工业生产提供参考。
1 材料与方法
1.1 材料与试剂
梅香鱼,购于广东省湛江市东风市场。
MRS固体培养基 英国Oxoid公司;GAM(gifu anaerobic medium)固体培养基、GAM半流动培养基、GAM液体培养基 日本日水制药株式会社;TSA(trypticase soy agar)固体培养基 美国BD公司;组胺试剂盒 日本Kikkoman公司。
1.2 仪器与设备
HORIBA B-211小巧型pH计、HORIBA B-721盐度计日本Horiba公司;RE2-33005S流变仪 日本Yamaden公司;AquaLab Series 3高精确度台式水分活度测定仪 美国AquaLab公司;IUL Masticator均质器 西班牙IUL公司。
1.3 方法
1.3.1 菌种的分离纯化
无菌称取25 g梅香鱼装入均质袋中,加入225 mL无菌生理盐水,高速均质30 s,过滤取上清液,采用平板涂布法,分别接种于MRS、GAM和TSA培养基中,30 ℃条件下培养48~72 h。挑取形态特征不同的菌落,反复纯化,并通过革兰氏染色、显微镜观察直至得到纯的培养物。将革兰氏阳性菌株接种到GAM斜面培养基培养48 h,置4 ℃条件下保存备用。
1.3.2 发酵菌株的确定
通常适合作发酵的菌株应满足不产生生物胺、过氧化氢酶实验呈阳性、发酵葡萄糖产酸但不产气、耐盐,并具有良好的抗菌活性
[16-17]。抗菌活性采用纸片扩散法
[18],其他指标测定采用《常见细菌系统鉴定手册》
[19]方法。
1.3.3 发酵菌株的16S rDNA鉴定
采用27 F与1492 R细菌通用引物作为正反向引物,利用MightyAmp DNA Polymerase进行细菌菌落聚合酶链式反应(polymerase chain reaction,PCR)扩增
[20],反应体系:Eubac 27 F(10 μmol/L)1.5 μL,Eubac 1492 R(10 μmol/L) 1.5 μL,MightyAmp DNA Polymerase 1.5 μL,2×MightyAmp Buffer 30 μL,ddH
2O 25.5 μL;反应条件:98 ℃(预变性)2 min,98 ℃(变性)10 s,55 ℃(复性)15 s,68 ℃(延伸)90 s,72 ℃(延伸)10 min,从变性到第一次延伸这个过程循环40 次。将PCR扩增产物寄送上海英骏生物技术有限公司广州实验室进行序列测定。根据16S rDNA测序结果,利用DDBJBLAST搜 索程序从GenBank进行同源性检索,并下载相似性高的模式菌株的16S rDNA基因序列进行分析。
1.3.4 发酵菌株在不同温度下的生长曲线测定
将发酵菌株分别接种于GAM液体培养基中,并分别在10、20、30 ℃温度条件下进行培养,每隔4 h测定OD
600
nm,直至达到微生物生长稳定期,记录不同温度下所需要的时间,选取适合发酵的温度和时间。
1.3.5 接种发酵实验
选取表面光泽、新鲜、体质量约120 g的沙丁鱼25 条,去腮、去内脏,用清水洗净表面和内部血污,沥干水分。按m(鱼)∶m(盐)=5∶1的比例添加食盐,均匀涂布于鱼体的表面和鱼肚内部,并平整堆叠在合适容器中,保鲜膜封口,10 ℃条件下腌制,过夜取出。将25 条鱼随机分成5 组,将适合发酵的菌株各自配制成10
7CFU/mL菌悬液进行单独接种,同时等比例混合发酵菌株后进行接种,以不接菌作空白对照。接种量2%,并采用喷洒方式接入到腌制的鱼体中进行发酵,发酵温度与时间按1.3.4节确定的温度与时间。
1.3.6 发酵鱼感官评定
挑选10 位有食品感官评定经验的评定者,对自然发酵的和人工接种发酵剂的发酵鱼制品的外观、气味、滋味、口感进行评定,满分为10 分,各因素的权重按层次分析法确定
[21],评价标准见表1。
表1 感官评价标准
Table 1 Criteria for sensory evaluation of Meixiang fish

指标(权重) 1~3 分 4~5 分 6~7 分 8~10 分外观(6.0%)色泽 褐变严重、无光泽 轻微褐变、无光泽 无褐变、略有光泽 无褐变、光泽好质地 鱼肉组织不完整、糜烂鱼肉组织略不完整、较软烂鱼肉组织较完整、结实鱼肉组织非常完整、结实气味(25.6%)腥臭 腥臭很重 腥臭较重 稍有腥臭 腥臭不明显异臭 腐败、哈败气味很重腐败、哈败气味较重有轻微腐败、哈败气味无腐败、哈败气味滋味(38.6%)无腐败、哈败气味咸味 咸味很淡或很重 咸味较淡或较重 咸味较适宜 咸味适宜口感(29.8%)滋味 完全无黄鱼滋味 鱼滋味较寡淡 鱼滋味较丰富 鱼滋味丰富腥味 腥味很重 腥味较重 稍有腥味 腥味不明显异味 腐败、哈败滋味很重腐败、哈败滋味较重有轻微腐败、哈败滋味鱼肉糜烂、咀嚼性很差、纤维性很差鱼肉较软烂、咀嚼性较差、纤维性较差鱼肉较结实、咀嚼性较好、纤维性较好鱼肉结实、咀嚼性好、纤维性好
1.3.7 理化指标测定
发酵后的鱼用绞肉机绞碎,称取一定量用于理 化指标测定。水分活度:ERH水分活度测试法;pH值:pH计法;盐度:盐度计法;组胺:按照组胺试剂盒中操作说明进行检测;亚硝酸盐:采用美国化学师协会的比色法
[22];挥发性盐基氮:采用GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》
[23]中的微量扩散法。
1.3.8 质构测定
采用装有一个圆柱形柱塞(5 mm直径)的流变仪测定发酵沙丁鱼的物理强度。取主骨附近的鱼肉,剪取约10 mm×10 mm×10 mm的正方体鱼肉,柱塞以鱼肉中心为轴,以1 mm/s的速率平行插入鱼肉中。测定鱼肉发生形变时的距离和力度。每一样品测试3次,取测量的平均值进行数据分析。
1.3.9 大肠菌群及致病菌的检测
大肠菌群的测定采用GB/T 4789.3—2010《食品微生物学检验 大肠菌群计数》
[24]方法。
沙门氏菌、副溶血性弧菌、金黄色葡萄球菌检测根据GB 29921—2013《食品中致病菌限量》
[25]中水产制品致病菌检测方法进行检验。
2 结果与分析
2.1 菌种的分离纯化及发酵菌株的鉴定
采用MRS、GAM和TSA培养基从梅香鱼中分离纯化得到158 株菌,其中G
+菌株95株。进一步发酵菌株筛选实验,符合过氧化氢酶阳性、发酵葡萄糖产酸不产气、可耐受20% NaCl、不产生组胺、且对大肠杆菌(Escherichia coli)和金黄色葡萄 球菌(Staphylococcus aureus)有明显抑制作用的菌株共3 株(菌株1~3),菌株1在MRS培养基的菌落湿润黏稠、易挑取、表面光滑呈较透明的白色、质地均匀,且边缘与中央部位颜色一致;菌株2的菌落不透明、呈白色、扁形、表面较湿润、菌落边缘光滑;菌株3圆形凸起、边缘整齐、表面光滑、湿润、不透明。显微观察3 株菌均为球状,排列成对、四联或成片。
对3 株菌株进行16S rDNA测序,经Blast在线比对得知,菌株1与嗜盐四联球菌(Tetragenococcus halophilus)相似度高达99%,菌株2与木糖葡萄球菌(Staphylococcus xylosus)有96%的相似度,疑似潜在新种。菌株3与腐生葡萄球菌(Staphylococcus saprophyticus)有99%的相似。将序列提交至NCBI,编号分别是Tetragenococcus halophilus strain CAMT 20661,登录号是KP 845287,Staphylococcus xylosus strain CAMT 29661,登录号是KP 845286,Staphylococcus saprophyticus strain CAMT 29662,登录号是KP 845285。
2.2 3 株菌在不同发酵温度条件下的生长规律

图1 3 株菌在不同温度下的生长曲线
Fig.1 Growth curves of three selected bacteria at different temperatures
a. 嗜盐四联球菌;b. 木糖葡萄球菌;c. 腐生葡萄球菌。
3 株菌在10、20、30 ℃的生长曲线见图1。嗜盐四联球菌在10 ℃培养时,8 h后进入对数生长期,84 h后进入稳定期,在20和30 ℃条件下均在4 h后进入对数生长期,20 ℃时在44 h后进入稳定期,30 ℃时在40 h后达到稳定期,见图1a;木糖葡萄球菌在10 ℃时进入对数生长期的时间8 h,84 h后达到稳定期,20 ℃和30 ℃时均在4 h后进入对数生长期,40 h后进入稳定期,见图1b;腐生葡萄球菌在10、20、30 ℃下进入对数生长期的时间依次是8、4、4 h,达到稳定期的时间依次是88、40、36 h,见图1c。3 株菌在20 ℃与30 ℃培养条件下进行入稳定期的时间差异不大,最大差仅8 h,但在10 ℃时进入稳定期却比20、30 ℃的时候至少推迟了 40 h。一般温度高发酵菌株生长快,生产周期短,但温度高不利于风味的保留,低温虽然能很好地保留风味,但是发酵周期长
[26],所以综合考虑,选择20 ℃为最佳发酵温度,44 h为最佳发酵时间。
2.3 感官特性评价
对不同实验组发酵鱼的外观、气味、滋味和口感4 个指标进行感官评价,结果见图2。从雷达图中可以看出,5 组发酵鱼制品外观无显著性差异,均为8 分;气味方面,混合发酵剂实验组9 分,明显高于其他实验组,空白对照组的气味评分最低(5 分);滋味和口感指标方面,混合发酵剂实验组的鱼制品均优于其他实验组。综合结果,混合发酵剂发酵鱼制品具有较高的总体可接受性(8.94 分),嗜盐四联球菌发酵的鱼制品次之(7.06 分),木糖葡萄球菌和腐生葡萄球菌发酵的鱼制品差别不大,分别为6.67 分和6.38 分,空白对照组发酵鱼制品最低(4.79 分)。
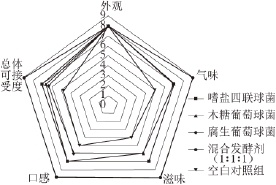
图2 5 种发酵鱼制品感官评价得分雷达图
Fig.2 Radar map of four fermented fish samples and unfermented fish
2.4 理化特性评价
5 组实验发酵鱼盐分、TVB-N、组胺和亚硝酸盐等主要成分含量的测定结果见表2。单菌株和混合菌株发酵的鱼制品的pH值均比空白对照组的低,说明这3株菌均具有一定的产酸能力;亚硝酸盐在 5 组实验发酵鱼中均未检测出;混合发酵剂实验组和单菌株发酵实验组的组胺与TVB-N含量相差不大,但均明显低于空白对照组组胺(2.48 mg/kg)和TVB-N含量(46.8 mg/100 g),说明这3株菌在发酵过程可能产生了有机酸等抑菌物质,从而有效地抑制了腐败菌的产生,阻碍了组胺与TVB-N的产生。且混合菌株发酵的鱼制品中的组胺含量(0.19 mg/kg)和TVB-N含量(20.8 mg/100 g)远低于GB 2733—2005《鲜、冻动物性水产品卫生标准》中的规定(组胺含量≤30 mg/100 g;TVB-N含量≤30 mg/100 g)。
表2 发酵鱼制品pH值、水分活度及主要成分含量
Table 2 pH, water activity and major components in fermented fish products
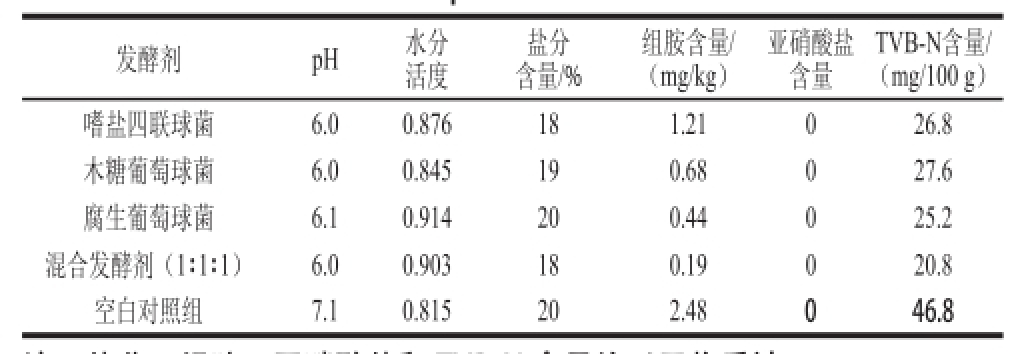
注:盐分、组胺、亚硝酸盐和TVB-N含量均以干物质计。
发酵剂 pH 水分活度盐分含量/%组胺含量/(mg/kg)亚硝酸盐含量TVB-N含量/(mg/100 g)嗜盐四联球菌 6.0 0.876 18 1.21 0 26.8木糖葡萄球菌 6.0 0.845 19 0.68 0 27.6腐生葡萄球菌 6.1 0.914 20 0.44 0 25.2混合发酵剂(1∶1∶1) 6.0 0.903 18 0.19 0 20.8空白对照组 7.1 0.815 20 2.48 0 46.8
2.5 质构分析
表3 不同发酵剂制得的发酵鱼制品质构分析结果
Table 3 Textural analysis of fermented fish products

发酵剂 弹性率/(N/m
2) 破断荷重/N破断变形/mm嗜盐四联球菌 147 191.5 2.34 4.65木糖葡萄球菌 139 264.2 2.25 4.15腐生葡萄球菌 137 302.8 2.19 4.05混合发酵剂(1∶1∶1) 194 278.5 2.81 6.00空白对照组 97 968.1 1.34 1.80
发酵鱼制品质构结果见表3。经分析发现,4 组接种菌株发酵鱼的鱼肉之间的破断荷重差异均不大,但都高于空白对照组(1.34 N),表明通过3 株菌的发酵以及混合菌的发酵可以提高鱼肉的硬度,使鱼肉更加紧实,而且混合发酵剂实验组的鱼肉的破断荷重(2.81 N)高于其他3组单菌株发酵实验组,说明混合发酵增加鱼肉硬度的效果优于3 株菌分别发酵。从破断变形和弹性率可以看出,混合发酵实验组的鱼制品的破断变形(6.00 mm)与弹性率(194 278.5 N/m
2)最大,而单菌株发酵的3 个实验组的破断变形和弹性率相差不大,但也远大于空白对照组。因此,接种了3 株菌的鱼肉具有一定的弹性与咀嚼性,但混合发酵剂比单菌株发酵剂改善鱼肉的弹性有更好的效果。综合各方面因素,混合发酵剂不仅能增强鱼肉的硬度,且改善了鱼肉的弹性,使其更富有咀嚼性。
2.6 大肠菌群与致病菌检测结果
在食品安全各项指标中,大肠菌群是评价食品是否被污染的一个重要指标。根据标准GB 2726—2005《熟肉制品卫生标准》
[27]的微生物指标中规定,肉制品的大肠菌群≤150 MPN/100 g。而这5 组发酵鱼的大肠菌群数量<3 MPN/100 g,均低于标准。
沙门氏菌、副溶血性弧菌和金黄色葡萄球菌是水产制品中主要的致病菌,根据GB 29921—2013《食品中致病菌限量》中水产制品总致病菌限量规定,沙门氏菌不可检出,副溶血性弧菌≤100 MPN/g,金黄色葡萄球菌≤100 CFU/g。而5 组发酵鱼制品中这3 种致病 菌均没有检测出,由此可见,从卫生指标角度看,5 组发酵鱼制品均是安全食品。
3 结 论
葡萄球菌和微球菌是传统发酵食品中重要微生物类群,本研究从传统自然发酵的梅香鱼中分离到嗜盐四联球菌、木糖葡萄球菌及腐生葡萄球菌3株适合发酵的菌株。其中嗜盐四联球菌属乳酸菌
[28],美国食品药品管理局认为大多数乳酸菌是安全的,由于其具有较强的抗菌活性,能抑制食品中的腐败菌和病原菌,因此常被用于食品加工中,提高产品的保藏性及改善风味等
[29]。罗立新等
[30]曾从发酵酱油中分离出嗜盐四联球菌,发现其具有较高的产酸能力,不仅具有一定的抑菌能力,而且也增加了酱油的风味。木糖葡萄球菌和腐生葡萄球菌对发酵食品中的风味物质的含量有明显影响,王萧等
[31]曾研究过木糖葡萄球菌对发酵香肠挥发性风味化合物的影响,发现木糖葡萄球菌处理的香肠中酯类和醇类含量较高,这些物质对发酵香肠风味的形成起到了重要作用。李想等
[32]对发酵里脊猪肉的研究发现接种腐生葡萄球菌处理组游离脂肪酸含量显著增加,且各个发酵阶段的直链醛和酮的含量均显著高于对照处理组。李宗军
[33]在中国传统发酵肉中分离得到木糖葡萄球菌和腐生葡萄球菌,经毒性实验表明其安全无毒,无致病性,可以作为肉类发酵剂的微生物资源。
本研究以嗜盐四联球菌、木糖葡萄球菌和腐生葡萄球菌这3株菌为发酵剂对沙丁鱼分别进行单菌株发酵和混合菌株发酵,对发酵过后的沙丁鱼进行了感官、理化指标的评价,从研究结果可知,3 株菌单菌株发酵时均可以改善鱼制品的风味和品质,尤其是在鱼制品的风味方面,3 株菌均不同程度地增加了鱼肉的风味和香气,且明显优于未接种发酵的鱼制品,而混合菌株发酵的鱼制品的品质更优于单菌株发酵,不仅感官总体可接受程度最高,改善了鱼肉的弹性,增加了咀嚼性,而且有效地抑制了腐败菌的生长,延缓了鱼制品的腐败。所以,既考虑发酵鱼的各项理化及微生物指标符合标准规定,又考虑发酵鱼的风味特性,从而确定使用混合发酵剂(1∶1∶1)进行发酵,能更好地改善鱼制品的品质。
参考文献:
[1] CRISAN E V, SANDS A. Microflora of four fermented fish sauces[J]. Applied Microbiology, 1975, 29(1): 106-108.
[2] FUKAMI K, FUNATSU Y, KAWASAKI K, et al. Improvement of fish-sauce odor by treatment with bacteria isolated from the fishsauce mush (moromi) made from Frigate Mackerel[J]. Journal of Food Science, 2004, 69(2): 45-49.
[3] WU Y C, KIMURA B, TATEO F. Comparison of three culture methods for the differentiation of Micrococcus and Staphylococcus in fermented squid shiokara[J]. Fisheries Science, 2000, 66(1): 142-146.
[4] ORDÓÑEZ J A, HIERRO E M, BRUNA J M, et al. Changes in the components of dry-fermented sausages during ripening[J]. Critical Reviews in Food Science and Nutrition, 1999, 39(4): 329-367.
[5] MATEO J, ZUMALACÁRREGUI J. Volatile compounds in chorizo and their changes during ripening[J]. Meat Science, 1996, 44(4): 255-273.
[6] 王磊, 刘学军. 草鱼肉发酵香肠的发酵工艺研究[J ]. 食品工业科技,2011, 32(2): 174-177.
[7] 杨华, 张亚杰, 张浩. 鲶鱼发酵香肠的研制[J]. 肉类工业, 2010(3):25-28.
[8] SABIA C, de NIEDERHÄUSERN S, MESSI P, et al. Bacteriocinproducing Enterococcus casseliflavus IM 416K1, a natural antagonist for control of Listeria monocytogenes in Italian sausages (cacciatore)[J]. International Journal of Food Microbiology, 2003, 87(1/2): 173-179.
[9] AYMERICH M T, GARRIGA M, MONFORT J M, et al. Bacteriocinproducing lactobacilli in Spanish-style fermented sausages:characterization of bacteriocinsa[J]. Food Microbiology, 2000, 17(1):33-45.
[10] GELMAN A, DRABKIN V, GLATMAN L. Evaluation of lactic acid bacteria, isolated from lightly preserved fi sh products, as starter cultures for new fi sh-based food products[J]. Innovative Food Science & Emerging Technologies, 2000, 1(3): 219-226.
[11] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al. Effect of iced storage of bigeye snapper (Priacanthus tayenus) on the chemical composition, properties and acceptability of Som-fug, a fermented Thai fi sh mince[J]. Food Chemistry, 2007, 102(1): 270-280.
[12] 张巧云. 豆酱中微生物多样性及人工接种多菌种发酵豆酱的研究[D].哈尔滨: 东北农业大学, 2013.
[13] 帅瑾. 传统自然发酵四川香肠中乳酸菌的分离、鉴定及其应用[D].雅安: 四川农业大学, 2013.
[14] 沈月新. 水产食品学[M]. 北京: 中国农业出版社, 2001: 205-213.
[15] 彭增起, 刘承初, 邓尚贵. 水产食品加工学[M]. 北京: 中国轻工业出版社, 2010: 196.
[16] 蔡鲁峰, 邓高毅, 黄亚芳, 等. 肉品发酵剂及肉品发酵技术优化的研究现状[J]. 食品与发酵工业, 2014, 40(9): 134-138.
[17] 潘明, 王世宽, 谢仁有, 等. 羊肉发酵香肠中发酵剂最佳发酵条件的探索[J]. 食品工业, 2013, 34(4): 29-31.
[18] 谭瑶, 赵清, 舒为群, 等. K-B纸片扩散法药敏试验[J]. 检验医学与临床, 2010, 7(20): 2290-2291.
[19] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社,2001: 370-398.
[20] LU Qingfang, HU Hanqiao, MO Junjie, et al. Enhanced amplifi cation of bacterial and fungal DNA using a new type of DNA polymerase[J]. Australasian Plant Pathology, 2012, 41(6): 661-663.
[21] 郭爱明, 郭耀邦. 层次分析法(AHP)确定食品质量指标权重[J]. 食品科学, 1994, 15(7): 6-10.
[22] Association of Offi cial Analytical Chemists. AOAC Offi cial Method 973.31 Nitrites in Cured Meat[S]. AOAC INTERNATIONAL, 2000.
[23] 上海市食品卫生监督检验所. GB/T 5009.44—2003 肉与肉制品卫生标准的分析方法[S]. 北京: 中国标准出版社, 2003.
[24] 中国疾病预防控制中心营养与食品安全所. GB 4789.3—2010食品微生物学检验 大肠菌群计数[S]. 北京: 中国标准出版社, 2010.
[25] 中华人民共和国国家卫生和计划生育委员会. GB 29921—2013食品中致病菌限量[S]. 北京: 中国标准出版社, 2013.
[26] GELMAN A, DRABKIN V, GLATMAN L. Evaluation of lactic acid bacteria, isolated from lightly reserved fi sh products, as starter cultures for new fish-based food products[J]. Innovative Food Science & Emerging Technologies, 2000, 1(3): 219-226.
[27] 江苏省疾病预防控制中心, 上海市卫生监督所, 黑龙江省食品卫生监督检验所, 等. GB 2726—2005 熟肉制品卫生标准[S]. 北京: 中国标准出版社, 2005.
[28] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 51-52.
[29] CALO-MATA P, ARLINDO S, BOEHME K, et al. Current applications and future trends of lactic acid bacteria and their bacteriocins for the biopreservation of aquatic food products[J]. Food and Bioprocess Technology, 2008, 1(1): 43-63.
[30] 罗立新, 吕莉, 潘力, 等. 中国酱油发酵酱醪中嗜盐四联球菌的鉴定[J].华南理工大学学报: 自然科学版, 2006, 34(12): 20-24.
[31] 王萧, 袁星露, 许慧卿, 等. 木糖葡萄球菌对发酵香肠挥发性风味化合物的影响[J]. 科技创新导报, 2011(3): 208.
[32] 李想, 邓锋, 秦春君, 等. 腐生葡萄球菌CGMCC3475对发酵里脊猪肉脂质分解氧化及风味特性的影响[J]. 食品与发酵工业, 2011,37(1): 152-157.
[33] 李宗军. 中国传统酸肉中葡萄球菌的分离鉴定与应用研究[J]. 生物技术通报, 2006(3): 77-79.
Selection of Starter Culture from Traditional Fermented Meixiang Fish and Its Effect on Quality
ZHU Wenjuan, AN Junying, ZHANG Xuemei, LIU Ying*, SUN Lijun, WANG Yaling, LIU Huanming
(Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution, Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, College of Food Science and Technology, Guangdong Ocean University,Zhanjiang 524088, China)
Abstract:Bacterial strains from naturally fermented Meixiang fish, a traditional Chinese fish product, were isolated and screened for their suitability to produce Meixiang fish as starter culture. Meanwhile, the influence of three selected strains inoculated singly or in combination (1:1:1) on the quality of fermented fish. The results showed that Tetragenococcus halophilus, Staphylococcus xylosus and Staphylococcus saprophyticus, all of which can meet the requirements for fish fermentation, were separated from the naturally fermented fish. Compared to those fermented and not fermented with each of the three strains, the fermented fish produced with their combination had the highest overall sensory acceptability and the best chewiness and elasticity, and inhibited the generation of histamine and total volatile basic nitrogen (TVB-N). This study can provide reference for targeted inoculation, manual control and large-scale industrial production of Meixiang fish.
Key words:Meixiang fish; fermentation; selection; quality
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2015)23-0162-05
doi:10.7506/spkx1002-6630-201523030
收稿日期:2015-01-25
基金项目:国家自然科学基金面上项目(31171734);广东省科技计划项目(2014A020217018);广东海洋大学创新强校工程科研项目(GDOU2013050205;GDOU20014050203)
作者简介:朱雯娟(1989—),女,硕士研究生,研究方向为水产品加工及贮藏工程。E-mail:kakarora@qq.com
*通信作者:刘颖(1966—),女,教授,博士,研究方向为食品质量与安全。E-mail:liuyingxk@sina.com





