我国葡萄酒中布鲁塞尔酒香酵母的检测和鉴定
曹培鑫
1,马 涛
1,杨凯迪
1,刘延琳
1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
摘 要:为快速且准确地检测葡萄酒中布鲁塞尔酒香酵母的存在情况,本研究比较了酒香酵母鉴别培养基(Dekkera bruxellensis differential medium,DBDM)和WLN(wallersteins laboratory nurtrient)培养基分离检测布鲁塞尔酒香酵母的效果,并利用特异聚合酶链式反应(polymerase chain reaction,PCR)扩增法对上述 两种培养基的分离检测效果作了进一步验证。结果表明,上述两种培养基均能对葡萄酒中的布鲁塞尔酒香酵母进行分离鉴别,而DBDM培养基较少出现假阳性菌落,具有更好的选择性,结合特异PCR扩增可准确鉴定布鲁塞尔酒香酵母。此外,利用DBDM培养基结合特异PCR扩增法对国内5 个主要葡萄酒产区的酒样进行布鲁塞尔酒香酵母感染情况的调查发现,河北、山东和吉林的葡萄酒中存在布鲁塞尔酒香酵母感染的情况,尤其是在橡木桶中陈酿的葡萄酒。因此,国内葡萄酒行业应对酒香酵母感染问题足够重视。
关键词:葡萄酒;布鲁塞尔酒香酵母;鉴别培养基;检测鉴定
酒香酵母属(Brettanomyces/Dekkera)于1904年被首次提出,最先是在啤酒中发现的,后来不断在葡萄酒中发现。目前公认的分类中,酒香酵母属有以下5 个种:Brettanomyces custersianus、Brettanomyces naardenensis、Brettanomyces nanus、Dekkera anomalus以及Dekkera bruxellensis。关于酒香酵母属的名称,经常会有Brettanomyces和Dekkera两种方法表示,最新的分类命名法对Dekkera anomalu和Dekkera b ruxellensis两种能够产生孢子的酒香酵母用Dekkera表示,其他3 种不能产生孢子的用Brettanomyces表示
[1]。由于其分类命名的变更,很多报道中依然采用了Brettanomyces的形式。本实验全部采用最新的命名方式,即以Dekkera bruxellensis来表示布鲁塞尔酒香酵母。
Dekkera bruxellensis是葡萄酒中最常发现 的酒香酵母,存在于葡萄和葡萄酒、酿酒设备以及橡木桶中。其会利用葡萄酒中固有的对羟基肉桂酸,如阿魏酸和对香豆酸等,在羟基肉桂酸脱羧酶作用下产生4-乙烯基苯酚和4-乙烯基愈创木酚,进一步在乙烯基还原酶的作用下转化为4-乙基苯酚和4-乙基愈创木酚等对葡萄酒风味影响极大的代谢产物
[2-3]。目前在世界各地的葡萄酒产区中都分离检测到Dekkera bruxellensis的存在
[4-10]。酒香酵母在葡萄酒中存在时,合适的 条件下会给葡萄酒带来烟熏、香料以及动物香 等香气,增加葡萄酒香气的复杂性,然而如果任由其在葡萄酒中存在不加处理,其产生的过高浓度的4-乙基苯酚和4-乙基愈创木酚会带来创可贴、鼠 尿、马汗等不良风味,使葡萄酒的质量受到影响,引起消费者的抗拒,从而造成酒厂的经济损失
[11-12]。酒香酵母相对 于酿酒酵母对SO
2以及酒精的耐受性更强,通常的葡萄酒处理手段很难完全将其除去,因此,对葡萄酒中酒香酵母的检测极为重要。目前对葡萄酒中Dekkera bruxellensis的检测,传统方法是利用鉴别培养基分离检测,常用的鉴别培养基是添加放线菌酮的WLN(wallersteins laboratory nurtrient)培养基
[7]和DBDM(Dekkera bruxellensis differential medium)培养基
[13]。Dekkera bruxellensis在葡萄酒中有时会呈现一种存活但不可培养的状态(viable but not culturable,VBNC)
[14-16],在此状态下其生理代谢仍会进行,但处于一种不生长繁殖的状态,直接涂布平板其不能生长,出现假阴性的检测结果,因此,在涂布平板检测时需要对酒样进行预处理,使其脱离VBNC状态。形态观察并不能够准确鉴定,需要结合其他手段进行鉴定。因此,对酒香酵母的分子鉴定和检测技术也有越来越多的研究,包括早期的26S rRNA基因D1~D2区测序
[17],对5.8S-ITS-18S区的聚合酶链式反应-限制性片段长度多态性(polymerase chain reactionrestriction fragment length polymorphism,PCR-RFLP)分析
[18],这两种方法需要对扩增片段进行测序或者酶切分析,操作相对复杂且用时较长,而针对Dekkera bruxellensis设计的特异性PCR扩增鉴定
[4,19-20]可以较快地完成鉴定。另外还有荧光原位交技术
[21]、巢式PCR
[10]以及实时定量PCR
[5,7,22]等技术也逐渐用于对Dekkera bruxellensis的检测和鉴定,但对设备条件要求较高。
相比于国际葡萄酒行业对Dekkera bruxellensis在葡萄酒发酵和贮存过程中发挥的作用和可能带来的风险的关注,国内葡萄酒行业对其还没有足够的重视,对于葡萄酒中Dekkera bruxellensis快速检测方法的开发以及其防范和治理等,都需要深入的研究。针对这一现状,本研究比较WLN和DBDM培养基分离检测Dekkera bruxellensis的效果,并利用特异PCR扩增法对上述两种培养基的分离检测效果作了进一步验证。并选用分离鉴别Dekkera bruxellensis效果较好的DBDM培养基结合特异PCR扩增法对我国不同产区的酒样进行Dekkera bruxellensis的分离检测,调查我国葡萄酒中该酵母的感染情况。本研究为Dekkera bruxellensis的分离鉴定以及检测提供技术支撑,并为我国葡萄酒行业酒香酵母的存在情况提供理论依据,对国内Dekkera bruxellensis的进一步研究将发挥重要作用。
1 材料与方法
1.1 材料
1.1.1 酒样来源
从国内主要的葡萄酒产区采集葡萄酒样品,取样为酒精发酵刚结束的发酵罐中的葡萄酒和正在储酒池、储酒罐以及橡木桶中陈酿的葡萄酒,陈酿的葡萄酒选择不同年份、品种以及不同储酒容器进行取样,尽量从容器底部取样,每个葡萄酒样品取样量为500 mL,其他信息见表1。
表1 本研究所用葡萄酒样品来源
Table 1 Wine samples from different areas in China used in this study
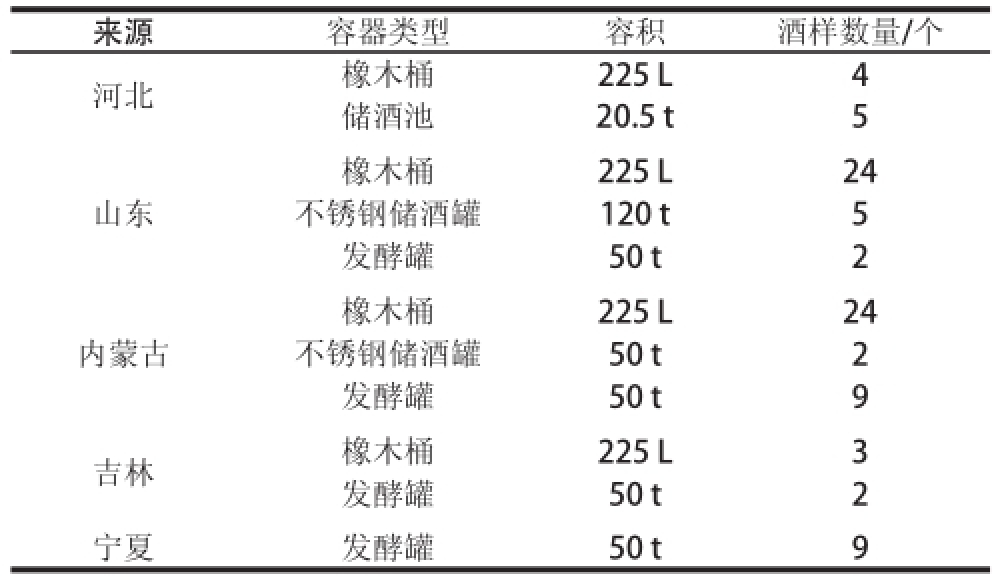
来源 容器类型 容积 酒样数量/个河北 橡木桶 225 L 4储酒池 20.5 t 5山东橡木桶 225 L 24不锈钢储酒罐 120 t 5发酵罐 50 t 2内蒙古橡木桶 225 L 24不锈钢储酒罐 50 t 2发酵罐 50 t 9吉林 橡木桶 225 L 3发酵罐 50 t 2宁夏 发酵罐 50 t 9
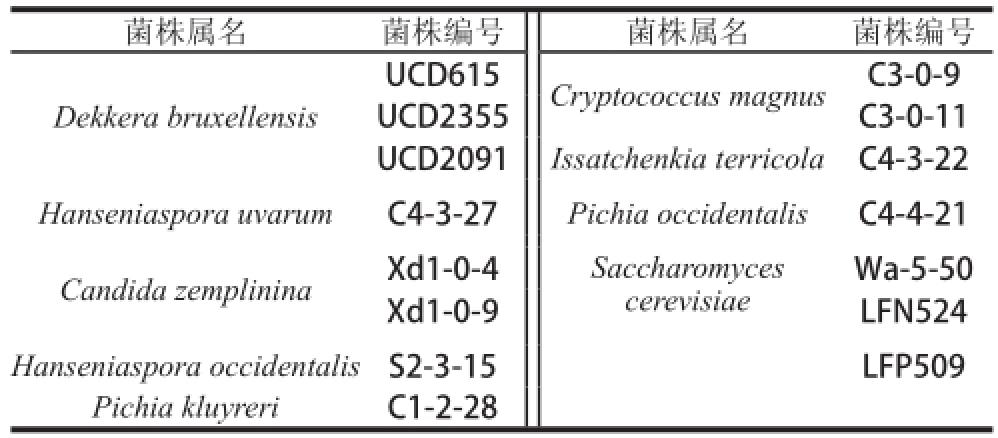
1.1.2 对照菌株
实验中所用菌株如表2所示,UCD系列菌株为加利福尼亚大学戴维斯分校的菌株保藏中心(Culture Collection,University of California,Davis)提供的Dekkera bruxellensis标准菌株。其余为本实验室分离筛选鉴定并保藏的菌株。
表2 不同种属酵母菌株
Table 2 Yeast strains belonging to different genera
1.1.3 培养基和试剂
YPD液体培养基:酵母浸粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,121 ℃灭菌20 min。
DBDM培养基
[13]:无氨基酵母氮源(yeast nitrogen base without amino acids,YNB)6.7 g/L、乙醇体积分数6%、氯霉素10 mg/L、放线菌酮10 mg/L、对香豆酸10 mg/L、溴甲酚绿22 mg/L、琼脂20 mg/L,山梨酸调pH值至5.4,琼脂高温灭菌,其他过滤除菌。
WLN培养基
[23]:葡萄糖50 g/L、蛋白胨5 g/L、酵母浸粉4 g/L、KH
2PO
40.55 g/L、KCl 0.425 g/L、CaCl
20.125 g/L、MgSO
40.125 g/L、FeCl
30.025 g/L、MnSO
40.025 g/L、溴甲酚绿22 mg/L、琼脂20 g/L,调pH值至6.2。另外添加50 mg/L放线菌酮。
PCR试剂:10×PCR buffer,2.5 mmol/L dNTP,25 mmol/L MgCl
2,5 U/μL Taq Polymerase,均购自宝生物公司。引物浓度为10 μmol/L,由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 酒样预处理
由于SO
2以及酒精的胁迫,Dekkera bruxellensis在葡萄酒中可能会以存活但不可培养的状态存在,直接涂布不能在培养基上生长,因此先对酒样进行预处理,将1 mL酒样接在5 mL YPD液体培养基(含10 mg/L放线菌酮,以抑制其他酵母的生长)中,28 ℃条件下静置活化24~48 h。
1.2.2 两种鉴别培养基比较
以河北的9 个酒样(酒样编号为CC1~CC9)涂布两种鉴别培养基,比较其分离检测效果。取100 μL原酒样品和经预处理活化后的酒样,分别涂布WLN和DBDM培养基,28 ℃条件下培养7~20 d,观察菌落形成情况。
1.2.3 DNA的提取
采用石英砂破壁提取法
[24]。YEPD平板培养基上培养2~3 d;1.5 mL离心管,用灭过菌的牙签挑取0.3 g菌体,加入3/10总体系体积的石英砂,加200 μL酵母裂解液,在匀浆机振荡,每2 min取下摇30 s,共循环4 次;65 ℃水浴10 min。之后加入等体积(200 μL)5 mol/L CH
3COOK,混匀,冰浴8 min;13 300 r/min离心5 min,吸350 μL上清液至新的离心管中;加入0.1 倍体积(35 μL)3 mol/L CH
3COONa,加入0.6 倍体积异丙醇(200 μL),混匀,后冰浴8 min,13 300 r/min离心5 min后收集沉淀;200 μL TE溶解,加入RNase 3 μL,65 ℃水浴10 min;加入200 μL氯仿-异戊醇(24∶1,V/V),抽提一次,12 000 r/min离心10 min;小心取上清液150 μL至新的离心管中,加入0.1 倍体积(20 μL)3 mol/L CH
3COONa及2.5 倍体积(375 μL)无水乙醇,混匀后13 300 r/min离心8 min,收集沉淀DNA;500 μL 70%乙醇洗涤沉淀,13 300 r/min离心8 min收集沉淀,吹干后加50 μL TE溶解,-20 ℃保藏(长期保存)。
1.2.4 特异引物PCR扩增鉴定
利用Cecchini等
[4]以Dekkera bruxellensis ITS1~ITS2区为靶序列设计的特异引物对,DekITS(5'-GACACGTGGAATAAGCAAGG-3')和BruxITR(5'-ATTATCCCCTCACTCCCCTC-3'),扩增片段长度为308 bp。PCR反应体系:2.5 μL 10×PCR buffer,1.0 μL dNTP,引物各0.5 μL,1.5 μL MgCl
2,0.25 μL Taq Polymerase,1 μL DNA模板,17.95 μL ddH
2O,总体积25 μL。反应条件:95 ℃预变性4 min;95 ℃变性30 s,60 ℃退火30 s,70 ℃延伸30 s,循环36 次;70 ℃保温10 min。扩增产物经10 g/L琼脂糖凝胶电泳检测(100 V,1 h),后置于凝胶成像仪内拍照观察。
1.2.5 26S rRNA基因D1~D2区测序验证
对特异PCR扩增为阳性的菌落进一步进行26S rRNA基因D1~D2区测序,验证其为Dekkera bruxellensis。使用通用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')进行26S rRNA基因D1/D2区的扩增
[17],PCR反应体系:5.0 μL 10×PCR buffer,1.6 μL dNTP,引物各1 μL,3.0 μL MgCl
2,0.5 μL Taq Polymerase,1 μL DNA模板,36.9 μL ddH
2O,总体积50 μL。PCR扩增程序为:95 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min 20 s,循环36 次;72 ℃保温8 min。扩增产物经10 g/L琼脂糖凝胶检测后,送生工生物工程(上海)股份有限公司进行纯化和测序分析。
1.2.6 不同产区葡萄酒中酒香酵母的分离检测
采用分离检测效果较好的鉴别培养基结合特异PCR扩增对其他地区的酒样进行Dekkera bruxellensis分离检测。
2 结果与分析
2.1 两种鉴别培养基的比较
表3 鉴别培养基上菌落形成情况
Table 3 Colony formation on differential media
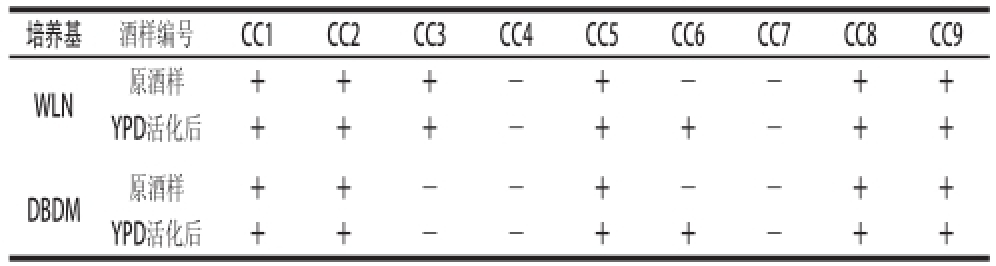
注:+.有菌落形成,—.无菌落形成。
培养基 酒样编号 CC1 CC2 CC3 CC4 CC5 CC6 CC7 CC8 CC9 WLN原酒样 + + + - + - - + + YPD活化后+ + + - + + - + + DBDM原酒样 + + - - + - - + + YPD活化后+ + - - + + - + +
9 个酒样活化前后分别在WLN培养基和DBDM培养基上进行涂布检测,菌落形成情况见表3。在WLN培养基上,未经活化的酒样有6 个样品出现菌落,经YPD活化后,原本没有菌落形成的CC6酒样也有菌落形成,共7 个酒样检测到菌落形成。在WLN培养基上,共出现了4 种不同形态的菌落:Ⅰ
W,奶油状,白色圆形突起,开始白色,后来稍带蓝绿色;Ⅱ
W,奶油状,深绿色,扁平圆形菌落;Ⅲ
W,不规则较大菌落,扁平,表面有褶皱,蓝绿色;Ⅳ
W,油状,稍突起,黄绿色圆形菌落(图1)。未经活化的酒样有5 个样品在DBDM培养基上形成菌落,活化后,原本没有菌落形成的CC6酒样有菌落形成。DBDM培养基上有两种形态的菌落,Ⅰ
D,奶油状,纯白色圆形突起;Ⅱ
D,奶油状,黄绿色圆形菌落。与Dekkera bruxellensis标准菌株形态对比,初步断定Ⅰ
W和Ⅰ
D菌株为Dekkera bruxellensis。
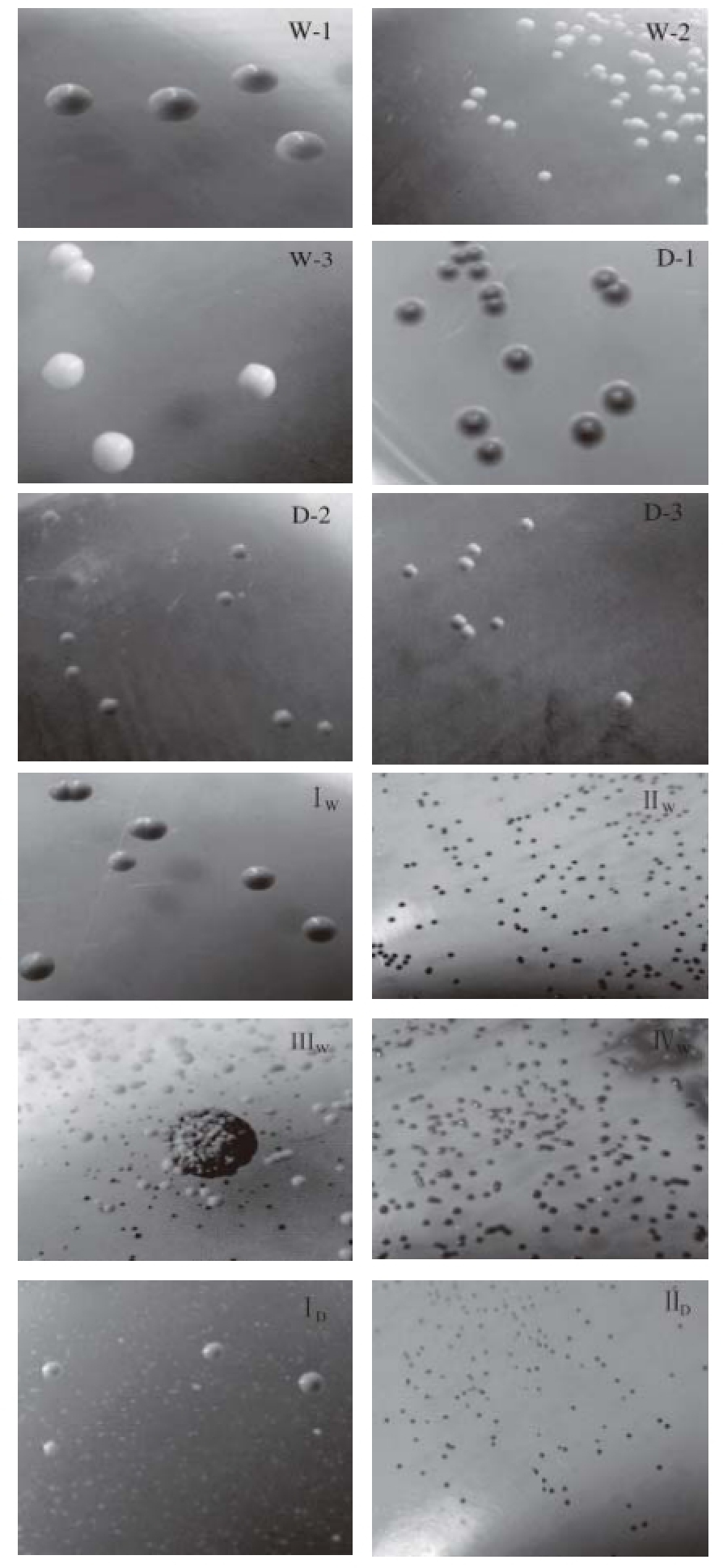
图1 鉴别培养基上的菌落形态
Fig.1 Colony types on differential media
W-1~W-3分别为UCD615、UCD2355、UCD2091在WLN培养基上的形态,D-1~D-3分别为UCD615、UCD2355、UCD2091在DBDM培养基上的形态;I
W~Ⅳ
W为WLN培养基上出现的菌落;I
D和Ⅱ
D为DBDM培养上出现的菌落。
Benito等
[25]比较鉴别培养基不同选择因子的作用时,发现放线菌酮是最强的选择因子,但并不能完全抑制其他酵母的生长,需要结合山梨酸、酒精等次级选择因子才能更具选择性。Morneau等
[23]比较15 种不同酵母菌在WLN和DBDM培养基上的生长情况,发现在WLN培养基中放线菌酮达到100 mg/L时,除了Dekkera bruxellensis还有3 种酵母能够生长,而在DBDM培养基上则只有Dekkera bruxellensis能够生长。实验各酒样菌落分布如表4所示,结果与之前的这些结论基本一致。WLN培养基成分营养丰富,虽然其添加了更高质量浓度的放线菌酮以抑制其他酵母的生长,但由于选择因素单一,部分其他酵母对放线菌酮存在抗性,出现多种形态的菌落,对分离检测结果的观察造成影响;而DBDM培养基除了有相对较低质量浓度的放线菌酮作为主要选择因子,还有山梨酸和酒精作为次级选择因子,并且不含有葡萄糖等常规性碳源,其选择能力较高,实验中出现其他菌落较少。相比于WLN培养基,DBDM培养基是更为理想的分离检测Dekkera bruxellensis的鉴别培养基。
表4 每个酒样在鉴别培养基上的菌落形态
Table 4 Strain types from each wine sample on differential media
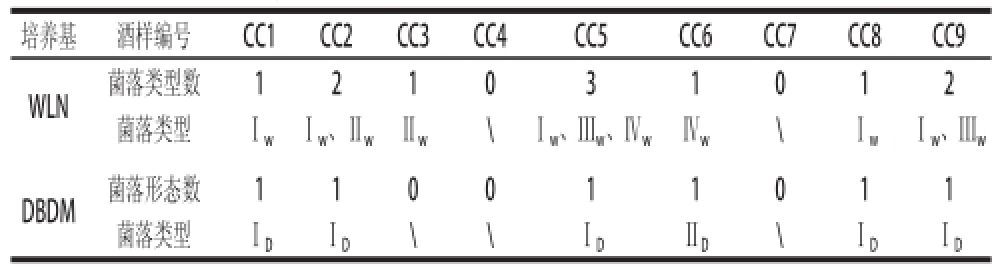
注:\.酒样在培养基涂布上无菌落产生。
培养基 酒样编号 CC1 CC2 CC3 CC4 CC5 CC6 CC7 CC8 CC9 WLN菌落类型数 1 2 1 0 3 1 0 1 2菌落类型 Ⅰ
w Ⅰ
w、Ⅱ
w Ⅱ
w \ Ⅰ
w、Ⅲ
w、Ⅳ
w Ⅳ
w \ Ⅰ
w Ⅰ
w、Ⅲ
wDBDM菌落形态数 1 1 0 0 1 1 0 1 1菌落类型 Ⅰ
D Ⅰ
D \ \ Ⅰ
D Ⅱ
D \ Ⅰ
D Ⅰ
D
2.2 PCR特异性扩增和26S rRNA基因D1~D2区测序鉴定
选择培养基虽然能够在形态上对菌落进行初步判定,但由于培养条件、菌株差异等因素,会使菌落在不同培养时期甚至同一时期内菌种内不同菌株的形态表现不同,因此,只根据菌落形态难以准确对Dekkera bruxellensis进行鉴定和检测,需要结合其他方法进一步鉴定。
2.2.1 PCR特异性扩增鉴定
Cecchini等
[4]利用17 种酵母菌和6 种细菌验证了该引物的特异性,实验中进一步用对实验室之前研究发现的葡萄和葡萄酒中最为常见的8 种酵母以及3 株Dekkera bruxellensis标准菌株验证其特异性,结果如图2所示,只有Dekkera bruxellensis的3 株菌有目的片段,其余酵母均未扩增出条带,结合实验和Cecchini等
[4]报道可以确定该引物对特异性良好。
对WLN培养基上4 种形态的菌落和DBDM培养基上2 种形态的菌落进行特异引物PCR扩增鉴定,其结果如图2所示,只有符合Dekkera bruxellensis形态特征的Ⅰ
W和Ⅰ
D型菌落扩增出与目的片段大小相符的条带,其他形态的菌落均未有条带,因此可以判断Ⅰ
W和Ⅰ
D形态的菌落为Dekkera bruxellensis。为进一步验证,分别从CC1、CC2、CC5、CC8、CC9挑选一株该形态菌株进行扩增,如图3所示,均有目的扩增片段。表明DBMD培养基和WLN培养基能够较为准确地对葡萄酒中的Dekkera bruxellensis进行检测;这5 个酒样中均存在Dekkera bruxellensis。

图2 不同酵母PCR扩增结果
Fig.2 PCR amplification of different yeast species
M. 2 000 bp DNA Marker;泳道1~15为菌株UCD615、UCD2355、UCD2091、C4-3-27、Xd1-0-4、Xd1-0-9、S2-3-15、C1-2-28、C3-0-9、C3-0-11、C4-3-22、C4-4-21、Wa-5-50、LFN524、LFP509依次扩增结果。
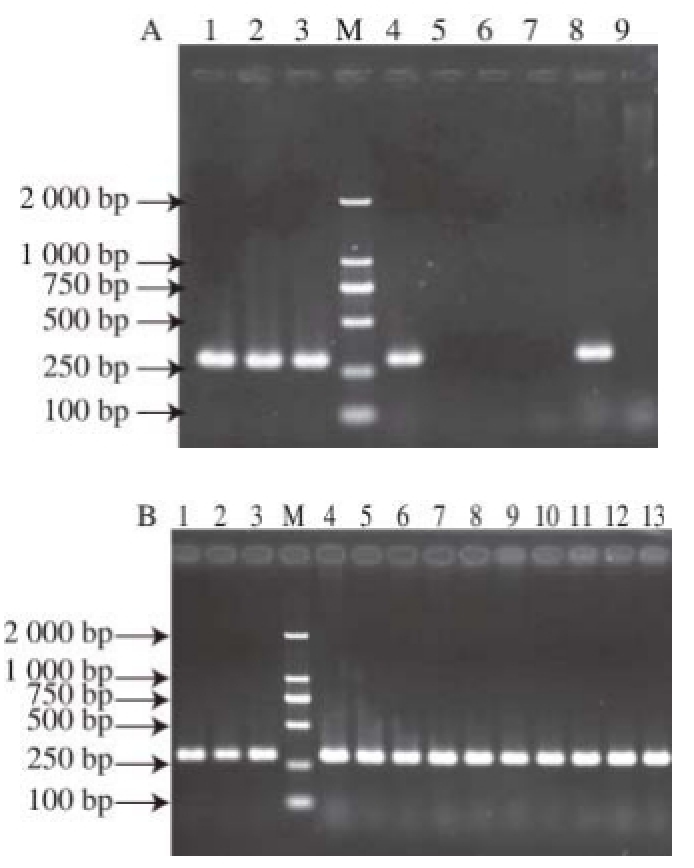
图3 实验菌株PCR扩增结果
Fig.3 PCR amplification of strains isolated from wine samples
M. 2 000 bp DNA Marker;A图:泳道1~3为酒香酵母标准菌株,泳道4~9依次为Ⅰ
W、Ⅱ
W、Ⅲ
W、Ⅳ
W、Ⅰ
D、Ⅱ
D;B图:泳道1~3为酒香酵母标准菌株,泳道4~8分别为CC1、CC2、CC5、CC8、CC9在WLN培养基上Ⅰ
W形态的菌落,泳道9~13分别为CC1、CC2、CC5、CC8、CC9在DBDM培养基上Ⅰ
D形态的菌落。
2.2.2 26S rRNA基因D1~D2区测序
为进一步验证,分别从5 个酒样的WLN和DBDM培养基上选取一株特异PCR扩增阳性的菌株,进行26S rRNA基因D1~D2区进行测序分析,测得的序列在国家生物技术信息中心(National Center for Biotechnology Information,NCBI)上进行对比,结果见表5,表明其确实为Dekkera bruxellensis。
表5 被测菌株26S rRNA基因D1~D2区与相关菌株序列相似性
Table 5 The identity of 26S rRNA gene D1/D2 fragment between the sequenced strains and related strains
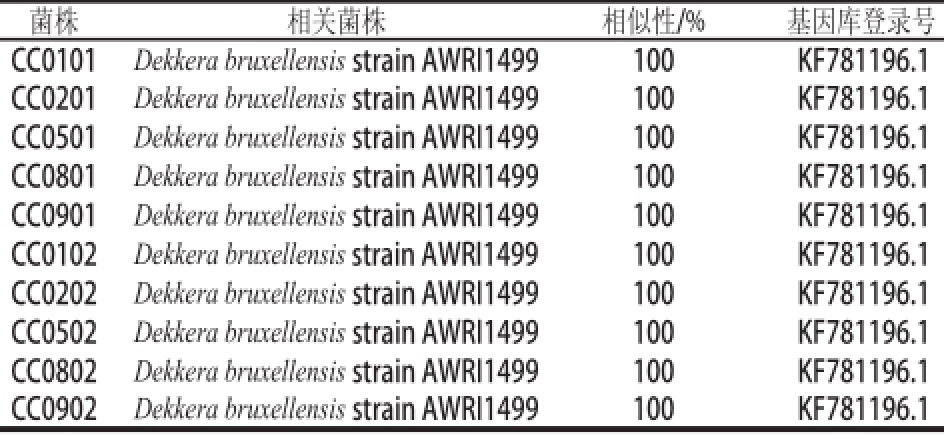
注:CC0101、CC0201、CC0501、CC0801、CC0901为WLN培养基分离到的菌株;CC0102、CC0202、CC0502、CC0802、CC0902为DBDM培养基分离到的菌株。
菌株 相关菌株 相似性/% 基因库登录号CC0101 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0201 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0501 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0801 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0901 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0102 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0202 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0502 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0802 Dekkera bruxellensis strain AWRI1499 100 KF781196.1 CC0902 Dekkera bruxellensis strain AWRI1499 100 KF781196.1
26S rRNA基因D1~D2区测序结果表明,鉴别培养基结合PCR特异性扩增可以准确地对Dekkera bruxellensis进行鉴定和检测,可以替代操作相对复杂、用时较长的26S rRNA基因D1~D2测序和5.8S-ITS-18S rRNA基因的PCR-RFLP方法。
2.3 不同产区葡萄酒中酒香酵母的分离检测
利用上述分离检测效果较好的DBDM培养基,对另外4 个地区的酒样进行分离检测,并对筛选得到的菌落进一步进行PCR特异性扩增鉴定。综合检测结果见表6,在研究的5 个地区中,山东、河北和吉林的酒样中存在酒香酵母,分别有6、5、3 个酒样被感染,山东与吉林9 个酒样的PCR特异扩增结果见图4。内蒙古的35 个酒样中均未检测到Dekkera bruxellensis的存在,酒样采集相对丰富,可以确认没有感染;而宁夏的酒样虽然此实验中没有分离到Dekkera bruxellensis,但由于样品量少,且酒样都是来自于较少出现Dekkera bruxellensis的发酵罐,难以说明其不存在感染。实验发现存在Dekkera bruxellensis的酒样均为陈酿期间的葡萄酒,尤其是橡木桶,这与之前报道的酒香酵母大多存在于陈酿期间结果一致,原因是酒香酵母生长相对较慢,抗逆性强,在陈酿期间没有其他酵母的竞争以及其可以利用橡木桶的纤维二糖作为碳源,在此时期内会慢慢繁殖
[26];部分研究人员也在葡萄和发酵结束的葡萄酒中分离到Dekkera bruxellensis
[1],但此实验中在刚发酵完的葡萄酒中没有分离检测到其存在,可能并不存在或者是由于其数量较少没有分离到。
Table 6 Contamination of Dekkera bruxellensisnsis in wines from different areas
表6 不同地区葡萄酒中Dekkera bruxellensis感染情况

注:+.存在酒香酵母感染;-.不存在酒香酵母感染。
?
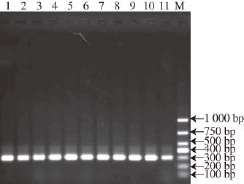
图4 山东和吉林酒样分离菌株PCR扩增结果
Fig.4 PCR amplification of strains isolated from wine samples produced in Shandong and Jilin
M. 1 000 bp DNA Marker;泳道1~2为酒香酵母标准菌株,泳道3~8为山东6 个酒样中分离到的菌株;泳道9~11为吉林3 个酒样中分离到的菌株。
3 结 论
WLN培养基和DBDM培养基均能对葡萄酒中的布鲁塞尔酒香酵母进行初步分离和鉴定,根据葡萄酒样品在两种培养基上形成的菌落形态,可以初步判断葡萄酒中是否存在布鲁塞尔酒香酵母。与WLN培养基相比,DBDM培养基有更好的选择性,较少出现假阳性菌落,分离检测效果相对较好,结合特异引物PCR能够准确地对Dekkera bruxellensis进行鉴定。
在调查的5 个国内主要葡萄酒产区的葡萄酒样品中,河北、山东和吉林产区的葡萄酒均检测到Dekkera bruxellensis的存在,尤其是陈酿在橡木桶中的葡萄酒,调查中发现感染Dekkera bruxellensis的酒样大部分为在橡木桶中陈酿的葡萄酒。国内葡萄酒行业应对酒香酵母感染问题足够重视,以避免其可能带来的风险。
参考文献:
[1] OELOFSE A, PRETORIUS I, du TOIT M. Significance of Brettanomyces and Dekkera during winemaking: a synoptic review[J]. South African Journal for Enology and Viticulture, 2008, 19(2): 128-144.
[2] CHATONNET P, DUBOURDIE D, BOIDRON J N, et al. The origin of ethylphenols in wines[J]. Journal of the Science of Food and Agriculture, 1992, 60(2): 165-178.
[3] CHATONNET P, VIALA C, DUBOURDIEU D. Influence of polyphenolic components of red wines on the microbial synthesis of volatile phenols[J]. American Journal of Enology and Viticulture,1997, 48(4): 443-448.
[4] CECCHINI F, IACUMIN L, FONTANOT M, et al. Dot blot and PCR for Brettanomyces bruxellensis detection in red wine[J]. Food Control,2013, 34(1): 40-46.
[5] TOFALO R, SCHIRONE M, CORSETTI A, et al. Detection of Brettanomyces spp. in red wines using real-time PCR[J]. Journal of Food Science, 2012, 77(9): M545- M549.
[6] PUIG A, BERTRAN E, FRANQUET R, et al. Brettanomyces bruxellensis prevalence in wines produced and marketed in Spain[J]. Annals of Microbiology, 2011, 61(1): 145-151.
[7] TESSONNIERE H, VIDAL S, BARNAVON L, et al. Design and performance testing of a real-time PCR assay for sensitive and reliable direct quantification of Brettanomyces in wine[J]. International Journal of Food Microbiology, 2009, 129(3): 237-243.
[8] AGNOLUCCI M, VIGENTINI I, CAPURSO G, et al. Genetic diversity and physiological traits of Brettanomyces bruxellensis strains isolated from Tuscan Sangiovese wines[J]. International Journal of Food Microbiology, 2009, 130(3): 238-244.
[9] RODER C, KONIG H, FROHLICH J. Species-specific identification of Dekkera/Brettanomyces yeasts by fluorescently labeled DNA probes targeting the 26S rRNA[J]. FEMS Yeast Research, 2007, 7(6): 1013-1026.
[10] IBEAS J I, LOZANO I, PERDIGONES F, et al. Detection of Dekkera-Brettanomyces strains in sherry by a nested PCR method[J]. Applied and Environmental Microbiology, 1996, 62(3): 998-1003.
[11] SU.REZ R, SU.REZ-LEPE J A, MORATA A, et al. The production of ethylphenols in wine by yeasts of the genera Brettanomyces and Dekkera: a review[J]. Food Chemistry, 2007, 102(1): 10-21.
[12] 游雪燕, 庄海宁, 冯涛. 葡萄酒中Brettanomyces酒香酵母属不良风味的研究进展[J]. 中国酿造, 2012, 31(12): 9-12.
[13] RODRIGUES F, GONCALVES G, PEREIRA-da-SILVA SMALFEITO-FERREIRA M, et al. Development and use of a new medium to detect yeasts of the genera Dekkera/Brettanomyces[J]. Journal of Applied Microbiology, 2001, 90(4): 588-599.
[14] AGNOLUCCI M, REA F, SBRANA C, et al. Sulphur dioxide affects culturability and volatile phenol production by Brettanomyces/Dekkera bruxellensis[J]. International Journal of Food Microbiology, 2010,143(1/2): 76-80.
[15] SERPAGGI V, REMIZE F, RECORBET G, et al. Characterization of the “viable but nonculturable” (VBNC) state in the wine spoilage yeast Brettanomyces[J]. Food Microbiology, 2012, 30(2): 438-447.
[16] ZUEHLKE J M, EDWARDS C G. Impact of sulfur dioxide and temperature on culturability and viability of Brettanomyces bruxellensis in wine[J]. Journal of Food Protection, 2013, 76(12):2024-2030.
[17] KURTZMAN C P, ROBNETT C J. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S)ribosomal DNA partial sequences[J]. Antonie van Leeuwenhoek,1998, 73(4): 331-371.
[18] ESTEVE-ZARZOSO B, BELLOCH C, URUBURU F, et al. Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J]. International Journal of Systematic Bacteriology, 1999, 49(1): 329-337.
[19] COCOLIN L, RANTSIOU K, IACUMIN L, et al. Molecular detection and identification of Brettanomyces/Dekkera bruxellensis and Brettanomyces/Dekkera anomalus in spoiled wines[J]. Applied and Environmental Microbiology, 2004, 70(3): 1347-1355.
[20] CONTRERAS A, SALINAS F, GANGA A, et al. Polymerase chain reaction confirmatory method for microbiological detection of Brettanomyces bruxellensis in wines[J]. Journal of Rapid Methods & Automation in Microbiology, 2008, 16(4): 308-319.
[21] STENDER H, KURTZMAN C, HYLDIG-NIELSEN J J, et al. Identification of Dekkera bruxellensis (Brettanomyces) from wine by fluorescence in situ hybridization using peptide nucleic acid probes[J]. Applied and Environmental Microbiology, 2001, 67(2): 938-941.
[22] ANDORRA I, ESTEVE-ZARZOSO B, GUILLAMON J M, et al. Determination of viable wine yeast using DNA binding dyes and quantitative PCR[J]. International Journal of Food Microbiology,2010, 144(2): 257-262.
[23] MORNEAU A D, ZUEHLKE J M, EDWARDS C G. Comparison of media formulations used to selectively cultivate Dekkera/ Brettanomyces[J]. Letters in Applied Microbiology, 2011, 53(4): 460-465.
[24] 周小玲, 沈微, 饶志明, 等. 一种快速提取真菌染色体 DNA 的方法[J].微生物学通报, 2004, 31(4): 89-92.
[25] BENITO S, PALOMERO F, MORATA A, et al. Identifying yeats belonging to the Brettanomyces/Dekkera genera through the use of selective-differential media[J]. African Journal of Microbiology Research, 2012, 34(6): 6348-6357.
[26] WEDRAL D, SHEWFELT R, FRANK J. The challenge of Brettanomyces in wine[J]. LWT-Food Science and Technology, 2010,43(10): 1474-1479.
Detection and Identification of Dekkera bruxellensis in Chinese Wines
CAO Peixin
1, MA Tao
1, YANG Kaidi
1, LIU Yanlin
1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China;2. Shaanxi Engineering Research Center for Wine and Viticulture, Yangling 712100, China)
Abstract:Dekkera bruxellensis is one of the major spoilage microorganisms in wines. In order to detect Dekkera bruxellensis in wines rapidly and accurately, the separation and detection efficiency of Dekkera bruxellensis using differential medium (DBDM) and Wallerstein nutrient (WLN) medium were compared. A specific polymerase chain reaction (PCR)assay was also used to further testify the results. The results showed that both DBDM a nd WLN could be useful to detect Dekkera bruxellensis in wines, while DBDM was more selective to identify Dekkera bruxellensis accurately when combined with the specific PCR. The application of DBDM combined with the specific PCR to investigate the infection of Dekkera bruxellensis in wines from five major producing regions in China showed that among the investigated regions, Dekkera bruxellensis spoilage was found in wines from three regions including Hebei, Shandong and Jilin, especially in the wines aged in oak barrels. Therefore, the Chinese wine industry should pay much attention to the issue of Dekkera bruxellensis spoilage.
Key words:wine; Dekkera bruxellensis; differential medium; detection and identification
中图分类号:TS261.1
文献标志码:A
文章编号:1002-6630(2015)23-0172-06
doi:10.7506/spkx1002-6630-201523032
收稿日期:2015-01-19
基金项目:中央高校基本科研业务费专项资金项目(重点项目)(Z109021201);国家现代农业(葡萄)产业技术体系建设专项(CARS-30-jg-3)
作者简介:曹培鑫(1990—),男,硕士研究生,研究方向为葡萄酒微生物。E-mail:736008703@qq.com
*通信作者:刘延琳(1966—),女,教授,博士,研究方向为葡萄酒及酿酒微生物。E-mail:yanlinliu@nwsuaf.edu.cn









