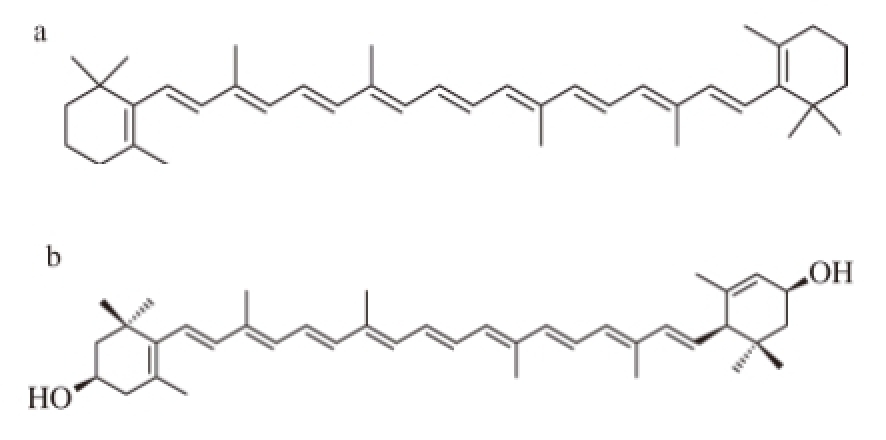
图1 1 β,β-胡萝卜素(a)和叶黄素(b)的分子结构
Fig.1 Molecular structures of β,β-carotene (a) and lutein (b)
王 梓,惠伯棣*,宫 平
(北京联合大学应用文理学院,北京 100191)
摘 要:研究杜氏藻在实验室培养过程中初始pH值和照射光波长对其体内类胡萝卜素(β-胡萝卜素和叶黄素)积累的影响。在实验中,配制不同初始pH值的培养基,用其培养105 d,测定培养液中藻细胞数和β-胡萝卜素及叶黄素的含量。用pH 7的培养基,在白光(全波)、红光(630 nm)和蓝光(430 nm)照射下培养藻40 d,测定培养液中藻细胞数和β-胡萝卜素、叶黄素的含量。结果表明:1)杜氏藻本身具有调节环境pH值向中性发生变化的能力。培养105 d后,不同初始pH值范围的培养液(pH 10~13、pH 1~3和pH 4~9)中藻养殖密度依次增加。初始pH 4时,培养液中藻细胞数量可达1 851 个/mL,达到最大值;初始pH值范围为7~9时,培养液中β-胡萝卜素(0.489~0.561 μg/mL)和叶黄素(0.610~0.700 μg/mL)积累量较高;初始pH值范围为11~13时,单个细胞内β-胡萝卜素(0.603~0.730 ng)和叶黄素(0.897~0.979 ng)积累量较高。2)杜氏藻养殖密度在全波光、红光(630 nm)和蓝光(430 nm)条件下均可增加。红光和蓝光均可诱导单个细胞中β-胡萝卜素和叶黄素积累量增加,蓝光效果最佳,单个细胞中叶黄素含量达到0.524 ng,β-胡萝卜素含量达到0.589 ng。
关键词:杜氏藻;类胡萝卜素;叶黄素;β-胡萝卜素
绿藻门,杜氏藻属(Dunaliella)中的嗜盐单细胞藻类可以生长在高盐度的海水、盐田和内陆盐湖之中。该属根据其形态和生理特征可鉴定出至少23 个种 [1-2],但根据对其18S rRNA基因、内转录间隔区、DNA序列比较以及限制性片段的研究结果,这个属中能鉴定出的藻种数量要少于23 个 [3]。Dunaliella salina是其中的一个种,称为杜氏藻,又名盐藻。
为了适应高盐环境,Dunaliella salina体内能够积累一定浓度的次生代谢产物:类胡萝卜素(carotenoid)和甘油。在其体内积累的类胡萝卜素中,β-胡萝卜素和叶黄素所占数量最多。二者的分子结构见图1。β-胡萝卜素的半系统名称为β,β-胡萝卜素(β,β-carotene),习惯名称为β-胡萝卜素(β-carotene)。由于其在人体的小肠中可被水解成视黄醇(retinol),β-胡萝卜素又被认为是VA源。加之其整体分子优秀的抗氧化能力,β-胡萝卜素已被认为是我国消费者日常膳食中重要的营养素和健康功能因子。鉴于杜氏藻体内积累有丰富的β-胡萝卜素,其已被用于制备天然β-胡萝卜素。到目前为止,我国是世界上杜氏藻源β-胡萝卜素的最大消费国,并已在内蒙和甘肃建成两个杜氏藻养殖生产基地。但其产量远远不能满足国内市场的需求。在今后相当长的时间内,发展我国的杜氏藻养殖产业都具有很强的迫切性。因此,研究影响其生长的环境因素、优化养殖技术、提高β-胡萝卜素的产量具有很现实的意义。

图1 1 β,β-胡萝卜素(a)和叶黄素(b)的分子结构
Fig.1 Molecular structures of β,β-carotene (a) and lutein (b)
杜氏藻个体的生长经历了比较复杂的生命周期,可进行营养和有性生殖 [4-6]。关于杜氏藻生长条件的研究分为露天养殖和室内养殖。国外研究表明:在露天养殖条件下,杜氏藻生长的最优生长盐质量浓度为100~150 g/L,甚至可达到190 g/L [7-8];天然生长的杜氏藻可在135 g/L的质量浓度下生长 [9],密度可达4×10 4个/mL [10],藻的群落结构变化与盐度、光强度、水温以及pH值的变化相关。在人工培养条件下,杜氏藻可在60~230 g/L的NaCl溶液中和pH 6~9的范围内生长,钙、镁离子在高质量浓度下亦可抑制其生长;在质量浓度20~80 g/L的NaCl溶液中杜氏藻生长较快 [11],当盐质量浓度高于150 g/L后,生长缓慢 [8]。同时,杜氏藻人工培养的最佳盐质量浓度可能随种、亚种而变化,有些为60 g/L,有些为120 g/L左右 [6]。这说明可生长杜氏藻的露天盐田和盐湖的实际盐质量浓度总是远远高于实验室条件下杜氏藻的最佳生长盐质量浓度。这反映了一个事实:杜氏藻选择的生长环境不一定是最佳生长环境。但在这个环境中,杜氏藻可能最具生存竞争能力。相对而言,国内研究更多集中于室内养殖,研究内容除了在碳源、氮源、维生素和金属离子等营养物质量上进行调整之外,还进行了盐度、光照、温度、pH值等方面进行的探索。焉翠蔚等 [12]研究了不同质量浓度NaCl对杜氏藻生长的影响,结论是杜氏藻生长的最适盐质量浓度为140 g/L。韦芳三等 [13]的研究表明:在盐质量浓度为400 g/L时,杜氏藻体内能够积累最高的脂肪量。王富平等 [14]的研究表明:较低质量浓度盐有利于杜氏藻细胞的生长,而较高质量浓度盐有利于积累较高的类胡萝卜素。秦彩云等 [15]的研究表明:杜氏藻在白、红、黄、蓝光下均能生长,并在10 d时达到最大养殖密度,且红光条件下的细胞密度最大。郑亚君等 [16]研究不同温度对盐生杜氏藻生长及脂肪酸组成的影响,随着培养温度的升高和光照强度的增加,藻株内饱和脂肪酸所占百分比例增加,多不饱和脂肪酸所占百分比例减小。pH值变化研究方面,除用缓冲盐控制培养环境pH值外 [17],还有人尝试通过充入CO 2气体的方式控制培养体系的pH值 [18]。这些方面的研究主要集中在物理条件对细胞生长方面的影响上,与体内类胡萝卜素的积累的相关性不足。
本研究探索培养液pH值和不同照射光波长对实验室条件下养殖杜氏藻中类胡萝卜素积累量的影响,为提高杜氏藻养殖中β-胡萝卜素的含量摸索出可行的方法与技术。
1.1 藻种与试剂
杜氏藻藻种购自上海光语生物科技有限公司。根据其形态学和生理特征,经18S rRNA基因分析,鉴定为Dunaliella salina。
Na 2SiO 3·9H 2O、乙二胺四乙酸二钠盐(ethylenediaminetetraacetic acid disodium salt,Na 2EDTA)、FeCl 3、ZnSO 4·7H 2O、CoCl 2·6H 2O、NaH 2PO 4·2H 2O、Na 2MoO 4·2H 2O、MnCl 2·4H 2O、CuSO 4、NaNO 3、甲醇、HCl、NaOH均为分析纯试剂 北京化学试剂公司;VB 1、VB 12、生物素为药品级(纯度≥97%)市售;海水盐 Formular Distributor公司;乙腈、乙酸乙酯均为色谱纯 重庆迪马工业有限责任公司;β-胡萝卜素及参比样品(C/N:22040-1G-F;紫外检测纯度≥97%) 美国Sigma公司;叶黄素(高效液相色谱(high performance liquid chromatography,HPLC)检测纯度≥99%) 浙江新昌制药厂。
1.2 仪器与设备
HPLC(由PU-2080和UV-2075组成)仪、白色(全波,25 W)、蓝色(430 nm,25 W)、红色(630 nm,25 W)水草灯 日本Jasco公司;Diamonsil TMC 18色谱柱(4.6 mm×250 mm,5 μm) 迪马公司;ST-80C型照度计 北京师范大学光电仪器厂;DM500型显微镜 德国Leica公司。
1.3 方法
1.3.1 培养液母液配制
用蒸馏水配制母液A(NaNO 3:75 g/L)、B(NaH 2PO 4· 2H 2O:5 g/L)、C(Na 2SiO 3·9H 2O:20 g/L)、D(Na 2EDTA:4.36 g/L)、E(FeCl 3·6H 2O:3.16 g/L)、F(CuSO 4·5H 2O、ZnSO 4·7H 2O、CoCl 2·6H 2O、MnCl 2·4H 2O、Na 2MoO 4·2H 2O分别为:0.01、0.023、0.012、0.18、0.07 g/L)和G(VB 1、VB 12、生物素分别为:0.01、0.05×10 -3、0.05×10 -3g/L)备用。根据如前所述文献报道 [8-10,12],在本研究中配制人工海水的海盐质量浓度为160 g/L。将配制的人工海水和A、B、C、D、E、F液在121 ℃条件下灭菌20 min。用5 mL的一次性针头吸取G母液,过0.22 μm滤膜,收集滤液。
1.3.2 杜氏藻的培养及密度测定
在pH值实验中,采用血球板计数法测定藻种每毫升培养液中的藻细胞数量(即藻养殖密度,单位:个/mL)。依次加0.2 mL的A、B、C、D、E、F、G母液于0.2 L的人工海水中,配成工作液。取3 mL工作液于10 mL试管中,用HCl和NaOH分别调每个试管中工作液的pH值,第1管调为pH 1,至第13管调为pH 13,合计13 管,为第1组。共做4 组,合计52 管。每管按V(藻种液)∶V(工作液)=1∶1接种。培养条件:温度为23 ℃;白光水草灯照射;光照时间为每日14 h;光照度:4 000 lx。每天定时振摇试管2~3 次,使藻种保持良好悬浮状态并与空气充分接触。分别于15、45、75、105 d计数1、2、3、4组中每管中的藻养殖密度。测定培养105 d藻液的pH值和培养液中β-胡萝卜素和叶黄素的含量。
在不同照射光波长实验中,采用血球板计数法测定藻种每毫升培养液中的藻细胞数量(即藻养殖密度)。依次加0.5 mL的A、B、C、D、E、F、G母液于0.5 L的人工海水中,配成工作液。取50 mL工作液于250 mL锥形瓶中,合计6 瓶,分3 组,每组2 瓶,分别用红光、蓝光、白光光源照射培养。每瓶按V(藻种液)∶V(工作液)=1∶1接种。培养条件:温度为23 ℃;光照时间为每日14 h;光照度:4 000 lx。每天定时摇瓶2~3 次,使藻种保持良好悬浮状态并与空气充分接触。分别于20、40 d计数每瓶中的藻养殖密度。测定40 d培养液中β-胡萝卜素和叶黄素的含量。
1.3.3 培养液中类胡萝卜素的萃取
取3 mL培养液于10 mL离心管中,2 000 r/min离心3 min,弃去上清。向管中沉淀加入1 mL甲醇,超声30 s,涡旋振荡30 s,2 000 r/min离心1 min,收集甲醇萃取液,向黄色沉淀中加入1 mL乙酸乙酯,超声30 s,涡旋振荡30 s,2 000 r/min离心1 min,沉淀为白色,收集萃取液,与甲醇萃取液合并,滤液用甲醇定容至5 mL,过0.45 μm滤膜,供C 18-HPLC分析。
1.3.4 类胡萝卜素组分的C 18-HPLC检测
HPLC条件:色谱柱为C 18Diamonsil TM(4.6 mm× 250 mm,5 μm);流动相A为乙腈-水(9∶1,V/V),流动相B为乙酸乙酯,流速为1 mL/min;检测波长为450 nm;进样量为20 μL;梯度:在20 min内,流动相B由0%上升至100%(线性)。根据与β-胡萝卜素和叶黄素参比样品的保留时间和光谱特征的比较,对样品中β-胡萝卜素和叶黄素组分定性。用叶黄素和β-胡萝卜素参比样品分别制作标准曲线。每根曲线由6 个点组成(包括原点),R 2>0.992 0。外标法定量样品中β-胡萝卜素和叶黄素组分。
1.3.5 藻细胞中类胡萝卜素含量的计算
藻细胞中各类胡萝卜素组分(β-胡萝卜素和叶黄素)的含量计算见下式。
式中:x为每个藻细胞中类胡萝卜素组分的含量/(ng/个);a为培养液类胡萝卜素组分含量/(μg/mL);b为每毫升培养液中藻细胞数量,即藻养殖密度/(个/mL)。
所有实验重复3 次以上,取平行数据计算结果。藻计数和类胡萝卜素含量分析数据的相对误差均小于7%。
2.1 杜氏藻中类胡萝卜素的C 18-HPLC分离
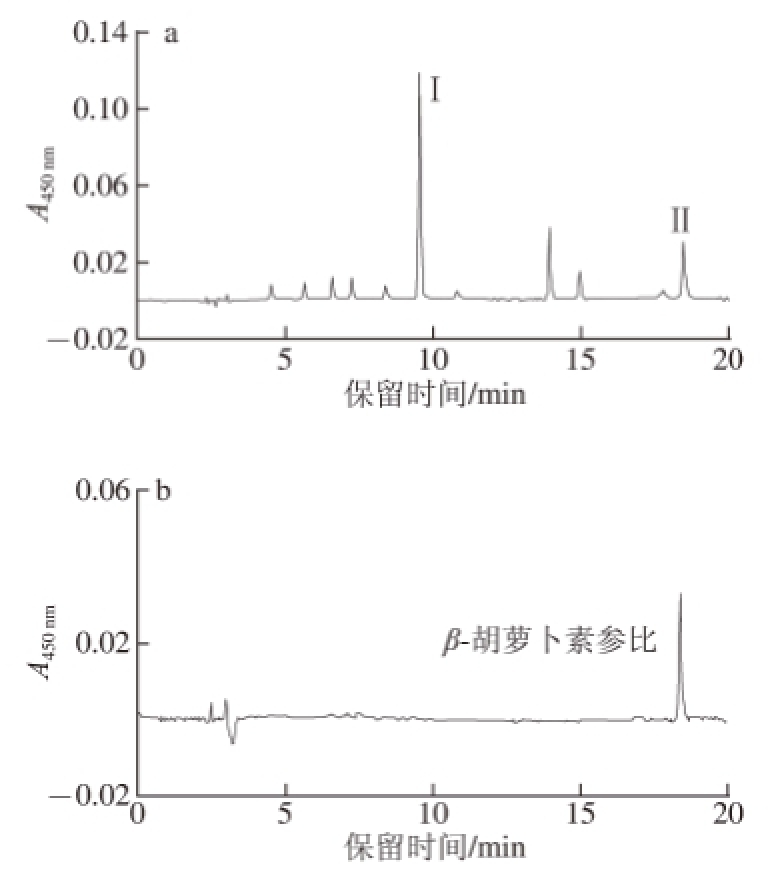
图2 杜氏藻萃取物的CC
1188-HHPPLLCC图
Fig.2 C
18-HPLC chromatogram of extracts from Dunaliella salina
图2是一个典型的光合生物体脂溶性萃取物的C 18-HPLC图。主要脂溶性色素包括:叶绿素c、叶绿素d、叶黄素、β-胡萝卜素等 [19]。通过与β-胡萝卜素和叶黄素参比样品的保留时间和光谱特征比较,鉴定色谱图上峰I和Ⅱ分别为叶黄素和β-胡萝卜素。其中,β-胡萝卜素作为叶黄素合成的前体而存在 [20]。
2.2 杜氏藻对环境pH值的调节能力

图3 培养过程中培养液pH值的变化
Fig.3 Variation in medium pH during culture
由图3可知,尽管培养液的初始pH值不同(从1~13),经过105 d的藻培养,所有培养液的pH值均发生变化,趋向中性。初始pH值为1和2的培养液变成2;初始pH值为3和4的培养液变为5;初始pH值为5和6的培养液变为6;初始pH值为7~9的培养液最终变为7;初始pH值为10~13的培养液最终变为9。这是一个可能引起兴趣的现象,合理的解释是:杜氏藻作为一种生物,可以自身合成一些物质,并释放到体外,调节环境的pH值,使环境发生有利于自己生存的变化。这一现象也可以解释为酸性和碱性环境对于杜氏藻来说属于逆境。这些逆境条件可以刺激杜氏藻体内的次生代谢系统合成某些次生代谢产物,用以调节环境pH值,使之向对自身生存有利的方向变化。当然,这些解释需要通过进一步的实验来证实。
目前,我国的主要杜氏藻养殖基地均位于内陆盐湖上。这些湖泊的pH值均偏碱性。在本研究中观察到的现象提示:在这些盐湖中大量生长的杜氏藻可能对湖水的pH值有一定的调节作用。这一作用需要引起应有的关注,并做进一步的研究来证实。
2.3 培养基初始pH值对藻养殖密度的影响
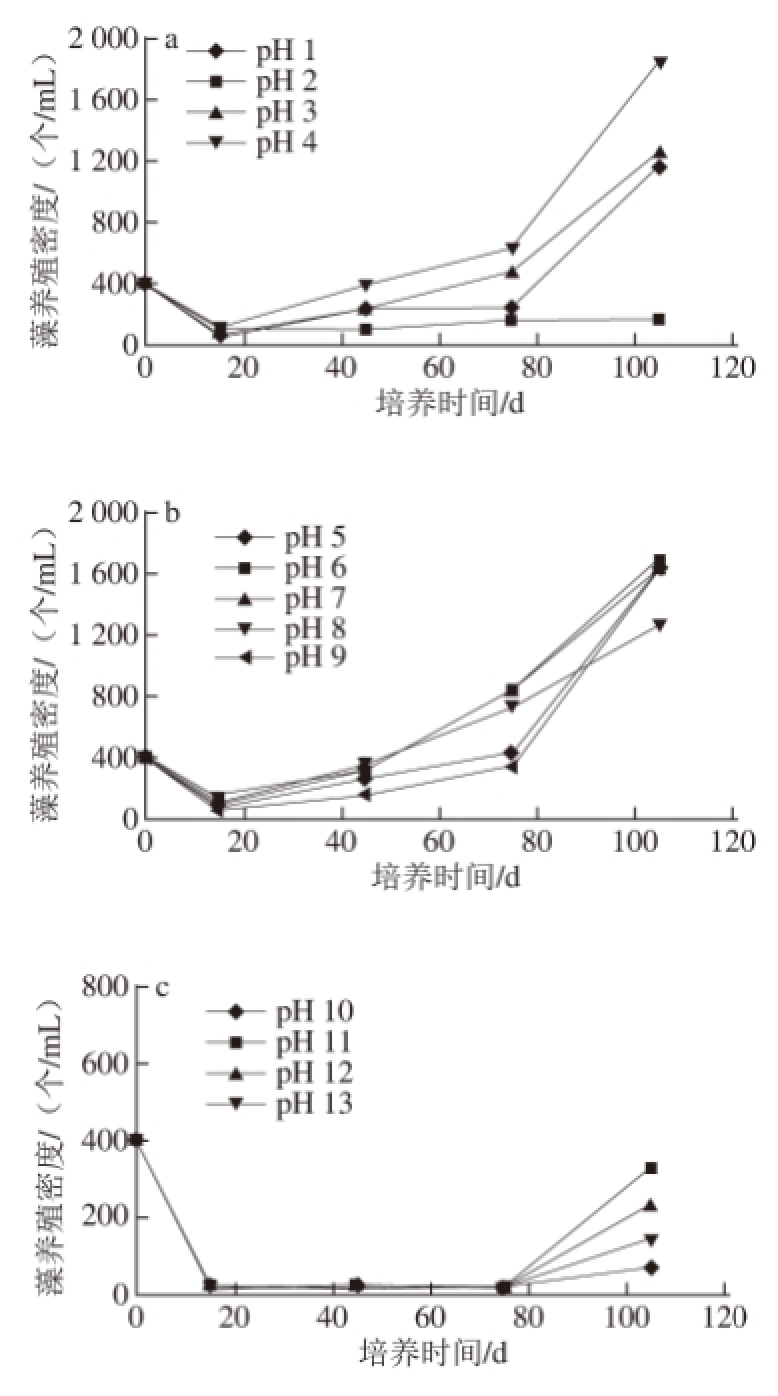
图4 培养基初始pH值对藻养殖密度的影响
Fig.4 Effect of initial medium pH on Dunaliella salina culture density
图4为不同初始pH值的培养基对藻养殖密度的影响。从三者的比较可以看出:杜氏藻在初始中性(pH 4~9)条件下培养时,其养殖密度的增加是最大的。相对比较起来,其养殖密度在初始酸性(pH 1~3)条件下的增长幅度较其在初始碱性(pH 10~13)条件下的增长幅度要大。当初始pH值为2和10时,杜氏藻的养殖密度增幅极小,基本上处于生长停滞的状态。本实验的结果表明:初始pH值为2和10的环境可抑制杜氏藻的生长。其代谢方面的特点有待于进一步探索。当初始pH值为4时,杜氏藻培养液中的养殖密度达到1 851 个/mL,增幅最大,超过了其在初始pH值为7时的增幅。这也是一个值得深入研究的现象。本研究中观察到:当培养基初始pH值为14时,在显微镜下观察,杜氏藻细胞全部死亡,这一现象表明:杜氏藻存活的pH值上限为13。
如前所述,在我国,无论是在沿海的盐田,还是在内陆的盐湖环境中,高盐碱性的条件比较常见,高盐酸性条件少见。本实验结果表明,如果在杜氏藻的养殖生产中调整接种时的初始pH值为4,可以获得较大的藻养殖密度。这一结论有待于大规模养殖实验来证实。
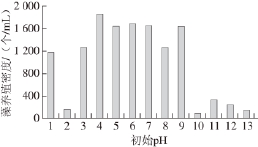
图5 培养105 d后的藻养殖密度
Fig.5 Dunaliella salina culture density after 105-day culture
由图5可知,当培养基初始pH值为4~9时,经过105 d的培养,培养液中藻的养殖密度较高,其中初始pH 4时,培养液中藻的养殖密度最高;当初始pH值为1和3时,培养液中藻的养殖密度其次;初始pH值为2和10时,藻生长极缓慢,养殖密度基本没有增加;当初始pH值为11~13时,培养液中藻的养殖密度较低。
2.4 不同初始pH值培养105 d后培养液中的类胡萝卜素含量
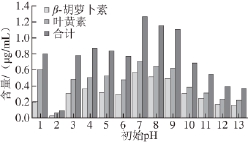
图6 不同初始pH值培养105 d后培养液中的类胡萝卜素含量
Fig.6 Carotenoid content in culture liquid after 105 days of culture
由图6可知,当培养基初始pH值为7~9时,经过105 d的培养,培养液中β-胡萝卜素和叶黄素的含量较高,β-胡萝卜素含量达到0.489~0.561 μg/mL,叶黄素含量达到0.610~0.700 μg/mL。其中,当培养基初始pH值为7时,培养液中的叶黄素和β-胡萝卜素的含量最高,这很可能是由于在此条件下藻养殖密度较高造成的。与之相比,当培养基初始pH值为4时,培养液中藻养殖密度最大,但叶黄素和β-胡萝卜素含量并不高。这一现象表明,培养基初始pH值为4时,杜氏藻细胞中类胡萝卜素的合成水平较低。
2.5 不同初始pH值培养105 d后藻细胞中的类胡萝卜素含量
由图7可知,当培养基初始pH值为11~13时,经过105 d的培养,单个细胞内,β-胡萝卜素含量达到0.603~0.730 ng,叶黄素含量达到0.897~0.979 ng。这说明初始培养条件为强碱性时,杜氏藻体内的类胡萝卜素合成可达到较高水平。
这一观察结果可为生产实践提供有价值的改进思路。例如:培养基初始pH值为4时,培养液中的藻养殖密度可达到最高。培养基初始pH值为11~13时,杜氏藻养殖体内类胡萝卜素合成水平可达到最大水平。
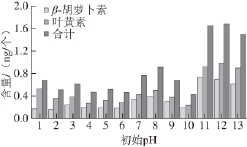
图7 不同初始pH值培养105 d后单个细胞中的类胡萝卜素含量
Fig.7 Carotenoid amount in single cells after 105-day culture
2.6 不同照射光波长对藻养殖密度的影响
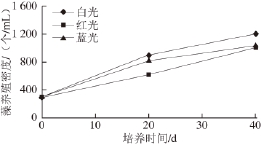
图8 不同照射光波长对藻养殖密度的影响
Fig.8 Effect of illumination wavelength on Dunaliella salina culture density
由图8可知,杜氏藻养殖密度在430 nm(蓝光)、630 nm(红光)和全波长光(白光)的照射下均增加,且增加幅度接近,白光照射的效果略好。培养40 d后,白光、红光、蓝光照射的藻养殖密度分别为1 205、1 008、1 043 个/mL。
2.7 不同光照培养40 d后培养液中类胡萝卜素的含量
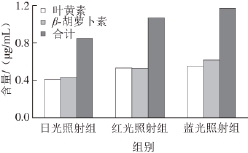
图9 不同光照下培养40 d后培养液中的类胡萝卜素含量
Fig.9 Carotenoid contents in culture liquid after 40-day culture under illumination at different wavelengths
由图9可知,蓝光和红光照射均可增加培养液中叶黄素和β-胡萝卜素的含量。其中蓝光效果更显著。
2.8 不同光照培养40 d后杜氏藻单个细胞中类胡萝卜素的含量
由图10可知,与白光照射相比,蓝光和红光照射均可明显增加杜氏藻单个细胞中的叶黄素和β-胡萝卜素的含量。其中蓝光效果更显著,单个细胞中叶黄素含量达到0.524 ng,β-胡萝卜素含量达到0.589 ng。培养40 d后培养液中叶黄素和β-胡萝卜素的含量增加可能是由于藻细胞中二者积累量增加所致。
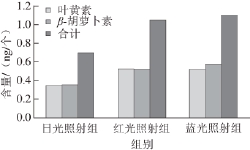
图10 不同光照下培养40 d后单个细胞中类胡萝卜素的含量
Fig.10 Carotenoid amount from single cells after 40-day culture at different wavelength lights
本实验结果表明:不同波长的照射光对杜氏藻的养殖密度影响并不大。但无论是长波长光还是短波长光(如红光或蓝光)均可增加藻细胞内类胡萝卜素的积累水平,其中短波长光的效果更为明显。在藻的养殖过程中调节环境pH值、进行双波长光照等设想可以用以增加类胡萝卜素类物质在藻细胞中的积累。这些设想在经过大规模生产实践的检验后,对生产技术的改进具有一定的实用意义。
人们对杜氏藻感兴趣主要是由于其可以自身合成并积累丰富的β-胡萝卜素。这使得杜氏藻具有被应用于商业生产的价值。第一个使用杜氏藻生产β-胡萝卜素的试点工厂成立于1966年,由前苏联建设。从此围绕这种嗜盐微生物,一项成功的高科技产业逐步发展成型。目前,这一技术已发展成在精细条件控制下的高密度集约化养殖技术。同时,国内对杜氏藻中类胡萝卜素类物质相关合成酶的表达研究也已展开 [21],这有助于从分子层面解释培养条件对杜氏藻中类胡萝卜素类物质代谢的影响。
参考文献:
[1] MASSYUK N P. Morphology, taxonomy, ecology and geographic distribution of the genus Dunaliella Teod. and prospects for its potential utilization[M]. Kiev: Naukova Dumka Press, 1973: 242.
[2] PREISIG H R. Morphology and taxonomy[M]//BEN-AMOTZ A,AVRON M. Dunaliella: physiology, biochemistry and biotechnology. Boca Raton: CRC Press, 1992: 1-15.
[3] OLMOS J, PANIAGUA J, CONTRERAS R. Molecular identification of Dunaliella sp. utilizing the 18S rDNA gene[J]. Letters in Applied Microbiology, 2000, 30: 80-84.
[4] OREN A, GUREVICH P, ANATI D A, et al. A bloom of Dunaliella parva in the Dead Sea in 1992: biological and biogeochemical aspects[J]. Hydrobiologia, 1995, 297: 173-185.
[5] LOEBLICH L A. Aplanospores of Dunaliella salina (Chlorophyta)[J]. Journal Protozoolngy, 1969, 16: 22-23.
[6] BOROWITZKA L J. The microflora: adaptations to life in extremely saline lakes[J]. Hydrobiologia, 1981, 81: 33-46.
[7] BROCK T D. Salinity and the ecology of Dunaliella from Great Salt Lake[J]. Journal of General Microbiology, 1975, 89: 285-292.
[8] van AUKEN O W, McNULTY I B. The effect of environmental factors on the growth of a halophylic species of algae[J]. The Biological Bulletin, 1973, 145: 210-222.
[9] POST F J. The microbial ecology of the Great Salt Lake[J]. Microbial Ecology, 1977, 3(2): 143-165.
[10] KAPLAN I R, FRIEDMANN A. Biological productivity in the Dead Sea. Part I. Microorganisms in the water column[J]. Israel Journal of Chemistry, 1970, 8: 513-528.
[11] JOHNSON M K, JOHNSON E J, MacELROY R D, et al. Effects of salts on the halophilic alga Dunaliella viridis[J]. Journal of Bacteriology, 1968, 95: 1461-1468.
[12] 焉翠蔚, 卢元芳, 李延团, 等. NaCl对杜氏杜氏藻生长的效应[J]. 曲阜师范大学学报, 1995, 21(1): 65-68.
[13] 韦芳三, 李纯厚, 戴明, 等. 盐度变化对杜氏藻生物量和总脂含量的影响[J]. 湖南农业科学, 2011(1): 134-135; 139.
[14] 王富平, 郭连城, 丁淑华. 环境因子对杜氏藻生长和色素的影响[J].海湖盐与化工, 1995, 23(1): 30-33.
[15] 秦彩云, 范丰梅, 郑维发. 过氧化氢对不同光质下杜氏藻SZ-05生长及代谢产物积累的影响[J]. 徐州师范大学学报: 自然科学版, 2009,27(1): 87-91.
[16] 郑亚君, 王翠红, 许萌萌, 等. 温度对杜氏藻生长和脂肪酸组成的影响[J]. 山西大学学报: 自然科学版, 2011, 34(增刊2): 123-126.
[17] 张学成, 孟振, 时艳侠, 等. 光照、温度和营养盐对三株盐生杜氏藻生长和色素积累的影响[J]. 中国海洋大学学报, 2006, 36(5):754-762.
[18] 高悦勉, 赵梓晴, 孙金阳, 等. 单胞藻培养中充入CO 2的增产效果研究[C]//2009年中国水产学会学术年会论文摘要集. 海口: 中国水产学会, 2009: 9.
[19] 惠伯棣, 欧阳清波, 曾悦. 植物食品中类胡萝卜素的高压液相色谱检测[J]. 中国食品添加剂, 2002(5): 72-82.
[20] 惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社,2005: 74-92.
[21] 章丽, 龚一富, 刘晓丹, 等. 盐生杜氏藻β-胡萝卜素羟化酶基因(chyb)的克隆及表达分析[J]. 农业生物技术学报, 2013, 21(8): 920-930.
Effects of Culture Medium pH and Illumination Wavelength on Carotenoid Content of Dunaliella salina
WANG Zi, HUI Bodi*, GONG Ping
(College of Applied Arts and Science, Beijing Union University, Beijing 100191, China)
Abstract:This study aims to explore the effects of initial pH of culture medium and different illumination wavelengths on the contents of carotenoids including β-carotene and lutein from Dunaliella salina during culture. In experiments, media with different pH values were prepared and used to culture Dunaliella salina for 105 days. Under the illumination of white(full wavelengths), red (630 nm) and blue light (430 nm), medium with pH 7 was applied to culture Dunaliella salina for 40 days. Dunaliella salina culture density was then determined while β-carotene and lutein contents were assessed from culture liquid. Data obtained from the experiments suggested that: 1) Dunaliella salina was able to adjust the environmental pH to neutral. After 105-day culture, an increased Dunaliella salina culture density was observed from culture liquids with original pH 10-13, pH 1-3 and pH 4-9 while the maximum Dunaliella salina culture density was counted at pH 4 (1 851 cell counts/mL). Higher β-carotene (0.489-0.561 μg/mL) and lutein (0.610-0.700 μg/mL) contents were observed from culture liquids with original medium pH 7-9, while higher β-carotene (0.603-0.730 ng) and lutein (0.897-0.979 ng) contents were seen from single cells with original medium pH 11-13; 2) Dunaliella salina culture density could increase under illumination at the full-range wavelength, red (630 nm) and blue light (430 nm) after 40- day culture. Both red and blue lights were able to induce increased contents of β-carotene (0.589 ng) and lutein (0.524 ng) from single cells while blue light was the most effective.
Key words:Dunaliella salina; carotenoid; lutein; β-carotene
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2015)23-0183-06
doi:10.7506/spkx1002-6630-201523034
收稿日期:2015-01-14
基金项目:北京联合大学2015年“启明星”大学生科技创新项目(201511417SJ061)
作者简介:王梓(1993—),女,本科,研究方向为食品科学与工程。E-mail:530767155@qq.com
*通信作者:惠伯棣(1959—),男,教授,博士,研究方向为类胡萝卜素化学及生物化学。E-mail:bodi_hui@buu.edu.cn