抗瓜类细菌性果斑病菌单克隆抗体的制备及特性鉴定
曾海娟
1,王广彬
2,郭慧琴
3,邱 实
1,李建武
1,翟绪昭
1,丁承超
1,宋春美
1,刘 箐
1,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.徐州绿健乳品饮料有限公司,江苏 徐州 221006;3.上海慧耘生物科技有限公司,上海 200433)
摘 要:以瓜类细菌性果斑病菌燕麦嗜酸菌西瓜亚种(Acidovorax avenae subsp. citrulli,Aac)野生型菌株SD01免疫BALB/c小鼠,间接酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法筛选获得4 株稳定分泌抗SD01菌株的单克隆杂交瘤细胞株6F、6D、7E、4F,腹水抗体效价分别为1∶102 400、1∶102 400、1∶25 600、1∶51 200。采用饱和硫酸铵沉淀及Protein-G亲和层析法纯化腹水,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)显示纯化后的单克隆抗体(mAb)纯度较高,纯化后单克隆抗体(2 mg/mL)效价分别为1∶12 800、1∶6 400、1∶3 200、1∶6 400,亚型鉴定结果表明4 种单克隆抗体均为IgG2 a。间接ELISA结果表明,4 种单克隆抗体对8 种果斑病菌结合能力不同:6F可以结合6 种,6D、4F可以结合8 种,7E可以结合5 种。与3 种非Aac近源种植物病原菌交叉反应情况为:6F、4F与2 种非Aac近源种植物病原菌存在交叉反应,6D、7E与3 种非Aac近源种植物病原菌均无交叉反应。
关键词:细菌性果斑病菌;单克隆抗体;制备;特性鉴定
瓜类细菌性果斑病(bacterial fruit blotch,BFB)是一种严重的细菌性病害,可引起西瓜、甜瓜等多种葫芦科植物患病。其病原体为燕麦嗜酸菌西瓜亚种(Acidovorax avenae subsp. citrulli,Aac),又称果斑病菌、西瓜斑菌,是一种具有极高破坏性的革兰氏阴性种传病菌。它可侵染果实、植株及种子,该病菌抗干旱能力非常强
[1],可在种子表面存活4~5 个月
[2]。带菌果实表面初期会出现水渍状斑点,最终导致整个果实腐烂,所引起的病害具有发病快、传播性强等特点,感染此病害会导致瓜类大量减产
[3]。
果斑病菌快速检测方法主要有基于聚合酶链式反应(polymerase chain reaction,PCR)的检测方法和免疫学方法。基于PCR的检测方法主要有巢式PCR(nested-PCR)
[4]、免疫PCR
[5-7]、实时荧光定量PCR
[8-9]、等温DNA扩增技术
[10-11]等,该类方法具有灵敏度高等优点,但需要精密的热循环仪器,对技术人员和设备也有一定的要求。免疫学方法是以抗体特异性识别并结合相应的抗原为基础的快速检测技术,与传统检测方法及上述检测方法相比,具有特异性强、快速、操作简便等优点,目前已广泛用于植物病原菌的检测,已报道的可用于果斑病菌检测的免疫学方法主要有酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)
[12]、免疫磁珠技术
[13]、免疫试纸条技术
[14-15]、蛋白宏阵列
[16]等。但免疫学技术的建立依赖于特异性的单克隆抗体,单克隆抗体专一性是免疫学检测方法的重要因素,但基于细菌血清型复杂、近源种较多等原因,特异性抗体的获取极为困难,因此特异性单克隆抗体是病原细菌免疫学检测的重要瓶颈,本实验拟制备抗果斑病菌的单克隆抗体,并对抗体的特性(效价、纯度、特异性)进行鉴定,旨在为建立特异、快速、简便的果斑病菌免疫学检测新技术奠定基础,关于该细菌单克隆抗体目前尚未见国内外报道。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 菌株与培养基
Aac标准菌株ATCC 29625,Aac野生菌株SD01、99-5、xj112、PLSB1、00-1、plsb91、tw31由中国检验检疫科学研究院从国内外瓜类产品中截获后分离所得,已进行了分离鉴定、柯赫氏法则等的验证;燕麦嗜酸菌卡特莱兰亚种NCPPB 961、嗜酸菌魔芋亚种ATCC 33996、玉米细菌性条斑菌ATCC 19307,由中国检验检疫科学研究院动植物检疫所提供。
金氏B培养基、脑心浸液培养基购自北京陆桥技术有限公司。
1.1.2 细胞与动物
骨髓瘤细胞SP2/0为上海理工大学有害微生物危害与控制研究所保存。
6~8 周龄SPF级BALB/c雌性小鼠(体质量约20 g),购自第二军医大学动物中心。
1.1.3 试剂
液体石蜡、8-氮鸟嘌呤(8-azaguanine,8-AG)、聚乙二醇(polyethylene glycol,PEG)、50×HAT(次黄嘌呤(hypoxanthine)、氨喋呤(aminopterin)、胸腺嘧啶核苷(thymidine))、50×HT(次黄嘌呤、胸腺嘧啶核苷)、辣根过氧化物酶(horse reddish peroxidase,HRP)标记的羊抗鼠IgG抗体 美国Sigma公司;Taq DNA聚合酶及其他PCR试剂 生工生物工程(上海)股份有限公司;本实验所用引物根据Walcott等
[17]报道,由生工生物工程(上海)股份有限公司合成,其核苷酸序列为:WFB1:GACCAGCCACACTGGGAC,WFB2:CTGCCGTACTCCAGCGAT;Biosun胎牛血清上海博升生物科技有限公司;DMEM高糖培养基 美国Invitrogen公司;单克隆抗体亚型鉴定二抗 洛阳佰奥通实验材料中心;Protein G亲和层析柱 美国GE Healthcare公司;25 mL细胞培养瓶、96 孔细胞培养板、24 孔细胞培养板 无锡耐思生物科技有限公司;其余常规试剂均为分析纯 国药集团化学试剂有限公司。
1.1.4 仪器与设备
PCR热循环仪 美国Applied Biosystems公司;凝胶成像仪 英国Syngene公司;Mini-power电泳仪、蛋白提纯仪、Mini-PROTEAN Tetra电泳仪 美国伯乐公司;SpectraMax M2多功能酶标仪 美国分子仪器公司;CO
2恒温培养箱 美国Thermo公司。
1.2 方法
1.2.1 菌株鉴定及细菌培养基选择
8 种果斑病菌菌株先在脑心浸液液体培养基中进行增菌培养,后在其固体培养基划线,挑单菌落于脑心浸液培养基中培养后进行PCR鉴定,并测定其在600 nm波长处的光密度(OD)值,选取生长较快的一株菌株作为免疫菌株。挑取该菌株的单菌落分别于脑心浸液液体培养基及金氏B液体培养基中37 ℃培养18 h后,采用梯度稀释涂平板计数,比较该菌株在2 种培养基中生长快慢程度。
1.2.2 Aac免疫小鼠方法
选择效果好的培养基进行SD01单菌落接菌,灭菌生理盐水离心重悬3 次,并调整菌浓度为10
8CFU/mL,免疫方案如表1所示。第4次免疫后第7天断尾采血,分离血清,采用间接ELISA法测定抗体效价。间接ELISA条件如下:甲醛灭活的全菌抗原的包被浓度为10
8CFU/mL,37 ℃包被2 h,质量分数3%的脱脂奶粉封闭1.5 h,血清100 μL/孔,37 ℃孵育1 h,PBST(phosphate buffered saline(磷酸盐缓冲液)+ Tween-20)洗涤3 次,HRP标记的羊抗鼠IgG 100 μL/孔,37 ℃反应1 h后PBST洗涤3 次,四甲基联苯胺(tetramethylbenzidine,TMB)显色液显色15 min,2 mol/L浓H
2SO
4终止反应,450 nm波长处测定OD值。以实验组OD
450
nm/阴性对照组OD
450
nm(P/N)≥2.1判定为阳性,以血清最大稀释倍数的阳性孔作为该小鼠血清效价。取血清效价最高小鼠的脾细胞用于细胞融合,融合前72 h进行小鼠腹腔冲击免疫,抗原剂量为0.6 mL/只。
表1 小鼠免疫程序
Table 1 Immunization schedule

(CFU/mL) 免疫方式 有无佐剂第1次免疫 第0天 0.4 10
8 皮下注射 无第2次免疫 第14天 0.4 10
8 腹腔注射 无第3次免疫 第28天 0.4 10
8 腹腔注射 无第4次免疫 第42天 0.4 10
8 腹腔注射 无冲击免疫 融合前3 d 0.6 10
8 腹腔注射 无项目 免疫时间 免疫剂量/(mL/只)菌体浓度/
1.2.3 细胞融合及筛选
摘眼球取血后,脊椎脱臼处死小鼠取脾脏,用注射器研磨获得脾细胞悬液,与SP2/0细胞分别用无血清培养基离心重悬3 次,并经血球计数板计数,按数量比5∶1混合后离心去上清液,以体积分数50%的PEG进行融合,含体积分数10%胎牛血清的DMEM高糖培养基终止融合,按10
5个/孔铺于已铺饲养层细胞的96 孔板中。杂交瘤细胞采用HAT培养基筛选,待细胞铺满孔底70%~80%时,取上清液,采用间接ELISA法测定抗体效价,以未处理的小鼠血清作为阴性对照。阳性孔细胞以有限稀释法进行克隆化,亚克隆过程改用HT培养基培养,间接ELISA法筛选,每次克隆筛选到的阳性孔扩大培养后冻存于液氮中。
1.2.4 腹水制备及抗体效价测定
采用体内诱生法制备腹水
[18]。将液体石蜡按0.5 mL/只腹腔注射致敏小鼠,7 d后杂交瘤细胞按10
6个/只腹腔注射已致敏小鼠,待小鼠腹腔膨大、精神不佳后无菌收集腹水,离心取上清液,倍比稀释,间接ELISA法测定腹水抗体效价,以腹水抗体最大稀释倍数的阳性孔作为该抗体效价。
1.2.5 抗体纯化及纯度测定
单克隆抗体腹水经饱和硫酸铵沉淀初步纯化后,再经Protein-G柱亲和层析纯化。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)测定纯化后抗体的纯度,参照文献[19]原理进行,样品于100 ℃条件下干浴5 min,加样量为20 μg,考马斯亮蓝R250染色,以脱色液进行脱色。
1.2.6 纯化后抗体效价及亚型鉴定
亚型鉴定采用间接ELISA法,按照小鼠单克隆抗体亚型分类试剂盒(IgG1、IgG2 a、IgG2 b、IgG3、IgA、IgM)说明书方法进行,2 mg/mL单克隆抗体均稀释1 000 倍,亚型鉴定羊抗鼠IgG抗体稀释1 000 倍。效价测定采用间接ELISA法,P/N≥2.1的抗体最大稀释倍数为该单克隆抗体的效价。
1.2.7 抗体特异性分析
间接ELISA法测定抗体对8 种果斑病菌及3 种非Aac植物病原菌结合情况,以10
8CFU/mL的上述11 种菌包被酶标板,2 mg/mL单克隆抗体均稀释1 000 倍,测定在450 nm波长处的OD值。
2 结果与分析
2.1 PCR鉴定结果

图1 8 种果斑病菌的PCR鉴定结果
Fig.1 PCR identification of Aac
M. Marker;1. ATCC 29625;2. SD01;3. PLSB1;4. xj112;5. 00-1;6. plsb91;7. 99-5;8. tw31。
由图1可知,8 种果斑病菌在360 bp处均出现亮条带,表明这8 种细菌均为Aac。另外,条带的亮度可能与基因表达量有关
[20]。
2.2 8 种菌生长快慢程度及培养基选择结果

图2 8 种果斑病菌生长快慢比较
Fig.2 Comparison of the growth speeds of bacterial fruit blotch

图3 菌株SD01在两种培养基中的生长效果
Fig.3 Comparison of the growth of strain SD01 in two media
a. 脑心浸液液体培养基;b. 金氏B液体培养基。
分别挑取8 种果斑病菌的单菌落于脑心浸液液体培养基中,培养相同时间后测定其在600 nm波长处的OD值。由图2可知,8 种Aac菌株在脑心浸液液体培养基中37 ℃培养18 h后,菌株SD01的OD
600
nm值最高,表明其生长速率最快,因此选择此菌株作为免疫菌株。挑取菌株SD01的单菌落于脑心浸液液体培养基和金氏B液体培养基中培养相同时间,分别将菌液依次10 倍稀释至稀释度为10
-6,涂平板计数,由图3可知,菌株SD01在两种培养基中生长速率差异较大,在脑心浸液培养基中生长较快,计数后得出其在两种培养基中的菌体浓度分别为1.3×10
9、4.1×10
8CFU/mL。
2.3 小鼠血清效价
将3 只小鼠血清分别稀释1 000、5 000、10 000、50 000 倍,血清效价测定结果如表2所示。1、2、3号小鼠血清效价分别可达到1∶10 000,1∶50 000,1∶5 000。2号小鼠血清稀释50 000 倍时,P/N为3.7,效价最高,因此选择2号小鼠加强免疫后进行细胞融合。
表2 小鼠血清效价比较(P//NN)
Table 2 Comparison of serum titers of mice (P/N)

小鼠编号 血清稀释倍数(×10
3)1 5 10 50 1 5.7 3.9 2.6 1.4 2 11.6 6.2 5.6 3.7 3 7.3 3.7 1.9 1.1
2.4 单克隆抗体筛选
在两种细胞融合实验中,共铺8 块96 孔细胞培养板,其中701 个孔有杂交瘤细胞生长,杂交瘤融合率为91.3%,经间接ELISA法筛选,得到4 孔具有特异性抗菌株SD01的杂交瘤细胞。在克隆化过程中有3 株杂交瘤细胞经3 次亚克隆后阳性克隆率为100%,命名为6F、6D、7E;有1 株杂交瘤细胞经4 次亚克隆后阳性克隆率达100%,命名为4F。4 株杂交瘤细胞经多次传代、反复冻存及复苏后,抗体分泌能力稳定。
2.5 腹水制备及纯化后抗体效价及亚型测定结果
间接ELISA测定4 株杂交瘤细胞株6F、6D、7E、4F的腹水抗体效价,阴性对照为未免疫的小鼠血清,对照值(N)为0.11。如图4a所示,杂交瘤细胞株6F、6D、7E、4F的腹水抗体效价分别为1∶102 400、1∶102 400、1∶25 600、1∶51 200。纯化后的抗体(2 mg/mL)效价如图4b所示,阴性对照为小鼠血清,对照值(N)为0.15,纯化后抗体效价分别为1∶12 800、1∶6 400、1∶3 200、1∶6 400,抗体亚型均为IgG2 a。

图4 腹水抗体及纯化后抗体的效价
Fig.4 Titers of ascites and purified antibodies
a. 腹水抗体;b. 纯化后抗体。
2.6 纯化单克隆抗体的SDS-PAGE分析

图5 纯化单克隆抗体的SDS-PAGGEE图
Fig.5 SDS-PAGE of purified monoclonal antibodies
M. Marker;1. 6F;2. 6D;3. 7E;4. 4F。
由图5可知,经硫酸铵沉淀及Protein-G柱亲和层析纯化后的4 株单克隆抗体分别都有一条约50 kD的重链、一条约25 kD的轻链,无多余的杂条带,表明腹水抗体中杂蛋白已经被除去,纯化后的抗体纯度较高。
2.7 抗体的特异性
间接ELISA检测4 种单克隆抗体对8 种果斑病菌结合情况:6F可以结合6 种果斑病菌,与00-1、tw31不结合,6D可以与8 种果斑病菌结合,7E可以结合5 种果斑病菌,与00-1、tw31、ATCC 29625不结合,4F可以结合8 种果斑病菌。与3 种非Aac近源植物病原菌交叉反应情况:6F与NCPPB 961、ATCC 33996有交叉反应,6D、7E与这3 种非Aac近源植物病原菌均无交叉反应,4F与ATCC 33996、ATCC 19307存在交叉反应,具体结果见表3。
表3 4 种单克隆抗体的特异性分析
Table 3 Specificity of monoclonal antibodies
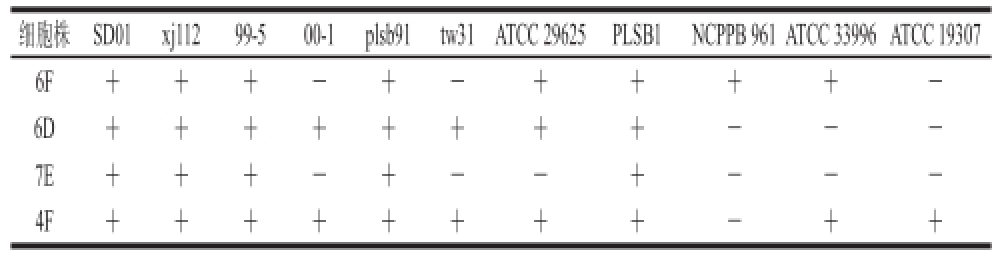
注:“+”表示能结合;“-”表示不能结合。
细胞株 SD01 xj112 99-5 00-1 plsb91 tw31ATCC 29625 PLSB1 NCPPB 961ATCC 33996ATCC 19307 6F+++-+- + + + + -6D++++++ + + - - -7E+++-+- - + - - -4F++++++ + + - + +
3 讨 论
本实验在选择免疫菌株时,采用检测OD
600
nm值进行菌株生长快慢的比较,而在选择培养基时,采用涂布平板计数法进行菌株生长快慢的比较,这是由于金氏B液体培养基本身就是混浊的,不能通过比较混浊度(OD
600
nm)来判定细菌浓度的大小。选取了两种液体培养基:脑心浸液培养基、金氏B培养基,前者营养成分较好,适用于营养苛求菌的培养;而金氏B培养基是果斑病菌国标上选用的培养基,因此本实验比较了菌株SD01在这两种培养基上生长的快慢。比较菌株生长快慢的目的是细菌只有在最适培养条件下,才会完全、充分地表达抗原,同时可缩短间接ELISA实验时间,较快地得到检测结果,进而可以较早处理阳性克隆孔。免疫小鼠时采用甲醛灭活的野生菌株SD01,免疫过程中未使用佐剂,由于全菌抗原比较完整,使免疫后获得了较高的血清效价。
SP2/0细胞融合前先经小鼠腹腔复壮,再采用8-AG培养基培养3 代以上。克隆化过程中,第1次亚克隆按2~3 个细胞/孔铺板,第2次、第3次亚克隆均按1 个细胞/孔铺板,铺板3~4 d后观察并记录每孔实际细胞生长的克隆数,发现96 孔板最外围孔内的细胞状态较差,可能是由于从培养箱取出96 孔板进行计数的过程中,外围孔温度波动较大,也表明了在杂交瘤细胞生长过程中保持稳定的培养温度及CO
2浓度等的重要性。在获得单克隆杂交瘤细胞株后,可以采用体外培养法和体内诱生法生产单克隆抗体,本实验采用体内诱生法生产腹水,因为运用此法获得的腹水中抗体浓度较高,生产成本低。
据报道,采用硫酸铵沉淀纯化腹水时
[21]纯度为25%,回收率为63%,纯度较低,只能作为初步纯化手段,本实验纯化腹水采用饱和硫酸铵沉淀后又经Protein-G柱亲和层析纯化,SDS-PAGE显示纯化后单克隆抗体纯度较高。实验中的8 种果斑病菌菌株均来源于中国检验检疫科学研究院,是从国内外瓜类产品中截获分离后得到的,也是目前国内仅有的果斑菌菌株,基本可以代表已报道的菌株类型和血清型,更多的果斑菌菌株目前还难以获取。目前,非Aac近源菌感染西瓜等瓜类种子或植株的情况尚未见报道,因此本实验在抗体特异性鉴定时考察了8 种果斑病菌和3 种非Aac近源菌的结合情况。
本研究所获得的4 株单克隆抗体,为开发检测果斑病菌试剂盒提供了前提条件,也可进一步用于建立果斑病菌的免疫学快速检测技术,如ELISA检测方法、免疫层析试纸技术、等离子体共振技术等,并可与其他植物病原菌抗体配合,建立植物病菌的多通道检测方法,如蛋白芯片等。对多种检测方法进行评估,并根据检测需要选择适合的检测方法,以达到高灵敏度、操作简便、高通量的检测目的。
参考文献:
[1] BLOCK C C, SHEPHERD L M. Long-term survival and seed transmission of Acidovorax avenae subsp. citrulli in melon and watermelon seed[J]. Phytopathology, 2009, 99(6). doi: 10.1094/PHP-2008-1219-01-BR.
[2] 李艳嫦, 孔静月, 吴九玲, 等. 西瓜细菌性果斑病菌在不同场所存活期的检测[J]. 华中农业大学学报, 2012, 31(3): 332-336.
[3] DUTTA B. Localization of Acidovorax citrulli in watermelon seed and its influence on survival and seedling transmission of bacterial fruit blotch of cucurbits[D]. Athens: University of Georgia, 2011: 1-17.
[4] 王婧, 毕阳, 朱艳, 等. 巢式PCR快速检测西瓜细菌性果斑病菌[J].中国农业科学, 2014, 47(2): 284-291.
[5] WANG Xiao, ZHANG Le, XU Fushou, et al. Immuno-capture PCR method for detecting Acidovorax avenae subsp. citrulli from watermelon[J]. Chinese Journal of Agricultural Biotechnology, 2007,4(2): 173-179.
[6] 徐福寿, 王笑, 谢关林, 等. 免疫捕捉PCR法检测西瓜种子带细菌性果斑病菌[J]. 果树学报, 2008, 25(2): 215-218.
[7] BAHAR O, EFRAT M, HADAR E, et al. New subspecies-specific polymerase chain reaction-based assay for the detection of Acidovorax avenae subsp. citrulli[J]. Plant Pathology, 2008, 57(4): 754-763.
[8] ZHAO T, FENG J J, SECHLER A, et al. An improved assay for detection of Acidovorax avenae subsp. citrulli in watermelon and melon seed[J]. Seed Science and Technology, 2009, 37(2): 337-349.
[9] HA Y, FESSEHAIE A, LING K S, et al. Simultaneous detection of Acidovorax avenae subsp. citrulli and Didymella bryoniae in cucurbit seedlots using magnetic capture hybridization and real-time polymerase chain reaction[J]. Phytopathology, 2009, 99(6): 666-678.
[10] OYA H, NAKAGAWA H, SAITO N, et al. Detection of Acidovorax avenae subsp. citrulli from seed using LAMP metho d[J]. Japanese Journal of Phytopathology, 2008, 74(4): 304-310.
[11] ZHANG J, TIAN Q, ZHU S, et al. Rapid on-site detection of Acidovorax citrulli by cross-priming amplifi cation[J]. Molecular and Cellular Probes, 2012, 26(4): 175-176.
[12] IMANANTO O, THUMMABENJAPONE P, LUXANANIL P, et al. Detection of Acidovorax avenae subsp. citrulli in plant samples using enzyme-linked immunosorbent assay[J]. Journal of International Society for Southeast Asian Agricultural Sciences, 2009, 15(1): 160-161.
[13] CHARLERMROJ R, HIMANANTO O, SEEPIBAN C, et al. Multiplex detection of plant pathogens using a microsphere immunoassay technology[J]. PLoS ONE, 2013, 8(4): e62344. doi:10.1371/journal.pone.0062344.
[14] 冯建军, 许勇, 李健强. 免疫凝聚试纸条和TaqMan探针实时荧光PCR检测西瓜细菌性果斑病菌比较研究[J]. 植物病理学报, 2006,36(2): 102-108.
[15] 粟寒, 吴翠萍, 李彬, 等. 免疫检测试纸条法检测西瓜子中的瓜类果斑病菌[J]. 植物检疫, 2009, 23(1): 12-13.
[16] 熊亮斌, 高丽萍, 刘箐, 等. 应用蛋白宏阵列快速检测西瓜细菌性果斑病菌[J]. 植物病理学报, 2011, 41(4): 432-436.
[17] WALCOTT R R, GITAITIS R D. Detection of Acidovorax avenae subsp. citrulli in watermelon seed using immunomagnetic separation and the polymerase chain reaction[J]. Plant Disease, 2000, 84(4): 470-474.
[18] 孙广瑞, 李小兵, 王哲. 制备分泌单克隆抗体杂交瘤细胞小鼠腹水的方法[J]. 中国现代医生, 2007, 45(5): 3-4.
[19] 萨姆布鲁克J, 弗里奇E F, 曼尼阿蒂斯T, 等. 分子克隆实验指南[M].金冬雁, 黎孟枫, 侯云德, 等译. 2版. 北京: 科学出版社, 1992:1713-1720.
[20] 王钊, 储丽红, 赵凯, 等. 利用免疫磁性分离-PCR检测安祖花细菌性枯萎病病原菌[J]. 园艺学报, 2013, 40(8): 1600-1608.
[21] 肖增鸿, 黄昭亮, 林月霞, 等. 腹水型单克隆抗体纯化方法的研究[J].中国医药生物技术, 2013(8): 425-428.
Preparation and Characterization of Monoclonal Antibody against Acidovorax avenae subsp. citrulli in Melons
ZENG Haijuan
1, WANG Guangbin
2, GUO Huiqin
3, QIU Shi
1, LI Jianwu
1, ZHAI Xuzhao
1, DING Chengchao
1, SONG Chunmei
1, LIU Qing
1,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China;2. Xuzhou Lüjian-Dairy Beverage Co. Ltd., Xuzhou 2210 06, China;3. Shanghai Prajna Biology Technique Ltd., Shanghai 200433, China)
Abstract:Four hybridoma cell lines secreting monoclonal antibodies (mAbs) against SD01, namely 6F, 6D, 7E and 4F,were generated by immunizing BALB/c mice using wild-type strain SD01 of Acidovorax avenae subsp. citrulli (Aac) as the immunogen. Ascites antibody titers were 1:102 400, 1:102 400, 1:25 600, and 1:51 200, respectively. Ascites were purifi ed using saturated ammonium sulfate precipitation and Protein-G affi nity chromatography. Sodium dodecyl sulfatepolyacrylamide gelelectrophoresis (SDS-PAGE) analysis showed high antibody purity. The titers of purified mAbs(2 mg/mL) were 1:12 800, 1:6 400, 1:3 200, and 1:6 400, respectively. The subclass of mAbs was IgG2 a. Indirect enzymelinked immunosorbent assay (ELISA) showed that four hybridoma cell lines had different binding capacity to eight strains of Aac and three species of non-Aac plant pathogens. 6F could bind six strains of Aac, 6D and 4F could bind eight strains of Aac, 7E could bind five strains of Aac. 6F and 4F had cross-reaction with two of the three species of non-Aac plant pathogens, and 6D and 7E had no cross-reaction with all the three species of non-Aac plant pathogens.
Key words:bacterial fruit blotch; monoclonal antibody; preparation; characterization
中图分类号:TS207.4
文献标志码:A
文章编号:1002-6630(2015)23-0228-05
doi:10.7506/spkx1002-6630-201523042
收稿日期:2015-01-29
基金项目:上海市科委高校能力建设项目(13430502400);“科技创新行动计划”长三角科技联合攻关领域项目(15395810900);上海市研究生教育创新计划项目
作者简介:曾海娟(1990—),女,博士研究生,研究方向为食品安全快速检测技术。E-mail:zenghaijuan12@126.com
*通信作者:刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理及快速检测技术。E-mail:liuq@usst.edu.cn








