嗜酸乳酸杆菌对自主活动受限型应激小鼠肠道黏膜免疫状态的影响
郝凤奇
1,李景梅
1,*,杨桂连
2,*
(1.长春理工大学生命科学技术学院,吉林 长春 130022;2.吉林农业大学动物科学技术学院,吉林 长春 130118)
摘 要:目的:探讨嗜酸乳酸杆菌(Lactobacillus acidophilus,LA)对自主活动受限型应激小鼠肠道黏膜免疫状态的影响。方法:以健康雌性BALB/c小鼠为受试动物,分为常规饲养组(NC组)、常规饲养条件灌胃LA组(NC+LA组)、应激组(S组)、应激条件灌胃LA组(S+LA组),小鼠的LA灌胃剂量为10
8CFU/d;应激组小鼠每天被限制自主活动3 h;15 d后取材,采用流式细胞术、酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)等方法,对肠系膜淋巴结(mesenteric lymph nodes,MLN)中CD4
+T细胞、CD8
+T细胞和CD11c
+树突细胞(CD11c
+dendritic cell,CD11c
+DC)比例,结肠组织白细胞介素-10(interleukin-10,IL-10)和白细胞介素-17(interleukin-17,IL-17)水平,以及小肠总分泌型免疫球蛋白A(secreted immunoglobulin A,sIgA)水平进行检测。结果:常规饲养条件下,LA能极显著提高小鼠MLN中CD4
+T细胞比例(P<0.01),显著提高MLN中CD11c
+DC比例、小肠总sIgA水平和结肠组织IL-10水平(P<0.05),显著降低结肠组织IL-17水平(P<0.05),而对MLN中CD8
+T细胞比例无显著影响(P>0.05);应激条件能极显著降低小鼠MLN中CD4
+T细胞比例和CD11c
+DC比例(P<0.01),显著降低CD8
+T细胞比例(P<0.05),极显著降低小鼠结肠组织IL-10水平和小肠总sIgA水平(P<0.01),极显著提高结肠组织IL-17水平(P<0.01);应激条件下,LA能显著提高小鼠MLN中CD4
+T细胞比例和CD11c
+DC比例(P<0.05),显著提高小鼠结肠组织IL-10水平和小肠总sIgA水平(P<0.05),并显著降低结肠组织IL-17水平(P<0.05),而对小鼠MLN中CD8
+T细胞比例无显著影响(P>0.05)。结论:给予自主活动受限型应激小鼠LA干预,可提高小鼠MLN中CD4
+T细胞和CD11c
+DC比例,上调结肠IL-10和小肠总sIgA分泌水平,下调结肠IL-17分泌水平,调节应激小鼠的肠道黏膜免疫状态。
关键词:嗜酸乳酸杆菌;自主活动受限;应激;肠道黏膜免疫
应激是机体对外部或内部刺激产生的一种生理性应答,应激过程中机体启动不同的防御机制对抗刺激以维持自身稳态
[1]。当机体长期处于某种或某几种应激条件下会增加罹患疾病的风险,如癌症、自身免疫性疾病和感染等
[2-3]。动物模型研究结果表明,重复性应激会影响机体正常的细胞免疫和体液免疫状态
[4-5],甚至会引起肠道微生物菌群结构的变化
[6-7],进而影响肠道黏膜免疫功能。
乳酸杆菌是人和动物肠道内重要的益生菌,通过增强黏膜屏障
[8]、促进肠道健康微生物群落结构形成
[9]、提高局部黏膜免疫应答
[10-11]、调节细胞因子分泌
[12]等作用调控机体的免疫状态。
本研究以嗜酸乳酸杆菌(Lactobacillus acidophilus,LA)为研究对象,通过BALB/c小鼠自主运动受限的应激模型,探讨应激条件下LA灌胃对小鼠肠系膜淋巴结(mesenteric lymph nodes,MLN)中CD4
+T细胞、CD8
+T细胞和CD11c
+树突细胞(CD11c
+dendritic cell,CD11c
+DC)比例,结肠组织白细胞介素-10(interleukin-10,IL-10)和白细胞介素-17(interleukin-17,IL-17)水平,以及小肠总分泌型免疫球蛋白A(secreted immunoglobulin A,sIgA)水平的影响,明确LA对该种应激条件下小鼠肠道黏膜免疫的调节作用,以期为深入研究LA的肠道黏膜免疫调控作用机制及其信号传导途径提供有价值的参考,对LA应用于功能性乳制品或肠道微生态制剂的开发提供一定指导。
1 材料与方法
1.1 材料
1.1.1 菌株
嗜酸乳酸杆菌(LA),分离自健康婴儿粪便,由长春理工大学微生物学实验室保存。
1.1.2 培养基与试剂
乳酸杆菌MRS培养基 自行配制;DMEM培养基美国Gibco公司;Cooktail蛋白酶抑制剂 瑞士罗氏公司;anti-mCD4-FITC、anti-mCD8-PE单克隆抗体 美国BD公司;小鼠IL-10、IL-17、总sIgA酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒美国R&D公司。
1.1.3 Green-berger Lysis Buffer的配制
基础缓冲液含1 mmol/L MgCl
2·6H
2O、15 mmol/L Tris-HCl、150 mmol/L NaCl、1 mmol/L CaCl
2、1% Triton,使用时按1∶100(V/V)加入Cooktail蛋白酶抑制剂。
1.1.4 动物
清洁级BALB/c雌性小鼠40 只,体质量(17.080±0.972) g,购自北京维通利华实验动物技术有限公司。
1.2 方法
1.2.1 LA菌体悬液的制备
采用MRS液体培养基,37 ℃条件下静止厌氧培养LA,待菌液OD
600
nm值为0.6~0.8时,4 ℃、6 000 r/min离心2 min,菌体沉淀用1×磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)清洗3 次后,制成10
8CFU/mL菌体悬液。
1.2.2 动物分组及处理
BALB/c小鼠随机平均分为4 组:常规饲养组(NC组)、常规饲养条件灌胃LA组(NC+LA组)、应激组(S组)、应激条件灌胃LA组(S+LA组),适应性饲养7 d后进行为期15 d的正式实验。
正式实验期内,NC组:常规条件饲养;NC+LA组:常规饲养条件下给每只小鼠灌胃LA菌体悬液,剂量为1 mL/d;S组:每天8:00—11:00将小鼠置于带有通气孔的透明容器中(内部尺寸:长×宽×高为10 cm×3 cm×3 cm),确保小鼠不能调头,只能前后移动。S+LA组:应激处理后给每只小鼠灌胃LA菌体悬液,剂量为1 mL/d。各组小鼠均在清洁级条件下饲养,自由饮水和采食,12 h光照/12 h黑暗,给予NC组和S组小鼠灌胃1×PBS(pH 7.4)1 mL/d。第16天对小鼠实行安乐死,无菌条件下取小肠、结肠、肠系膜淋巴结(MLN)用于指标检测。
1.2.3 MLN细胞悬液的制备及流式细胞术检测
将MLN置于盛放有DMEM培养基的平皿中,用注射器末端研磨后,过无菌筛网制成细胞悬液,2 000 r/min离心5 min,弃上清液,沉淀用PBS洗涤2 次,加入适量DMEM培养基计数。取细胞悬液200 μL分别加入2.0 mL FACS Buffer,2 000 r/min离心5 min,弃上清液,沉淀用PBS洗涤2 次后再用FACS Buffer混匀至10
6个,加入到Tube管中,每管加入15 μL荧光标记的单克隆抗体(CD4
+T细胞检测采用anti-mCD4-FITC单克隆抗体、CD8
+T细胞检测采用anti-mCD8-PE单克隆抗体),4 ℃避光作用30 min,FACS Buffer洗涤2 次后重悬于100 μL FACS Buffer中,进行BD Canto流式细胞仪检测。
1.2.4 结肠组织IL-10、IL-17水平检测
采用预冷的Green-berger Lysis Buffer将结肠组织制成匀浆,采用ELISA试剂盒,按照说明书方法操作,检测IL-10、IL-17水平。
1.2.5 小肠总sIgA水平检测
取幽门下至回盲结合部约15 cm肠段,无菌1×PBS(pH 7.4)缓慢冲洗肠腔后,刮取肠黏膜表面黏液层,收集于1.5 mL无菌离心管中,加入0.5 mL无菌1×PBS(pH 7.4,含Cooktail蛋白酶抑制剂)混匀后,4 ℃、12 000 r/min离心10 min,取上清液,按照ELISA试剂盒说明书方法操作,检测总sIgA水平。
1.3 数据统计分析
数据分析和作图采用Graphpad Prism 6.0软件,结果用±s表示。
2 结果与分析
2.1 各组小鼠体质量变化分析
实验结束时,NC组、NC+LA组、S组、S+LA组小鼠体质量分别为(20.81±0.56)、(21.13±0.23)、(19.94±0.48)、(20.17±0.33) g,各组小鼠体质量变化无显著差异(P>0.05)。
2.2 小鼠MLN中CD4
+T细胞、CD8
+T细胞和CD11c
+DC比例变化分析
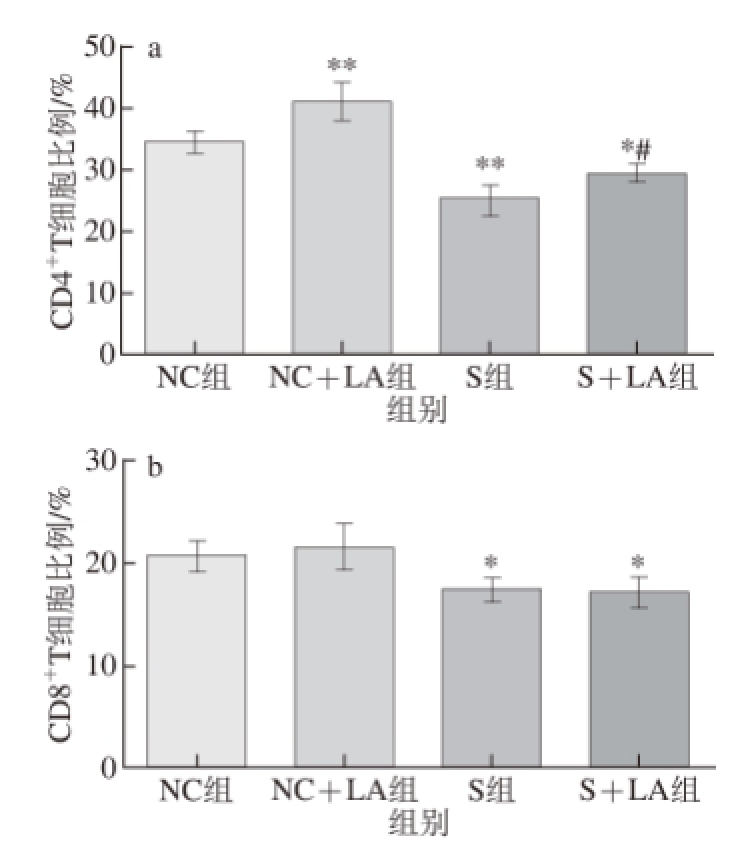
图1 各组小鼠MLN中CCDD44
+T细胞、CCDD88
+TT细胞比例
Fig.1 Ratios of CD4
+T cells and CD8
+T cells in MLN from mice from each group
*. 与NC组相比,差异显著(P<0.05);**. 与NC组相比,差异极显著(P<0.01);#. 与S组相比,差异显著(P<0.05)。下同。
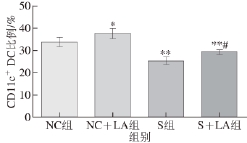
图2 各组小鼠MLN中CD1111cc
+ DDCC比例
Fig.2 Ratio of CD11c
+DCs in MLN from mice from each group
由图1、2可知,NC组小鼠MLN中CD4
+T细胞、CD8
+T细胞和CD11c
+DC比例分别为(34.46±1.76)%、(20.59±1.59)%和(33.97±2.15)%,NC+LA组分别为(41.12±3.03)%、(21.66±2.33)%和(37.95±1.98)%,S组分别为(25.28±2.41)%、(17.49±1.10)%和(25.52±1.53)%,S+LA组分别为(29.46±1.39)%、(17.24±1.42)%和(29.48±0.88)%。常规饲养条件下,LA极显著提高了小鼠MLN中CD4
+T细胞比例(P<0.01),显著提高了CD11c
+DC比例(P<0.05),而对CD8
+T细胞比例变化无显著影响(P>0.05);给予小鼠自主活动限制后,极显著降低了小鼠MLN中CD4
+T细胞和CD11c
+DC比例(P<0.01),显著降低了CD8
+T细胞比例(P<0.05),在此条件下,尽管灌胃LA可显著提高小鼠MLN中CD4
+T细胞比例和CD11c
+DC比例(P<0.05),但仍显著或极显著低于NC组(P<0.05或P<0.01),且给予LA不能提高自主活动受限小鼠的MLN中CD8
+T细胞比例。
2.3 小鼠结肠组织中IL-10、IL-17水平变化分析
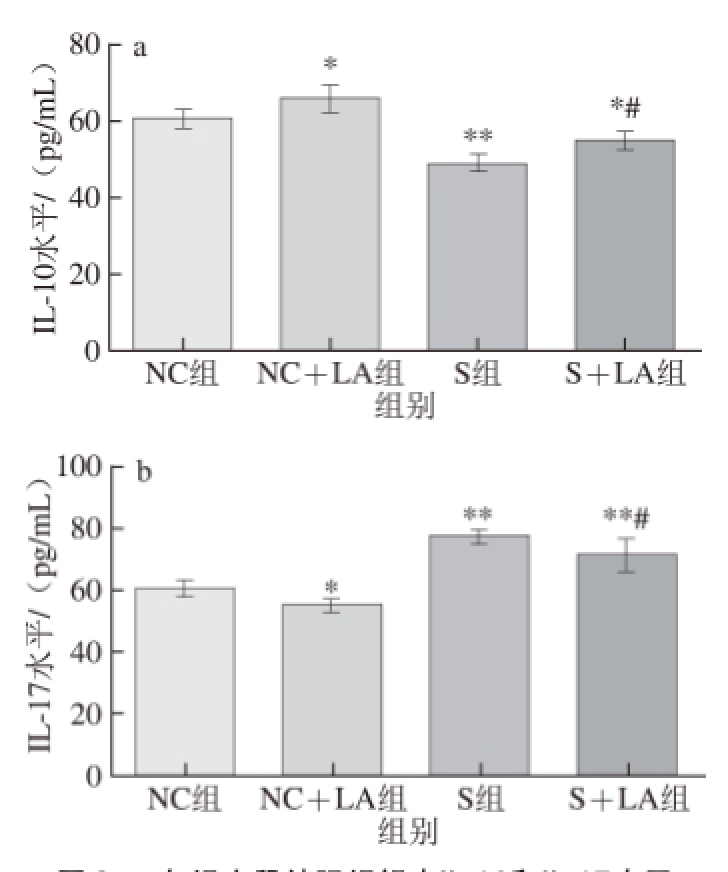
图3 各组小鼠结肠组织中IL-10和IL-177水平
Fig.3 Levels of IL-10 and IL-17 in colon tissue from mice from each group
由图3可知,NC组小鼠结肠组织中IL-10、IL-17水平分别为(60.07±2.25)、(61.04±2.15) pg/mL,NC+LA组分别为(65.86±3.60)、(55.27±2.13) pg/mL,S组分别为(49.08±2.26)、(77.88±1.59) pg/mL、S+LA组分别为(54.83±2.57)、(72.08±4.82) pg/mL。常规饲养条件下,LA显著提高了小鼠结肠组织中IL-10水平(P<0.05),显著降低了IL-17水平(P<0.05);给予小鼠自主活动限制后,极显著降低了小鼠结肠组织中IL-10水平(P<0.01),极显著提高了IL-17水平(P<0.01),在该条件下,尽管灌胃LA可显著提高小鼠结肠组织中IL-10水平(P<0.05),显著降低IL-17水平(P<0.05),但仍与NC组有显著或极显著差异(P<0.05或P<0.01)。
2.4 小鼠小肠总sIgA水平变化分析

图4 各组小鼠小肠总sIgAA水平
Fig.4 Level of small intestinal total sIgA in mice from each group
由图4可知,NC组小鼠小肠总sIgA水平为(31.67±1.59) μg/mL,NC+LA组为(35.93±2.17)μg/mL, S组为(23.18±2.18) μg/mL,S+LA组为(27.08±1.64) μg/mL。常规饲养条件下,LA显著提高了小鼠小肠总sIgA水平(P<0.05);给予小鼠自主活动限制后,极显著降低了小鼠小肠总sIgA水平(P<0.01),在该条件下,尽管LA可显著提高小鼠小肠sIgA水平(P<0.05),但仍极显著低于NC组(P<0.01)。
3 讨 论
近年来,人类微生物组计划(Human Microbiome Project,HMP)和人体肠道宏基因组研究(Metagenomics of the Human Intestinal Tract,MetaHIT)计划的阶段性研究成果表明,人类肠道中有约10
14个共生微生物,种类多达1 000 种,称之为“微生物组”,编码的基因达100 万个以上,被誉为“人类的第二个基因组”。肠道微生物组与多种肠道外疾病相关,如糖尿病、肥胖、类风湿性关节炎等
[13-14]。机体70%的免疫细胞在肠道中发挥作用,肠道微生物组与肠道黏膜免疫间的互作稳态对宿主的健康至关重要。乳酸杆菌作为人类和动物肠道内的益生菌,被公认为“GRAS”(Generally Regarded as Safe)等级的微生物,对于缓解肠易激综合征(irritablebowelsyndrome,IBS)、炎症性肠病(inflammatory bowel disease,IBD)、抗生素引起的腹泻等具有一定作用。
关于应激对健康的影响,传统的思维关注于体液代谢和离子平衡方面,通常忽略了肠道微生态平衡调控机体健康的作用。动物实验表明,应激降低了肠道中拟杆菌属的相对丰度,提高了梭菌属的相对丰度
[7]。因此,研究外源乳酸杆菌干预应激条件下肠道黏膜的免疫状态具有重要意义。本实验所采用的LA分离自健康婴儿粪便,前期研究结果表明,该菌能显著提高C57BL/6雌性小鼠结肠集合淋巴结中TLR2
+细胞比例,上调Th1和Th2型免疫反应
[15]。本实验旨在前期工作基础上,初步探讨该菌对自主活动受限型应激小鼠肠道黏膜免疫状态的影响。
自主活动受限是应激条件的一种,本实验中连续15 d给予小鼠3 h/d的自主活动受限。第10天时,除NC组小鼠外,其他各组小鼠均出现排斥进入受限装置的现象,并伴有饮水量增加的行为学变化,但实验结束后,各组小鼠体质量并无显著差异,推测原因是15 d的应激并未累积至肠道消化吸收功能紊乱,这是否类似于人类的亚健康状态,还有待于进一步探讨。然而,为探索该应激条件是否影响了小鼠肠道黏膜免疫状态,以及外源乳酸杆菌干预对肠道黏膜免疫的影响,实验结束时,分别检测了各组小鼠MLN中CD4
+T细胞、CD8
+T细胞、CD11c
+DC比例以及结肠组织中IL-10、IL-17水平和小肠总sIgA水平。
MLN是肠道黏膜免疫系统中重要的次级淋巴器官,是肠道中T细胞驻留的重要场所之一,肠道黏膜固有层中未成熟树突细胞(immature dendritic cell,iDC)遇到抗原时,对其进行捕获和加工,其自身分化为成熟树突细胞(mature dendritic cell,mDC),并携带抗原信息迁移至MLN中,活化T细胞
[16]。CD4
+T细胞和CD8
+T细胞的动态变化一定程度上反映了机体的免疫状态。MLN中的Naïve CD4
+T细胞被激活后,可根据不同的刺激信号分化为Th1、Th2、Treg、Th17等亚型
[17-18]。近年来,肠道Treg细胞与Th17细胞数量间的动态平衡是肠道炎症的重要指标
[19-20]。Treg细胞通过分泌IL-10发挥抑制炎症作用,调控肠道黏膜免疫应答趋向耐受反应
[21];Th17细胞通过分泌IL-17发挥促炎作用,调控肠道黏膜免疫应答趋向炎症反应
[22]。正常情况下,Treg/Th17、IL-10/IL-17间处于动态平衡,以维持肠道黏膜免疫稳态
[16]。然而,一旦在某些因素的影响下平衡被打破,将会引起肠道黏膜免疫紊乱。本实验中,15 d的重复性自主活动受限条件下,小鼠MLN中CD4
+T细胞比例极显著降低,说明应激导致了小鼠肠道黏膜免疫状态发生了改变,结合IL-10和IL-17两种细胞因子来看,应激条件极显著提高了IL-17水平,极显著降低了IL-10水平,推测应激可能诱发小鼠肠道炎症性疾病。然而,应激条件下同时给予LA干预,可使IL-10水平显著增加,IL-17水平显著降低,但二者仍未恢复到正常水平。此外,常规饲养条件下,LA显著增加IL-10水平,显著降低IL-17水平。结果表明,常规饲养或应激条件下,LA均具有调控肠道黏膜免疫趋向耐受、降低炎症性肠道疾病发生的潜能。
CD8
+T细胞识别由MHCI类分子递呈的内源性抗原肽,其主要功能亚群是细胞毒性T细胞
[23]。本实验中,应激导致了CD8
+T细胞比例显著降低。与CD4
+T细胞不同的是,常规饲养或应激条件下,LA对MLN中CD8
+T细胞比例均无显著影响,说明LA对肠道黏膜免疫的调节作用并非依赖于CD8
+T细胞,这可能与CD8
+T只识别内源性抗原肽有关。
DC是机体内专职抗原递呈细胞,是连接先天免疫和获得免疫的“桥梁”
[24-25]。肠道黏膜免疫系统中的DC依赖其自身的模式识别受体,如Toll样受体(Toll like receptor,TLR)、NOD样受体(NOD like receptor,NLR)、C型凝集素受体(C-type lectin receptor,CLR)等识别肠道内相应的微生物相关配体,并引起免疫级联反应,包括DC激活、介导T细胞活化、细胞因子分泌等,从而发挥免疫调节作用
[22]。已有研究证实,DC表面模式识别受体中TLR2识别肽聚糖分子、TLR4识别脂多糖分子、DC-SIGN识别S层蛋白分子
[12,26-28]。CD11c是小鼠肠道DC活化的重要标志,本实验中,常规饲养条件或应激条件下,LA均显著增加MLN中CD11c
+DC比例,说明LA具有诱发肠道DC活化的潜能,鉴于LA是G
+菌,其菌体表面含有大量的肽聚糖和S层蛋白,因此推测LA活化DC很可能依赖于其表面的肽聚糖和S层蛋白。
sIgA是肠道黏膜局部体液免疫应答中的主要抗体。乳酸杆菌通过激活DC,或调节肠道菌群稳态等方式,直接或间接上调sIgA水平
[29]。本实验中,常规饲养条件或应激条件下,LA均显著增加肠道sIgA水平,表明LA具有提高肠道黏膜局部体液免疫的作用。
4 结 论
本实验结果表明,15 d的自主活动受限型应激条件下,小鼠肠道黏膜免疫功能紊乱,主要表现为MLN中CD4
+T细胞、CD8
+T细胞和CD11c
+DC比例显著或极显著降低,结肠组织中IL-10水平极显著降低、IL-17水平极显著增加,以及小肠总sIgA水平极显著降低。LA具有调节应激小鼠肠道黏膜免疫的潜能,主要表现为提高MLN中CD11c
+DC和CD4
+T细胞比例,上调结肠组织中IL-10水平和小肠总sIgA水平,下调结肠组织中IL-17水平。然而,LA菌体表面一种或多种分子与肠道相关免疫细胞间的相互作用及其机制,以及LA对应激条件下肠道微生物群落组成的影响仍需进一步深入研究。
参考文献:
[1] CRUZ F C, MARIN M T, LE.O R M, et al. Behavioral and neuroendocrine effects of the exposure to chronic restraint or variable stress in early adolescent rats[J]. International Journal of Developmental Neuroscience, 2012, 30(1): 19-23.
[2] MAUNDER R G. Evidence that stress contributes to inflammatory bowel disease: evaluation, synthesis, and future directions[J]. Inflammatory Bowel Diseases, 2005, 11(6): 600-608.
[3] COHEN S, JANICKI-DEVERTS D, DOYLE W J, et al. Chronic stress, glucocorticoid receptor resistance, inflammation, and disease risk[J]. Proceedings of the National Academy of Sciences, 2012,109(16): 5995-5999.
[4] BAUER M E, PERKS P, LIGHTMAN S L, et al. Restraint stress is associated with changes in glucocorticoid immunoregulation[J]. Physiology & Behavior, 2001, 73(4): 525-532.
[5] DU Q, MIN S, CHEN L Y, et al. Major stress hormones suppress the response of macrophages through down-regulation of TLR2 and TLR4[J]. Journal of Surgical Research, 2012, 173(2): 354-361.
[6] SUDO N, CHIDA Y, AIBA Y, et al. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice[J]. Journal of Physiology, 2004, 558(1): 263-275.
[7] BAILEY M T, DOWD S E, GALLEY J D, et al. Exposure to a social stressor alters the structure of the intestinal microbiota: implications for stressor-induced immunomodulation[J]. Brain, Behavior, and Immunity, 2011, 25(3): 397-407.
[8] GALDEANO C M, PERDIGON G. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity[J]. Clinical and Vaccine Immunology,2006, 13(2): 219-226.
[9] RAUCH M, LYNCH S V. The potential for probiotic manipulation of the gastrointestinal microbiome[J]. Current Opinion in Biotechnology,2012, 23(2): 192-201.
[10] GALDEANO C M, de LEBLANC A M, VINDEROLA G, et al. Proposed model: mechanisms of immunomodulation induced by probiotic bacteria[J]. Clinical and Vaccine Immunology, 2007, 14(5):485-492.
[11] QUIGLEY E M M. Gut microbiota and the role of probiotics in therapy[J]. Current Opinion in Pharmacology, 2011, 11(6): 593-603.
[12] van BAARLEN P, WELLS J M, KLEEREBEZEM M. Regulation of intestinal homeostasis and immunity with probiotic lactobacilli[J]. Trends in Immunology, 2013, 34(5): 208-215.
[13] LOZUPONE C A, STOMBAUGH J I, GORDON J I, et al. Diversity,stability and resilience of the human gut microbiota[J]. Nature, 2012,489: 220-230.
[14] Human Microbiome Project Consortium. A framework for human microbiome research[J]. Nature, 2012, 486: 215-221.
[15] 郝凤奇, 李景梅, 李成玉, 等. 2种乳酸杆菌肠道黏膜免疫调节作用的比较[J]. 西北农林科技大学学报: 自然科学版, 2014, 42(10): 29-34.
[16] MACDONALD T T, MONTELEONE I, FANTINI M C, et al. Regulation of homeostasis and inflammation in the intestine[J]. Gastroenterology, 2011, 140(6): 1768-1775.
[17] GERRIETS V A, RATHMELL J C. Metabolic pathways in T cell fate and function[J]. Trends in Immunology, 2012, 33(4): 168-173.
[18] WANG R, GREEN D R. Metabolic checkpoints in activated T cells[J]. Nature Immunology, 2012, 13(10): 907-915.
[19] HILL D A, ARTIS D. Intestinal bacteria and the regulation of immune cell homeostasis[J]. Annual Review of Immunology, 2009,28: 623-667.
[20] BARBI J, PARDOLL D, PAN F. Metabolic control of the Treg/Th17 axis[J]. Immunological Reviews, 2013, 252(1): 52-77.
[21] HARRISON O J, POWRIE F M. Regulatory T cells and immune tolerance in the intestine[J]. Cold Spring Harbor Perspectives in Biology, 2013, 5(7): a018341. doi: 10.1101/cshperspect.a018341.
[22] IWAKURA Y, ISHIGAME H, SAIJO S, et al. Functional specialization of interleukin-17 family members[J]. Immunity, 2011, 34(2): 149-162.
[23] JANEWAY C A, TRAVERS P, WALPORT M J, et al. Immunobiology:the immune system in health and disease[M]. New York: Garland Science, 2001: 1-56.
[24] BANCHEREAU J, STEINMAN R M. Dendritic cells and the control of immunity[J]. Nature, 1998, 392: 245-252.
[25] van VLIET S J, den DUNNEN J, GRINGHUIS S I, et al. Innate signaling and regulation of dendritic cell immunity[J]. Current Opinion in Immunology, 2007, 19(4): 435-440.
[26] LEBEER S, VANDERLEYDEN J, de KEERSMAECKER S C J. Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens[J]. Nature Reviews Microbiology, 2010,8(3): 171-184.
[27] WELLS J M, ROSSI O, MEIJERINK M, et al. Epithelial crosstalk at the microbiota: mucosal interface[J]. Proceedings of the National Academy of Sciences, 2011, 108(Suppl 1): 4607-4614.
[28] BRON P A, van BAARLEN P, KLEEREBEZEM M. Emerging molecular insights into the interaction between probiotics and the host intestinal mucosa[J]. Nature Reviews Microbiology, 2012, 10(1): 66-78.
[29] OELSCHLAEGER T A. Mechanisms of probiotic actions: a review[J]. International Journal of Medical Microbiology, 2010, 300(1): 57-62.
Influence of Lactobacillus acidophilus on Intestinal Mucosal Immunity in a Mouse Model of Stress Induced by Auto-Activity Restriction
HAO Fengqi
1, LI Jingmei
1,*, YANG Guilian
2,*
(1. School of Life Science and Technology, Changchun University of Science and Technology, Changchun 130022, China;2. College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China)
Abstract:Objective: To assess the influence of Lactobacillus acidophilus on intestinal mucosal immunity in a mouse model of stress induced by auto-activity restriction. Methods: Male health BALB/c mice were divided into 4 groups. In normal control group (NC), the mice received balanced diet and water and were left undisturbed in their cages. In NC plus Lactobacillus acidophilus (NC + LA) group, the mice were given a suspension of LA with 10
8CFU/d per mouse through intragastric administration under normal control condition. In stress group (S), the mice were subjected to stress induced by auto-activity restriction for 3 h per day. In stress plus LA (S+LA) group, the mice were given a suspension of LA with 10
8CFU/d per mouse through intragastric administration under stress condition. After 15 days, mice from each group were sacrificed. CD4
+T, CD8
+T and CD11c
+dendritic cells (CD11c
+DCs) in mesenteric lymph nodes (MLN),interleukin-10 (IL-10) and interleukin-17 (IL-17) levels in colon tissue, total secretory immunoglobulin A (sIgA) level in small intestine were analyzed by fl ow cytometry and enzyme-linked immunosorbent assay (ELISA). Results: Under NCcondition, the proportions of CD4
+T cells and CD11c
+DCs in MLN (CD4
+T cell: P < 0.01, CD11c
+DC: P < 0.05), small intestinal sIgA level and IL-10 level in colon tissue (sIgA, IL-10: P < 0.05) were enhanced by LA and IL-17 level in colon tissue was decreased (P < 0.05), but the proportion of CD8
+T cells in MLN was not signifi cantly varied (P > 0.05). After auto-activity restriction, the proportions of CD4
+T cells, CD8
+T cells and CD11c
+DCs, and the levels of IL-10 and small intestinal sIgA were decreased (CD4
+T cell, CD11c
+DC, IL-10, sIgA: P < 0.01, CD8
+T cell: P < 0.05). Interestingly, the proportion of CD4
+T cells and CD11c
+DCs, the levels of IL-10 and small intestinal sIgA were increased, and the level of IL-17 was decreased by LA under stress condition (P < 0.05), but the proportion of CD8
+T cells was not signifi cantly affected(P > 0.05). Conclusion: LA administered to mice subjected to auto-activity restriction enhances the proportions of CD4
+T cells and CD11c
+DCs in MLN, up-regulates the levels of IL-10 in colon and total small intestinal sIgA, and downregulates the level of IL-17 in colon, thereby modulating their intestinal mucosal immunity under stress condition.
Key words:Lactobacillus acidophilus; auto-activity restriction; stress; intestinal mucosal immunity
中图分类号:Q939.91
文献标志码:A
文章编号:1002-6630(2015)23-0247-06
doi:10.7506/spkx1002-6630-201523045
收稿日期:2015-03-04
基金项目:国家自然科学基金面上项目(31272552);吉林省教育厅科学技术研究项目
作者简介:郝凤奇(1981—),男,讲师,硕士,研究方向为微生物与免疫学。E-mail:hao4269@126.com
*通信作者:李景梅(1969—),女,教授,博士,研究方向为微生物学。E-mail:ljm3023@126.com杨桂连(1978—),男,副教授,博士,研究方向为动物微生态与黏膜免疫。E-mail:yangguilian@jlau.edu.cn



