郭亚惠 1,刘志勇 2,曾志将 1,*,陈丽玲 2,张 洁 2,舒 坤 2,周林斌 1,潘其忠 1
(1.江西农业大学蜜蜂研究所,江西 南昌 330045;2.江西中医药大学实验动物科技中心,江西 南昌 330006)
摘 要:研究不同取浆时间生产的蜂王浆(royal jelly,RJ)对溴代苯诱导小鼠氧化损伤的保护作用。以免移虫48 h生产的蜂王浆(48 h RJ)和72 h生产的蜂王浆(72 h RJ)为研究材料,灌胃给予昆明小鼠,蜂王浆分别设高剂量组9 g/(kg·d)(48 h RJ-H组、72 h RJ-H组)、中剂量组3 g/(kg·d)(48 h RJ-M组、72 h RJ-M组)和低剂量组1 g/(kg·d)(48 h RJ-L组、72 h RJ-L组),同时设一空白对照组。灌胃剂量为10 mL/kg,空白对照组小鼠则灌胃等量蒸馏水。连续灌胃45 d,然后给各组小鼠灌胃0.3 mg/kg溴代苯油溶液(灌胃剂量为10 mL/kg),22 h后测定小鼠的肝脏质量以及血清和肝脏组织中丙二醛(malondialdehyde,MDA)含量,超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总抗氧化能力(total antioxidative capacity,T-AOC)活性。结果表明:预防性灌胃RJ对溴代苯攻击后小鼠的体质量、肝脏质量和肝脏系数无显著影响(P>0.05);除48 h RJ-L组外,其他组小鼠血清中的MDA含量均显著低于空白对照组(P<0.05),中、高剂量的RJ可显著升高小鼠血清中的SOD和GSH-Px活力,而所有灌胃RJ的小鼠血清T-AOC活力都显著高于空白对照组(P<0.05);灌胃RJ也可显著降低小鼠肝脏组织中的MDA含量和GSH-Px、T-AOC活力(P<0.05),除48 h RJ-L组外,其他组小鼠肝脏组织中SOD活力均显著高于空白对照组(P<0.05)。48 h RJ和72 h RJ对溴代苯诱导小鼠氧化损伤均具有一定的保护作用,但两者存在一定差异。
关键词:蜂王浆;取浆时间;氧化损伤
蜂王浆(royal jelly,RJ)是蜂群中5~15 日龄工蜂的咽下腺和上颚腺分泌的一种乳白色或淡黄色浆状物质,由于是蜂王的主要食物而得名为“蜂王浆”,同时也是蜜蜂小幼虫的食物,又称之为“蜂乳” [1]。蜂王浆呈半透明、微黏稠,部分溶解于水和乙醇,pH值为3.5~4.5,密度为1.1 mg/mL,随着贮藏时间的延长颜色不断变黄 [2]。
蜂王浆成分与蜂种、蜜源、产地、季节等因素相关 [3-6]。蜂王浆中含有丰富的氨基酸、类胰岛素、活性多肽、维生素、黄酮类化合物、核酸、有机酸等活性物质 [4-9],具有增强免疫力、抗氧化、降血脂、控制血糖等生物学功能 [10-14]。
在养蜂生产中,多数养蜂者是移虫后72 h取浆,但有少数养蜂者是移虫后48 h取浆。48 h所取的蜂王浆(48 h RJ)与72 h所取的蜂王浆(72 h RJ)两者成分有所不同 [5,15],但二者生物学功能是否存在差异尚不清楚。为了科学评价48 h RJ和72 h RJ对动物抗氧化活性的影响,本实验拟研究48 h RJ和72 h RJ对小鼠抗氧化活性的影响,旨在为高活性蜂王浆的生产提供理论依据。
1.1 材料、动物与试剂
1.1.1 材料
利用江西农业大学蜜蜂研究所饲养的意大利蜜蜂(Apis mellifera ligustica),按照“免移虫蜂王浆生产技术” [16-18],控制蜂王产卵,以1 日龄内幼虫进行免移虫蜂王浆生产48 h RJ和72 h RJ,并于-18 ℃条件下保存备用。
1.1.2 动物
清洁级雄性昆明小鼠70 只,体质量18~22 g,江西中医药大学实验动物科技中心提供,合格证号:SCXK(赣)2011-0001。饲料、垫料由北京科澳协力有限公司提供。小鼠饲养在环境温度为20~23 ℃、相对湿度为45%~55%的屏障实验系统内。
1.1.3 试剂
丙二醛(malondialdehyde,MDA)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、总抗氧化能力(total antioxidative capacity,T-AOC)测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
UV-1201紫外-可见分光光度计 日本岛津公司;低温冷冻离心机 湖南湘仪实验室仪器开发有限公司;超声匀浆器 德国赛多利斯公司;旋涡混旋器 海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 动物分组
将70 只雄性昆明小鼠分为6 个实验组(即48 h RJ和72 h RJ各设高、中、低3 个剂量组)和1 个空白对照组(C组),每组小鼠10 只。参照人体推荐用量为15 g/(50 kg·d)(即人体用量300 mg/kg),设立3 g/(kg·d)为动物实验的中剂量组,表示为48 h RJ-M和72 h RJ-M,上下再各设高剂量组为9 g/(kg·d)(48 h RJ-H和72 h RJ-H)和低剂量组为1 g/(kg·d)(48 h RJ-L和72 h RJ-L)。小鼠灌胃剂量为10 mL/kg,空白对照组则灌胃等量蒸馏水,连续灌胃45 d。
1.3.2 抗氧化功能测定实验
第45天灌胃后使小鼠饥饿过夜,然后再给予受试样品,1 h之后,给予各组小鼠灌胃0.3 mg/kg溴苯油溶液(灌胃剂量为10 mL/kg),22 h后对小鼠摘眼球取血测定MDA含量,SOD、GSH-Px和T-AOC活性。然后处死小鼠取肝脏称质量,用解剖刀切下0.20 g肝脏组织,加入3.8 mL生理盐水,用玻璃匀浆机以2 000 r/min匀浆10 s,间歇30 s,重复3 次,制成质量分数5%的肝组织匀浆,并于4 ℃、3 500 r/min离心(离心半径为15.3 cm)10 min,取适量上清液测定其MDA含量,SOD、GSH-Px和T-AOC活性。
1.3.2.1 肝脏系数测定
称量小鼠体质量并剖取小鼠肝脏,用电子天平称量肝脏质量,按照下式计算小鼠肝脏系数。
1.3.2.2 MDA含量和SOD、GSH-Px和T-AOC活性测定
按照试剂盒说明书方法测定小鼠血清及肝脏组织中MDA含量和SOD、GSH-Px和T-AOC活性。
1.4 数据统计分析
实验结果以SPSS软件进行最小显著差异(least significant difference,LSD)法两两比较,以P<0.05为差异显著性的标志。
2.1 小鼠体质量的变化
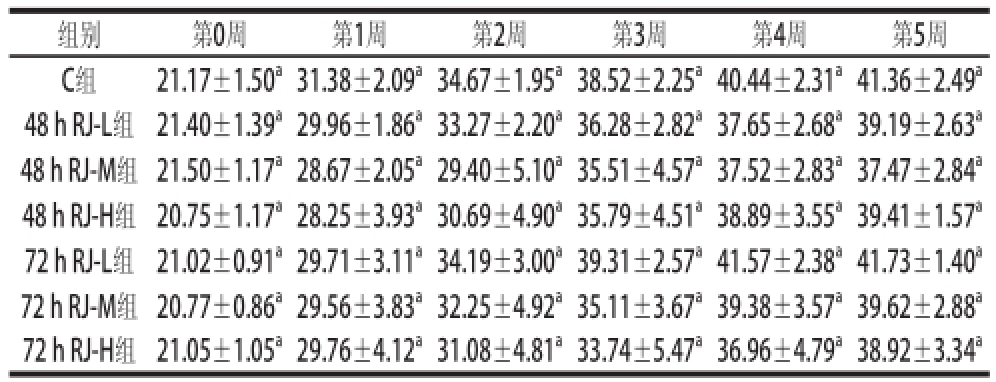
表1 不同剂量组48 h RJ和72 h RJ对小鼠体质量的影响(x =10)
Table 1 Effects of 48 h RJ and 72 h RJ on average body weight of mice
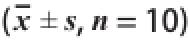
注:同列小写字母不同表示差异显著(P<0.05)。下同。
组别 第0周 第1周 第2周 第3周 第4周 第5周C组 21.17±1.50 a31.38±2.09 a34.67±1.95 a38.52±2.25 a40.44±2.31 a41.36±2.49 a48 h RJ-L组 21.40±1.39 a29.96±1.86 a33.27±2.20 a36.28±2.82 a37.65±2.68 a39.19±2.63 a48 h RJ-M组 21.50±1.17 a28.67±2.05 a29.40±5.10 a35.51±4.57 a37.52±2.83 a37.47±2.84 a48 h RJ-H组 20.75±1.17 a28.25±3.93 a30.69±4.90 a35.79±4.51 a38.89±3.55 a39.41±1.57 a72 h RJ-L组 21.02±0.91 a29.71±3.11 a34.19±3.00 a39.31±2.57 a41.57±2.38 a41.73±1.40 a72 h RJ-M组 20.77±0.86 a29.56±3.83 a32.25±4.92 a35.11±3.67 a39.38±3.57 a39.62±2.88 a72 h RJ-H组 21.05±1.05 a29.76±4.12 a31.08±4.81 a33.74±5.47 a36.96±4.79 a38.92±3.34 a
由表1可知,各组小鼠在相同时间的体质量与C组比较无显著差异(P>0.05)。各组小鼠生长发育良好,活动正常,体质量稳定增加。
2.2 小鼠肝脏质量及肝脏系数测定结果
表2 不同剂量组48 h RJ和72 h RJ对小鼠体质量、肝脏质量及肝脏系数的影响(
 =7)
=7)
Table 2 Effects of 48 h RJ and 72 h RJ on body weight and liver index of bromobenzene-challenged mice
 , = 7)
, = 7)

组别 溴代苯诱导后小鼠体质量/g 肝脏质量/g 肝脏系数/% C组 38.06±1.51 a 1.90±0.50 a 4.98±1.23 a48 h RJ-L组 37.40±3.03 a 1.81±0.78 a 4.86±0.47 a48 h RJ-M组 36.29±2.35 a 1.58±0.23 a 4.36±0.70 a48 h RJ-H组 38.98±2.37 a 1.79±0.18 a 4.61±0.55 a72 h RJ-L组 38.40±2.30 a 1.59±0.27 a 4.12±0.54 a72 h RJ-M组 37.59±1.61 a 1.64±0.33 a 4.35±0.82 a72 h RJ-H组 38.11±3.00 a 1.56±0.30 a 4.12±0.94 a
由表2可知,预防性灌胃蜂王浆的各组小鼠在溴代苯攻击后,其体质量、肝脏质量和肝脏系数与C组相比无显著差异(P>0.05),且灌胃蜂王浆的各组小鼠间也无显著差异(P>0.05)。
2.3 小鼠血清抗氧化指标测定结果
Table 3 Effects of 48 h RJ and 72 h RJ on antioxidant enzyme activities and MDA content in serum of bromobenzene-challenged
 ,n=7)=7 Table 3 Effects of 48 h RJ and 72 h RJ on antioxidant enzyme
,n=7)=7 Table 3 Effects of 48 h RJ and 72 h RJ on antioxidant enzyme
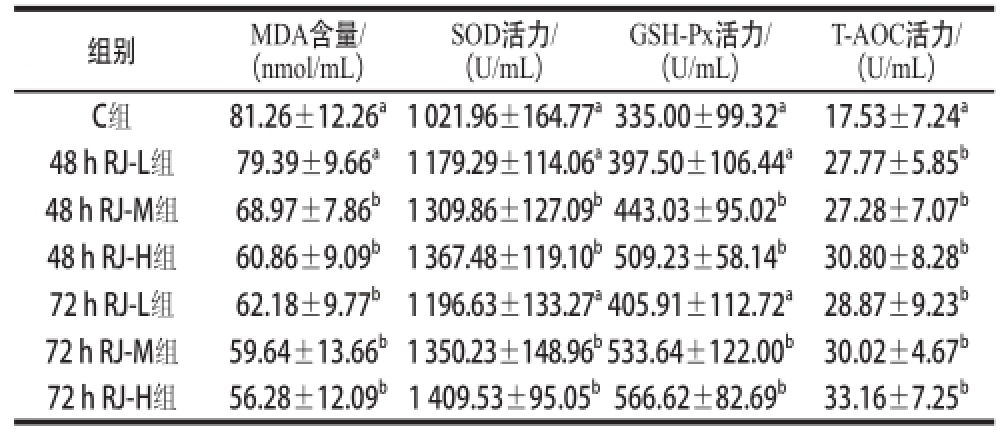
表3 不同剂量组48 h RJ和72 h RJ对小鼠血清抗氧化指标的影响(activities and MDA content in serum of bromobenzene-challenged mice (ice
 , n = 7) = 7
, n = 7) = 7
?
由表3可知,除48 h RJ-L组小鼠血清中MDA含量与C组差异不显著外,其他5 个实验组小鼠血清中MDA含量都显著低于C组和48 h RJ-L组(P<0.05);各组小鼠血清中SOD和GSH-Px活力表现出相似规律,即48 h RJ-M组、48 h RJ-H组、72 h RJ-M组、72 h RJ-H组这4 个组小鼠血清的SOD和GSH-Px活力都显著高于C组、48 h RJ-L组和72 h RJ-L组(P<0.05);6 个实验组小鼠血清的T-AOC活力都显著高于C组(P<0.05)。
2.4 小鼠肝脏组织抗氧化指标测定结果
由表4可知,6 个实验组小鼠肝脏组织中MDA含量都显著低于C组;48 h RJ-M组、48 h RJ-H组、72 h RJ-L组、72 h RJ-M组、72 h RJ-H组这5 个实验组小鼠肝脏组织中SOD活力都显著高于C组和48 h RJ-L组;各组小鼠肝脏组织中GSH-Px和T-AOC活力表现出相似规律,即6 个实验组小鼠肝脏组织中GSH-Px和T-AOC活力都显著高于C组。
表4 不同剂量组48 h RJ和72 h RJ对小鼠肝脏组织抗氧化指标的影响
 =7)
=7)
Table 4 Effects of 48 h RJ and 72 h RJ on antioxidant enzyme activity and MDA content in liver tissue of bromobenzene-challenged mice
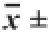 , = 7)
, = 7)
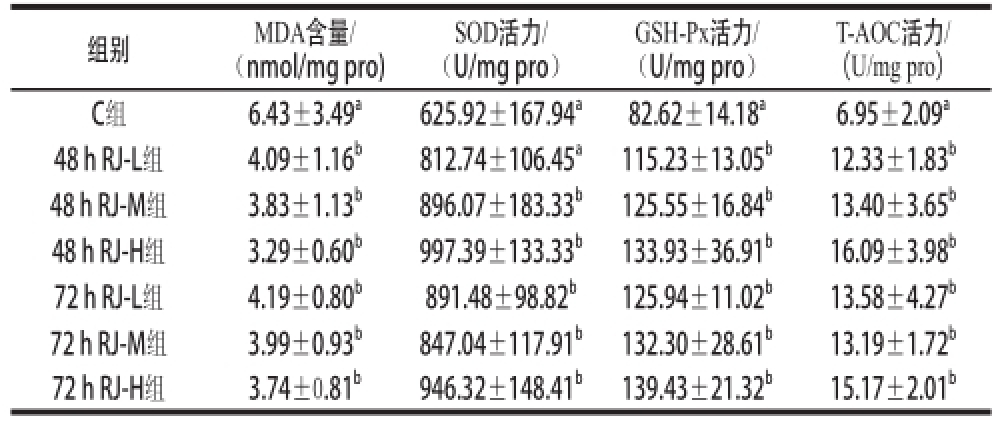
T-AOC活力/(U/mg pro)C组 6.43±3.49 a 625.92±167.94 a 82.62±14.18 a 6.95±2.09 a48 h RJ-L组 4.09±1.16 b 812.74±106.45 a 115.23±13.05 b 12.33±1.83 b48 h RJ-M组 3.83±1.13 b 896.07±183.33 b 125.55±16.84 b 13.40±3.65 b48 h RJ-H组 3.29±0.60 b 997.39±133.33 b 133.93±36.91 b 16.09±3.98 b72 h RJ-L组 4.19±0.80 b 891.48±98.82 b 125.94±11.02 b 13.58±4.27 b72 h RJ-M组 3.99±0.93 b 847.04±117.91 b 132.30±28.61 b 13.19±1.72 b72 h RJ-H组 3.74±0.81 b 946.32±148.41 b 139.43±21.32 b 15.17±2.01 b组别 MDA含量/(nmol/mg pro)SOD活力/(U/mg pro)GSH-Px活力/(U/mg pro)
衰老是一种渐进而复杂的生物过程,在这个过程中机体会产生自由基。正常情况下,体内自由基的产生与消除应处于平衡状态,但随着年龄的增长,抗氧化酶类活性下降,使体内消除自由基的能力减低,体内过量的自由基就会引起脂质过氧化、损伤生物膜、影响细胞功能,进而导致疾病和衰老,因此抗氧化能力是反映机体抗衰老能力的重要指标 [19]。MDA是脂质过氧化反应的代谢产物,其含量高低可反映机体脂质过氧化水平,在一定程度上间接反映了机体脂膜双层结构破坏和细胞损伤的程度。SOD、GSH-Px和T-AOC作为体内重要的氧自由基清除剂,在保护细胞不受毒性自由基的损伤方面发挥着重要作用,其活性高低间接反映了机体清除氧自由基的能力。
溴代苯为一种化学性的肝脏毒物,在体内可经细胞色素P450酶类系统进行代谢产生有毒性的中间产物3,4-环氧化物成分,造成机体细胞膜脂质过氧化反应及细胞内钙离子平衡状态的紊乱,从而引起肝细胞的氧化损伤,是保健食品功能学评价常用的模型 [20]。
本实验中各RJ剂量组小鼠生长状况良好,说明蜂王浆是安全的。48 h RJ和72 h RJ均提高了小鼠的抗氧化活性,可能与蜂王浆中含有的Cu/Zn-SOD、酚类物质、10-羟基-2-癸烯酸(10-hydroxyl-decenoic acid,10-HDA)、活性蛋白质及其酶解物等具有强抗氧化性有关 [21-25],其机理还有待于进一步研究。
通过本实验测定的小鼠血清和肝脏组织中MDA含量,SOD、GSH-Px、T-AOC活力可知,蜂王浆对溴代苯诱导小鼠抗氧化损伤的保护作用存在量-效关系,高剂量组和中剂量组蜂王浆对小鼠的抗氧化损伤活性明显强于低剂量组。72 h RJ-L组小鼠肝脏中SOD活性显著高于48 h RJ-L组,这种差异可能是两种蜂王浆中抗氧化成分的含量不同所致,其抗氧化成分还有待进一步确定。
参考文献:
[1] 曾志将. 养蜂学[M]. 2版. 北京: 中国农业出版社, 2009: 146.
[2] 陈崇羔, 和绍禹. 蜜蜂产品学[M]. 北京: 中国农业出版社, 2010: 38.
[3] 王艳辉, 余玉生, 卢焕仙, 等. 不同品种蜜蜂及不同花期生产蜂王浆癸烯酸含量的差异[J]. 江苏农业科学, 2013, 40(12): 337-338.
[4] ZENG Zhijiang, ZOU Yang, GUO Dongsheng, et al. Comparative studies of DNA and RNA from the royal jelly of Apis mellifera and Apis cerana[J]. Indian Bee Journal, 2006, 68: 18-21.
[5] ZHENG Huoqing, HU Fuliang, DIETEMANN V. Changes in composition of royal jelly harvested at different times: consequences for quality standards[J]. Apidologie, 2011, 42(1): 39-47.
[6] WEI Wenting, HU Yuanqiang, ZHENG Huoqing, et al. Geographical influences on content of 10-hydroxy-trans-2-decenoic acid in royal jelly in China[J]. Journal of Economic Entomology, 2013, 106(5):1958-1963.
[7] FERIOLI F, ARMAFORTE E, CABONI M F. Comparison of the lipid content, fatty acid profile and sterol composition in local Italian and commercial royal jelly samples[J]. Journal of the American Oil Chemists' Society, 2014, 91(6): 875-884.
[8] WE AVER N, JOHNSTON N C, BENJAMIN R, et al. Novel fatty acids from the royal jelly of honeybees (Apis mellifera L.)[J]. Lipids,1968, 3(6): 535-538.
[9] SCH.NLEBEN S, SICKMANN A, MUELLER M J, et al. Proteome analysis of Apis mellifera royal jelly[J]. Analytical and Bioanalytical Chemistry, 2007, 389(4): 1087-1093.
[10] 曾星凯, 谢国秀, 吴小波, 等. 蜂王浆活性组分癸烯酸和氨基酸含量变化对小白鼠抗疲劳作用研究[J]. 江西农业大学学报, 2009, 31(3):526-529.
[11] 颜伟玉, 曾星凯, 谢国秀, 等. 蜂王浆中不同活性组分对大鼠降血脂效果影响[J]. 江西农业大学学报, 2009, 31(5): 826-829.
[12] IWANAMI Y, IWAMATSU M, OKADA I, et al. Comparison of inhibitory effects of royal jelly acid and myrmicacin on germination of Camellia sinensis pollens[J]. Experientia, 1979, 35(10): 1311-1312.
[13] MORITA H, IKEDA T, KAJITA K, et al. Effect of royal jelly ingestion for six months on healthy volunteers[J]. Nutrition Journal,2012, 11(1): 77. doi: 10.1186/1475-2891-11-77.
[14] VITTEK J. Effect of royal jelly on serum lipids in experimental animals and humans with atherosclerosis[J]. Experientia, 1995,51(9/10): 927-935.
[15] 郭亚惠, 周林斌, 潘其忠, 等. 不同取浆时间对蜂王浆产量和成分的影响[J]. 江西农业大学学报, 2015, 37(1): 120-125.
[16] 曾志将, 吴小波, 张飞, 等. 蜂王浆机械化生产关键技术研究与应用(Ⅰ): 仿生免移虫生产器设计[J]. 江西农业大学学报, 2013, 35(4):842-847.
[17] 张飞, 吴小波, 颜伟玉, 等. 蜂王浆机械化生产关键技术研究与应用(Ⅱ): 仿生免移虫蜂王浆生产技术[J]. 江西农业大学学报, 2013,35(5): 1036-1041.
[18] 张飞, 吴小波, 颜伟玉, 等. 蜂王浆机械化生产关键技术研究与应用(Ⅲ): 仿生免移虫生产蜂王浆的蜂群配套饲养技术[J]. 江西农业大学学报, 2013, 35(6): 1261-1265.
[19] 周刚, 范纯武. 抗氧化与抗衰老[J]. 中国水电医学, 2008, 12(1): 34-35.
[20] 董艳, 孙青, 姜迎, 等. 番茄红素对溴代苯诱导小鼠脂质过氧化损伤的拮抗作用[J]. 环境与健康杂志, 2012, 29(6): 514-516.
[21] 闵丽娥, 黄裕林. 蜂王浆超氧化物歧化酶分离纯化及部分性质研究[J].化学研究与应用, 2001, 13(5): 567-569.
[22] 侯春生. 蜂王浆中活性小分子物质2,6-二叔丁基苯酚的抗衰老作用研究[D]. 福州: 福建农林大学, 2007: 1-2.
[23] 侯春生, 韩日畴, 曹莉, 等. 蜂王浆的抗氧化药理作用及深加工产业化前景[J]. 食品研究与开发, 2008, 29(8): 150-154.
[24] 许建香, 张智武, 刘永东, 等. 蜂王浆水溶性蛋白及其酶解产物的抗氧化活性[J]. 食品科学, 2009, 30(5): 72-75.
[25] 孙晓生, 杨柳. 抗衰老机制与药物的研究进展[J]. 广州中医药大学学报, 2009, 26(6): 593-597.
Protective Effect of Royal Jelly on Bromobenzene-Induced Oxidative Damage in Mice
GUO Yahui
1, LIU Zhiyong
2, ZENG Zhijiang
1,*, CHEN Liling
2, ZHANG Jie
2, SHU Kun
2, ZHOU Linbin
1, PAN Qizhong
1
(1. Honeybee Research Institute, Jiangxi Agricultural University, Nanchang 330045, China;2. Laboratory Animal Science and Technology Center, Jiangxi University of Traditional Chinese Medicine, Nanchang 330006, China)
Abstract:The aim of this study is to explore the protective effects of royal jelly (RJ) harvested at different time points on bromobenzene-induced oxidative damage in mice. The 48 h RJ and 72 h RJ were fed to Kunming mice by gavage, each of which was used to set up a high dose group at 9 g/(kg·d) (48 h RJ-H and 72 h RJ-H), a moderate dose group at 3 g/(kg·d)(48 h RJ-M and 72 h RJ-M) and a low dose group at 1 g/(kg·d) (48 h RJ-L and 72 h RJ-L), respectively. At the same time, a control group was set up. Each mouse in the experimental groups was given RJ at a dose of 10 mL/kg, while the control group mice were given the same amount of distilled water. The mice were fed royal jelly daily by oral gavage for 45 days, and then given bromobenzene oil at a dose of 0.3 mg/kg (10 mL/kg) by gavage. After 22 h, liver weight and malondialdehyde (MDA)content, superoxide dismutase (SOD) activity, glutathione peroxidase (GSH-Px) activity and total antioxidant capacity(T-AOC) in blood and liver tissue of each mouse were detected. Results showed that preventive administration of RJ had no significant effect on body weight, liver weight or liver coefficient in bromobenzene-challenged mice (P > 0.05). The level of serum MDA in the mice from all groups except the 48 h RJ-L group was significantly reduced compared to that in the blank control group (P < 0.05). Administration of moderate and high-dose RJ caused a significant elevation in the levels of serum SOD activity and GSH-Px content, and the mice from all groups administered with RJ showed significantly increased levels of serum T-AOC than the blank control group (P < 0.05). In addition, oral gavage of RJ resulted in a significant reduction in the levels of MDA, GSH-Px and T-AOC in liver tissue (P < 0.05). The level of SOD activity in liver tissue of the mice from all groups except the 48 h RJ-L group exhibited a significant increase compared with those from the blank control group(P < 0.05). Therefore, both 48 h RJ and 72 h RJ have protective effects on bromobenzene-induced oxidative damage in mice.
Key words:royal jelly; harvesting time; oxidative damage
中图分类号:S896.3
文献标志码:A
文章编号:1002-6630(2015)23-0253-04
doi:10.7506/spkx1002-6630-201523046
收稿日期:2015-02-03
基金项目:国家现代农业(蜂)产业技术体系建设专项(CARS-45-kxj12);赣鄱英才555工程资助项目(赣才字〔2013〕2号)
作者简介:郭亚惠(1990—),女,硕士研究生,主要从事蜜蜂研究。E-mail:343359192@qq.com
*通信作者:曾志将(1965—),男,教授,博士,主要从事蜜蜂教学与研究。E-mail:bees1965@sina.com