刘 媛 1,2,王 健 2,牟建楼 1,孙剑锋 1,王 颉 1,*
(1.河北农业大学食品科技学院,河北 保定 071000;2.河北北方学院农林科技学院,河北 张家口 075000)
摘 要:采用CCK-8(Cell Counting Kit-8)法检测海湾扇贝多肽混合物对体外培养的人肝癌HepG2细胞增殖的抑制作用,利用 倒置显微镜及流式细胞仪观察、分析其对HepG 2细胞的形态和细胞凋亡的影响。结果表明:不同质量浓度海湾扇贝多肽混合物(4、6、8、10、12 mg/mL)能够抑制人肝癌HepG2细胞的生长,且抑制率随海湾扇贝多肽混合物质量浓度的增加而升高。经12 mg/mL海湾扇贝多肽混合物处理后,HepG2细胞的形态发生了明显改变,表现为细胞皱缩、透明度降低、细胞核固缩等,并出现了凋亡小体。海湾扇贝多肽混合物可诱导HepG2细胞凋亡。
关键词:海湾扇贝多肽;HepG2细胞;细胞凋亡
恶性肿瘤又称为癌症,它是目前严重威胁人类生命和影响人类健康的主要疾病之一。海洋生物来源的抗肿瘤活性物质具有毒副作用小、药效高的特点,现已成为天然抗癌药物极好的潜在资源。扇贝是海洋生物的一种,因其营养价值高,且含有多种生理活性成分,在海洋抗癌药物研究 [1-6]中具有很好的应用和开发前景。本研究团队已通过酶解技术、反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)和串联飞行时间质谱等方法从海湾扇贝中获得了包含5 个组分的海湾扇贝多肽混合物 [7-8]。为了探讨所得海湾扇贝多肽混合物的抗肿瘤活性及其抑瘤机制,本实验对其体外抗肿瘤活性及机制进行初步研究和探讨,为将海湾扇贝多肽混合物进一步开发为天然抗肿瘤活性成分奠定理论基础。
1.1 材料与试剂
人肝癌HepG2细胞由河北北方学院生命科学研究中心惠赠。
RPMI-1640培养基、胰蛋白酶、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 美国Gibco公司;胎牛血清 天津市川页生化制品有限公司;细胞增殖和细胞毒性检测试剂盒(Cell Counting Kit-8,CCK-8)上海同仁化学公司;庆大霉素 郑州羚锐制药有限公司;AnnexinⅤ-PE/7-AAD细胞凋亡检测试剂盒 美国BD公司;二甲基亚砜(dimethyl sulfoxide,DMSO)美国Sigma公司。
1.2 仪器与设备
FACS-AriaⅡ型流式细胞仪 美国BD公司;Ti-U荧光倒置显微镜 日本Nikon公司;SpectraMax M2e多功能微孔板检测系统 美国Molecular Devices公司;HEPA class 100 CO 2培养箱 美国Thermo Electron公司;1300 SERIES A2生物安全柜 美国Thermo Fisher公司;TDL-50B低速台式离心机 上海安亭科学仪器厂;D-1型自动蒸汽灭菌锅 北京发恩科贸有限公司。
1.3 方法
1.3.1 人肝癌HepG2细胞培养
在RPMI-1640培养基中加入10%胎牛血清和终效价为100 IU/mL的庆大霉素,调整pH值至7.4,将人肝癌HepG2细胞复苏后,加入上述RPMI-1640培养基,于37 ℃、5% CO 2培养箱中扩增培养,每24 h换液1 次,直至细胞生长至对数生长期。取对数生长期细胞用不同质量浓度海湾扇贝多肽混合物处理。
1.3.2 海湾扇贝多肽混合物对HepG2细胞生长的影响
采用CCK-8法 [9-10]检测海湾扇贝多肽混合物对HepG2细胞生长的影响:取对数生长期的人肝癌HepG2细胞,经0.25%的胰蛋白酶消化后,配成5×10 4个/mL的单细胞悬液,接种于96 孔板中,100 μL/孔,置于37 ℃、5% CO 2培养箱中培养过夜,弃培养液。设对照组和实验组,实验组分别加入不同质量浓度海湾扇贝多肽混合物(4、6、8、10、12 mg/mL,用RPMI-1640培养基稀释),对照组加入等体积RPMI-1640培养基。继续培养,于24 h后检测海湾扇贝多肽混合物对细胞增殖的抑制率。检测前4 h加入CCK-8试剂(20 μL/孔), 继续培养4 h后用多功能微孔板检测系统测定吸光度(A 490 nm),按照下式计算细胞增殖抑制率。每组每个时间点设4 个重复孔。
1.3.3 海湾扇贝多肽混合物对HepG2细胞形态的影响
取经传代培养、生长状态良好的肿瘤细胞,经0.25%胰蛋白酶消化后配成5×10 4 个/mL单细胞悬液,分别接种于6 个50 mL的培养 瓶中,37 ℃、5% CO 2培养箱中培养,待细胞贴壁后,实验组分别加入不同质量浓度海湾扇贝多肽混合物(4、6、8、10、12 mg/mL,用RPMI-1640培养基稀 释),对照组加入等体积RPMI-164 0培养基,继续培养24 h后,于倒置显微镜下观察细胞形态并拍照 [11]。
1.3.4 海湾扇贝多肽混合物对HepG2细胞凋亡的影响
采用AnnexinⅤ-PE/7-AAD双染细胞凋亡试剂盒检测人肝癌HepG2细胞的凋亡。取对数生长期的人肝癌HepG2细胞,经0.25%的胰蛋白酶消化后,配成1×10 6个/mL单细胞悬液,分别接种于6 个 50 mL的培养瓶中,37 ℃、5% CO 2培养箱中培养,待细胞贴壁后,实验组分别加入不同质量浓度海湾扇贝多肽混合物(4、6、8、10、12 mg/mL,用RPMI-1640培养基稀释),对照组加入等体积RPMI-1640培养基,继续培养 24 h 后,1 500 r/min离心7 min,收集细胞,经0.25%的胰蛋白酶消化后,用磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)洗涤2 次, 用标记缓冲液重悬细胞,调整细胞密度为1×10 6个/mL,吹打混匀后取100 μL细胞悬液加入5 mL培养管,分别加入5 μL AnnexinⅤ-PE及5 μL 7-AAD-PerCP-Cy5.5,混匀后避光染色20 min,加入400 μL标记缓冲液,流式细胞仪检测细胞凋亡状况 [12]。
1.3.5 海湾扇贝多肽混合物对HepG2细胞p53、Bcl-2蛋白表达的影响
取对数生长期的人肝癌HepG2和SMMC-7721细胞,经0.25%的胰蛋白酶消化后,配成1×10 6个/mL单细胞悬液,分别接种于6 个50 mL的培养瓶中,37 ℃、5% CO 2培养箱中培养,待细胞贴壁后,实验组分别加入不同质量浓度海湾扇贝多肽混合物(4、6、8、10、12 mg/mL,用RPMI-1640培养基稀释),对照组加入等体积RPMI-1640培养基,继续培养 24 h 后,1 500 r/min离心7 min,收集细胞,用PBS(pH 7.4)洗涤3 次,最后1 次移入1 mL离心管中,分别加入等量预热的细胞固定液,振荡器低速振荡混匀,37 ℃孵育15 min,经0.25%的胰蛋白酶消化后,配成1×10 6个/mL单细胞悬液,1 500 r/min离心7 min,收集细胞,加入1 mL破膜剂进行细胞破膜。振荡器低速振荡混匀细胞,冰上孵育30 min,清洗细胞。用缓冲液重悬细胞,使细胞终浓度为1×10 6个/mL,每个处理取100 μL细胞悬液,分别加入20 μL PE-p53或PE-Bcl-2孵育20 min,振荡器低速振荡混匀细胞,冰上孵育30 min,清洗细胞,加入约500 μL缓冲液重悬细胞,混匀后上流式细胞仪检测 [13]。
1.4 统计学处理
采用SAS 9.1软件进行数据统计学处理和分析。采用t检验分析两组间差异,方差不齐者采用秩和检验分析,P<0.05和P<0.01表示有统计学意义。
2.1 海湾扇贝多肽混合物对人肝癌HepG2细胞增殖的影响
海湾扇贝多肽混合物作用于体外培养的人肝癌HepG2细胞24 h后,采用CCK-8法检测,结果显示各质量浓度海湾扇贝多肽混合物对HepG2细胞增殖均出现不同程度的抑制作用,结果如图1所示。
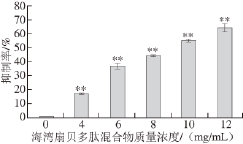
图1 海湾扇贝多肽混合物对HepG2细胞增殖的抑制作用
Fig.1 Inhibitory effect of bay scallop polypeptide mixture on the proliferation of HepG2 cells
**.与对照组(0 mg/mL)相比,差异极显著(P<0.01)。
由图1可 知,5 个不同质量浓度(4、6、8、10、12 mg/mL)海湾扇贝多肽混合物作用HepG2细胞24 h,对HepG2细胞的生长均具有明显的抑制效果,并且随着多肽质量浓度增加,抑制率也随之增加,且与对照组相比均有极显著差异(P<0.01)。
2.2 海湾扇贝多肽混合物对人肝癌HepG2细胞形态的影响
用倒置显微镜观察海湾扇贝多肽混合物作用24 h后HepG2细胞的形态,结果如图2所示。

图2 海湾扇贝多肽混合物对HepG2细胞形态结构的影响
Fig.2 Effect of bay scallop polypeptide mixture on morphology of HepG2 cells cultured in vitro
a~f.海湾扇贝多肽混合物质量浓度分别为0(对照组)、4、6、8、10、12 mg/mL。图4同。
由图2可知,对照组(图2a)HepG2细胞透亮,形态饱满,呈梭形或多突起形,突起部分较长,细胞生长状态良好,紧密连接成片,细胞核较大,位于细胞中心。而不同质量浓度海湾扇贝多肽混合物处理24 h后,实验组HepG2细胞总数不断变少,个体瘦小,出现不同程度的突起短缩、逐渐变圆,胞浆减少,且可见大小不等的空泡,细胞膜局部均向外出现一定程度的膨出-出芽现象。随海湾扇贝多肽混合物质量浓度的提高,上述改变更加明显,尤其以12 mg/mL海湾扇贝多肽混合物处理组变化最为明显,HepG2细胞的细胞核固缩、碎裂,呈圆形、卵圆形或肾形,被挤向细胞一侧,且出芽细胞更加多见,有的呈现典型的玫瑰花环状。以上结果说明,经不同质量浓度海湾扇贝多肽混合物处理24 h后,HepG2细胞的生长受到了不同程度的抑制。
2.3 海湾扇贝多肽混合物对人肝癌HepG2细胞凋亡的影响
以海湾扇贝多肽混合物作用HepG2细胞24 h后,用AnnexinⅤ-PE/7-AAD双染细胞凋亡试剂盒经流式细胞仪检测细胞凋亡情况,结果如图3所示。
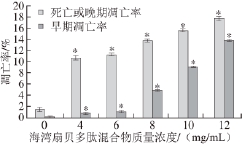
图3 海湾扇贝多肽混合物对HepG2细胞凋亡的影响
Fig.3 Effect of bay scallop polypeptide mixture on apoptosis of HepG2 cells
*.同一指标与对照组(0 mg/mL)相比,差异显著(P<0.05)。图5同。
由图3可知,与对照组(0 mg/mL)相比,各质量浓度海湾扇贝多肽混合物组HepG2细胞的死亡或晚期凋亡率和自发早期凋亡率均显著升高(P<0.05),且随海湾扇贝多肽混合物质量浓度的增加,细胞凋亡率也相应升高,两者成正相关。当海湾扇贝多肽混合物质量浓度为12 mg/mL时,HepG2细胞死亡或晚期凋亡率达到(17.69±0.04)%。以上结果说明,海湾扇贝多肽混合物对HepG2细胞具有明显的诱导凋亡作用。
以AnnexinⅤ-PE(标记凋亡细胞)荧光强度为横坐标、7-AAD-PerCP-Cy5.5(标记死亡细胞)荧光强度为纵坐标,采用流式细胞仪测得的散点图如图4所示。
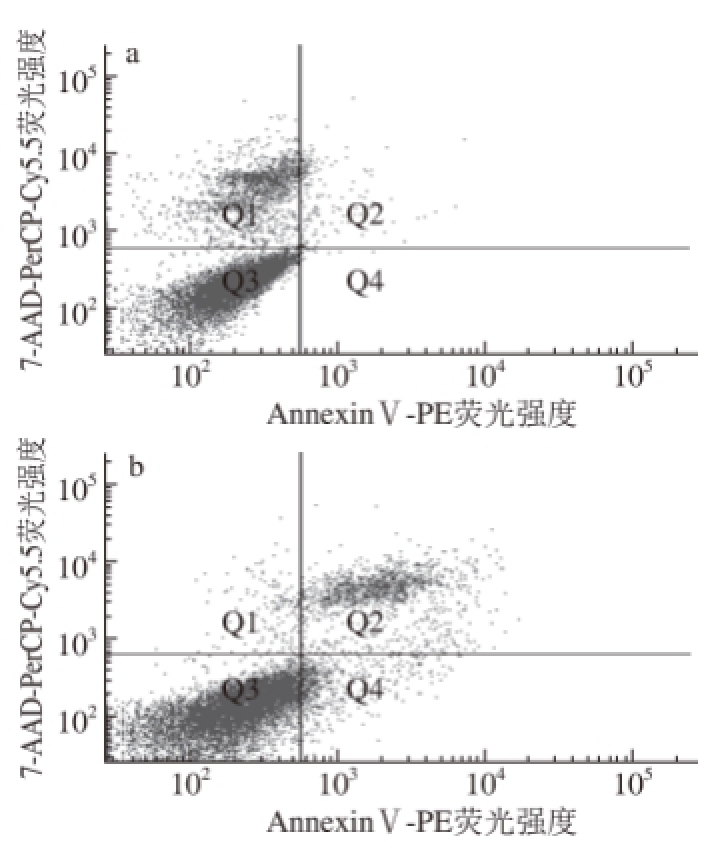
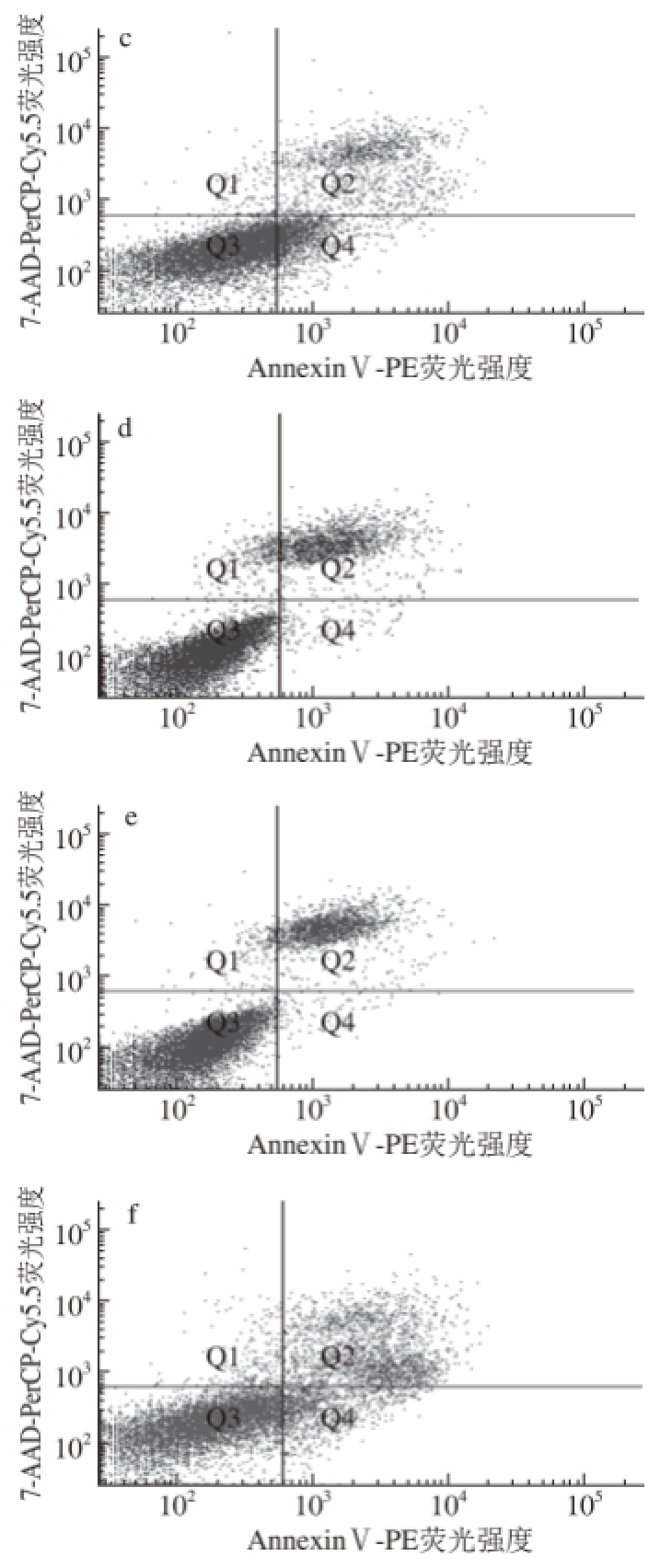
图4 HepG2细胞的流式散点图
Fig.4 Flow cytometric graphs showing the effect of bay scallop polypeptide mixture on apoptosis of HepG2 cells
由图4可知,与对照组(图4a)相比,各质量浓度海湾扇贝多肽混合物组在Q2象限均出现了标记的死亡或晚期凋亡细胞,在Q4象限均出现了标记的早期凋亡细胞。随着海湾扇贝多肽混合物质量浓度的增加,Q2象限和Q4象限标记的细胞逐渐增多,当海湾扇贝多肽混合物质量浓度为12 mg/mL时,Q2象限和Q4象限标记的细胞最多。以上结果证明,海湾扇贝多肽混合物作用于体外培养的人肝癌HepG2细胞24 h后,对HepG2细胞的早期凋亡和晚期凋亡均有一定的诱导作用,且随着海湾扇贝多肽混合物质量浓度的增大,其诱导HepG2细胞早期和晚期凋亡的作用也逐渐增强,12 mg/mL时效果最明显。
2.4 海湾扇贝多肽混合物对人肝癌HepG2细胞p53、Bcl-2蛋白表达的影响
海湾扇贝多肽混合物作用于HepG2细胞24 h后,经流式细胞仪检测p53、Bcl-2蛋白表达情况如图5所示。

图5 海湾扇贝多肽混合物对HepG2细胞p53和Bcl-2蛋白表达的影响
Fig.5 Effect of bay scallop polypeptide mixture on p53 and Bcl-2 expression of HepG2 cells
由图5可知,经5 个不同质量浓度(4、6、8、10、12 mg/mL)的海湾扇贝多肽混合物作用于体外培养的人肝癌HepG2细胞24 h后,p53蛋白表达明显升高,Bcl-2蛋白表达则明显降低,与对照组(0 mg/mL)相比有显著差异(P<0.05),且海湾扇贝多肽混合物的质量浓度越高,蛋白表达的差异越大。12 mg/mL海湾扇贝多肽混合物处理组p53和Bcl-2蛋白的阳性表达率分别为(6.40±0.27)%和(3.60±0.12)%,而对照组则分别为(1.80±0.29)% 和(12.60±0.55)%。
以往对活性物质进行体外抑瘤活性检测的报道中,多采用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)比色法,与MTT法相比,WST-8(CCK-8试剂中的有效成分)具有操作简化、结果更加稳定、线性范围更宽、灵敏度更高的优点。为此,本实验选用CCK-8法检测海湾扇贝多肽混合物对人肝癌HepG2细胞的增殖抑制作用,结果表明,不同质量浓度(4、6、8、10、12 mg/mL)的海湾扇贝多肽混合物在作用24 h后能极显著抑制HepG2细胞的增殖,随着海湾扇贝多肽混合物质量浓度的提高,抑制效果逐渐增强,12 mg/mL海湾扇贝多肽混合物处理组的效果最明显。这提示海湾扇贝多肽混合物能够抑制HepG2细胞增殖,具有抗肿瘤活性。
在正常生理或病理状态下,细胞凋亡是机体细胞发生的一种自发性、程序性死亡过程。它与癌症等许多疾病的发生有关。目前,许多抗肿瘤药物作用的主要机制之一是诱导肿瘤细胞凋亡 [14-17]。细胞凋亡首先表现为形态学改变,凋亡细胞最典型的特征是细胞核形态变化,为此,细胞形态学观察成为判断细胞凋亡最基本、最可靠的方法 [18]。本实验以不同质量浓度的海湾扇贝多肽混合物作用于人肝癌HepG2细胞24 h后,用倒置显微镜观察细胞形态,结果显示,海湾扇贝多肽混合物处理24 h后,人肝癌HepG2细胞均出现了细胞凋亡的形态学改变,其中,12 mg/mL海湾扇贝多肽混合物处理组细胞出现了典型的细胞凋亡形态学改变,表明海湾扇贝多肽混合物能够诱导人肝癌HepG2细胞发生凋亡,且呈剂量-效应依赖关系。
在细胞凋亡研究中,流式细胞术是一种可靠的技术手段,能够较准确地测定出凋亡细胞占所测定总细胞的百分含量。本实验用AnnexinⅤ-PE/7-AAD双染细胞凋亡试剂盒经流式细胞仪检测HepG2细胞的凋亡情况,结果显示,与对照组相比,不同质量浓度海湾扇贝多肽混合物处理组的HepG2细胞均出现一定程度的凋亡,且随着海湾扇贝多肽混合物质量浓度的增加,死亡或晚期凋亡率、早期凋亡率均明显升高。这说明海湾扇贝多肽混合物对人肝癌HepG2细胞的早期凋亡和晚期凋亡均有一定的诱导作用,且成剂量-效应正相关。
细胞凋亡是维持机体稳定的重要保护机制,一旦细胞凋亡机能紊乱或降低时,肿瘤发生率就会增加 [19]。目前认为细胞凋亡的发生受多个基因的调控,其中,Bcl-2家族调节的线粒体通路是目前研究较为透彻的一个。该家族可分为2 个亚群:其中一个亚群由Bax、Bik、Bak等促凋亡分子组成;另一个亚群由Bcl-2、Bcl-X、Bcl-W等抗凋亡蛋白组成。下调Bcl-2蛋白表达或上调Bax蛋白表达可促进多种肿瘤细胞凋亡,反之则抑制肿瘤细胞凋亡。Bcl-2家族蛋白对细胞凋亡的调控取决于自身表达水平的高低。因此,Bcl-2蛋白的表达水平具有重要的生理意义 [20-21]。
朱开梅等 [22-23]研究发现,构树叶总黄酮可通过下调Bcl-2蛋白和上调Bax蛋白表达,即下调 Bcl-2/Bax,从而抑制HepG-2细胞的生长,诱导细胞凋亡。孟显峰等 [24]研究发现,肌醇六磷酸可能通过调控Bcl-2及Bax蛋白的表达而诱导HepG2细胞的凋亡。吕必华等 [25]研究发现,选择性环氧合酶-2抑制剂NS-398可能通过下调Bcl-2蛋白表达,活化Caspase-3通路,从而诱导肝癌细胞HepG2凋亡。另外,1979年被首次报道的p53也是重要的肿瘤抑制基因,是目前发现的与人类肿瘤相关性最高的基因 [26]。p53蛋白在肿瘤细胞由G 1期到S期的转变中起重要调控作用,p53蛋白过度表达能阻滞细胞周期,影响细胞生长,并通过Caspases途径最终诱导细胞凋亡 [27]。本研究发现,与对照组相比,海湾扇贝多肽混合物作用于人肝癌HepG2细胞24 h后,p53蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低。
综上所述,海湾扇贝多肽混合物对体外培养的人肝癌HepG2细胞生长有一定的抑制作用,可通过上调p53蛋白表达、下调Bcl-2蛋白表达诱导人肝癌HepG2细胞发生凋亡,从而发挥其抑瘤作用。
参考文献:
[1] CHEN Haiying, CHU Xiao, YAN Chunling, et al. Polypeptide from Chlamys farreri attenuates murine thymocytes damage induced by ultraviolet B[J]. Acta Pharmacologica Sinica, 2007,28(10): 1665-1670.
[2] LIU Xiaojin, WANG Wencheng, WANG Hongjiang, et al. A polypeptide from Chlamys farreri inhibits UVB-induced HaCaT cells apoptosis via the Apaf-1/caspase-9 and Smac/XIAP signaling pathway[J]. Chinese Journal of Oceanology and Limnology, 2009, 27:587-593.
[3] RAWAT D S, JOSHI M C, JOSHI P, et al. Marine peptides and related compounds in clinical trial[J]. Anti-cancer Agents in Medicinal Chemistry, 2006, 6(1): 33-40.
[4] 杨永芳, 郁迪, 闫海强, 等. 海洋贝类提取物抗肿瘤活性的研究进展[J].中药材, 2011, 34(7): 1152-1155.
[5] 仲伟珍, 张健, 宋立萍, 等. 海洋贝类提取物的药理作用研究[J]. 中国海洋药物, 2004, 23(3): 31-33.
[6] 胡文琴, 王恬, 孟庆利. 抗氧化活性肽的研究进展[J]. 中国油脂,2004, 29(5): 42-45.
[7] 刘媛, 王健, 牟建楼, 等. 扇贝贝肉抗氧化肽制备及体外抗氧化实验研究[J]. 食品工业科技, 2014, 35(8): 206-209.
[8] 刘媛, 王健, 牟建楼, 等. 海湾扇贝多肽对小鼠H 22肝癌移植瘤的抑制机制研究[J]. 现代食品科技, 2014, 30(12): 1-6.
[9] 陈燕, 薛大忠, 罗强, 等. COX-2选择性抑制剂联合奥沙利铂对结肠癌HCT-8细胞增殖和凋亡的影响[J]. 中国现代医学杂志, 2014,24(6): 19-23.
[10] 罗强, 孙黎, 田青青, 等. 刚地弓形虫速殖子培养上清液对人胃癌细胞BGC-823增殖和凋亡的影响[J]. 中国寄生虫与寄生虫病杂志,2014, 32(2): 123-127.
[11] 李海军, 赵晓霞, 白美玲, 等. 苦参碱对乳腺癌MCF-7细胞凋亡及线粒体跨膜电位的影响[J]. 江苏医药, 2011, 37(4): 396-398.
[12] 罗强, 孙黎, 张力, 等. 姜黄素对人结肠癌SW620细胞凋亡机制的影响[J]. 中国老年学杂志, 2011, 31(16): 3108-3109.
[13] 孙黎, 罗强, 张力, 等. 金莲花黄酮对A549细胞生长及凋亡的影响[J].中国老年学杂志, 2011, 31(1): 82-83.
[14] JI Y B, GAO S Y, JI C F, et al. Induction of apoptosis in HepG2 cells by solanine and Bcl-2 protein[J]. Journal of Ethnopharmacology, 2008,115(2): 194-202.
[15] HASEGAWA M, YAGI K, IWAKAWA S, et al. Chitosan induces apoptosis via caspase-3 activation in bladder tumor cells[J]. Japanese Journal of Cancer Research, 2001, 92(4): 459-466.
[16] 董志峰, 程云, 欧阳藩, 等. 海鞘中的抗肿瘤生物活性物质[J]. 生物工程进展, 1999, 19(2): 32-34.
[17] NEZHAT F, WADLER S, MUGGIA F, et al. Phase II trial of the combination of bryostatin-1 and cisplatin in advanced or recurrent carcinoma of the cervix: a New York gynecologic oncology group study[J]. Gynecologic Oncology, 2004, 93(1): 144-148.
[18] 宋莹, 王建刚, 崔朝初, 等. 壁虎粗多肽诱导人肝癌细胞HepG2凋亡的机制研究[J]. 中药材, 2012, 35(6): 863-866.
[19] van GEELEN C M M, PENNARUN B, EK B V, et al. Downregulation of active caspase 8 as a mechanism of acquired TRAIL resistance in mismatch repair-profi cient colon carcinoma cell lines[J]. International Journal of Oncology, 2010, 37(4): 1031-1041.
[20] 王安红, 卢国彦, 周昆, 等. 补骨脂乙素诱导HepG2细胞凋亡及对Bcl-2家族表达的影响中药药理与临床[J]. 中药药理与临床, 2012,28(5): 23-25.
[21] MIAO Ruidong, WEI Juan, LÜ Minghua, et al. Conjugation of substituted ferrocenyl to thiadiazine as apoptosis-inducing agents targeting the Bax/Bcl-2 pathway[J]. European Journal of Medicinal Chemistry, 2011, 46(10): 5000-5009.
[22] 朱开梅, 陈丹, 李美波, 等. 构树叶总黄酮调控Bcl-2与Bax蛋白表达及caspase-3活性诱导HepG细胞凋亡的研究[J]. 中国实验方剂学杂志, 2014, 19(20): 128-133.
[23] 朱开梅, 李美波, 骆彩珍, 等. 构树叶总黄酮提取物诱导人肝癌细胞HepG2细胞凋亡及机制[J]. 中国医院药学杂志, 2013, 33(21):1763-1767.
[24] 孟显峰, 宋扬, 杨伟品. IP6诱导肝癌细胞HepG2凋亡及其对Bcl-2和Bax蛋白表达影响[J]. 青岛大学医学院学报, 2011, 47(4): 311-313.
[25] 吕必华, 张玲, 刘静. COX-2抑制剂NS-398对肝癌HepG2细胞凋亡蛋白Bcl-2和Caspase 3表达的影响[J]. 公共卫生与预防医学, 2007,18(4): 21-24.
[26] 周爱儒, 查锡良. 生物化学[M]. 北京: 人民卫生出版社, 2000: 421.
[27] KUO Yuchun, KUO Polin, HSU Yaling, et al. Ellipticine induces apoptosis through p53-dependent pathway in human hepatocellular carcinoma HepG2 cells[J]. Life Sciences, 2006, 78(22): 2550-2557.
Effect of Polypeptide Mixture from Bay Scallop on Proliferation and Apoptosis of HepG2 Cells
LIU Yuan
1,2, WANG Jian
2, MU Jianlou
1, SUN Jianfeng
1, WANG Jie
1,*
(1. College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000, China;2. College of Agriculture and Forestry Science and Technology, Hebei North University, Zhangjiakou 075000, China)
Abstract:The antitumor effi cacy and mechanism of the polypeptide mixture from bay scallop were studied by CCK-8 assays using inverted microscope and fl uorescence-activated cell sorter (FACS). The results showed that different concentrations of the polypeptide mixture from bay scallop (4, 6, 8, 10 and 12 mg/ mL) could supp ress the gr owth of human hepatocellular carcinoma cells HepG2, and the growth inhibitory rate increased with increasing concentration of the polypeptide mixture. After treated with the polypeptide mixture at a dose of 12 mg/mL, the morphology of HepG2 cells was changed, showing cell shrinkage, decreased transparency and nuclear chromatin pyknosis as well as the a ppearance of apoptotic bodies. To conclude, the polypeptide mixture from bay scallop can induce apoptosis of HepG2 cells.
Key words:polypeptide from bay scallop; HepG2 cell; apoptosis
中图分类号:S986.1
文献标志码:A
文章编号:1002-6630(2015)23-0257-05
doi:10.7506/spkx1002-6630-201523047
收稿日期:2015-01-30
基金项目:国家海洋公益性行业科研专项(201205031);河北省科技计划项目(14273205D-3)
作者简介:刘媛(1981—),女,讲师,博士研究生,研究方向为农产品加工及贮藏工程。E-mail:liuyuanwenwen1981@126.com
*通信作者:王颉(1959—),男,教授,博士,研究方向为食品加工与利用。E-mail:wj591020@163.com