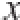 ±s表示,应用SPSS 17.0统计软件,采取单因素方差分析(analysis of variance,ANOVA)比较组间的统计学差异。
±s表示,应用SPSS 17.0统计软件,采取单因素方差分析(analysis of variance,ANOVA)比较组间的统计学差异。
林 霖 1,2,杨国栋 1,汪纪仓 1,2
(1.河南科技大学动物科技学院,河南 洛阳 471003;2.河南省高等学校环境与畜产品安全重点学科开放实验室,河南 洛阳 471003)
摘 要:目的:探讨虎杖苷对镉致小鼠睾丸氧化应激损伤的保护作用。方法:40 只小鼠随机分成5 组:正常对照组,镉组,25、50、100 mg/(kg·d)虎杖苷保护组,于实验第1天,镉组及虎杖苷保护组小鼠一次性腹腔注射2 mg/kg氯化镉(氯化镉质量浓度为0.2 mg/mL),制造小鼠睾丸氧化应激损伤,虎杖苷保护组小鼠同时经口灌胃给予25、50、100 mg/(kg·d)虎杖苷,连续灌胃1 周后处死小鼠,统计小鼠睾丸脏器系数;苏木精-伊红(hematoxylin-eosin,HE)染色,观察小鼠睾丸组织病理学变化;检测虎杖苷对小鼠睾丸超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,以及丙二醛(malonaldehyde,MDA)和8-羟基脱氧鸟苷(8-hydroxy-2-deoxyguanosine,8-OHdG)含量的影响。结果:与正常对照组比较,镉组小鼠睾丸脏器系数显著降低,睾丸组织细胞变性、坏死,生精细胞明显减少,而虎杖苷保护组小鼠睾丸组织细胞损伤均明显减轻;与正常对照组比较,镉组小鼠睾丸组织SOD及GSH-Px活性均极显著降低,MDA及8-OHdG含量均极显著升高(P<0.01)。与镉组比较,50、100 mg/(kg·d)虎杖苷保护组小鼠的睾丸脏器系数显著或极显著升高(P<0.05或P<0.01),睾丸组织的SOD活性明显升高,差异达到显著或极显著水平(P<0.05或P<0.01);25、50、100 mg/(kg·d)虎杖苷保护组小鼠睾丸组织的GSH-Px活性明显升高,差异达到显著或极显著水平(P<0.05或P<0.01),而MDA及8-OHdG含量均明显降低,差异同样达到显著或极显著水平(P<0.05或P<0.01)。结论:虎杖苷能减轻镉致小鼠睾丸组织细胞脂质过氧化损伤,抑制氧化应激对睾丸细胞DNA的损伤。
关键词:虎杖苷;镉;睾丸损伤;氧化应激
虎杖苷是以植物中药虎杖为主要来源的提取物,是植物体内一种天然的二苯乙烯类多酚物质。近年来,研究表明虎杖苷具有抗炎、抗氧化、抗肿瘤、抗疲劳等作用 [1-3],能够治疗出血性休克、肾上腺素导致的心、肺损伤,能拮抗顺铂、四氯化碳(CCl 4)等毒物引起的肝、肾毒性损伤 [4-8]。镉是一种主要的环境污染物,能损伤组织和器官,并有潜在的致癌作用 [9],雄性睾丸对镉引起的毒性敏感,镉可导致睾丸组织损伤、生精障碍和不育 [10-13]。近年来,研究发现一些植物提取物的活性成分如蓝莓花青素、黄芪甲苷等对镉的睾丸毒性均有一定的拮抗作用 [14-15],虎杖苷作为一种作用广泛的植物活性成分,对重金属镉导致的睾丸损伤有无保护作用尚未见报道,本实验就虎杖苷对镉致小鼠睾丸损伤的保护作用及其机理进行探讨,为虎杖苷防治重金属镉对人和动物雄性生殖健康的影响提供理论依据。
1.1 材料与试剂
虎杖苷,经高效液相色谱(high performance liquid chromatography,HPLC)检测纯度为98.2%,购于陕西慈缘生物技术有限公司。
超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malonaldehyde,MDA)试剂盒 南京建成生物工程研究所;8-羟基脱氧鸟苷(8-hydroxy-2-deoxyguanosine,8-OHdG)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒上海研生生物科技有限公司;其他试剂均为分析纯。
1.2 动物
清洁级健康昆明雄性小鼠40 只,体质量(30±2) g,购于郑州大学实验动物中心,合格证号:SCXK(豫)2005-0001,小鼠饲养环境室温控制在20~25 ℃、相对湿度55%~65%,小鼠的食物为郑州大学实验动物中心提供的小鼠标准颗粒饲料,自由饮用纯净水,实验期为7 d。
1.3 方法
1.3.1 动物分组与处理
40 只雄性小鼠适应性饲养3 d后,随机分为5 组,每组8 只:正常对照组,镉组,25、50、100 mg/(kg·d)虎杖苷保护组,于实验第1天,正常对照组小鼠腹腔注射灭菌生理盐水0.01 mL/g(以体质量计,下同),镉组和虎杖苷保护组小鼠一次性腹腔注射氯化镉溶液0.01 mL/g(200 mg氯化镉溶解到1 L 0.9%生理盐水中,氯化镉质量浓度为0.2 mg/mL)。同时,虎杖苷保护组小鼠分别灌胃25、50、100 mg/(kg·d)虎杖苷(灌胃剂型为混悬剂,虎杖苷质量浓度分别为2.5、5、10 mg/mL,助悬剂为0.5%羧甲基纤维素钠溶液,小鼠一次灌胃容量为0.01 mL/g),正常对照组和镉组小鼠灌胃0.5%羧甲基纤维素钠溶液,灌胃容量为0.01 mL/g。从实验第1天起,小鼠每天灌胃1 次,连续灌胃7 d,于末次灌胃24 h后,称体质量,脱颈椎处死小鼠。常规剖开腹腔,取出两侧睾丸,精确称量睾丸质量,一侧睾丸置入质量分数为4%的多聚甲醛溶液中固定,制作组织切片;切取另一侧部分睾丸,精确称质量,用眼科剪剪碎,在冰浴的玻璃匀浆器中匀浆,检测匀浆液中的SOD、GSH-Px活性以及MDA和8-OHdG含量。
1.3.2 小鼠睾丸组织病理学检测
常规制备小鼠睾丸石蜡组织切片,苏木精-伊红(hematoxylin-eosin,HE)染色,光镜下观察各组小鼠睾丸组织细胞形态结构。
1.3.3 小鼠睾丸氧化应激指标检测
小鼠睾丸组织匀浆蛋白含量的测定采用考马斯亮蓝法;MDA含量测定采用硫代巴比妥法,8-OHdG含量测定参照8-OHdG ELISA试剂盒说明书方法,SOD活性测定采用黄嘌呤氧化酶法,GSH-Px活性测定采用改良5,5'-二硫代双(2-硝基苯甲酸)(5,5'-dithiobis-(2-nitrobenzoic acid),DTNB)直接显色法,严格按照试剂盒说明书方法操作。
1.4 数据处理
实验数据均以
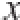 ±s表示,应用SPSS 17.0统计软件,采取单因素方差分析(analysis of variance,ANOVA)比较组间的统计学差异。
±s表示,应用SPSS 17.0统计软件,采取单因素方差分析(analysis of variance,ANOVA)比较组间的统计学差异。
2.1 小鼠睾丸形态及脏器系数变化

图1 各组小鼠睾丸脏器系数变化
Fig.1 Change in testis organ coefficient of mice in each group
△. 与正常对照组相比,差异显著(P<0.05);△△. 与正常对照组相比,差异极显著(P<0.01);*. 与镉组相比,差异显著(P<0.05);**. 与镉组相比,差异极显著(P<0.01)。
与正常对照组比较,镉组小鼠睾丸体积明显缩小,色泽稍灰暗。如图1所示,镉组小鼠睾丸脏器系数极显著降低(P<0.01);各剂量虎杖苷保护组小鼠睾丸的体积和脏器系数与镉组比较均不同程度增加,50 mg/(kg·d)虎杖苷保护组小鼠睾丸脏器系数显著升高(P<0.05),100 mg/(kg·d)虎杖苷保护组小鼠睾丸脏器系数极显著升高(P<0.01)。
2.2 小鼠睾丸组织病理学观察
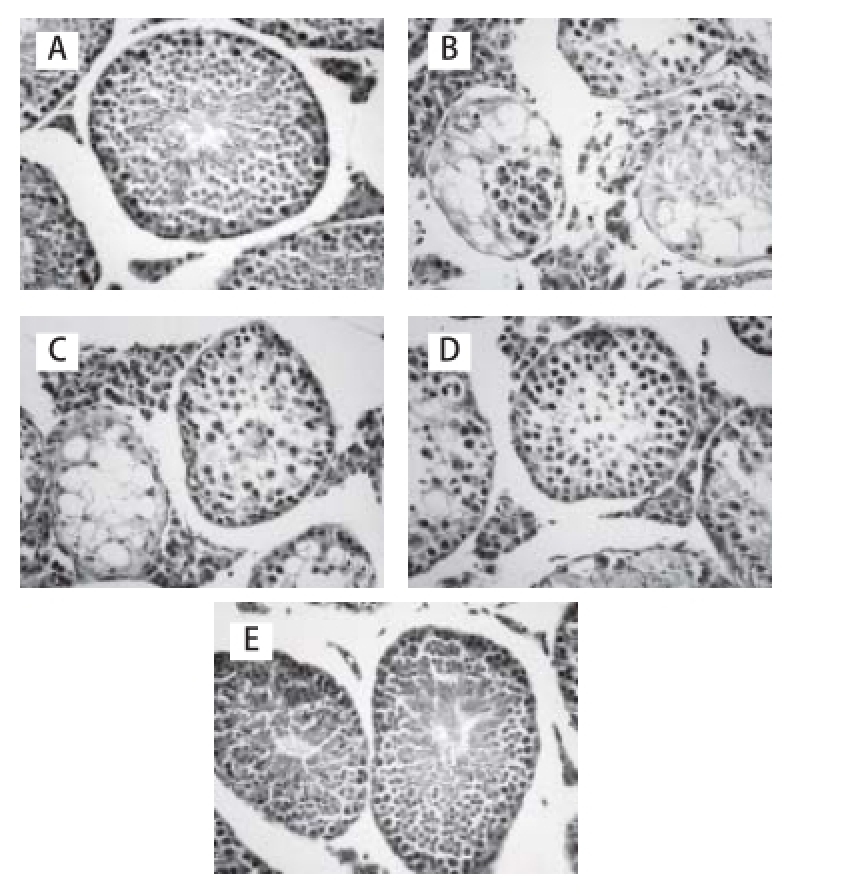
图2 光镜下各组小鼠睾丸组织形态结构(HE,×400)
Fig.2 Histological characteristics of testis sections stained with HE (× 400)
A. 正常对照组;B. 镉组;C~E. 25、50、100 mg/(kg·d)虎杖苷保护组。
如图2所示,正常对照组小鼠睾丸组织结构清晰,生精细胞层数多、排列整齐,可见精子产生。镉组小鼠睾丸曲细精管管壁变薄,上皮细胞排列紊乱、细胞层数明显减少,管腔中无精子;存在少量变性、坏死的生精细胞:变性细胞的胞质内细胞器肿胀,核体积略增大;坏死细胞的胞膜破裂,胞质内出现空泡,细胞溶解。镉组小鼠睾丸有较多生精细胞变性、坏死、脱落,偶见生精小管上皮细胞坏死、溶解;部分睾丸生精小管上皮细胞已全部坏死、溶解,管壁结构分辨不清,间质内纤维大量增生。虎杖苷保护组小鼠睾丸组织损伤明显减轻,100 mg/(kg·d)虎杖苷保护组小鼠睾丸形态及组织结构基本接近正常对照组,生精细胞层数较多、排列基本整齐,并有精子生成。
2.3 虎杖苷对小鼠睾丸组织抗氧化酶活性及氧化应激产物的影响
表1 各组小鼠睾丸组织MDA、8-OHdG含量及SOD、GSH-Px活性
Table 1 Contents of MDA and 8-OHdG and activities of SOD and GSH-Px in testis tissue from each group of mice

注:*. 与正常对照组相比,差异显著(P<0.05);**. 与正常对照组相比,差异极显著(P<0.01);▲. 与镉组相比,差异显著(P<0.05);▲▲. 与镉组相比,差异极显著(P<0.01)。
组别 SOD活力/(U/g) GSH-Px活力/(U/g) MDA含量/(nmol/g)8-OHdG含量/(ng/L)正常对照组 151.89±13.39 56.23±2.26 25.04±1.81 29.96±3.23镉组 114.06±8.66** 32.54±1.85** 39.20±2.33** 56.25±4.32** 25 mg/(kg·d)虎杖苷保护组 121.57±9.52 36.78±1.96 ▲ 36.45±3.05 ▲ 51.76±4.47 ▲50 mg/(kg·d)虎杖苷保护组 128.59±10.74 ▲ 41.33±1.71 ▲ 33.57±3.18 ▲▲ 47.47±5.47 ▲100 mg/(kg·d)虎杖苷保护组 142.20±8.71 ▲▲ 48.25±2.36 ▲▲ 28.96±2.71 ▲▲ 35.47±3.58 ▲▲
由表1可知,与正常对照组比较,镉组小鼠睾丸组织SOD及GSH-Px活力极显著降低(P<0.01),MDA和8-OHdG含量极显著升高(P<0.01);与镉组比较,50、100 mg/(kg·d)虎杖苷保护组小鼠睾丸组织SOD活力均明显升高,差异达到显著或极显著水平(P<0.05或P<0.01),25、50、100 mg/(kg·d)虎杖苷保护组小鼠睾丸组织GSH-Px活性明显升高,差异达到显著或极显著水平(P<0.05或P<0.01);与镉组比较,25、50、100 mg/(kg·d)虎杖苷保护组小鼠睾丸组织MDA和8-OHdG含量均明显降低,差异同样达到显著或极显著水平(P<0.05或P<0.01)。
镉广泛应用于现代工业、农业,如电镀、染料、涂料、电池、农药等领域,可通过消化、呼吸等途径进入人和动物体内,因其代谢缓慢、半衰期长,易在体内多种组织、器官中蓄积 [16-17],能对机体多种脏器造成危害,是一种国际公认的主要环境污染物。镉属于过渡金属元素,具有非常活泼的外层轨道电子,易发生电子传递反应而抑制线粒体呼吸链,并产生羟自由基(·OH)、超氧阴离子自由基(O 2 -·)、H 2O 2等 [18],可攻击质膜上不饱和脂肪酸的双键,导致脂质过氧化损伤。镉还可与微量元素相互作用,影响抗氧化酶系中的金属辅基如Cu、Zn、Se等金属依赖性酶的活性,降低其清除氧自由基的能力 [19-20]。镉不仅能导致组织细胞脂质过氧化损伤,同时还可导致细胞DNA氧化损伤、DNA链断裂、DNA-蛋白质交联损伤,染色体畸变 [21]。
本实验对小鼠采取一次性腹腔注射2 mg/kg氯化镉,1 周后小鼠睾丸脏器系数明显降低,睾丸组织发生变性与坏死等病理学改变,此病理结果与陈敏等 [22]观察到小鼠染镉1、3 d后睾丸的形态呈出血、水肿特征,5 d后睾丸开始缩小的报道一致,同时也表明本实验观察到染镉7 d后小鼠的睾丸体积缩小,是睾丸组织经过了出血、水肿、坏死等一系列病理演变过程的结果,小鼠睾丸脏器系数越低,其损伤越严重,其变化与睾丸的组织病理变化相一致;与此对应,小鼠睾丸组织中脂质过氧化产物MDA的含量亦极显著升高,表明脂质过氧化可能是镉诱导睾丸组织损伤的主要因素之一。
虎杖苷又称白藜芦醇苷,为植物虎杖体内天然的二苯乙烯类多酚类物质,具有顺式与反式两种构象,自然界中主要以反式构象存在。研究已表明,虎杖苷能拮抗出血性休克及CCl 4造成的小鼠脂质过氧化损伤 [7-8],对果糖诱导的氧化应激损伤也有较强的抑制作用 [3]。本实验结果表明,随着虎杖苷剂量的增加,小鼠睾丸组织MDA含量也呈现逐步降低趋势,与镉组比较,25 mg/(kg·d)虎杖苷可以显著降低睾丸组织MDA含量(P<0.05),50、100 mg/(kg·d)虎杖苷可以极显著降低睾丸组织MDA含量(P<0.01);睾丸组织中的SOD和GSH-Px活性随虎杖苷剂量的增加呈增强趋势,这表明虎杖苷能够通过提升抗氧化酶活性、抑制镉诱导的自由基对睾丸组织细胞的攻击、减轻脂质过氧化程度,从而使小鼠睾丸组织MDA含量降低。而睾丸MDA含量变化与睾丸的病理学损伤程度相一致,伴随睾丸MDA含量逐渐降低,睾丸脏器系数逐渐接近正常对照组,小鼠睾丸组织病变逐渐减轻,表明虎杖苷与镉诱导的睾丸氧化应激损伤存在剂量-效应关系。
8-OHdG是活性氧簇致细胞DNA损伤的产物,活性氧自由基如O 2 -·、·OH等可攻击DNA鸟嘌呤碱基第8位碳原子,生成8-OHdG,导致DNA空间结构发生改变,所以8-OHdG常作为氧化损伤及DNA突变的标志物 [23-24]。镉可引起大鼠肝细胞DNA损伤及8-OHdG含量显著升高 [25],本实验发现镉可导致小鼠睾丸组织8-OHdG含量极显著升高,表明镉具有DNA毒性。各剂量虎杖苷保护组小鼠睾丸组织8-OHdG含量显著或极显著降低,表明虎杖苷可以有效减轻镉诱导的活性氧簇自由基对小鼠睾丸DNA的攻击,进而减少细胞发生基因突变的机率。
本实验说明虎杖苷能拮抗镉引起的小鼠睾丸的毒性损伤,减轻睾丸的脂质过氧化损伤程度,并具有抑制镉对小鼠睾丸组织细胞DNA氧化损伤的保护作用。
参考文献:
[1] GIAMPIETRO R A, de FILIPPIS D, CARTENI M, et al. Polydatin,a natural precursor of resveratrol, induces β-defensin production and reduces in.ammatory response[J]. In.ammation, 2013, 36(1): 26-33.
[2] DING Xianqiong, TANG Keji, LU Pingjun, et al. Antifatigue effects of polydatin from Chinese herb polygonum cuspidatum in swimming mice[J]. African Journal of Microbiology Research, 2009, 3(7): 358-361.
[3] CHEN Lüyi, ZHOU Lan, LIN Qinxiong, et al. Polydatin ameliorates renal injury by attenuating oxidative stress-related inflammatory responses in fructose-induced urate nephropathic mice[J]. Food and Chemical Toxicology, 2013, 52: 28-35.
[4] MIAO Qing, SHI Xiaopeng, YE Mingxiang, et al. Polydatin attenuates hypoxic pulmonary hypertension and reverses remodeling through protein kinase C mechanisms[J]. International Journal of Molecular Sciences, 2012, 13: 7776-7787.
[5] DONG Ming, DING Wenwen, LIAO Yansong, et al. Polydatin prevents hypertrophy in phenylephrine induced neonatal mouse cardiomyocytes and pressure-overload mouse models[J]. European Journal of Pharmacology, 2015, 746: 186-197.
[6] SINAN I, DAMLA A A, NEUWIRTH O, et al. Protective effect of polydatin, a natural precursor of resveratrol, against cisplatin-induced toxicity in rats[J]. Food and Chemical Toxicology, 2014, 72: 147-153.
[7] WANG Xingmin, SONG Rui, CHEN Yunyan, et al. Polydatin: a new mitochondria protector for acute severe hemorrhagic shock treatment[J]. Expert Opinion on Investigational Drugs, 2013, 22(2):169-179.
[8] ZHANG Hong, Y. Chenghao, JIANG Yiping, et al. Protetive effects of polydatin from polygonum cuspidatum against carbon tetrachlorideinduced live injury in mice[J]. PLoS ONE, 2012, 7(9). doi: 10.1371/ journal.pone.0046574.
[9] MISRA R R, SMITH G T, WAALKES M P. Evaluation of the direct genotoxic potential of cadmium in four different rodent cell lines[J]. Toxicology, 1998, 126: 103-114.
[10] 江燕琼, 王佳月, 唐思贤, 等. 镉对鹌鹑睾丸组织的毒性研究[J]. 复旦学报: 自然科学版, 2007, 46(6): 869-873.
[11] 廖晓岗, 石之虎, 邹聪, 等. 镉对大鼠睾丸支持细胞波形蛋白、E-钙黏蛋白表达及血睾屏障的影响[J]. 重庆医科大学学报, 2011, 36(7):814-817.
[12] SIU E R, MRUK D D, PORTO C S, et al. Cadmium-induced testicular injury[J]. Toxicology and Applied Pharmacology, 2009,238(3): 240-249.
[13] 张明, 邬静, 袁慧, 等. 镉诱导仔猪睾丸支持细胞氧化酶活性降低及DNA的损伤[J]. 中国兽医学报, 2010, 30(6): 818-821.
[14] 龚频, 陈福欣, 虢红梅, 等. 蓝莓花青素对镉致小鼠睾丸损伤的保护作用[J]. 中华劳动卫生职业病杂志, 2014, 32(10): 762-764.
[15] 宁巍, 廖晓岗, 王毅, 等. 镉对大鼠血睾屏障的损伤及黄芪甲苷的保护作用[J]. 解剖学报, 2014, 45(5): 705-709.
[16] 蔡秋, 龙梅立, 朱明, 等. 贵州牛组织镉污染与饲养环境的相关性研究[J]. 食品科学, 2007, 28(7): 434-437.
[17] 任继平, 李德发, 张丽英. 镉毒性研究进展[J]. 动物营养学报, 2003,15(1): 1-6.
[18] STOHS S J, BAGCHI D, HASSOUN E, et al. Oxidative mechanism in the toxicity of chromium and cadmium ions[J]. Journal of Environmental Pathology, Toxicology and Oncology, 2000, 19(3):201-213.
[19] 周雍, 金慧英, 冯伟华, 等. 急性镉中毒大鼠睾丸氧化损伤机制的研究[J]. 第二军医大学学报, 2002, 23(1): 64-66.
[20] ARASH K, MASOUD A, OMID D. Cadmium-induced oxidative stress in the rat testes: protective effects of betaine[J]. International Journal of Peptide Research and Therapeutics, 2013, 19: 337-344.
[21] 金龙金, 方周溪, 张婵, 等. 镉暴露小鼠生精细胞DNA损伤与Bcl-2和Bax表达率及超微结构改变[J]. 中华劳动卫生职业病杂志, 2005,23(4): 271-273.
[22] 陈敏, 谢吉民, 高晓钦, 等. 镉对小鼠睾丸的毒作用[J]. 工业卫生与职业病, 2000, 26(5): 275-277.
[23] 朴恩谊, 徐立红. 8-OHdG在医学领域的应用与研究进展[J]. 中国细胞生物学学报, 2012, 34(5): 493-499.
[24] PRABHULKAR S, LI Chengzhong. Assessment of oxidative DNA damage and repair at single cellular level via real-time monitoring of 8-OHdG biomarker[J]. Biosensors and Bioelectronics, 2010, 26(4):1743-1749.
[25] 潘洪志, 万丽葵, 李辉, 等. 番茄红素对镉中毒大鼠肝细胞DNA损伤的影响[J]. 营养学报, 2006, 28(1): 83-84.
Ameliorative Effect of Polydatin on Oxidative Stress Damage Induced by Cadmium in Testis of Mice
LIN Lin
1,2, YANG Guodong
1, WANG Jicang
1,2
(1. College of Animal Science and Technology, Henan University of Science and Technology, Luoyang 471003, China;2. Open Laboratory of Key Discipline for Environment and Animal Products Safety of Henan Institute of Higher Learning, Luoyang 471003, China)
Abstract:Objective: To study the protective effect of polydatin on oxidative stress damage induced by cadmium in the testis of mice. Methods: Forty male mice were randomly divided into five groups including negative control group, cadmium(Cd) group, and polydatin-protected groups (25, 50 and 100 mg/(kg·d) polydatin). Oxidative stress damage was induced by 2 mg/kg cadmium chloride on the testis in mice from the Cd group and polydatin-protected groups on the 1st day of the experiment. On the same day, the mice treated with cadmium except those from the Cd group were subjected to intragastric administration of polydatin at doses of 25, 50 and 100 mg/(kg·d). The experiment lasted one week. Testis organ coefficient,the activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) and the contents of MDA and 8-hydroxy-2-deoxyguanosine (8-OHdG) were examined on testis in each group. Moreover testis tissue morphology was examined by HE. Results: Testis organ coefficient was decreased, and pathological observations of testis exhibited serious damage with degeneration, necrosis and decreased number of seminiferous cells in mice from the Cd group, while testis organ coefficient was enhanced. The damage was slighter in the testis of mice treated with polydatin. Compared with the control group, the activities of SOD and GSH-Px were decreased remarkably, and the contents of MDA and 8-OHdG were enhanced in the testis of mice from the Cd group (P < 0.01). However, compared with the Cd group, testis organ coefficient and the activity of SOD were enhanced significantly in the testis of mice treated with 50 and 100 mg/(kg·d) polydatin (P < 0.05 or P < 0.01),and the activity of GSH-Px was enhanced significantly in the testis of mice treated with 25, 50 and 100 mg/(kg·d) polydatin(P < 0.05 or P < 0.01). Moreover, the levels of MDA and 8-OHdG were decreased significantly in the testis of mice treatedwith 25, 50 and 100 mg/(kg·d) polydatin (P < 0.05 or P < 0.01). Conclusion: Polydatin has ameliorative effect on testis lipid peroxidation, and can act as a protector to inhibit DNA damage induced by cadmium.
Key words:polydatin; cadmium; testis damage; oxidative stress
中图分类号:R144
文献标志码:A
文章编号:1002-6630(2015)23-0275-04
doi:10.7506/spkx1002-6630-201523050
收稿日期:2015-02-15
基金项目:河南省教育厅自然科学研究项目(13B230989);河南科技大学青年科学基金项目(2014QN062)
作者简介:林霖(1972—),男,实验师,硕士,研究方向为分子毒理学与中毒病防治。E-mail:linlin403@163.com