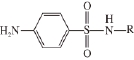
图1 磺胺类药物母核结构
[22]
Fig.1 Structure of sulfonamides
[22]
张 元 1,2,李伟青 1,周伟娥 1,任志芹 1,张 峰 1,*,冯雪松 2,周 昱 2,李绍辉 1,郑 阳 1
(1.中国检验检疫科学研究院食品安全研究所,北京 100176;2.中国医科大学药学院,辽宁 沈阳 110013)
摘 要:磺胺类兽药残留是目前重要的动物源性食品安全问题,检测食品中磺胺类兽药残留对人体健康具有重要的意义。检测食品基质中痕量兽药残留依赖于有效的前处理方法和精密的分析仪器。本文论述磺胺类兽药分析检测的研究背景和现状,并对国内外食品中磺胺类兽药残留的传统提取技术和新型提取技术等前处理方法及检测方法进行综述,为食品中磺胺类药物的残留监控提供参考。
关键词:食品;前处理技术;检测;磺胺类兽药残留
磺胺类药物是含有对氨基苯磺酰胺结构的一类药物的总称,其母核结构如图1所示,多数药物是由母核R位置上出现不同取代基取代而形成。该药物作为抗生素使用已有超过70 a历史,主要通过与对氨基苯甲酸(P-amino benzoic acid,PABA)竞争性结合二氢叶酸合成酶,影响细菌核蛋白合成而发挥抑菌作用 [1-2],该药物具有抗菌谱广、价格低廉、性质稳定等诸多优点。截止目前,无论在临床还是兽药领域,该药物均有着极其广泛的应用 [3-5],Baran等 [6]研究表明,丹麦在2009年每1 kg猪肉、牛肉、鸡肉及鱼肉中的磺胺类药物平均使用量分别为4.82、17.2、0.033和58.5 mg。

图1 磺胺类药物母核结构
[22]
Fig.1 Structure of sulfonamides
[22]
由于磺胺类药物在预防和治疗过程中的不规范使用,许多动物源性食品常存在该类药物的残留问题。鉴于此,人类往往成为了该类药物的“被动吸收者”。磺胺类药物具有致过敏、抑制体内酶活性、引起肠内菌群失调等 [7-9]副作用,人类若大量摄入,往往具有很大的风险性。需要指出的是,许多磺胺类药物的降解产物也具有一定的生物活性,部分甚至具有更严重的毒性 [2]。磺胺类药物如果在肉、蛋、乳等各类动物性食品中发生残留,一方面,残留的药物可能对人体健康造成潜在的危害 [7-9];另一方面,兽药残留也会阻碍动物源性产品的进出口贸易 [2]。我国农业部规定动物性食品中总磺胺的最高残留限量(maximum residue limit,MRL)为0.1 mg/kg。许多其他国家及相关机构也对食品中磺胺类药物MRL进行了规定,具体见表1。
表1 各国及地区磺胺类药物MRL
Table 1 MRL of sulfonamides in different countries and regions

各标准制定机构及组织 食品基质 MRL/(.g/kg)国际食品法典委员会 食品和饲料 磺胺类总量≤100欧盟 可食动物肝、肾;牛、羊乳及肌肉 磺胺类总量≤100可食动物肝、肾;牛、羊乳及肌肉 氨苯砜禁用美国食品药品监督管理局 食品和饲料 磺胺类总量≤100日本厚生劳动省 食品 磺胺类不得检出中华人民共和国农业部 可食动物肝、肾、脂肪;牛、羊乳及肌肉 磺胺类总量≤100牛乳 磺胺二甲嘧啶≤25
食品安全领域目前已经有大量关于磺胺类药物检测的研究性论文,如牛奶 [10-12]、鸡蛋 [13-14]、肉类(猪、牛、羊、鸡) [15-17]、鱼及水产品 [18-20]等。Dmitrienko等 [2]基于斯高帕斯数据库对磺胺类药物近年来研究现状进行综述,指出自1995年开始,标题、摘要或者关键词中含有“磺胺”的文献数量已经增长了接近4 倍,与此同时,1996—2008年,磺胺类药物的研究报道数量连续13 a实现增长。
Blasco等 [21]对各类抗生素作为兽药或饲料添加剂的使用量进行了统计,指出磺胺类药物是目前使用量最大的兽药抗生素之一,在对多种食品进行兽药残留检测过程中,磺胺类药物以检出率20%牢牢占据各类兽药抗生素残留榜首 [21](图2)。Dmitrienko等 [2]还对2008-2013年5 a间不同食品基质中检出磺胺类残留的比例进行了统计,结果证实,牛奶、肉类和鸡是残留磺胺类检出率最高的3 种动物源性食品(图3)。

图2 食品中各类残留兽药检出率
[2211]
Fig.2 Detection rates of different kinds of veterinary drugs in foods
[21]

图3 不同食品中磺胺类兽药残留检出率
[22]
Fig.3 Detection rates of sulfonamides in foods
[2]
建立复杂基质中磺胺类药物残留的检测方法,前处理是极其重要的一环 [22-23]。前处理不仅要最大限度地提取待测目标物,还需要最大程度地减少杂质的存在,从而降低基质干扰,降低检测限。目前前处理方法可以分为传统方法和一些新型前处理技术,如加压液体萃取(pressurized liquid extraction,PLE)法、固相萃取(solid-phase extraction,SPE)法、基质辅助固相分散萃取(matrix solid-phase dispersion,MSPD)法和“快速、简易、廉价、有效、稳定、安全”(quick, easy, cheap,effective rugged, safety,QuEChERs)萃取法等。
2.1 传统前处理方法
传统前处理方法包括溶剂提取或液液萃取法,无论对于食品样品还是其他样品,前处理的第一步通常是先将样品进行匀浆处理,后加入一定的极性或者非极性有机试剂进行提取,提取结束后过膜处理,以除去不溶基质及部分杂质 [2]。但考虑到样品中多含有脂类物质或者蛋白质,因此前处理过程可能还需要加入一些除脂或者沉淀蛋白的过程。
乙腈是目前最常用的提取试剂,对于很多食品基质,采取乙腈作为提取溶剂均已有报道 [24-30]。例如Zhang Yupu等 [28]采用乙腈提取肝脏组织中的7 种磺胺类药物,回收率均在84.6%以上。另外,蜂蜜及婴儿食品采用乙腈也均有一定报道 [31-33]。少数研究则采取其他有机试剂进行提取(如甲醇、乙酸乙酯及二氯甲烷等),也均获得了较好的提取效果 [34-37]。此外,混合提取溶剂也常被使用作为提取试剂,常见的混合提取溶剂包括:乙腈-四氢呋喃、甲醇-水、乙腈-磷酸以及甲醇-二甲基亚砜等 [38-40]。与此同时为了提高有机溶剂从食品样品中的提取效率,提取过程中超声、微波和振荡处理常常被采用 [41-43]。
近年来,在复杂食品基质中同时测定多种磺胺类药物的新型前处理方法相应被开发出来 [44-61],具体见表2。
表2 各种新型提取技术优缺点
Table 2 Advantages and disadvantages of different extraction technologies

提取技术 优势 不足 参考文献提取效率高;自动化程度高,操作简易;可采用水作为提取剂SPE 操作简单、省时、省力 成本高 [46-51]回收率高 需专业人员协助方法开发MSPD 对于固体和黏性样品前处理简单 经常需要额外的净化步骤 [52-54]QuEChERS 操作简便、迅速、节省试剂,成本低 对于部分物质提取选择性低 [55-60]分散液液微萃取 提取效率高、所需时间短 有机试剂消耗量大 [57,61]PLE 设备相对复杂运行成本高 [44-45]
2.2 PLE法
PLE法是在较高温度(50~200 ℃)和压力(7~21 MPa)下用有机溶剂萃取固体或半固体的自动化方法。该方法具有回收率高、萃取时间短(≤15 min)且自动化程度高等优点。由于具有诸多优点,该法目前已被美国环保局(United States Enviromental Protection Agency,USEPA)选定为推荐的标准方法(标准编号3545),Yu Huan [44]和王菊梅 [45]等分别采用该法提取动物源性食品(肉、肝脏、肾脏)和奶粉中磺胺类药物残留,前者回收率为71.1%~118.3%,后者回收率为87.6%~91.4%,均获得了较好的提取效果。
2.3 SPE法
采用有机溶剂从食品基质中提取得到的溶液,常常含有各类杂质干扰。为最大程度地降低杂质干扰,减小基质效应,在上机之前对样品进行一定的净化处理是必不可少的。通常情况下,不同食品基质中含有的主要杂质成分是不一致的,如肉类中含有较高的脂类杂质,而鸡蛋中含有较多的蛋白质,蜂蜜中则含有大量的糖类。综上所述,针对不同食品基质,需要采取不同的净化方式 [44-51]。SPE柱是最常用的净化方式,待测药物从不同食品基质,如肉类、鸡蛋、奶中分离出来后,经过不同类型的SPE柱发挥富集、净化及去除杂质的作用。目前,市售的SPE柱各式各样,其中已有多种SPE柱被报道用于磺胺类药物的富集和净化,如Oasis、Bond柱等 [46-51]。乙腈、甲醇、甲醇-甲酸铵等溶液作为常见的洗脱溶剂均取得了较好的效果。Economou等 [46]采用Oasis HLB柱对蜂蜜进行净化,回收率可达70%~106%。刘铁铮等 [47]采用Bond ODS-C 18柱对鸡蛋样品净化,回收率高达73.2%~102.6%。Wang Hui等 [50]采用自制的阳离子交换树脂SPE对鸡肉进行净化,利用液质进行测定,该法回收率高达82.6%~92.3%。由此可见,SPE法净化回收率较高,符合现代化检测的要求。
2.4 MSPD法
MSPD法最早于1989年被提出,该方法常用于液体或者黏稠样品,对于部分含有脂类的原料也适用 [52-54],Zhang Yupu等 [28]建立了检测肉中7 种磺胺类药物的MSPD法,选用硅藻土作为分散吸附剂,吸附剂和待测样品质量比为3∶1,丙酮作洗脱溶剂,7 种磺胺类药物的回收率均在84.6%以上。Lu Yanbin等 [54]对鱼中磺胺类药物的检测方法进行开发,回收率为69.0%~96.3%。Zhang Yupu等 [28]还分别对硅胶、硅藻土和中性氧化铝等吸附剂,甲醇、二氯甲烷、正己烷、乙腈和丙酮等洗脱溶剂配合使用效果进行了比较,结果认为硅藻土/丙酮为食品基质中检测磺胺类药物的最佳前处理组合。Lu Yanbin等 [54]认为C 18配合乙腈/二氯甲烷(1∶1,V/V)也能获得较好的提取净化效果。吴淑秀等 [39]使用乙二胺-N-丙基硅烷和十八烷基键合相硅胶两种基质分散净化剂净化,9 种磺胺检出限达0.1~0.8 μg/kg,回收率为74.1%~115.8%。总体而言,MSPD法用于不同食品基质的净化,回收率令人满意,符合检测要求。此外,碳纳米管配合乙腈和50 mmol/L乙酸铵溶液(95∶5,V/V)也被少数学者所推崇 [46]。
2.5 QuEChERs法
QuEChERs法是2003年美国Anastassiades等 [55]提出的,该方法最初应用于农产品中(蔬菜、水果等)农药残留筛查。近年来食品中部分兽药的QuEChERs法也被开发出来 [16,56-58],QuEChERs法将提取、分离和净化等多个步骤融合为一步,因此可以减少实测样品用量,减少试剂和耗材消耗,同时节省操作人员的精力和时间,此外,QuEChERs法具有较广的样品检测范围,对于各种食品,如果蔬、植物、谷物、肉类等均可以采用,目前欧盟已制定EN 15662—2007:QuEChERs-气相色谱-质谱/液相色谱-质谱测定植物源性食品中农药残留。
QuEChERs法在分离磺胺类药物及部分其他种类药物时有着较好的提取效果。Frenich等 [58]比较研究了在提取食品中的磺胺类药物及部分其他药物时该方法和其他前处理方法的优劣,结果显示相比于SPE、液液萃取和MSPD法,QuEChERs方法取得了更高的回收率。此外,该方法 还具有节省时间和试剂等优势。在该研究中,完成15 份样品前处理的时间仅不足1 h,而其他方法均需要3 h以上。Abdallah等 [16]采用QuEChERs前处理结合高分辨质谱同时测定动物组织中22 种磺胺类药物及其代谢物残留,检出限为3~26 μg/kg,定量限为11~88 μg/kg,回收率为88%~112%。Arroyo-Manzanares等 [57]则采用QuEChERs法结合荧光检测器测定牛奶中9 种磺胺残留,该方法回收率高达83.6%~104.7%,检出限低于2.73 μg/L。综上所述,QuEChERs方法符合现代分析要求。为了简化和优化该方法在兽药领域内的应用,很多研究者对传统QuEChERs方法进行了改进以使分离磺胺类药物时效果更好,均取得了较好的效果。
2.6 其他
近年来,分散液相微萃取(dispersive liquidliquid microextraction,DLLME)也成为热点研究领域之一 [57,59]。该方法主要通过获得亚微米乳液作为提取液上机检测,由于粒径较小,因而可以获得较大的质量交换面积,从而缩短分析时间。通常该方法中平衡时间少于1 min。除此以外,固相微萃取 [60]、浊点萃取 [2]等提取方式也被一些学者提出用于磺胺类药物的检测,均取得较好的效果。
目前在复杂基质中磺胺类药物及其代谢物的检测技术已经取得很大进展,借助于灵敏度较高的分析仪器,如高效液相色谱-质谱(high performance liquid chromatography-mass,HPLC-MS)法等,药物检出限和定量限均能满足 各国出入境、食品药品监督管理局及相关机构的检测要求。
Dmitrienko等 [2]通过对既往磺胺类药物的检测研究归纳总结指出,既有的分析技术手段主要包括HPLC-MS/MS、HPLC串联其他检测器法、电泳分析法、免疫分析法及其他分析方法。与此同时,该研究还指出,HPLC-MS/MS法在近5 a应用于磺胺类测定的检测仪器中所占比例最高,为38%(图4),HPLC-其他法应用紧随其后,约占全部比例的22%,电泳分析法位居第三,约占总量的15%。

图4 近5 a各类型检测器分析磺胺类药物所占 比例
[22]
Fig.4 The percentages of sulfonamides analyzed by different detectors in recen t 5 years
[2]
3.1 HPLC-MS法
HPLC法往往具备较高的灵敏度和较宽的线性范围 [61-63],因此常被用于磺胺类药物的残留分析,其中反相HPLC法更为常用。在HPLC串联的各种检测器中,串联质谱由于灵敏度和选择性高于其他检测器,目前被认为是效果最好的分析手段。质谱技术可以对色谱中无法分离的物质进行定量,尽管如此,在定量时,实验者仍然需要尽可能地 优化色谱条件以对目标化合物进行分离,拟降低杂质对待测物产生的基质效应。
目前各种食品基质中磺胺类药物的质谱检测方法均有报道。Yu Huan等 [44]建立了同时测定肉、肝脏等不同组织中18 种磺胺类 药物的HPLC和HPLC-MS/MS方法,均取得了较好的分离和检测效果。Zhao Xiaotian等 [64]也建立了高灵敏度和选择性的测定牛肉和牛奶中12 种磺胺类兽药残留的HPLC-MS/MS法,检出限达到0.4~2 μg/L,能够很好的满足测定需求。Hoff等 [61]采用HPLC串联高分辨质谱同时测定肝脏、肌肉和肾脏中的 16 种磺胺类药物及代谢物,检出限达到10 μg/kg,确定限(CCα)达到111.2~164.1 μg/kg,也能够满足测定要求。然而质谱方法存在的最主要的问题就是仪器成本高且对操作人员要求极高,在多数基层食品安全检测部门使用仍然较难,同时,由于质谱仪器与许多流动相不“兼容”,流动相的选择也相对“挑剔”。
3.2 液相色谱法
反相高效液相色谱-紫外检测器、二极管阵列检测 器及荧光检测器 均为经典的磺胺类药物的分析方法 [65-67],目前在食品残留领域仍然有着极其广泛的应用。但上述几种检测器通常只能用作定量分析,而无法直接提供待测物的结构或化学组成。分析磺胺类药物时,紫外检测器通常选取270~280 nm波长范围,少数研究选取255 nm [2];二极管阵列检测器通常选取267、268、263 nm作为检测波长;磺胺类药物进行荧光检测时通常需经过衍生化处理,衍生后通常选取405~420 nm激发波长,和485~495 nm吸收波长。上述3 种检测器各有优劣,紫外检测器价格低廉、通用性强,但灵敏度和选择性低;荧光检测器灵敏度和选择性高,但样品在进入检测器之前经常需要衍生化处理,操作繁琐;二极管阵列检测器能够得到任意波长的色谱图,极为方便,但其灵敏度较荧光检测器低。
上述检测过程中待测物在色谱中实现分离是必不可少的一环,不同填料的色谱柱应用于该类药物的分离均有报道,目前反相柱(尤其是C 18柱)应用较广。近年来,为了优化分离步骤,提高分离效能,很多学者在改变柱温、引入超高压系统等方面做了许多尝试。Shaaban等 [68]采用超高效液相色谱-紫外法,在60 MPa及60 ℃条件下,实现了9 种磺胺类药物的有效分离,分离时间仅为3 min。
流动相也是实现磺胺类药物分离的重要影响因素之一,最常采用的流动相组合为乙腈-水或甲醇-水等。除此以外,Xu Wenjuan等 [69]也采用三相组合的流动相进行分离,取得了较好的分离效果。黄冬梅等 [63]采取柱后衍生化法测定虾米中14 种磺胺药物残留,采用乙腈、甲醇和2%乙酸溶液梯度淋洗,50 min内实现了对14 种磺胺类药物的充分分离。调节流动相pH值也是保证峰形,改善分离度的影响因素之一。因此很多学者在建立磺胺类药物分析方法的同时,也常利用甲酸、乙酸或者引入缓冲盐以达到调节并控制pH值。黄冬梅等 [63]采取2%乙酸溶液用于促进磺胺药物的电离,改善峰形拖尾,提高分离效果。除了上述影响因素以外,不同的梯度条件也是极其重要的。
3.3 毛细管电泳分析方法
毛细管电泳方法也是一种较好的定量分析方法,在样品量很小的时候具有较多优势,该方法分离效能高、试剂、耗材消耗少,同时能实现多物质的同时检测。Chu Qingcui等 [70]采用毛细管电泳分析法同时测定了鸡和猪组织中6 种磺胺类药物,选用40 mmol/L Na 2B 4O 7和25 mmol/L KH 2PO 4(pH 6.2)缓冲体系作为流动相,在18 kV电压下,17 min内这6 种磺胺类抗生素均取得了良好的分离效果。Farooq等 [71]则采用了流动相为45 mmol/L的磷酸盐缓冲体系,同时测定鸡肉和牛肉中4 种磺胺类抗生素含量,在20 kV电压下,4 种磺胺类药物的检出限达到4~6 mg/kg。
3.4 免疫测定法
免疫测定法具有专属性高、灵敏度高、操作简易、成本低的优点,在日常分析中应用非常广泛。该方法基于抗原与抗体相结合的原理,可在较短时间内实现对少量残留物质的测定。除此以外,该方法还具有无需复杂的前处理及净化步骤的优势。关于免疫分析法测定磺胺类药物已有较多报道。龚云飞等 [72]通过酶联免疫吸附法(enzyme-linked immuno sorbent assay,ELISA)建立了猪肉和猪肝中磺胺二甲基嘧啶残留的方法,检出限分别为4.81、3.91 mg/L。
3.5 其他
生物传感器是近年来提出的一种较新颖的检测方法,在样品量很小时,该方法具备优势较大,该方法同样基于抗原和抗体结合的原理,可以避免复杂的前处理及净化步骤。近几年有学者指出,生物检测器可以有效地应用于食品或者环境样品中磺胺类药物残留的检测。Conzuelo等 [73]采用该方法检测了牛奶中6 种磺胺类药物残留,过程中成本低、仪器操作简易,具有较大的应用价值。此外,微生物测定法用于磺胺类药物的测定也已有报道 [2]。
在过去5 a中,不同食品基质中磺胺类药物残留的不同分析检测方法相应地被开发出来,在食品、环境样品及药物分析中均有相关报道。在分析过程中,研究的热点主要集中在待测物提取和净化步骤的改进。笔者认为其中最能实现该目标的前处理方法是QuEChERS和SPE技术,这两种技术的优势都包括低试剂消耗及高通量。因此,这些技术有望在未来取得较大突破。
目前提出的分析方法主要基于HPLC串联(多级)质谱,因此在HPLC-MS/MS取得相应进 展也将有助于我们取得更好的残留筛查目的。目前的研究趋势是质谱检测器与现代化的色谱技术(比如超高效液相色谱)联用,同时四极杆-飞行时间质谱仪和轨道阱质谱仪(Orbitrap)也是更为有效的检测工具,随着技术的飞速发展,痕量有机物包括磺胺类物质的定性定量及多残留筛查均取得了较大的进步,但这些检测仪器仍然具备价格昂贵且运行维护成本高的问题,为了降低成本,缩短分析时间,很多微生物学测定方法、免疫法及生物传感器测定方法被相继开发出来,仪器的小型化及自动化同样也是研究的热点领域之一,相信随着研究的进展,在不久的将来在分析仪器及前处理领域均会取得较大的突破。
参考文献:
[1] 马丽丽, 郭昌胜, 胡伟, 等. 固相萃取-高效液相色谱-串联质谱法同时测定土壤中氟喹诺酮、四环素和磺胺类抗生素[J]. 分析化学,2010, 38(1): 21-26.
[2] DMITRIENKO S G, KOCHUK E V, APYARI W, et al. Recent advances in sample preparation techniques and methods of sulfonamides detection: a review[J]. Analytica Chimica Acta, 2014,850: 6-25.
[3] ADRIAN J, FONT H, DISERENS J M, et al. Generation of broad specificity antibodies for sulfonamide antibiotics and development of an enzyme-linked immunosorbent assay (ELISA) for the analysis of milk samples[J]. Journal of Agricultural and Food Chemistry, 2009,57(2): 385-394.
[4] SPIELMEYER A, AHLBORN J, HAMSCHER G. Simultaneous determination of 14 sulfonamides and tetracyclines in biogas plants by liquid-liquid-extraction and liquid chromatography tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2014,406(11): 2513-2524.
[5] PAPADOPOULOU M V, BLOOMER W D, ROSENZWEIG H S,et al. Nitrotriazole-and imidazole-based amides and sulfonamides as antitubercular agents[J]. Antimicrobial Agents and Chemotherapy,2014, 58(11): 6828-6836.
[6] BARAN W, ADAMEK E, ZIEMIAŃSKA J, et al. Effects of the presence of sulfonamides in the environment and their influence on human health[J]. Journal of Hazardous Materials, 2011, 196: 1-15.
[7] SARMAH A K, MEYER M T, BOXALL A B. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment[J]. Chemosphere,2006, 65(5): 725-759.
[8] COMPANY. R, GRANADOS M, GUITERAS J, et al. Antibiotics in food: legislation and validation of analytical methodologies[J]. Analytiacal and Bioanalytical Chemistry, 2009, 395(4): 877-891.
[9] 徐慧敏, 蔡宏文, 李天元, 等. 磺胺类药物过敏和交叉过敏的研究进展[J]. 中国药理学与毒理学杂志, 2012, 26(6): 897-902.
[10] 佘永新, 刘佳佳, 王静, 等. 超高压液相色谱-串联四极杆质谱法对牛奶中24种磺胺类药物残留的检测[J]. 分析测试学报, 2008, 27(12):1313-1317.
[11] 孟哲, 石志红, 吕运开, 等. 超高效液相色谱-高分辨四极杆飞行时间质谱法快速筛查乳制品中磺胺类与氟喹诺酮类药物[J]. 分析化学,2014, 42(10): 1493-1500.
[12] MENG Zhe, SHI Zhihong, LIANG Shuxuan, et al. Residues investigation of fluoroquinolones and sulphonamides and their metabolites in bovine milk by quantification and confirmation using ultra-performance liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2015, 174: 597-605.
[13] VANDENBERGE V, DELEZIE E, HUYGHEBAERT G, et al. Residues of sulfadiazine and doxycycline in egg matrices due to cross-contamination in the feed of laying hens and the possible correlation with physicochemical, pharmacokinetic and physiological parameters[J]. Food Additives & Contaminants: Part A, 2012, 29(6):908-917.
[14] CAPRIOTTI A L, CAVALIERE C, PIOVESANA S, et al. Multiclass screening method based on solvent extraction and liquid chromatography-tandem mass spectrometry for the determination of antimicrobials and mycotoxins in egg[J]. Journal of Chromatography A,2012, 1268: 84-90.
[15] 庞国芳, 曹彦忠 张进杰, 等. 液相色谱-串联质谱同时测定家禽组织中16种磺胺残留[J]. 分析化学, 2005, 33(9): 1252-1256.
[16] ABDALLAH H, AMAUDGUIHEM C, JABER F, et al. Multiresidue analysis of 22 sulfonamides and their metabolites in animal tissues using quick, easy, cheap, effective, rugged, and safe extraction and high resolution mass spectrometry (hybrid linear ion trap-Orbitrap)[J]. Journal of Chromatography A, 2014, 1355: 61-72.
[17] ZHAO Yonggang, ZHOU Lixin, PAN Shengdong, et al. Fast determination of 22 sulfonamides from chicken breast muscle using core-shell nanoring amino-functionalized superparamagnetic molecularly imprinted polymer followed by liquid chromatographytandem mass spectrometry[J]. Journal of Chromatography A, 2014,1345: 17-28.
[18] 李晴, 罗辉泰, 黄晓兰, 等. 四级杆飞行时间串联质谱高通量筛查鱼肉中的药物残留[J]. 分析化学, 2014, 42(10): 1478-1485.
[19] STOREY J M, CLARK S B, JOHNSON A S, et al. Analysis of sulfonamides, trimethoprim, fluoroquinolones, quinolones,triphenylmethane dyes and methyltestosterone in fish and shrimp using liquid chromatography-mass spectrometry[J]. Journal of Chromatography B, 2014, 972(1): 38-47.
[20] NAKAJIMA T, NAGANO C, KANDA M, et al. Single-laboratory validation study of rapid analysis method for multi-class veterinary drugs in milk, fish and shellfish by LC-MS/MS[J]. Journal of the Food Hygienic Society of Japan, 2013, 54(4): 335-344.
[21] BLASCO C, PIC. Y, TORRES C M. Progress in analysis of residual antibacterials in food[J]. TrAC Trends in Analytical Chemistry, 2007,26(9): 895-913.
[22] MARAZUELA M D, BOGIALLI S. A review of novel strategies of sample preparation for the determination of antibacterial residues in foodstuffs using liquid chromatography-based analytical methods[J]. Analytica Chimica Acta, 2009, 645(1/2): 5-17.
[23] 王翔, 邓晓军 宋国新, 等. 食品中磺胺类兽药残留前处理技术的研究进展[J]. 食品科学, 2009, 30(7): 254-257.
[24] KOWALSKI C J, ŁEBKOWSKA-WIERUSZEWSKA B, OSYPIUK M. High performance liquid chromatography determination of sulphachloropyrazine residues in broiler and turkey edible tissues[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical Life Sciences, 2009, 877(18/19): 1787-1791.
[25] MOR F, SAHINDOKUYUCU KOCASARI F, OZDEMIR G, et al. Determination of sulphonamide residues in cattle meats by the Charm-II system and validation with high performance liquid chromatography with fluorescence detection[J]. Food Chemistry,2012, 134(3): 1645-1649.
[26] ABOUFAZELI F, ZHAD H R, SADEGHI O, et al. Novel Cd(II) ion imprinted polymer coated on multiwall carbon nanotubes as a highly selective sorbent for cadmium determination in food samples[J]. Journal of AOAC International, 2014, 97(1): 173-178.
[27] COSTI E M, SICILIA M D, RUBIO S. Multiresidue analysis of sulfonamides in meat by supramolecular solvent microextraction,liquid chromatography and fluorescence detection and method validation according to the 2002/657/EC decision[J]. Journal of Chromatography A, 2010, 1217(40): 6250-6257.
[28] ZHANG Yupu, XU Xu, QI Xiao, et al. Determination of sulfonamides in livers using matrix solid-phase dispersion extraction highperformance liquid chromatography[J]. Journal of Separation Science,2012, 35(1): 45-52.
[29] 赵海香, 刘海萍, 闫早婴, 等. 多壁碳纳米管固相萃取净化-高效液相色谱法测定猪肉和鸡肉中的磺胺多残留[J]. 色谱, 2014, 32(3):294-298.
[30] XU Zhigang, SONG Chaoyong, HU Yuling, et al. Molecularly imprinted stir bar sorptive extraction coupled with high performance liquid chromatography for trace analysis of sulfa drugs in complex samples[J]. Talanta, 2011, 85(1): 97-103.
[31] 李小运, 王浩. 液相色谱-质谱联用技术测定蜂蜜中的11种磺胺类残留[J]. 食品研究与开发, 2010, 31(4): 105-107.
[32] 曲斌. QuEChERS在动物源性食品兽药残留检测中的研究进展[J].食品科学, 2013, 34(5): 327-331.
[33] 何强, 孔祥虹, 李建华, 等. 超高效液相色谱-串联质谱法同时测定蜂蜜中硝基咪唑类、磺胺类、喹诺酮类兽药残留[J]. 分析试验室,2010, 29(8): 61-65.
[34] WANG Lili, WU Jing, WANG Qin, et al. Rapid and sensitive determination of sulfonamide residues in milk and chicken muscle by microfluidic chip electrophoresis[J]. Journal of Agricultural and Food Chemistry, 2012, 60(7): 1613-1618.
[35] BERNAL J, NOZAL M J, JIM.NEZ J J, et al. A new and simple method to determine trace levels of sulfonamides in honey by high performance liquid chromatography with fluorescence detection[J]. Journal of Chromatography A, 2009, 1216(43): 7275-7280.
[36] 熊春兰, 郭平, 占春瑞, 等. 高效液相色谱-串联质谱法同时测定水产品中8类38种兽药残留[J]. 分析测试学报, 2013, 32(2): 193-198; 204.
[37] 高洋洋, 张朝晖, 刘鑫, 等. 超高效液相色谱-串联质谱法测定动物源性食品中的磺胺增效剂[J]. 色谱, 2014, 32(5): 524-528.
[38] 陈刚, 邓晓军, 孙锦兰, 等. 高效液相色谱-串联质谱法同时测定动物源性食品中35种兽药残留量[J]. 理化检验: 化学分册, 2014, 50(7):809-814.
[39] 吴淑秀, 公茂金, 朱万燕, 等. 液相色谱串联质谱法测定猪肉和猪肝中9种磺胺类药物的残留[J]. 分析试验室, 2012, 31(2): 79-83.
[40] XU Yang, DING Jie, CHEN Haiyan, et al. Fast determination of sulfonamides from egg samples using magnetic multiwalled carbon nanotubes as adsorbents followed by liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2013, 140(1/2): 83-90.
[41] 郭黎明, 朱奎, 江海洋, 等. 超高效液相色谱-串联质谱法同时测定鸡肝中残留的四环素类、磺胺类和喹诺酮类药物[J]. 色谱, 2009,27(4): 412-416.
[42] BALAKRISHNAN V K, EXALL K N, TOITO J M. The development of a microwave-assisted extraction method for the determination of sulfonamide antibiotics in sediments and soils[J]. Canadian Journal of Chemistry, 2014, 92(5): 369-377.
[43] DASENAKI M E, THOMAIDIS N S. Multi-residue determination of seventeen sulfonamides and five tetracyclines in fish tissue using a multi-stage LC-ESI-MS/MS approach base d on advanced mass spectrometric techniques[J]. Analytica Chimica Acta, 2010, 672(1/2):93-102.
[44] YU Huan, TAO Yanfei, CHEN Dongmei, et al. Development of a high performance liquid chromatography method and a liquid chromatography-tandem mass spectrometry method with the pr essurized liquid extraction for the quantification and confirmation of sulfonamides in the foods of animal origin[J]. Journal of Chromatography B, 2011, 879(25): 2653-2662.
[45] 王菊梅. 加速溶剂提取-高效液相色谱法测定奶粉中磺胺类药物的含量[J]. 中国卫生检验杂志, 2011, 21(5): 1103-1106.
[46] ECONOMOU A, PETRAKI O, TSIPI D, et al. Development of a liquid chromatography-tandem mass spectrometry method for thedetermination of sulfonamides, trimethoprim and dapsone in honey and validation according to Commission Decision 2002/657/EC for banned compounds[J]. Talanta, 2012, 97: 32-41.
[47] 刘铁铮, 王冉, 柳伟荣, 等. 鸡蛋中7种磺胺药物的多残留检测方法研究[J]. 食品科学, 2005, 26(11): 183-186.
[48] 班付国, 胡兴娟, 吴宁鹏, 等. 超高效液相色谱-串联质谱法测定猪肉中66种兽药残留的研究[J]. 中国兽药杂志, 2014, 48(6): 40-51.
[49] 李存, 江海洋, 吴银良, 等. 高效液相色谱-荧光-紫外法测定动物肌肉组织中多类药物残留[J]. 分析化学, 2009, 37(8): 1102-1106.
[50] WANG Hui, XU Yang, SONG Weitao, et al. Automatic sample preparation of sulfonamide antibiotic residues in chicken breast muscle by using dynamic microwave-assisted extraction coupled with solid-phase extraction[J]. Journal of Separation Science, 2011, 34(18): 2489-2497.
[51] KOWALSKI P, PLENIS A, OLEDZKA I, et al. Optimization and validation of the micellar electrokinetic capillary chromatographic method for simultaneous determination of sulfonamide and amphenicol-type drugs in poultry tissue[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 54(1): 160-167.
[52] HOU Xiaolin, WU Yinliang, YANG Ting, et al. Multi-walled carbon nanotubes-dispersive solid-phase extraction combined with liquid chromatography-tandem mass spectrometry for the analysis of 18 sulfonamides in pork[J]. Journal of Chromatography B, 2013, 929:107-115.
[53] 王重洋, 王远鹏, 王宁, 等. 基质固相分散-超快速液相色谱法测定牛肉中磺胺类兽药[J]. 分析化学, 2013, 41(1): 83-87.
[54] LU Yanbin, SHEN Qing, DAI Zhiyuan, et al. Development of an on-line matrix solid-phase dispersion/fast liquid chromatography/ tandem mass spectrometry system for the rapid and simultaneous determination of 13 sulfonamides in grass carp tissues[J]. Journal of Chromatography A, 2011, 1218(7): 929-937.
[55] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/ partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J]. Journal of AOAC International,2003, 86(2): 412-431.
[56] 李娜, 张玉婷, 刘磊 等. QuEChERS-超高效液相色谱-串联质谱法测定动物源食品中4类29种禁限用兽药残留[J]. 色谱, 2014, 32(12):1313-1319.
[57] ARROYO-MANZANARES N, G.MIZ-GRACIA L, GARC.ACAMPAŇA A M. Alternative sample treatments for the determination of sulfonamides in milk by HPLC with fluorescence detection[J]. Food Chemistry, 2014, 143: 459-464.
[58] FRENICH A G, AGUILERA-LUIZ M M, VIDAL J L M, et al. Comparison of several extraction techniques for multiclass analysis of veterinary drugs in eggs using ultra-high pressure liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2010, 661(2): 150-160.
[59] 包锦渊, 迟晓峰, 董琦, 等. 分散液相微萃取-高效液相色谱法测定蜂蜜中的磺胺类抗生素[J]. 光谱实验室, 2012, 29(3): 1934-1937.
[60] 彭英, 何欢, 孙成, 等. 新型固相微萃取-高效液相色谱测定牛奶中4种磺胺类药物残留[J]. 分析化学, 2013, 41(4): 529-533.
[61] HOFF R B, PIZZOLATO T M, PERALBA M C R, et al. Determination of sulfonamide antibiotics and metabolites in liver,muscle and kidney samples by pressurized liquid extraction or ultrasound-assisted extraction followed by liquid chromatographyquadrupole linear ion trap-tandem mass spectrometry (HPLC-QqLITMS/MS)[J]. Talanta, 2015, 134(1): 768-778.
[62] EBRAHIMPOUR B, YAMINI Y, REZAZADEH M. A sensitive emulsification liquid phase microextraction coupled wit h on-line phase separation followed by HPLC for trace determination of sulfonamides in water samples[J]. Environmental Monitoring and Assessment, 2015,187(1): 1-13.
[63] 黄冬梅, 黄宣运, 顾润润, 等. 柱后衍生高效液相色谱法测定虾中14种磺胺类药物残留量[J]. 色谱, 2014, 32(8): 874-879.
[64] ZHAO Xiaotian, LIN Qinbao, SONG Huan, et al. Development of an immunoaffinity chromatography purification and ultra performance liquid chromatography tandem mass spectrometry method for determination of 12 sulfonamides in beef and milk[J]. Journal of Agricultural and Food Chemistry, 2011, 59(18): 9800-9805.
[65] 陈振桂, 占春瑞, 郭平, 等. 高效液相色谱法同时测定水产品中13种磺胺类药物残留的研究[J]. 食品科学, 2007, 28(10): 448-451.
[66] HUANG Xiaojia, QIU Ningning, YUAN Dongxing. Simple and sensitive monitoring of sulfonamide veterinary residues in milk by stir bar sorptive extraction based on monolithic material and high performance liquid chromatography analysis[J]. Journal of Chromatography A, 2009, 1216(46): 8240-8245.
[67] GAO Ruixia, ZHANG Junjie, HE Xiwen, et al. Selective extraction of sulfonamides from food by use of silica-coated molecularly imprinted polymer nanospheres[J]. Analytical and Bioanalytical Chemistry,2010, 398(1): 451-461.
[68] SHAABAN H, G.RECKI T. Optimization and validation of a fast ultrahigh-pressure liquid chromatographic method for simultaneous determination of selected sulphonamides in water samples using a fully porous sub-2 μm column at elevated temperature[J]. Journal of Separation Science, 2012, 35(2): 216-224.
[69] XU Wenjuan, SU Shufang, JIANG Ping, et al. Determination of sulfonamides in bovine milk with column-switching high performance liquid chromatography using surface imprinted silica with hydrophilic external layer as restricted access and selective extraction material[J]. Journal of Chromatography A, 2010, 1217(46): 7198-7207.
[70] CHU Qingcui, ZHANG Dongli, WANG Jinyan, et al. Multiresidue analysis of sulfonamides in animal tissues by capillary zone electrophoresis with electrochemical detection[J]. Journal of the Science of Food and Agriculture, 2009, 89(14): 2498-2504.
[71] FAROOQ M U, SU Ping, YANG Yi. Applications of a novel sample preparation method for the determination of sulfonamides in edible meat by CZE[J]. Chromatographia, 2009, 69(9/10): 1107-1111.
[72] 龚云飞, 王唯芬, 张明洲, 等. 磺胺二甲嘧啶快速直接竞争ELISA试剂盒的研制及应用[J]. 畜牧兽医学报, 2011, 42(7): 1007-1014.
[73] CONZUELO F, GAMELLA M, CAMPUZANO S, et al. Disposable and integrated amperometric immunosensor for direct determination of sulfonamide antibiotics in milk[J]. Biosensors and Bioelectronics,2012, 36(1): 81-88.
Progress in Sample Pretreatment and Analytical Techniques for the Determination of Sulfonamide Residues in Foods
ZHANG Yuan
1,2, LI Weiqing
1, ZHOU Weie
1, REN Zhiqin
1, ZHANG Feng
1,*, FENG Xuesong
2, ZHOU Yu
2, LI Shaohui
1, ZHENG Yang
1
(1. Institute of Food Safety, Chinese Academy of Inspection and Quarantine, Beijing 100176, China;2. School of Pharmacy, China Medical University, Shenyang 110013, China)
Abstract:The existence of sulfonamide (SA) residues in animal derived foods is an important food safety issue and the detection of SAs is of great significance for protecting human health. The detection of SAs in a complex food matrix mainly relies on an effective pretreatment method and precise instruments. This paper summarizes the background and current status of research on veterinary sulfonamides, and reviews traditional and novel extraction techniques for sample pretreatment and analytical methods for the determinatio n of sulfonamide residues in foods. It is hoped that this review can provide a reference for monitoring sulfonamide residues in foods.
Key words:food; pretreatment technology; detection; sulfonamide residues
中图分类号:S859.84
文献标志码:A
文章编号:1002-6630(2015)23-0340-07
doi:10.7506/spkx1002-6630-201523061
收稿日期:2015-02-05
基金项目:国家重大科学仪器设备开发专项(2012YQ14000806);北京市科技计划课题(Z141100002614020);质检公益性行业科研专项分项目(201410088-02);中国检验检疫科学研究院基本科研业务费专项资金资助项目(2015JK008);辽宁省自然科学基金项目(201202252)
作者简介:张元(1990—),男,硕士研究生,研究方向为药物分析及食品分析。E-mail:13840149878@163.com
*通信作者:张峰(1974—),男,研究员,博士,研究方向为分析化学。E-mail:fengzhang@126.com