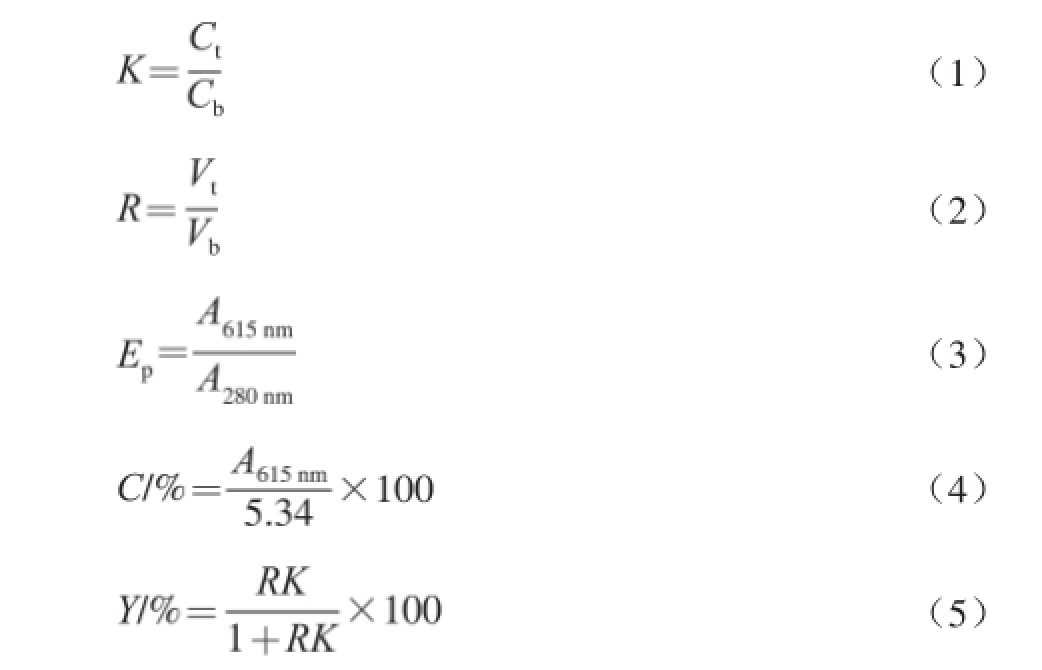
田盼盼 1,程 超 1,2,汪兴平 1,2,*
(1.湖北民族学院生物科学与技术学院,湖北 恩施 445000;2.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
摘 要:利用逐级盐析法结合双水相萃取对葛仙米藻蓝蛋白进行纯化,设计三因素二次回归正交旋转组合试验对提取工艺进行优化,并应用Design-Expert 7.0软件建立了各影响因素与萃取纯度的数学回归模型。结果显示最佳的提取工艺为:20% (NH 4) 2SO 4盐析去沉淀后用40%和50% (NH 4) 2SO 4盐析得藻蓝蛋白,再用质量分数10%的聚乙二醇6 000、质量分数18%的(NH 4) 2SO 4进行双水相萃取。所得产物纯度可达到8.6,回收率为71.40%。对所得产物进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析,得到清晰的两条条带(条带1和条带2),其分子质量分别在35 ku和15 ku左右。通过质谱分析可知,条带2的分子质量为15 ku左右,等电点5.35,部分肽的氨基酸序列为TPLTEAVAAADSQGR和DIGYYLR。通过SWISS-MODEL网站模拟蛋白质结构得出,条带2可能是葛仙米藻蓝蛋白的α亚基。
关键词:葛仙米;藻蓝蛋白;逐级盐析;双水相萃取;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;质谱分析
SDS-PAGE electrophoresis; mass spectrometry
葛仙米(Nostoc spharoids Kützing),属蓝藻门(Cyanophyta)蓝藻纲(Cyanophyceae)念珠藻科(Nostocaceae)念珠藻属(Nostoc),又名水木耳,古名天仙菜、天仙米 [1],是一种珍贵的食用藻类资源,同时具有药用价值。据《本草纲目拾遗》、《本草纲目》记载,葛仙米不仅对烫伤、脱肛、夜盲症等病症有疗效,还具美容功效 [2]。藻胆蛋白是蓝藻和红藻特有的捕光色素蛋白,是一种具有重要生理活性的天然色素。常用于食品、染料、化妆品和医疗保健等方面。其荧光性还可用于生物工程、免疫化学和临床医学等领域 [3]。此外,它还是一种极具开发潜力的光敏剂,在光合作用的理论研究方面具有重要价值,并可用于肿瘤治疗 [4]。葛仙米中藻胆蛋白含量丰富,随着研究的不断深入,其商业价值日益凸显,藻胆蛋白的开发和最大限度的利用已备受关注。已知的藻胆蛋白包括藻红蓝蛋白、异藻蓝蛋白、藻蓝蛋白和藻红蛋白 [5]。目前,通过转基因方法生产藻胆蛋白的技术尚不成熟,因此获取该物质的主要途径还停留在直接从藻类植物中提取的阶段 [6]。对葛仙米藻胆蛋白的提取、分离与纯化工作已取得一定程度的进展。汪兴平等 [7]用反复冻融法对葛仙米进行细胞壁破除,将葛仙米在0 ℃条件下放置0.5 h后研磨,重复3 次后提取,其细胞壁破除效果良好,蛋白质得率高。采用正交旋转组合实验对藻胆蛋白提取工艺进行优化,确定了最佳提取条件为含0.21 mol/L NaCl的pH 7.3的磷酸盐缓冲液,浸提4.5 h,得率为7.125% [8]。
双水相萃取(aqueous two-phase extration,ATPE)技术始于20世纪60年代,由Albertsson最早发现。因其具有容易操作、适于放大生产且能充分保证成分的生物活性等优点而被广泛应用 [9]。国内外关于双水相萃取的报道很多,不少学者通过双水相萃取出了纯度较高的蛋白质。如甘林火 [10]、刘清新 [11]、刘杨 [12]、王巍杰 [13]等都做了双水相萃取技术纯化蛋白质的研究。对于双水相萃取中各种条件的确定也有不少的研究,有研究指出降低上下相体积比可以使目标蛋白纯度和产量提高 [14]。Pati等 [15]发现逐渐提高结线长度,可在结线长度为33.53%时,提高蛋白总产量,最大产量可达97.47%。且结线长度的持续增加会导致界面中的蛋白质不断沉淀,使藻胆蛋白产量下降。Benavides等 [16]研究发现,用低相对分子质量(1 000和1 450)的聚乙二醇(polyethylene glycol,PEG)对B-藻红蛋白分离效果较好。本研究结合盐析的方法对葛仙米藻蓝蛋白进行双水相萃取,旨在为葛仙米藻蓝蛋白的纯化提供一定的理论依据和技术基础。并对纯化后的产物进行电泳分析和质谱分析,意在为后续的深入研究提供一定的参考。
1.1 材料与试剂
葛仙米 鹤峰县走马镇鹤峰县葛仙米开发公司。
PEG、(NH 4) 2SO 4、磷酸二氢钾、三水合磷酸氢二钾、氯化钠、甘氨酸、考马斯亮蓝G250、溴酚蓝国药集团化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) Biosharp生物科技公司;三羟甲基氨基甲烷(Tris) 美国Amresco公司;过硫酸铵 中国医药上海化学试剂公司;丙烯酰胺、甲叉双丙烯酰胺 北京拜尔迪生物技术有限公司;fermentas蛋白标准品 上海泽迈生物技术有限公司。
1.2 仪器与设备
RT-02A型2两装粉碎机 荣聪精密科技有限公司;SHY-2A数显水浴恒温振荡器 金坛市科兴器厂;ALPHA1-4型真空冷冻干燥机 德国Christ公司;Avanti J-30I冷冻高速离心机 美国Beckman公司;WFJ7200紫外-可见光分光光度计 尤尼柯(上海)仪器有限公司;FA 2140电子天平 上海天平仪器公司;透析袋(3 500) Biosharp生物科技公司;Infinite 200PRO多功能酶标仪 瑞士Tecan公司;TDL-60B飞鸽牌低速台式离心机 上海右一仪器有限公司;IKA旋涡混匀器北京中科星宇商贸有限公司;DYCZ-24D型电泳槽、DYY型三恒电泳仪 北京市六一仪器厂;STS-2型脱色摇床 上海琪特分析仪器有限公司;GENEX单道可调移液枪 芬兰百得实验室仪器(中国)有限公司。
1.3 方法
1.3.1 葛仙米藻胆蛋白粗提液的制备
称取100 g干燥的葛仙米,粉碎,蒸馏水4 ℃充分溶胀,反复冻融3 次使细胞壁充分破除,用pH 7.3的0.5 mol/L磷酸缓冲液(含0.2 mol/L NaCl)浸提4.3 h,4℃、10 000 r/min离心20 min得藻胆蛋白粗提液。
1.3.2 逐级盐析法制取葛仙米藻胆蛋白
在1.3.1节所得粗提液中加入一定质量的(NH 4) 2SO 4,使溶液质量分数达到20%,盐析过夜后冷冻离心(4 ℃、10 000 r/min离心20 min)除去沉淀得上清液。逐次在所得上清液中缓慢加入(NH 4) 2SO 4(注意低温条件下缓慢加入且不断搅拌,以防止因部分(NH 4) 2SO 4质量分数过高导致蛋白质的结构和活性变化),使(NH 4) 2SO 4溶液质量分数依次达到30%、40%、50%、60%、70%。低温静置过夜,高速冷冻离心,透析,真空冷冻干燥得不同盐析条件下的蛋白质粉末。
1.3.3 双水相萃取体系的优化
1.3.3.1 双水相体系相图的绘制
参考Albertsson [17]浊点法,分别配制40%的PEG 1 500、4 000、6 000、8 000溶液和40%的(NH 4) 2SO 4溶液,称取0.700 g的PEG于大试管中,加0.5 mL水,然后向内滴入(NH 4) 2SO 4溶液,直到溶液刚好变浑浊,记下滴定体积,重复以上加水和滴定操作,分别计算出每次达到浑浊时溶液中PEG和(NH 4) 2SO 4的质量分数 [18]。以(NH 4) 2SO 4质量分数为横坐标,PEG质量分数为纵坐标绘制相图。
1.3.3.2 葛仙米藻蓝蛋白的双水相萃取体系
取1.3.2节40%和50%盐析所得产物作为双水相萃取实验材料进行双水相萃取实验。
称取一定质量(NH 4) 2SO 4和PEG于15 mL带刻度试管中,加蒸馏水漩涡混匀使其完全溶解,加入10 mg/mL的葛仙米藻胆蛋白粗提液2 mL,蒸馏水调至体系总质量为10 g。混匀后避光萃取30 min,2 000 r/min离心5 min,待彻底分层后读取上下相体积,多功能酶标仪分别测定上下相在波长280、568 nm和615 nm处的吸光度,据公式(1)~(5) [10]计算藻蓝蛋白的回收率和纯度。
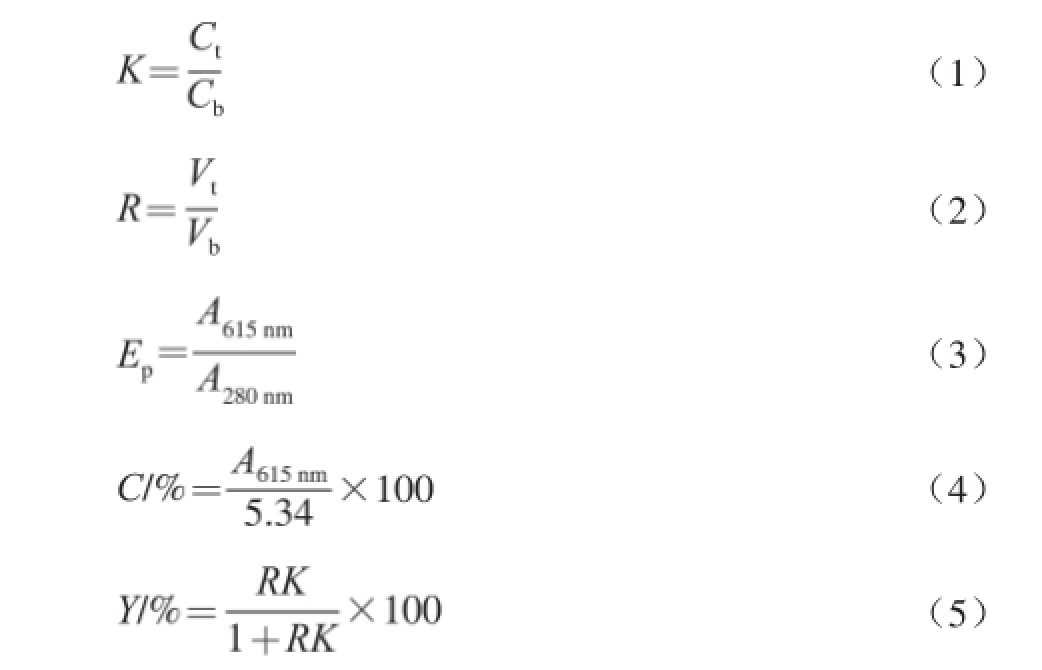
式(1)~(5)中:C、C t、C b分别为藻蓝蛋白、上相藻蓝蛋白和下相藻蓝蛋白的质量分数/%;K为分配系数;R为相比;V t为上相体积/mL;V b为下相体积/mL;E p为藻蓝蛋白纯度;A 280 nm和A 615 nm分别为相应波长条件下的吸光度;Y为藻蓝蛋白回收率/%。
1.3.3.3 PEG相对分子质量对葛仙米藻蓝蛋白萃取效果的影响
依据1.3.3.1节方法所得相图,选取一定质量分数PEG和(NH 4) 2SO 4组成双水相体系。取40%和50%盐析所得藻胆蛋白作为双水相萃取实验材料,按照1.3.3.2节方法进行双水相萃取。以葛仙米藻蓝蛋白的纯度和回收率为主要参考指标,分别考察相对分子质量为1 500、4 000、6 000、8 000的PEG对双水相萃取效果的影响。
1.3.3.4 PEG质量分数对葛仙米藻蓝蛋白萃取效果的影响
在1.3.3.3节基础上选取相对分子质量最优的PEG,并分别配制成6%、8%、10%、12%、14%的PEG溶液,和一定质量分数(NH 4) 2SO 4构成双水相体系,得出PEG质量分数对双水相萃取藻蓝蛋白效果的影响。
1.3.3.5 (NH 4) 2SO 4质量分数对葛仙米藻蓝蛋白萃取效果的影响
参考1.3.3.4节结果,选用最优质量分数的PEG,分别和质量分数为12%、14%、16%、18%、20%的(NH 4) 2SO 4溶液构成双水相体系,得出(NH 4) 2SO 4质量分数对双水相萃取效果的影响。
1.3.3.6 中心组合试验设计
基于单因素试验结果,运用中心组合试验设计原理,对显著影响双水相萃取藻蓝蛋白纯度的3 个因素PEG相对分子质量(X 1)、PEG质量分数(X 2)、(NH 4) 2SO 4质量分数(X 3)做三因素三水平响应面分析试验(表1)。
表1 响应面设计因素水平表
Taabbllee 11 FFaaccttoorrss aanndd lleevveellss uusseedd iinn tthhee cceenntteerr ccoommppoossiittee ddeessiiggnn

因素 水平-1 0 1 X 1PEG相对分子质量 4 000 6 000 8 000 X 2PEG质量分数/% 13 14 15 X 3(NH 4) 2SO 4质量分数/% 15 16 17
1.3.4 藻胆蛋白的质量及纯度分析
分别称量1.3.2节各盐析条件下所得葛仙米藻胆蛋白,并按式(6)计算得率。
分别称取1.3.2节盐析所得藻胆蛋白及1.3.3节双水相萃取所得藻蓝蛋白,配成1 mg/mL溶液,于紫外-可见光分光光度计下进行光谱扫描,扫描波长250~750 nm,得光谱扫描曲线。
1.3.5 SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)分析
配制溶液:3.0 mol/L pH 8.9的Tris-HCl分离胶缓冲液;0.5 mol/L pH 6.7的Tris-HCl浓缩胶缓冲液;pH 8.3的Tris(0.05 mol/L)-甘氨酸(0.384 mol/L)电极缓冲液;50%甲醇溶液和冰醋酸按一定比例混合成固定液;考马斯亮蓝G-250染色液;样品溶解液;甲醇和冰醋酸混合配制成脱色液。
制胶:按一定要求和比例分别配制质量分数为3%的浓缩胶和12.5%的分离胶 [19]。
样品处理:称取双水相萃取所得葛仙米藻蓝蛋白粉末,配成2 mg/mL溶液,样品溶解液溶解,煮沸5 min冷却后上样,上样量20 μL,标准蛋白上样量5 μL。
电泳:连接电泳装置,放入适量电极缓冲液后开始电泳。初始电流稳定在10 mA左右,待样品完全进入分离胶后,电流调至20~30 mA。待染料前沿距离胶片底部1.5 cm时停止电泳。小心取出胶片,蒸馏水浸泡10 min以除去残留的SDS,放入固定液中固定1 h,染色液染色1 h,脱色液中脱色(前期每隔0.5 h换一次脱色液)直到胶带清晰透明为止。
1.3.6 葛仙米藻蓝蛋白的质谱鉴定
切下电泳胶片上的条带1和条带2,经除盐、浓缩,于2 μL基质(含5 mg/mL的α-4-羟基肉桂酸的50%硝酸铈铵,0.1%三氟乙酸溶液)中混合溶解后点样。利用质谱仪进行质谱分析。紫外波长为355nm,重复速率为200 Hz,加速电压为20 000 V,最优质量分辨率为1 500 D,扫描质量范围为700~3 200 D [20-21]。
利用软件Mascot distiller过滤基线峰、识别信号峰。利用Matrixscience公司的Mascot软件搜索IPI_mouse数据库,寻找匹配的相关蛋白质,同时查询其功能,来明确鉴定的蛋白质种类。
2.1 逐级盐析法所得藻胆蛋白分析
2.1.1 逐级盐析所得藻胆蛋白得率和藻蓝蛋白纯度分析
表2 逐级盐析所得纯度和得率
Taabbllee 22 TThhee ppuurriittyy ooff pphhyyccoobbiilliipprrootteeiinn ssaalltteedd oouutt wwiitthh ddiiffffeerreenntt concentrations of ammonium sulfattee
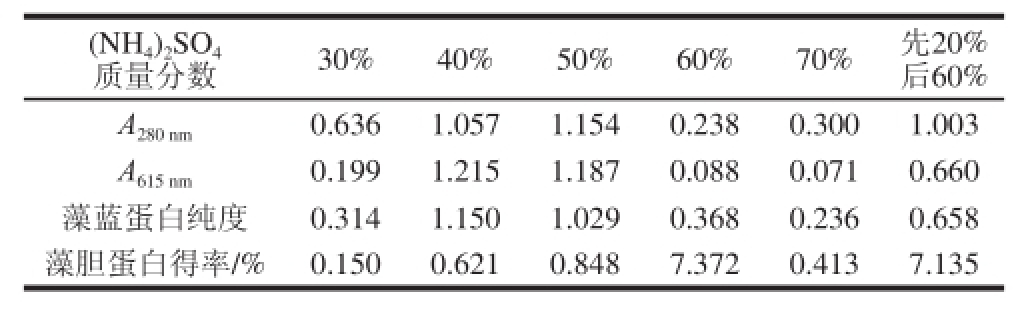
(NH 4) 2SO 4质量分数 30% 40% 50% 60% 70% 先20%后60% A 280 nm 0.636 1.057 1.154 0.238 0.300 1.003 A 615 nm 0.199 1.215 1.187 0.088 0.071 0.660藻蓝蛋白纯度 0.314 1.150 1.029 0.368 0.236 0.658藻胆蛋白得率/% 0.150 0.621 0.848 7.372 0.413 7.135
如表2所示,不同质量分数(NH 4) 2SO 4盐析所得蛋白质得率不同,其中60%盐析蛋白质得率最大。(NH 4) 2SO 4质量分数在30%~50%范围内逐级盐析时,藻胆蛋白的得率随着质量分数的增大而增大。实验观察发现,30%盐析产物呈红棕色,60%盐析产物呈淡蓝色,70%盐析产物呈淡粉色,40%和50%盐析产物呈深蓝色。由产物颜色推断:30%盐析产物可能大部分是杂蛋白;40%和50%盐析产物中可能含有较大量的藻蓝蛋白;60%盐析产物中可能仅含少量藻蓝蛋白;70%盐析产物中可能几乎不含藻蓝蛋白。40%和50%盐析产物中藻蓝蛋白纯度可达到1以上。与先20%后60%盐析的方法比较,逐级盐析法可以逐级除去粗提液中的杂质,得到纯度较高的藻蓝蛋白。
2.1.2 逐级盐析藻胆蛋白紫外-可见扫描图谱
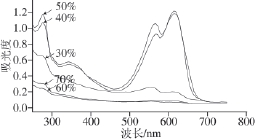
图 1 逐级盐析藻胆蛋白紫外-可见光谱扫描曲线
Fig.1 UV-Vis spectra of phycobiliprotein purifi ed by stepwise salting-out
如图1所示,40%和50%盐析产物在波长280 nm处有较高峰值,在可见光区有明显的两个峰,且615 nm波长处(藻蓝蛋白)的峰值高于波长568 nm处(藻红蛋白)的峰值。说明这部分盐析产物中含有大量藻胆蛋白,且前者含量高于后者。30%盐析产物在波长280 nm处有较高的吸收峰,但568 nm和615 nm波长处的峰值较小,表明这部分物质中虽含有较多的蛋白质,但藻红蛋白和藻蓝蛋白的含量较低,也可能是藻蓝蛋白和藻红蛋白在处理过程中丢失了色基基团。60%和70%盐析产物在波长280 nm处的吸收很少,说明这两部分物质中蛋白质含量少。结合表2各质量分数逐级盐析产物质量判断,主要杂质可能在60%盐析时被除去。通过以上比较可以看出,逐级盐析方法可有效除去蛋白质中的其他成分,得到纯度较高的藻蓝蛋白和藻红蛋白。
2.2 葛仙米藻蓝蛋白的双水相萃取

图 2 PEG 1 500、4 000、6 000、8 000和(NH
4)
2SSOO
4双水相相图
Fig.2 Two-phase aqueous diagrams with PEG 1 500, 4 000,6 000 or 8 000/(NH
4)
2SO
4
2.2.1 PEG-(NH 4) 2SO 4双水相系统相图图2为4 种不同相对分子质量PEG和(NH 4) 2SO 4组成双水相体系的相图。曲线下方各点为均匀混合体系,曲线上各点为临界点,曲线上方各点为两相区。从图2可以看出,PEG相对分子质量越小,体系分相需要(NH 4) 2SO 4和
PEG质量分数越高。当PEG质量分数一定时,PEG相对分子质量越小,形成双水相所需的(NH 4) 2SO 4质量分数越大。实验过程中发现,PEG相对分子质量越高,越难在水中溶解,且溶解分相后PEG相黏度越大。这可能是由于PEG相对分子质量越大憎水能力越强所致。
2.2.2 双水相萃取单因素试验结果
2.2.2.1 PEG相对分子质量对双水相萃取效果的影响

图 3 PEG相对分子质量对萃取效率的影响
Fig.3 Infl uence of PEG molecular weight on the extracting effi ciency
选择质量分数12%的PEG和16%的(NH 4) 2SO 4组成双水相体系。萃取分层后藻蓝蛋白富集在上相PEG相,上相为蓝绿色,下相无色。如图3所示,纯度和回收率呈现相反的变化趋势,纯度高时回收率低,回收率高时纯度低。各体系的回收率均在50%以上,PEG 6 000与(NH 4) 2SO 4形成双水相体系萃取出的藻蓝蛋白纯度可达3.5以上,比其他体系的纯度高出2 倍以上。故选择PEG 6 000为最佳的相对分子质量。
2.2.2.2 PEG质量分数对双水相萃取效果的影响
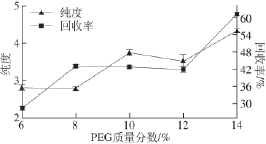
图 4 PEG质量分数对双水相体系萃取效果的影响
Fig.4 Effect of PEG percentage on the purity and recovery of phycobiliprotein
用不同质量分数的PEG 6 000和16%(NH 4) 2SO 4形成双水相体系,萃取藻蓝蛋白。结果如图4所示,随着PEG质量分数提高,藻蓝蛋白纯度和回收率均逐渐提高。14%的PEG 6 000和(NH 4) 2SO 4形成体系萃取所得藻蓝蛋白的纯度和回收率均明显高于其他体系,纯度可达到4以上,回收率近60%。所以选择14%为PEG 6 000的最佳质量分数。
2.2.2.3 (NH 4) 2SO 4质量分数对双水相萃取效果的影响
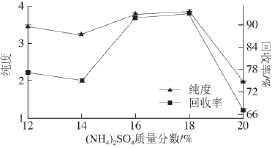
图5 (NNHH
4)
2SSOO
4质量分数对双水相体系萃取效果的影响
Fig.5 Effect of (NH
4)
2SO
4concentration on the purity and recovery of phycobiliprotein
用不同质量分数的(NH 4) 2SO 4和14% PEG 6 000构成双水相体系,如图5所示,(NH 4) 2SO 4质量分数在14%~18%变化时,体系萃取藻蓝蛋白的纯度和回收率随着质量分数的增大而提高。18% (NH 4) 2SO 4和14%的PEG 6 000形成体系萃取出的藻蓝蛋白纯度和回收率优于其他组,但是试验过程中发现,18% (NH 4) 2SO 4与PEG形成双水相体系时,由于(NH 4) 2SO 4质量分数太大不易溶解,且形成的体系黏度较大不易分相,不利于实际操作,故选择16%为(NH 4) 2SO 4的最佳质量分数,该体系萃取藻蓝蛋白的纯度在4左右,回收率可达到90%以上。
2.2.3 葛仙米藻蓝蛋白双水相萃取回归模型的建立
在单因素试验基础上,根据中心组合试验设计原理 [22]设计了17 组试验,分别测定并计算各组藻蓝蛋白的纯度和回收率,试验结果见表3。
表3 中心组合试验设计及结果
Taabbllee 33 EExxppeerriimmeennttaall ddeessiiggnn mmaattrriixx wwiitthh eexxppeerriimmeennttaall rreessuullttss
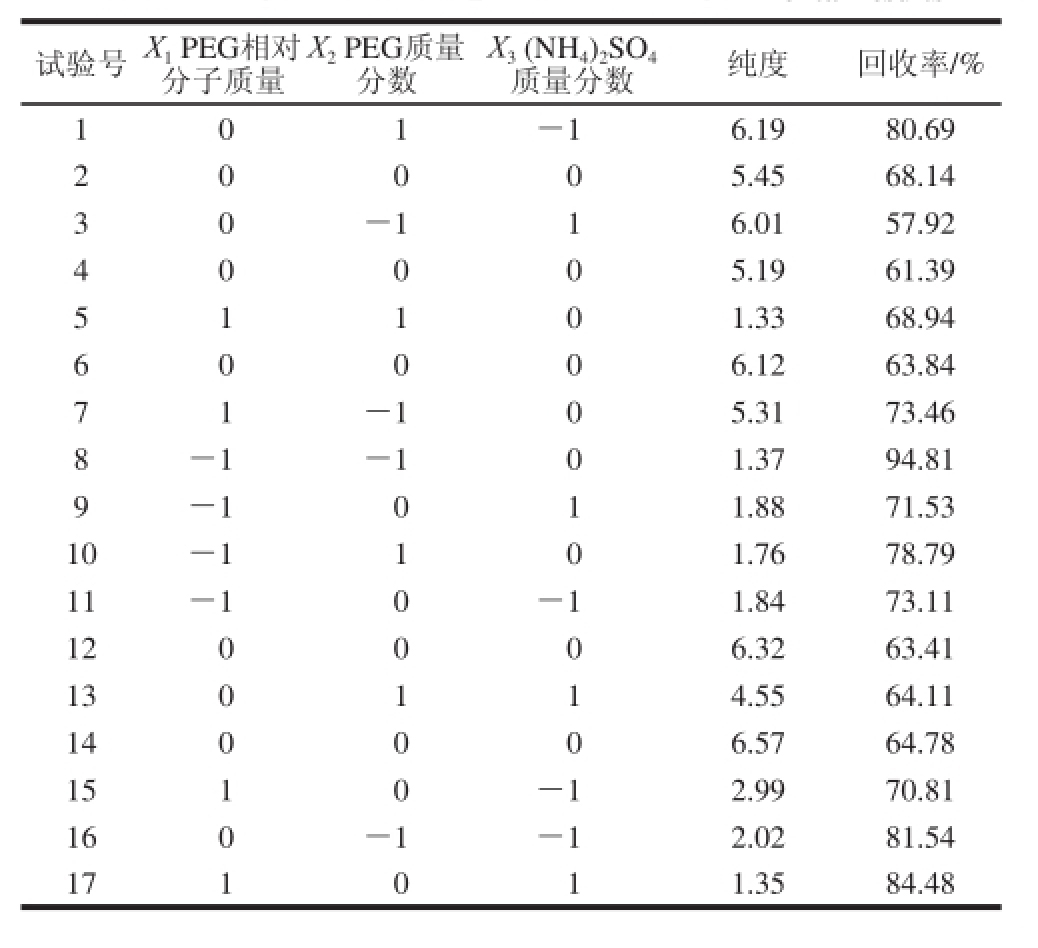
试验号 X 1PEG相对分子质量X 2PEG质量分数X 3(NH 4) 2SO 4质量分数 纯度 回收率/% 1 0 1 -1 6.19 80.69 2 0 0 0 5.45 68.14 3 0 -1 1 6.01 57.92 4 0 0 0 5.19 61.39 5 1 1 0 1.33 68.94 6 0 0 0 6.12 63.84 7 1 -1 0 5.31 73.46 8 -1 -1 0 1.37 94.81 9 -1 0 1 1.88 71.53 10 -1 1 0 1.76 78.79 11 -1 0 -1 1.84 73.11 12 0 0 0 6.32 63.41 13 0 1 1 4.55 64.11 14 0 0 0 6.57 64.78 15 1 0 -1 2.99 70.81 16 0 -1 -1 2.02 81.54 17 1 0 1 1.35 84.48
用Design-Expert 7.0软件对表3结果进行分析,得出各影响因素的效应及其交互效应的关联方程 [23]。利用软件对双水相萃取工艺条件进行优化,得出响应面图。本研究重点考虑葛仙米藻蓝蛋白的纯度,因此多元回归拟合主要以葛仙米藻蓝蛋白纯度作为响应值,分析得到葛仙米藻蓝蛋白纯度与各因素变量的二次方程模型为:y=-696.63+ 0.02X 1+37.03X 2+47.65X 3-5.45×10 -4X 1X 2-2.30×10 -4X 1X 3-1.41X 2X 3-7.70×10 -7X 1 2-0.41X 2
2-0.83X 3 2。2.2.4 最佳双水相萃取工艺方差分析及响应面优化
表 4 响应面法方差分析
Taabbllee 44 AAnnaallyyssiiss ooff vvaarriiaannccee (AANNOOVVAA) ffoorr qquuaaddrraattiicc rreessppoonnssee ssuurrffaaccee mmooddeell
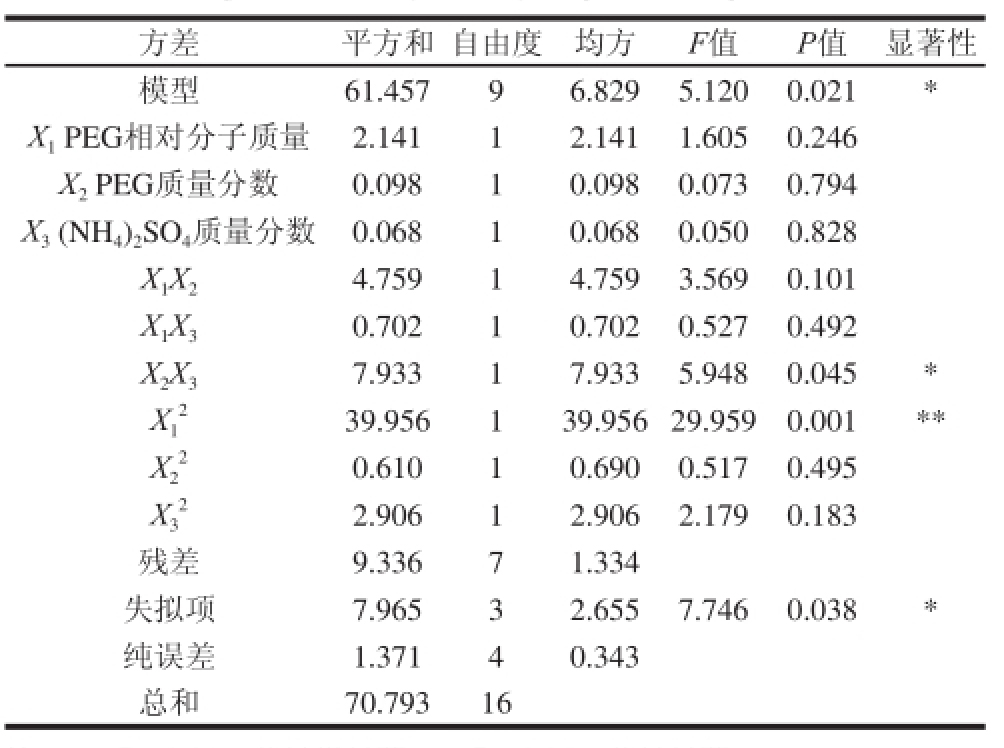
注:**. P<0.01,差异极显著;*. P<0.05,差异显著。
方差 平方和自由度 均方 F值 P值 显著性模型 61.457 9 6.829 5.120 0.021 * X 1PEG相对分子质量 2.141 1 2.141 1.605 0.246 X 2PEG质量分数 0.098 1 0.098 0.073 0.794 X 3(NH 4) 2SO 4质量分数 0.068 1 0.068 0.050 0.828 X 1X 2 4.759 1 4.759 3.569 0.101 X 1X 3 0.702 1 0.702 0.527 0.492 X 2X 3 7.933 1 7.933 5.948 0.045 * X1 2 39.956 1 39.956 29.959 0.001 ** X2 2 0.610 1 0.690 0.517 0.495 X3 2 2.906 1 2.906 2.179 0.183残差 9.336 7 1.334失拟项 7.965 3 2.655 7.746 0.038 *纯误差 1.371 4 0.343总和 70.793 16
由表4的方差分析可知,各因素中,一次项X 1、X 2、X 3不显著,X 2X 3显著,X 1 2极显著。由此可见,各影响因素与响应值之间不呈简单的线性相关关系。由方差分析结果看出,回归模型也是显著的,相关系数R 2=61.457/70.793=0.868,说明响应值(藻蓝蛋白纯度)有86.8%的变化由试验各影响因素决定,即PEG相对分子质量、PEG质量分数和(NH 4) 2SO 4质量分数。因此,该方程可以对试验各因素与响应值之间的真实关系进行较好的描述,可利用此回归模型对实验可能产生的真实结果进行预测和分析 [24],得出最佳双水相萃取工艺条件。


图 6 各因素交互作用的响应面与等高线
Fig.6 Response surface plot and contour plot showing the effects of process conditions on phycobiliprotein purity
由图6响应面3D图和等高线分析图可以直观地看出各个因素的交互作用 [25]。PEG相对分子质量与(NH 4) 2SO 4质量分数交互作用较强,在因素所选范围内响应值存在极值,即响应面的最高点,也是等高线最小椭圆的中心点,较大的X 1、X 3反而使响应值趋于减小。这可能是由于PEG相对分子质量过大或者(NH 4) 2SO 4质量分数过大反而阻止了蛋白质分子进入体系上相PEG相,从而分离效果变差。X 1、X 2之间也有交互作用,但是相对于X 1、X 3的交互作用较弱,X 2、X 3之间没有明显的交互作用。
由Design-Expert 7.0软件拟合二次回归模型预测得到最佳萃取工艺为PEG相对分子质量6 000、(NH 4) 2SO 4质量分数18.29%、PEG质量分数10%,藻蓝蛋白纯度为8.6,回收率为71.40%。考虑到实际操作和生产的便利,最佳工艺确定为PEG相对分子质量6 000、(NH 4) 2SO 4质量分数18%、PEG质量分数10%。
2.2.5 双水相萃取藻蓝蛋白纯度分析
2.2.5.1 双水相萃取藻蓝蛋白光谱扫描分析

图 7 双水相萃取藻蓝蛋白紫外-可见光谱扫描曲线
Fig.7 UV-Vis spectra of phycocyanin extracted by aqueous two-phase system
由图7可知,双水相萃取可以纯化粗提液,去除杂质成分,从而得到纯度较高的藻蓝蛋白。
2.2.5.2 双水相萃取藻蓝蛋白的SDS-PAGE
双水相萃取得到的蛋白质经SDS-PAGE电泳,如图8所示,图谱上有清晰的颜色很深的两条带,其他条带较少且颜色较浅。说明经过双水相萃取,得到了葛仙米藻蓝蛋白中杂质含量少,纯度较高。且由图8可知,蛋白质经SDS-PAGE得到两条带(条带1和条带2),条带1的分子质量在35 ku左右,条带2的分子质量在15 ku左右。
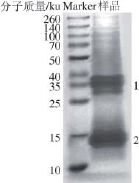
图 8 双水相萃取蛋白质的SDS-PAGGEE图
Fig.8 SDS-PAGE analysis of phycocyanin extracted by aqueous two-phase system
2.2.5.3 萃取后的藻蓝蛋白的质谱鉴定
通过质谱仪进行分析,并与Synpcc7942_1048数据进行对比,可知条带2的分子质量约为15 ku,等电点为5.35。匹配肽的氨基酸序列(斜体加黑表示)见图9a。
利用SWISS-MODEL网站对其蛋白结构进行模拟,结果见图9b,通过结构模拟得出,此氨基酸序列可能是藻蓝蛋白的α亚基。

图 9 条带2的氨基酸序列(a)和模拟蛋白结构(bb)
Fig.9 Amino acid sequence (a) and simulated protein structure (b) of band 2
本研究首先用(NH 4) 2SO 4逐级盐析法获得葛仙米藻胆蛋白,然后在此基础上用双水相萃取技术对所得产物进一步纯化,并对所得产物的质量和纯度进行分析。实验发现,通过逐级盐析的方法,可有效除去杂质成分,明显提高产物中藻蓝蛋白纯度。与先用20%后用60%盐析方法相比,通过20% (NH 4) 2SO 4盐析除杂后对上清液采用30%、40%、50%、60%、70% (NH 4) 2SO 4逐级盐析法,可使藻蓝蛋白纯度提高近1倍,产物的纯度可达1.1左右。用双水相萃取法对逐级盐析所得纯度在1.1左右葛仙米藻胆蛋白进一步纯化,并通过中心组合试验设计,对实验结果进行响应面分析,从而对萃取工艺进行优化,得到最佳工艺条件为:PEG相对分子质量6 000、(NH 4) 2SO 4质量分数18%、PEG质量分数10%。按照此工艺所得藻蓝蛋白纯度为8.6,回收率为71.40%。
通过Design-Expert 7.0软件分析并建立了响应值(葛仙米藻蓝蛋白纯度)与各因素之间的数学模型y=-696.63+ 0.02X 1+37.03X 2+47.65X 3-5.45×10 -4X 1X 2-2.30×10 -4X 1X 3-1.41X 2X 3-7.70×10 -7X 1 2-0.41X 2 2-0.83X 3 2,该模型回归显著,且对试验有较好的拟合度,可用于指导生产。
对双水相萃取所得藻蓝蛋白进行SDS-PAGE分析,得到清晰的两条条带(条带1和条带2),其分子质量分别在35 ku(条带1)和15 ku(条带2)左右。通过质谱分析可知,条带2的分子质量为15 ku左右,等电点5.35,部分肽的氨基酸序列为TPLTEAVAAADSQGR和DIGYYLR。通过SWISS-MODEL网站模拟蛋白质结构得出,条带2可能是葛仙米藻蓝蛋白的α亚基。
参考文献:
[1] 丁广奇, 王学文. 植物学名解释[M]. 北京: 科学出版社, 1986: 452-463.
[2] 谢宗万. 全国中草药汇编[M]. 北京: 人民卫生出版社, 1983: 156-163.
[3] 王广策, 邓田, 曾呈奎. 藻胆蛋白的研究概况(Ⅱ): 藻胆蛋白的结构及其光谱特性[J]. 海洋科学, 2000, 24(3): 9-22.
[4] 彭卫民, 商树田, 刘国琴, 等. 螺旋藻藻胆蛋白研究进展[J]. 农业生物技术学报, 1998, 6(2): 173-177.
[5] JOHAN A, HELLEBUST J, CRAIGIE S. Handbook of phycological methods physiological and biochemical methods[M]. Cambridge: Cambridge University press, 1978: 48-76.
[6] 郑江. 藻胆蛋白的提取纯化研究进展[J]. 食品科学, 2002, 23(11): 159-161.
[7] 汪兴平, 谢笔钧, 程超, 等. 反复冻融法在葛仙米破壁技术中的应用[J].食品科学, 2005, 26(3): 162-164.
[8] 汪兴平, 谢笔钧, 潘思轶, 等. 葛仙米藻胆蛋白提取工艺的优化研究[J].农业工程学报, 2006, 22(4): 227-229.
[9] 辜鹏, 谢放华, 黄海艳, 等. 双水相萃取技术的研究现状与应用[J].化工技术与开发, 2007, 36(11): 29-33.
[10] 甘林火. 双水相萃取法富集分离地木耳中的藻蓝蛋白[J]. 华侨大学学报: 自然科学版, 2011, 32(6): 672-675.
[11] 刘清新, 郭卫芹. 盐析结合双水相萃取法提取纯化藻蓝蛋白[J]. 食品工程, 2011(18): 122-125.
[12] 刘杨, 王雪青, 庞广昌, 等. 双水相萃取法富集分离螺旋藻藻蓝蛋白的研究[J]. 海洋科学, 2008, 32(7): 30-32.
[13] 王巍杰, 徐长波. 双水相萃取藻蓝蛋白的研究[J]. 粮油加工,2010(5): 92-95.
[14] 冯维希, 岳岑, 黄文. 双水相技术分离纯化藻胆蛋白的研究进展[J].食品研究与开发, 2010, 31(12): 246-249.
[15] PATIL G, RAGHAVARAO K S M S. Aqeous two phase extraction for purification of C-phycocyanin[J]. Biochemical Engineering Journal, 2007, 34(2): 156-164.
[16] BENAVIDES J, MAREO R. Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentum[J]. Journal of Chromatography B, 2006, 844(1): 39-44.
[17] ALBERTSSON P A. Partition of cell particles and macromolecules[M]. 2nd ed. New York: Wiley, 1971: 58-71.
[18] 张儒, 张变玲, 谢涛, 等. 双水相体系萃取人参根中人参皂苷的研究[J].天然产物研究与开发, 2012, 24(11): 1610-1613.
[19] 刘志国. 生物化学实验[M]. 武汉: 华中科技大学出版社, 2009: 93-101.
[20] 石思恩, 王建军, 翟伟, 等. 人肺腺癌细胞耐顺铂株A549/CDDP的比较蛋白质组学研究[J]. 中国肺癌杂志, 2009, 11(12): 1155-1158.
[21] 汪泓, 郑璐侠, 史芳亮, 等. 垂体后叶注射液中主成分和杂蛋白谱的生物质谱研究[J]. 药物分析杂志, 2014, 34(3): 505-510.
[22] 吴有炜. 试验设计与数据处理[M]. 苏州: 苏州大学出版社, 2002: 115-154.
[23] KALIL S J, MAUGERI F, RODRIGUES M I. Response surface analysis and simulation as a tool for bioprocess design and optimization[J]. Process Biochemistry, 2006, 22(2): 539-550.
[24] 陈健, 孙爱东, 高雪娟, 等. 响应面分析法优化超声波提取槟榔原花青素工艺[J]. 食品科学, 2011, 32(4): 82-86.
[25] 董发明, 白喜婷. 响应面法优化超声提取杜仲雄花中黄酮类化合物的工艺参数[J]. 食品科学, 2008, 29(8): 227-231.
Purifi cation of Phycocyanin from Nostoc spharoids Kützing by Stepwise Salting-out and Aqueous Two-Phase Extraction
TIAN Panpan
1, CHENG Chao
1,2, WANG Xingping
1,2,*
(1. School of Biological Science and Technology, Hubei University for Nationalities, Enshi 445000, China; 2. Key Laboratory of Biological Resources Protection and Utilization of Hubei Province, Hubei University for Nationalities, Enshi 445000, China)
Abstract:In this paper, stepwise salting-out combined with aqueous two-phase extraction was used to purify phycocyanin from Nostoc spharoids Kützing. The extraction process was optimized by using a three-factor quadratic regression orthogonal rotation combination design. Using the Design-Expert 7.0 software, a mathematical regression model was established indicating the effect of various extraction conditions on phycocyanin purity. The optimal extraction process was determined as follows: after discarding of the precipitate salted out by 20% (NH 4) 2SO 4, phycobiliproteins were salted out from the supernatant by 40% and 50% (NH 4) 2SO 4before being subjected to aqueous two-phase extraction with 10% PEG 6 000 and 18% (NH 4) 2SO 4. The purity (the absorbance ratio at 615 nm and 280 nm) and recovery of the purified product under the optimized conditions were 8.6 and 71.40%, respectively. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) analysis of the product revealed two clear bands having molecular weights of about 35 and 15 ku, respectively. Mass spectrometry (MS) analysis confi rmed that the molecular weight of band 2 was about 15 ku . Its isoelectric point was 5.35 and its partial amino acid sequences were TPLTEAVAAADSQGR and DIGYYLR, respectively. Through simulation of protein structure according to the SWISS-MODEL website, we speculated that band 2 might be the α-subunit of phycocyanin from Nostoc spharoids Kützing.
Key words:Nostoc spharoids Kützing; phycocyanin; stepwise salting-out; aqueous two-phase extraction;
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2015)24-0016-07
doi:10.7506/spkx1002-6630-201524003
收稿日期:2015-06-24
基金项目:国家自然科学基金地区科学基金项目(31260365);湖北省教育厅团队项目(T201312)
作者简介:田盼盼(1989—),女,硕士研究生,研究方向为天然产物开发与利用。E-mail:1003939513@qq.com
*通信作者:汪兴平(1963—),男,教授,博士,研究方向为生物资源的开发与利用。E-mail:hbmywxp@163.com