枇杷香气成分固相微萃取条件的正交试验优化
陈薇薇,孙海艳*,蒋 赟,郝晨星,李晓林,郭启高,何 桥,向素琼,梁国鲁*
(西南大学园艺园林学院,重庆 400716)
摘 要:探讨顶空固相微萃取采集枇杷香气的最优条件,以红肉枇杷“金华1号”为材料,采用正交试验研究萃取温度、萃取时间、样品量和萃取头类型4 个因素对枇杷香气检出峰数量和总峰面积的影响。以总峰面积为评价指标时,萃取条件最优组合为萃取温度50 ℃、萃取时间40 min、样品量6 g和萃取头类型85 μm PA,但检出峰数偏低。以检出峰数为评价指标,在保证检出峰数差异不显著的前提条件下,选取总峰面积大的萃取条件作为最优组合,即萃取条件的最优组合为萃取头类型50/30 μm DVB/CAR/PDMS、萃取时间20 min、萃取温度50 ℃、样品量5 g。本研究共检测到8 类91 种香气成分,其中醇类物质占17.6%;醛类物质占13.2%;酯类物质占24.2%;烷烃类物质占14.3% ;酮类占9.9%;烯烃类物质占10.9%;酸类物质占6.6%;其他类物质3 种,占3.3%。
关键词:枇杷;固相微萃取;优化;香气
枇杷为蔷薇科(Rosaceae)苹果亚科(Maloideae)枇杷属(Eriobotry japonica)植物,主要分布在东亚、东南亚等热带亚热带地区
[1],是世界上重要的常绿果树之一。我国主要分布在长江以南的浙江、安徽、江苏和福建等省。枇杷成熟于初夏,果实甜酸适度,风味独特,肉质细嫩,风味鲜美,堪称果中珍品,深受人们喜爱。随着市场对果品品质的要求越来越高,人们也越来越关注果实风味。而枇杷果实中香气物质的种类和含量是构成并影响其风味品质的重要因素之一。因此,香气成分分析已成为枇杷果实成熟期品质鉴别的重要研究内容之一。样品中香气成分的提取是进行分析的关键环节,已有研究提取挥发性成分多采用蒸汽蒸馏法
[2-3]、有机溶剂萃取法
[3-4]和动态顶空法
[4-5]等。固相微萃取(solid phase micro-extraction,SPME)法与传统技术相比,适合萃取小分子质量的挥发、半挥发性物质,具有无需有机溶剂、所需样品量少、灵敏度高、方便快捷等优点
[5-7],并可以与气相色谱(gas chromatography,GC)和高效液相色谱(high performance liquid chromatography,HPLC)
[8]等技术联用进行分离检测,其中SPME-GC是研究最早、也是发展最成熟的一种联用技术,已经被广泛应用于挥发性物质研究领域
[8-10]。如在油桃、杏、百香果、草莓、葡萄、杨梅等果实香气物质成分分析中已经广泛运用
[2,11-15]。SPME是采用针头涂敷的吸附剂,对达到气-液平衡的气体化学成分进行吸附,在GC高温进样口解吸,通过质谱(mass spectrometry,MS)分析即可定性和定量。但在萃取过程中,萃取量、萃取头类型、萃取温度、萃取时间、加入的电解质和pH值、试样混合速率等都是影响萃取效果的重要因素
[16-17]。然而,有关枇杷果实香气固相微萃取条件的优化鲜见相关报道。因此,本研究采用多因素正交试验设计,综合评价固相微萃取过程中的温度、时间、样品量和萃取头类型4 个因素对枇杷果肉香气成分的检出峰数和总峰面积的影响,筛选出最优的萃取条件,为枇杷果实香气组分的检测及进一步分析提供参考。
1 材料与方法
1.1 材料
以西南大学选育的2014年通过重庆市农作物新品种鉴定的红肉枇杷“金华1号”的成熟果实为材料。
1.2 仪器与设备
QP2010型GC-MS联用仪、AOC-5000自动进样装置 日本岛津公司;3 种类型萃取头(85 μm聚丙烯酸酯(polyacrylate,PA)、65 μm聚二甲基硅氧烷/二乙烯基苯(polydimethylsiloxane/divinylbenzene,PDMS/ DVB)、50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)) 美国Supelco公司;顶空进样瓶(20 mL) 中国安普公司。
1.3 方法
1.3.1 样品处理
将保存的样品用液氮研磨至粉末状,取适量样品于20 mL顶空萃取瓶,加入5 mL饱和氯化钠溶液,置于自动萃取装置的萃取盘,准备进样。
1.3.2 GC-MS操作条件
GC条件:色谱柱:Rtx-5MS(30 m×0.25 μm,0.25 mm);升温程序:初始温度40 ℃,保持2 min,以3 ℃/min的速率升至150 ℃,保持1 min,再以10 ℃/min的速率升至220 ℃,保持1 min,最后以5 ℃/min的速率升至240 ℃保持2 min;载气为氦气,流速1 mL/min,恒线速率,进样方式为不分流进样。
MS条件:离子源为电子电离(electron ionization, EI)源,离子源温度230 ℃,接口温度240 ℃,电子能量70 eV,扫描范围m/z 35~350。
1.3.3 正交试验设计
采用L
9(3
4)正交试验设计,选取萃取过程中所涉及的4 个关键因素,包括萃取温度、萃取时间、样品量和萃取头类型。根据预实验及前人单因素试验确定因素范围
[16-18],并在每个因素内设置3 个水平,以探寻最佳水平。试验共9 个处理,重复2 次,以检出峰数和总峰面积为评价指标,试验设计见表1。
表1 正交试验因素及水平
Taabbllee 11 FFaaccttoorrss aanndd lleevveellss uusseedd iinn oorrtthhooggoonnaall aarrrraayy eexxppeerriimmeennttss

水平因素A萃取头类型 B萃取时间/min C萃取温度/℃D样品量/g 1 85 μm PA 20 30 4 2 65 μm PDMS/DVB 30 40 5 3 50/30 μm DVB/CAR/PDMS 40 50 6
1.3.4 定性与定量分析
SPME采用自动进样装置,枇杷香气成分分析采用GC-MS联用仪。数据分析运用计算机检索并与图谱库(NIST 08)的标准质谱图对照,结合有关文献,确认香气物质的化学成分,按峰面积归一化法算出样品各个组分的相对含量。
1.4 数据处理
对实验结果按有重复无交互作用资料做方差分析,检验各因素对检出峰数和检出峰面积的影响。所有计算通过DPS数据分析系统9.50完成。
2.1 正交试验结果
2 结果与分析
表2 正交试验设计与结果
Taabbllee 22 RReessuullttss aanndd aannaallyyssiiss ooff oorrtthhooggoonnaall aarrrraayy eexxppeerriimmeennttss

注:同列肩标不同字母表示差异显著(P<0.05)。
试验号 A萃取头类型B萃取时间C萃取温度D样品量总峰面积(×10
8)检出峰数/个1 1 1 1 1 7.023
ab 129
b2 1 2 2 2 5.318
bc 128
b3 1 3 3 3 7.571
a 151
b4 2 1 2 3 1.057
d 362
a5 2 2 3 1 1.437
d 285
a6 2 3 1 2 1.524
d 308
a7 3 1 3 2 5.522
bc 299
a8 3 2 1 3 5.225
bc 298
a9 3 3 2 1 4.998
c 316
a总峰面积K
1 19.91 13.60 13.77 13.46 K
2 4.018 11.98 11.37 12.36 K
3 15.74 14.09 14.53 13.85 R 2.649 0 0.352 0 0.526 0 0.248 2检出峰数K
1' 408 790 735 730 K
2' 955 711 806 735 K
3' 913 775 735 811 R' 91.166 7 13.166 7 11.833 3 13.5
表3 色谱峰总峰面积方差分析
Taabbllee 33 AAnnaallyyssiiss ooff vvaarriiaannccee (AANNOOVVAA) ooff tthhee ttoottaall aarreeaass ooff GGCC ppeeaakkss
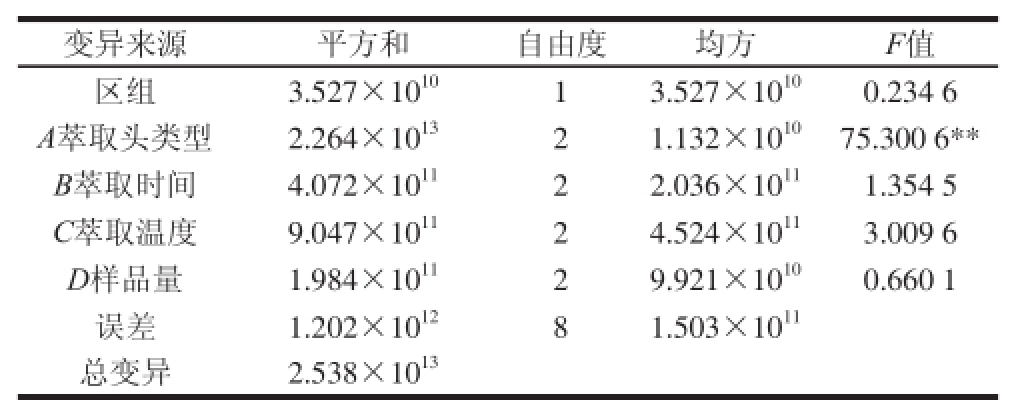
注:**.差异极显著(P<0.01),表5同。
变异来源 平方和 自由度 均方 F值区组 3.527×10
10 1 3.527×10
10 0.234 6 A萃取头类型 2.264×10
13 2 1.132×10
1075.300 6** B萃取时间 4.072×10
11 2 2.036×10
11 1.354 5 C萃取温度 9.047×10
11 2 4.524×10
11 3.009 6 D样品量 1.984×10
11 2 9.921×10
10 0.660 1误差 1.202×10
12 8 1.503×10
11总变异 2.538×10
13
表 4 不同类型萃取头对总峰面积的多重比较
TTaabbllee 44 MMuullttiippllee ccoommppaarriissoonn ooff ppeeaakk aarreeaa aammoonngg ddiiffffeerreenntt ttyyppeess ooff extraction fi bbeerr
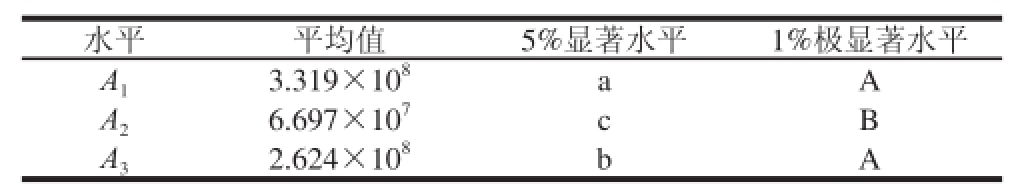
注:字母不同表示差异显著,表6同。
?
如表2所示,比较总峰面积极差(R)值得知,因素效应顺序为:萃取头类型>萃取温度>萃取时间>样品量,其中,85 μm PA检出峰总峰面积高于其他2种萃取头。对表2作方差分析,由表3可知,4 个因素中除不同萃取头类型间差异达极显著外,萃取温度、萃取时间和样品量间差异均不显著。不同萃取头类型的多重比较结果(表4)表明,85 μm PA和50/30 μm DVB/CAR/PDMS间差异显著,但两者与65 μm PDMS/DVB间差异达极显著。不同处理间总峰面积的比较结果显示(表2),3号处理总峰面积最大,除与1号处理间差异不显著外,与其他7个处理均差异显著。使用65 μm PDMS/DVB萃取头的4、5、6号处理总峰面积普遍偏低,与另外2种萃取头类型的处理间差异显著。由此可得检出峰总峰面积的最优萃取条件组合为萃取温度50 ℃、萃取时间40 min、样品量6 g、萃取头类型85 μm PA,即试验中的3号处理,2个重复峰面积总和为7.571×10
8。
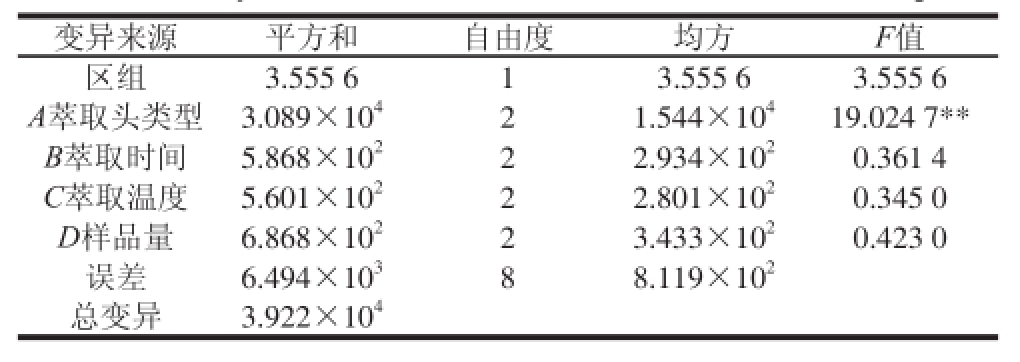
表5 色谱检出峰数方差分析
Taabbllee 55 AAnnaallyyssiiss ooff vvaarriiaannccee (AANNOOVVAA) ooff tthhee ttoottaall nnuummbbeerr ooff GGCC ppeeaakkss
变异来源 平方和 自由度 均方 F值区组 3.555 6 1 3.555 6 3.555 6 A萃取头类型 3.089×10
4 2 1.544×10
4 19.024 7** B萃取时间 5.868×10
2 2 2.934×10
2 0.361 4 C萃取温度 5.601×10
2 2 2.801×10
2 0.345 0 D样品量 6.868×10
2 2 3.433×10
2 0.423 0误差 6.494×10
3 8 8.119×10
2总变异 3.922×10
4
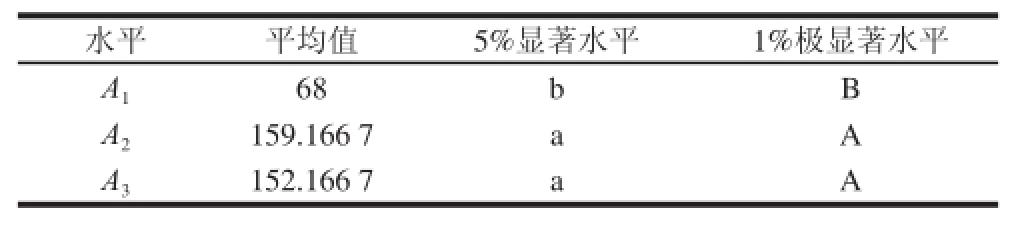
表6 不同类型萃取头对检出峰数的多重比较
TTaabbllee 66 MMuullttiippllee ccoommppaarriissoonn ooff ppeeaakk nnuummbbeerr aammoonngg ddiiffffeerreenntt ttyyppeess ooff extraction fi bbeerr
水平 平均值 5%显著水平 1%极显著水平A
1 68 b B A
2 159.166 7 a A A
3 152.166 7 a A
对检出峰数影响最大的因素仍为萃取头类型,且远高于萃取温度、萃取时间和样品量。各处理检出峰数的方差分析结果(表5)表明,萃取头类型对检出峰数有极显著影响(P<0.01),而萃取时间、萃取温度和样品量影响不显著。对萃取头类型进一步多重比较,结果(表
6和表2)表明,采用65 μm PDMS/DVB和50/30 μm DVB/ CAR/PDMS萃取头的处理出峰数差异不显著,但都显著高于使用85 μm PA萃取头的处理组合。
2.2 枇杷香气成分分析
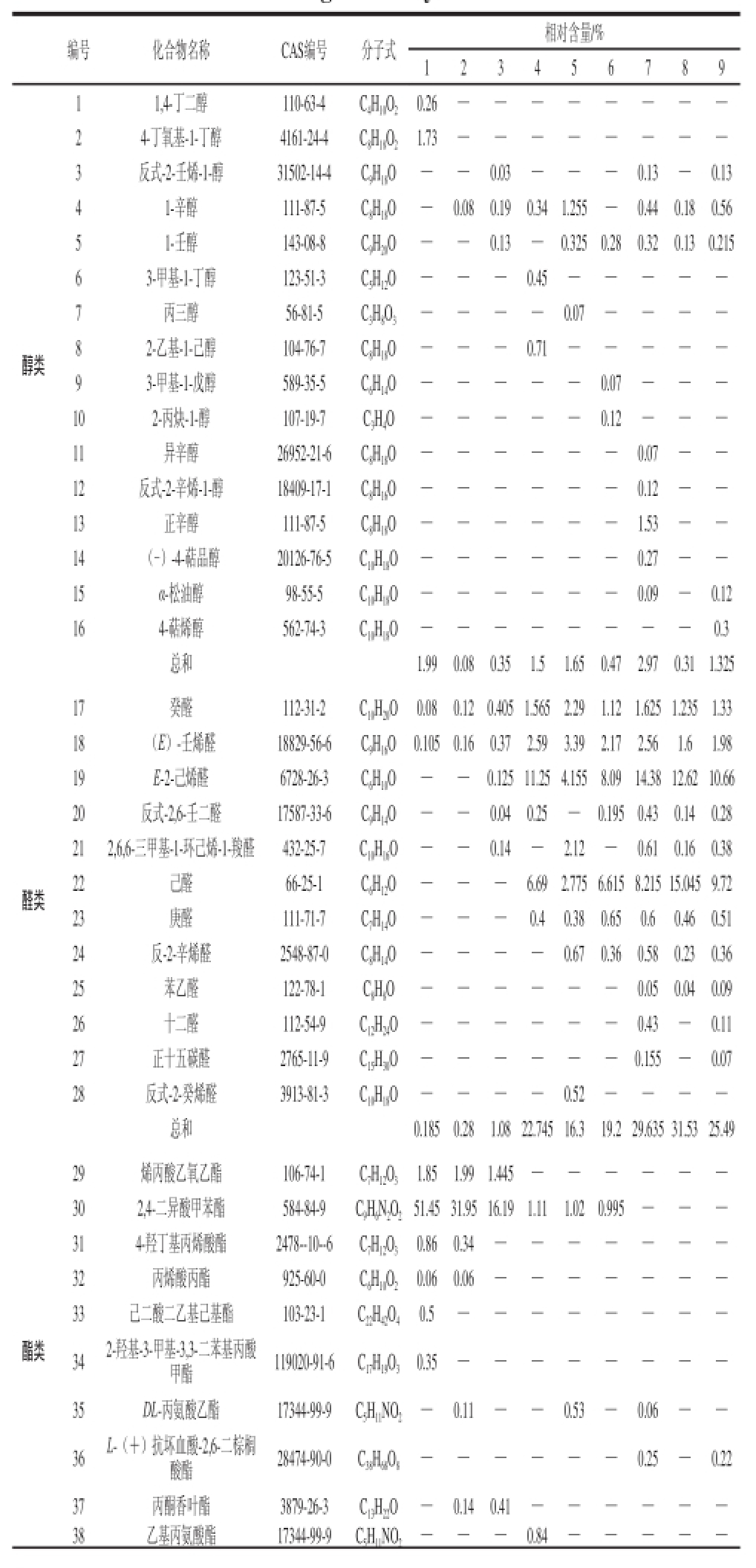
表7 9 种正交试验组合枇杷香气成分及其相对含量
TTaabbllee 77 AArroommaa ccoommppoonneennttss aanndd rreellaattiivvee ccoonntteennttss iinn llooqquuaatt ffrroomm nniinnee orthogonal array ruunnss
编号 化合物名称 CAS编号 分子式相对含量/% 123456789醇类1 1,4-丁二醇 110-63-4 C
4H
10O
2 0.26 — — — — — — — —2 4-丁氧基-1-丁醇 4161-24-4 C
8H
18O
2 1.73 — — — — — — — —3 反式-2-壬烯-1-醇 31502-14-4 C
9H
18O — — 0.03 — — — 0.13 — 0.13 4 1-辛醇 111-87-5 C
8H
18O — 0.08 0.19 0.341.255 — 0.44 0.18 0.56 5 1-壬醇 143-08-8 C
9H
20O — — 0.13 — 0.3250.28 0.32 0.130.215 6 3-甲基-1-丁醇 123-51-3 C
5H
12O — — — 0.45 — — — — —7丙三醇 56-81-5 C
3H
8O
3 — — — — 0.07 — — — —8 2-乙基-1-己醇 104-76-7 C
8H
18O — — — 0.71 — — — — —9 3-甲基-1-戊醇 589-35-5 C
6H
14O — — — — — 0.07 — — —10 2-丙炔-1-醇 107-19-7 C
3H
4O — — — — — 0.12 — — —11 异辛醇 26952-21-6 C
8H
18O — — — — — — 0.07 — —12 反式-2-辛烯-1-醇 18409-17-1 C
8H
16O — — — — — — 0.12 — —13 正辛醇 111-87-5 C
8H
18O — — — — — — 1.53 — —14 (-)-4-萜品醇 20126-76-5 C
10H
18O — — — — — — 0.27 — —15 α-松油醇 98-55-5 C
10H
18O — — — — — — 0.09 — 0.12 16 4-萜烯醇 562-74-3 C
10H
18O — — — — — — — — 0.3总和 1.99 0.08 0.35 1.5 1.65 0.47 2.97 0.311.325醛类17 癸醛 112-31-2 C
10H
20O 0.08 0.120.405 1.5652.29 1.12 1.625 1.2351.33 18 (E)-壬烯醛 18829-56-6 C
9H
16O 0.1050.16 0.37 2.59 3.39 2.17 2.56 1.6 1.98 19 E-2-己烯醛 6728-26-3 C
6H
10O — — 0.125 11.25 4.1558.09 14.38 12.62 10.66 20 反式-2,6-壬二醛 17587-33-6 C
9H
14O — — 0.04 0.25 — 0.195 0.43 0.14 0.28 21 2,6,6-三甲基-1-环己烯-1-羧醛 432-25-7 C
10H
16O — — 0.14 — 2.12 — 0.61 0.16 0.38 22 己醛 66-25-1 C
6H
12O — — — 6.692.775 6.615 8.215 15.045 9.72 23 庚醛 111-71-7 C
7H
14O — — — 0.4 0.38 0.65 0.6 0.46 0.51 24 反-2-辛烯醛 2548-87-0 C
8H
14O — — — — 0.67 0.36 0.58 0.23 0.36 25 苯乙醛 122-78-1 C
8H
8O — — — — — — 0.05 0.04 0.09 26 十二醛 112-54-9 C
12H
24O — — — — — — 0.43 — 0.11 27 正十五碳醛 2765-11-9 C
15H
30O — — — — — — 0.155 — 0.07 28 反式-2-癸烯醛 3913-81-3 C
10H
18O — — — — 0.52 — — — —总和 0.1850.28 1.08 22.745 16.3 19.2 29.635 31.53 25.49酯类29 烯丙酸乙氧乙酯 106-74-1 C
7H
12O
3 1.85 1.991.445 — — — — — —30 2,4-二异酸甲苯酯 584-84-9 C
9H
6N
2O
251.45 31.95 16.191.11 1.020.995 — — —31 4-羟丁基丙烯酸酯 2478--10--6 C
7H
12O
3 0.86 0.34 — — — — — — —32 丙烯酸丙酯 925-60-0 C
6H
10O
2 0.06 0.06 — — — — — — —33 己二酸二乙基己基酯 103-23-1 C
22H
42O
4 0.5 — — — — — — — —34 2-羟基-3-甲基-3,3-二苯基丙酸甲酯 119020-91-6 C
17H
19O
3 0.35 — — — — — — — —35 DL-丙氨酸乙酯 17344-99-9 C
5H
11NO
2 — 0.11 — — 0.53 — 0.06 — —36 L-(+)抗坏血酸-2,6-二棕榈酸酯 28474-90-0 C
38H
68O
8 — — — — — — 0.25 — 0.22 37 丙酮香叶酯 3879-26-3 C
13H
22O — 0.14 0.41 — — — — — —38 乙基丙氨酸酯 17344-99-9 C
5H
11NO
2 — — — 0.84 — — — — —
续表7

编号 化合物名称 CAS编号 分子式相对含量/% 123456789酯类39 邻苯二甲酸二异丁酯 84-69-5 C
16H
22O
4 — — — — 0.11 — 0.07 — —40 3-乙基二醇二甲基丙烯酸酯 109-16-0 C
14H
22O
6 — — — 0.23 1.81 0.38 — 0.03 —41 邻苯二甲酸二丁酯 84-74-2 C
16H
22O
4 — — — — 0.24 0.09 — — —42 丙酸乙烯酯 105-38-4 C
5H
8O
2 — — — 0.17 — — — — —43 2-甲基丁酸甲酯 868-57-5 C
6H
12O
2 — — — 13.59 13.59 19.72 8.285 21.82 18.655 44 异丁酸丁酯 97-87-0 C
8H
16O
2 — — — 0.07 — — — — —45 碳酸丙烯乙酯 1469-70-1 C
6H
10O
3 — — — — 0.34 — — — —46 苯甲酸甲酯 93-58-3 C
8H
8O
2 — — — — 0.29 0.09 — — —47 乙酸丁酯 123-86-4 C
6H
12O
2 — — — — 0.28 — 0.855 1.3250.99 48 2-甲基丙酸丁酯 97-87-0 C
8H
16O
2 — — — — 0.06 — — — —49 二氢猕猴桃内酯 17092-92-1 C
11H
16O
2 — — 0.12 — — — — — —总和 55.07 34.59 18.165 16.01 18.27 21.275 9.52 23.175 19.87酮类50 β-紫罗兰酮 14901-07-6 C
13H
20O — — 0.435 — 1.48 — 0.47 — 0.27 51 1-辛烯-3-酮 4312-99-6 C
8H
14O — — — 0.606 0.9550.57 1.7 0.55 0.81 52 6-甲基-5-庚烯-2-酮 110-93-0 C
8H
14O — — — 1.73 1.66 2.31 1.31 — 1.23 53 2,2-二甲基己酮 5405-79-8 C
8H
16O — — — 0.03 0.04 0.08 — — —54 香叶基丙酮 3796-70-1 C
13H
22O — — — — — — 0.39 — 0.375 55 2,3-辛二酮 585-25-1 C
8H
14O
2 — — — 0.11 — — — — —56 (E)-4-(2,6,6-三甲基-1-环己烯-1-基)-3-丁烯-2-酮 79-77-6 C
13H
20O — — — — 1.74 — — — —57 3-辛酮 106-68-3 C
8H
16O — — — — — — — 1.25 —58 甲基庚烯酮 110-93-0 C
8H
14O — — — — — — — — 1.74 59 (E)-4-(2,6,6-三甲基-1-环己烯-1-基)-3-丁烯-2-酮 79-77-6 C
13H
20O — — — — — — 0.47 — —总和 0 0 0.435 2.476 5.8752.96 4.34 1.8 4.425烷烃60 正二十一烷 629-94-7 C
21H
44 0.11 — — — 0.27 — — — —61 异丁烷 75-28-5 C
4H
10 — — — 0.18 — — — — —62 1-戊基-环丙烷 2511-91-3 C
8H
16 — — — 0.1 — 0.235 — — —63 1-乙基-1-甲基-环戊烷 16747-50-5 C
8H
16 — — — — — — 0.07 0.63 0.06 64 3-甲基十一烷 1002-43-3 C
12H
26 — — — 0.23 — — 0.04 — 0.08 65 2,2-二甲基戊烷 590-35-2 C
7H
16 — — — — 0.16 0.09 — — —66 辛烷 111-65-9 C
8H
18 — — — 0.72 1.27 1.255 1.075 0.925 1.365 67 3,5-二甲基-4-辛烷 7335-17-3 C
10H
22 — — — — — 0.14 — — —68 3,6-二甲基-辛烷 15869-94-0 C
10H
22 — — — — — 0.12 — — —69 3,7-二甲基-壬烷 17302-32-8 C
11H
24 — — — 0.86 0.09 0.19 — 0.17 70 2,3,5-三甲基-癸烷 62238-11-3 C
13H
28 — — — — — — 0.06 — —71 3,8-二甲基-癸烷 17312-55-9 C
12H
26 — — — — — — 0.12 — 0.105 72 2,2,3,3,5,6,6-正庚烷 7225-67-4 C
14H
30 — — — — — — 0.13 — —总和 0.11 0 0 2.09 1.7 1.931.685 1.5551.78烯烃73 8-甲基-1-癸烯 61142-79-8 C
21H
22 — — — 0.430.135 — 0.05 — 0.04 74 丙烯 115-07-1 C
3H
6 — — — 0.15 — — — — —75 异辛烯 5026-76-6 C
8H
16 — — — 0.175 — 0.1 — — —76 (+)-4长松针烯 29050-33-7 C
10H
16 — — — — — — 0.370.3250.46 77 枯烯 98-82-8 C
9H
12 — — — — — — 0.39 — —78 萜品油烯 586-62-9 C
10H
16 — — — — 1.16 0.89 — — —79 右旋萜二烯 5989-27-5 C
10H
16 — — — — — — — 0.88 —80 环辛四烯 629-20-9 C
8H
8 — — — — 4.2 — — — —81 反式角鲨烯 111-02-4 C
30H
50 — — — — — — 4.84 — —82 α-蒎烯 80-56-8 C
10H
16 — — — — — — — 0.13 —总和 0 0 0 0.755 5.4950.99 5.651.335 0.5酸类83 2-甲基丁酸 116-53-0 C
5H
10O
2 0.4 0.070.595 7.055 — — 1.155 0.565 1.455 84 乙酸 64-19-7 C
2H
4O
2 — 0.140.455 — — — 0.94 1.65 —85 十六烷酸 57-10-3 C
16H
32O
2 — 0.53 — — — 0.87 — 0.15 86 壬酸 112-05-0 C
9H
18O
2 — 0.020.155 — — — 0.34 — 0.1 87 月桂酸 143-07-7 C
12H
24O
2 — — 0.08 — — — — — —88 乙醛酸 298-12-4 C
2H
2O
3 — — — — — — — — 1.41
续表7
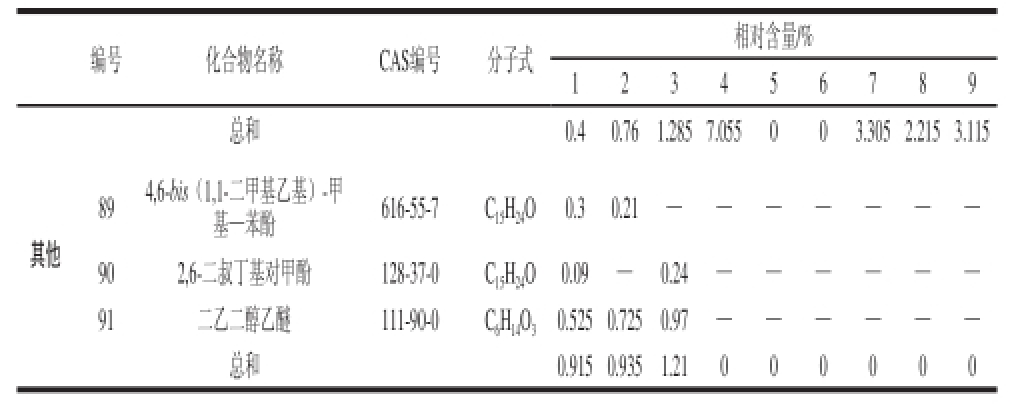
注:—.未检出。
编号 化合物名称 CAS编号 分子式相对含量/% 123456789总和 0.4 0.761.285 7.055 0 0 3.305 2.215 3.115其他89 4,6-bis(1,1-二甲基乙基)-甲基—苯酚 616-55-7 C
15H
24O 0.3 0.21 — — — — — — —90 2,6-二叔丁基对甲酚 128-37-0 C
15H
24O 0.09 — 0.24 — — — — — —91 二乙二醇乙醚 111-90-0 C
6H
14O
30.525 0.7250.97 — — — — — —总和 0.915 0.9351.21 0 0 0 0 0 0
由表7可知,9种处理检测出匹配度大于85%的香气成分共8 类91 种,其中醇类物质16 种,占17.6%;醛类物质12 种,占13.2%;酯类物质22 种,占24.2%;烷烃类物质13 种,占14.3%;酮类9 种,占9.9%;烯烃类物质10 种,占10.9%;酸类物质6 种,占6.6%;其他类物质3 种,占3.3%。本研究中相对含量较高的为醛类和酯类类物质,醛类主要为C
6~C
15的醛类物质,其中C
8~C
13的中级醛具有果香味,C
6醛则是具有“青香型”的香气物质
[19];同时,酯类物质一般也具有使人愉快的水果香气
[20]。9 种处理香气成分,仅有两种共有成分癸醛和(E)-壬烯醛,处理4和处理5两者的相对含量均在1%以上。
3 讨论与结论
与单因素试验相比,正交试验具有工作量小、数据分析简便直观、获得信息丰富等特点,在化学分析条件的优化中应用价值很高
[21]。本研究从3 个不同水平上系统比较了萃取温度、萃取时间、样品量和萃取头类型4 个因素对枇杷香气成分分析中总峰面积和检出峰数量的影响,对SPME条件进行了优化。综合本研究的分析结果,萃取头类型对总峰面积和检出峰数有极显著的影响。以总峰面积为评价指标时,最优萃取条件组合(3号处理)的总峰数则偏低。以检出峰数为指标评价时,由表2可知,处理4~9号的出峰总数较高,但差异不显著,在保证检出峰数差异不显著的前提下,选取总峰面积大的萃取条件(7号处理)作为最优萃取条件组合,即萃取头类型50/30 μm DVB/CAR/PDMS、萃取时间20 min、萃取温度50 ℃、样品量5 g。
本研究香气成分分析结果共有8 类91 种,其中醇类物质16 种,占17.6%;醛类物质12种,占13.2%;酯类物质22 种,占24.2%;烷烃类物质13 种,占14.3%;酮类9 种,占9.9%;烯烃类物质10 种,占10.9%;酸类物质6 种,占6.6%;其他类物质3种,占3.3%。在所检测到的91种物质中,相对含量较高的的为酯类和醛类物质,同时酯类物质和醛类物质的阈值很低,低达10
-9级别
[22],由此可见,酯类和醛类物质为枇杷的主要香气成分。此外,尽管醇类物质的相对含量较低,但其阈值通常较高为10
-6级别
[22],因此,醇类物质是否为枇杷的主要香气成分有待进一步验证。本研究中酮类和烯烃类物质的相对含量较低,但其阈值也较低,大部分为10
-9级别
[23-27],比如具有紫罗兰花香的β-紫罗兰酮香气阈值为7 μg/L
[28],α-蒎烯香气阈值为4.6 μg/L
[23],因此,酮类和烯烃类也为枇杷主要的香气成分。与其他枇杷香气成分研究相比,付婷婷
[29]对大五星枇杷的香气成分分析研究中共检测到6 类116 种香气成分,含量最高的的为酯类物质,其次为醚类和醇类物质,而本研究中,仅检测到1 种醚类物质,且相对含量在0.525%~0.97%之间;在付婷婷的研究中还检测到烷烃类物质的种类和含量也很高,但该研究认为烷烃类物质不构成果实的香气成分,未在文中列出。蒋际谋等
[30]对香钟枇杷和解放钟枇杷及两者杂交子代优系果实的香气成分分析研究中共检测到了11 类91 种香气成分,含量最高的为萜类物质中的D-柠檬烯(62.59%~68.32%),其次为醛类物质;而本研究中萜类物质的含量则较低(0.5%~5.65%)。此外,Chen Faxing等
[31]的研究报道了酮、酸、酸、烷类为“早钟6号”中含量最高的香气成分。本研究与其他研究的差异可能与选用的品种、栽培条件等有关,同时也表明了枇杷果肉具有丰富的香气成分。
参考文献:
[1] 郑永华, 席玙芳, 应铁进, 等. 枇杷果实采后生理与贮藏研究[J]. 浙江林学院学报, 1993, 10(3): 276-281.
[2] 陈美霞, 陈学森, 冯宝春. 两个杏品种果实香气成分的气相色谱-质谱分析[J]. 园艺学报, 2004, 31(5): 663-665.
[3] 陈美霞, 陈学森, 程传格. 杏果实香气成分的气相色谱-质谱分析[J].色谱, 2004, 22(6): 665.
[4] 涂正顺, 李华, 李嘉瑞, 等. 猕猴桃品种间果香成分的GC-MS分析[J].西北农林科技大学学报: 自然科学版, 2002, 30(2): 96-100.
[5] MEJIAS R C, MARIN R N, MORENO M V G, et al. Optimisation of headspace solid-phase microextraction for analysis of aromatic compounds in vinegar[J]. Journal of Chromatography A, 2002, 953(1): 7-15.
[6] 王锡昌, 陈俊卿. 固相微萃取技术及其应用[J]. 上海水产大学学报,2005, 13(4): 348-352.
[7] 牛丽影, 吴继红, 廖小军, 等. 不同类型橙汁挥发性风昧成分的测定与比较[J]. 中国食品学报, 2008, 8(1): 119-124.
[8] DU Liping, WANG Chao, LI Jianxun, et al. Optimization of headspace solid-phase microextraction coupled with gas chromatography-mass spectrometry for detecting methoxyphenolic compounds in Pu-erh tea[J]. Journal of Agricultural and Food Chemistry, 2013, 61(3): 561-568.
[9] PONTES M, MARQUES J C, CAMARA J S. Screening of volatile composition from Portuguese multifloral honeys using headspace solid-phase microextraction-gas chromatography-quadrupole mass spectrometry[J]. Talanta, 2007, 74(1): 91-103.
[10] 魏好程, 王贵禧, 梁丽松, 等. HS-SPME 在桃果实挥发性芳香物质分析中应用研究[J]. 食品科学, 2007, 28(7): 347-351.
[11] 韩素芳, 丁明, 刘亚群, 等. 顶空固相微萃取-气相色谱-质谱测定百香果香气条件的优化[J]. 中国食品学报, 2010, 10(4): 278-284.
[12] 胡玲, 王友升, 李丽萍. 油桃果实挥发性物质的固相微萃取条件优化研究[J]. 食品工业科技, 2010, 31(4): 220-222.
[13] VANDENDRIESSCHE T, NICOLAI B M, HERTOG M. Optimization of HS-SPME fast GC-MS for high-throughput analysis of strawberry aroma[J]. Food Analytical Methods, 2013, 6(2): 512-520.
[14] WANG Dong, CAI Jian, ZHU Baoqing, et al. Study of free and glycosidically bound volatile compounds in air-dried raisins from three seedless grape varieties using HS-SPME with GC-MS[J]. Food Chemistry, 2015, 177: 346-353.
[15] CHENG Huan, CHEN Jianle, LI Xin, et al. Differentiation of the volatile profi les of Chinese bayberry cultivars during storage by HSSPME-GC/MS combined with principal component analysis[J]. Postharvest Biology and Technology, 2015, 100: 59-72.
[16] 杨大进, 方从容, 王竹天. 固相微萃取技术及其在分析中的应用[J].中国食品卫生杂志, 1999, 11(3): 36-39.
[17] 刘春红. 固相微萃取技术及其在国内食品领域中的应用[J]. 生命科学仪器, 2007, 5(9): 3-8.
[18] 李国鹏. 中国梨果实挥发性物质鉴定及酯类物质生物合成相关基因表达的研究[D]. 杭州: 浙江大学, 2012.
[19] 席万鹏, 郁松林, 周志钦. 桃果实香气物质生物合成研究进展[J]. 园艺学报, 2013, 40(9): 1679-1690.
[20] 卢静茹, 林向阳, 张如, 等. HS-SPME-GC-MS联用分析美国巴旦木香气成分[J]. 食品科学, 2015, 36(2): 120-125. doi: 10.7506/ spkx1002-6630-201502023.
[21] 李为争, 柴晓乐, 付国需, 等. 肉桂挥发物顶空固相微萃取条件的正交优化[J]. 河南农业科学, 2011, 40(2) : 131-134.
[22] ALVAREZ S, RIERA F A, ALVAREZ R, et al. A new integrated membrane process for producing clarifi ed apple juice and apple juice aroma concentrate[J]. Journal of Food Engineering, 2000, 46(17): 109-125.
[23] CZERNY M, CHRISTLBAUER M, FISCHER A, et al. Reinvestigation on odour thresholds of key food aroma compounds and development of an aroma language based on odour qualities of defined aqueous odorant solutions[J]. European Food Research and Technology, 2008, 228(2): 265-273.
[24] KARAGUL Y, VLAHOVICH K N, DRAKE M, et al. Characteristic aroma components of rennet casein[J]. Journal of Agricultural and Food Chemistry, 2003, 51(23): 6797-6801.
[25] SEMMELROCH P, GROSCH W. Studies on character impact odorants of coffee brews[J]. Journal of Agricultural and Food Chemistry, 1996, 44(2): 537-543.
[26] 范刚, 乔宇, 姚晓琳, 等. 柑橘加工制品中香气物质的研究进展[J].中国农业科学, 2009, 42(12): 4324-4332.
[27] BUTTERY R G, LING L C. Volatile flavor components of corn tortillas and related products[J]. Journal of Agricultural and Food Chemistry, 2002, 43(7): 1878-1882.
[28] KANANI D M, NINHADE B P, BALAKRISHNAN P, et al. Recovery of valuable tea aroma components by pervaporation[J]. Industrial and Engineering Chemistry Research, 2003, 42(26): 6924-6932.
[29] 付婷婷. “大五星”枇杷采后低温冷害及变温处理效果的研究[D].成都: 四川农业大学, 2011.
[30] 蒋际谋, 胡文舜, 许奇志, 等. 枇杷品种香甜和解放钟及两者杂交子代优系果实香气成分分析[J]. 植物遗传资源学报, 2014,15(4): 894-900.
[31] CHEN Faxing, LIU Xinghun, CHEN Lisong, et al. The determination of volatile constituents of loquat fruit and leaf by gas chromatographymass spectrometry coupled with solid-phase microextraction[C]//ⅢInternational Symposium on Loquat, Antakya, Hatay, Turkey. Leuven Belgium: J. Janick, A. Aytekin Polat, 2011: 369-372.
Orthogonal Array Optimization of Solid Phase Micro-Extraction Conditions for Loquat Aroma Compounds
CHEN Weiwei, SUN Haiyan
*, JIANG Yun, HAO Chenxing, LI Xiaolin, GUO Qigao, HE Qiao, XIANG Suqiong, LIANG Guolu* (College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400716, China)
Abstract:This study aimed to explore the optimal conditions of head space solid phase micro-extraction (HS-SPME) for the analysis of aroma compounds in “Jinhua 1” red-fl eshed loquats. An orthogonal array design was applied to establish the optimum conditions of extraction temperature, extraction time, sample weight and fi ber. The results showed that based on peak area, the optimal conditions were determined as follows: 6 g of sample was extracted at 50 ℃ for 40 min using an 85 μm PA fi ber, under which, however, a smaller number of peaks were separated, while those determined based on the total number of peaks without producing signifi cant differences in this parameter were determined as follows: 5 g of sample was extracted at 50 ℃ for 20 min using a 50/30 μm DVB/CAR/PDMS fi ber. A total of 91 aroma components were identifi ed in loquat, which belonged to eight chemical classes including alcohols (17.6%), aldehyde (13.2%), esters (24.2%), alkane (14.3%), ketone (9.9%), olefi ns (10.9%), acids (6.6%) and three other substances (3.3%).
Key words:loquat; headspa ce-solid-phase micro extraction (HS-SPME); optimization; aroma
中图分类号:S667.3
文献标志码:A
文章编号:1002-6630(2015)24-0035-05
doi:10.7506/spkx1002-6630-201524006
收稿日期:2015-05-26
基金项目:“十二五”国家科技支撑计划项目(2013BAD02B02);中央高校基本科研业务费专项(XDJK2014D046;XDJK2015C054);西南大学本科生创新基金项目(1319001)
作者简介:陈薇薇(1990—),女,硕士研究生,研究方向为果树遗传育种与生物技术。E-mail:253482217@qq.com
*通信作者:孙海艳(1975—),女,助理研究员,博士研究生,研究方向为果树遗传育种与生物技术。
E-mail:sunhaiyan1975@126.com
梁国鲁(1960—),男,研究员,博士,研究方向为果树遗传育种与生物技术。E-mail:lianggl@swu.edu.cn








