胡卫成 1,王新风 1,沈 婷 1,王毓宁 2,陈 铭 1,尤 龙 1,纪丽莲 1,*,李鹏霞 2,*
(1.淮阴师范学院 江苏省高校区域现代农业与环境保护协同创新中心,淮阴师范学院生命科学学院,江苏省环洪泽湖生态农业生物技术重点实验室,江苏 淮安 223300;2.江苏省农业科学院农产品加工研究所, 江苏 南京 210014)
摘 要:对莲蓬壳总黄酮的超声提取工艺和抗氧化活性进行研究。在单因素试验基础上,采用响应面分析法对超声辅助提取的工艺参数进行优化,得到最优工艺条件为液料比40∶1(mL/g)、乙醇体积分数48%、提取温度60 ℃、提取时间10 min。在此条件下测得莲蓬壳总黄酮提取率为8.32%。抗氧化实验结果表明:莲蓬壳总黄酮具有较强清除1,1-二苯基-2-三硝基苯肼自由基能力和还原力,同时可显著性抑制H 2O 2诱导的人皮肤纤维细胞氧化应激损伤,是一种极具开发潜力的天然抗氧化剂。
关键词:响应面分析法;莲蓬壳;总黄酮;超声提取;自由基Abstract: Using Box-Behnken design and response surface methodology, the optimized extraction conditions for maximum yield (83.2 mg rutin equivalents/g) of total fl avonoids from lotus (Nelumbo nucifera Gaertn.) receptacle were determined as follows: temperature, 60 ℃; ethanol concentration, 48%; ratio of liquid to solid, 40:1 (mL/g); and extraction duration,10 min. The fl avonoids extracted from lotus receptacle (FLR) exerted remarkable scavenging effects on 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical and exhibited high reducing power. Moreover, FLR pretreatment effectively elevated cell viability in H 2O 2-treated human skin fi broblast cells. The results obtained from in vitro models clearly suggest that FLR, as a byproduct of the agricultural and food industries, is a potential source of natural antioxidant.
莲蓬壳又名莲房,为睡莲科多年生水生草本植物莲(Nelumbo nucifera Gaertn.)的干燥成熟花托,是莲子生产过程中的副产物。中医常用于治疗崩漏、尿血、产后瘀阻、恶露不尽等病症 [1-3]。莲蓬壳富含大量活性物质,其中主要以金丝桃苷、槲皮素-3-二葡萄糖苷、槲皮素、莲房原花青素、莲子碱为主 [4-6]。现代药理研究表明莲蓬壳具有较强的抗氧化作用 [7],可有效地抑制黑色素瘤细胞B 16的增殖 [8],莲蓬壳中的莲房原花青素和银杏内酯联用能够改善东莨菪碱所致的小鼠学习记忆障碍 [9],与半胱氨酸联用可有效地抑制氧化应激损伤,改善记忆障碍 [10]。目前莲蓬壳中有效成分的提取工艺包括热回流提取总黄酮工艺、微波辅助提取多酚工艺以及超声辅助提取多酚工艺 [11-12],超声辅助提取总黄酮工艺鲜有系统研究。
超声提取是利用超声波的机械振动与空化作用来促使植物有效成分的浸出方法,与传统提取工艺相比,超声波提取法通过破坏植物细胞膜,加快了溶剂向细胞内的扩散和有效成分的溶出,显著地提高了细胞物质的溶出速率,缩短了提取时间,有效地提高了提取率。近年来超声提取技术被广泛用于植物有效成分的提取研究 [13-17]。莲蓬壳一般于立夏后采摘,仅少量莲蓬壳作为民间香料使用,大部分被作为农业废弃物处理,不仅造成生物资源的浪费,同时也给环境带来严重的污染。本实验采用超声辅助提取技术优化莲蓬壳中总黄酮提取工艺,测定其提取液抗氧化能力和对人皮肤纤维细胞氧化应激损伤的保护作用。不仅为莲蓬壳总黄酮的高效提取开发探究新的途径,同时也为探究天然抗氧化剂提供一定的理论基础。
1.1 材料与试剂
莲蓬壳(江苏省金湖县,2013年9月),50 ℃烘干后,粉碎过80 目筛,得莲蓬壳粉末,置常温干燥处备用。
芦丁标准品、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、甲氮甲唑蓝(1-(4,5-dimethylthiazol-2-yl)-3,5-diphenylformazan,MTT)、2,6-二叔丁基对甲基苯酚(butylated hydroxytoluene,BHT)、叔丁基对苯二酚(tertbutylhydroquinone,TBHQ)、台盼蓝 美国Sigma公司;硝酸铝、氢氧化钠、亚硝酸钠、氯化铁、铁氰化钾、三氯乙酸、无水乙醇均为分析纯试剂;人皮肤成纤维细胞CCD-986Sk细胞 美国典型培养物保藏中心(ATCC);DMEM培养基、胎牛血清 美国Gibco公司。
1.2 仪器与设备
分析天平 北京赛多利斯仪器系统有限公司;Tecan infinite M200PRO酶标仪 瑞士Tecan公司;KQ-500B超声波清洗器 昆山市超声仪器有限公司;二氧化碳培养箱 日本Sanyo公司;倒置显微镜 日本Olympus公司。
1.3 方法
1.3.1 标准曲线的制作
准确称取芦丁标准品0.05 g,80%乙醇溶液溶解后定容至50 mL,得到1 mg/mL芦丁标准溶液。
参照Hossain等 [18]的方法,用80%乙醇溶液配制不同质量浓度的芦丁标准溶液(0.1、0.2、0.3、0.4、0.5 mg/mL),各吸取1 mL后加入5%亚硝酸钠溶液0.3 mL,摇匀,避光反应5 min,依次加入10%硝酸铝溶液0.3 mL,4%氢氧化钠溶液2 mL,混匀放置15 min后,在波长510 nm处测定其吸光度。以芦丁质量浓度为横坐标,吸光度为纵坐标,绘制芦丁标准曲线,标准方程Y= 0.003X-0.013 9,R 2=0.999 8。式中:Y为吸光度;X为黄酮质量浓度/(mg/mL)。
1.3.2 莲蓬壳总黄酮含量的测定
莲蓬壳提取物过滤后,取滤液1 mL,按照标准曲线的测定方法,在510 nm波长处测定吸光度。根据回归方程计算莲蓬壳中总黄酮提取率,如式(1)所示:
式中:ρ为总黄酮质量浓度/(mg/mL);V为提取液体积/mL;N为稀释倍数;M为莲蓬壳质量/g。
1.3.3 莲蓬壳总黄酮提取的单因素试验
分别以超声提取时间、提取温度、液料比、乙醇体积分数4 个单因素试验,考察各因素对总黄酮提取率的影响。
1.3.4 响应面分析法优化工艺条件
根据单因素试验结果,利用Design-Expert 7.0软件进行响应面分析,优化莲蓬壳总黄酮的提取工艺,试验因素与水平见表1。
表1 Box-Behnken试验因素和水平
Table 1 Factors and levels used in Box-Behnken design
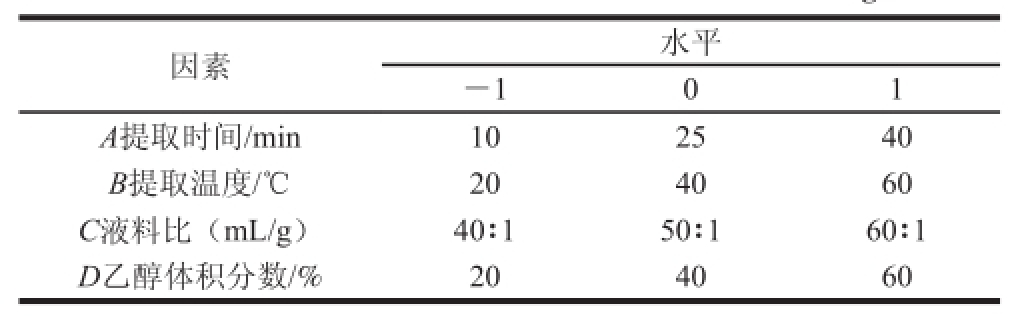
因素 水平-1 0 1 A提取时间/min 10 25 40 B提取温度/℃ 20 40 60 C液料比(mL/g) 40∶1 50∶1 60∶1 D乙醇体积分数/% 20 40 60
1.3.5 抗氧化能力测定
1.3.5.1 配制不同质量浓度莲蓬壳总黄酮溶液
准确称取1.000 g莲蓬壳粉末后用响应面法所得最佳工艺参数提取,滤液用旋转蒸发仪浓缩后定容至10 mL,将定容后的提取液配制成不同质量浓度的莲蓬壳总黄酮溶液。
1.3.5.2 莲蓬壳总黄酮清除DPPH自由基的测定 [19]
分别向板孔内加入100 μL不同质量浓度莲蓬壳提取液和100 μL 0.2 mmol/L的DPPH溶液,混匀后避光反应30 min,在波长517 nm处测定吸光度,重复3 次,取平均值,对DPPH自由基清除率计算如式(2)所示。

式中:A 1为DPPH溶液与待测液的吸光度之和;A 2为待测液与溶剂的吸光度之和;A 3为DPPH溶液与溶剂的吸光度之和。
1.3.5.3 Fe 3+还原能力测定 [19]
取0.2 mL不同质量浓度莲蓬壳提取液,加入0.5 mL 0.2 mol/L pH 6.6磷酸缓冲液和0.5 mL 1%铁氰化钾溶液,50 ℃条件下水浴30 min,然后加入0.5 mL 10%的三氯化铁溶液,离心,取上清液0.5 mL,加入0.5 mL蒸馏水和0.1 mL 0.1%氯化铁溶液,混合均匀,静置10 min。在波长700 nm处测定吸光度,重复3 次,取平均值。
1.3.5.4 CCD-986Sk细胞培养 [20]
CCD-986Sk细胞培养于含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养液(4.5 g/L D-葡萄糖、L-谷氨酰胺、110 mg/L丙酮酸钠)中,置于37 ℃、5% CO 2细胞培养箱中。待细胞生长至融合率达80%时,用1 mL 0.25%胰酶+0.02%乙二胺四乙酸消化2 min,按1∶4传代进行传代培养。
1.3.5.5 莲蓬壳总黄酮对细胞存活率的影响
取对数生长期细胞,调整细胞数至3×10 4个接种于96 孔板,培养16 h,用不同质量浓度的莲蓬壳总黄酮共培养。处理24 h后,吸取上清液,每个孔加入100 μL 的MTT工作液,于二氧化碳培养箱内培养4 h,加入100 μL MTT终止液,完全溶解后,在酶联免疫检测仪上于波长550 nm处测定各孔吸光度,计算细胞存活率。
1.3.5.6 莲蓬壳总黄酮对H 2O 2诱导细胞损伤的保护作用
取对数生长期细胞,调整细胞数至3×10 4个接种于96 孔板,培养16 h。分别设正常组(不加药物正常培养的细胞),莲蓬壳总黄酮预先处理组 (5、10、20、40 μg/mL),同时设空白对照组,每组设3 个复孔。样品处理0.5 h后,加入1 mmol/L H 2O 2,处理6 h后,吸取上清,用上述方法测定细胞存活率。
1.4 数据处理
所有实验均重复3次,各实验数据均以
 ±s表示,数据采用SPSS 19.0软件进行处理,不同字母表示组间比较差异显著(P<0.05)。
±s表示,数据采用SPSS 19.0软件进行处理,不同字母表示组间比较差异显著(P<0.05)。
2.1 单因素试验结果

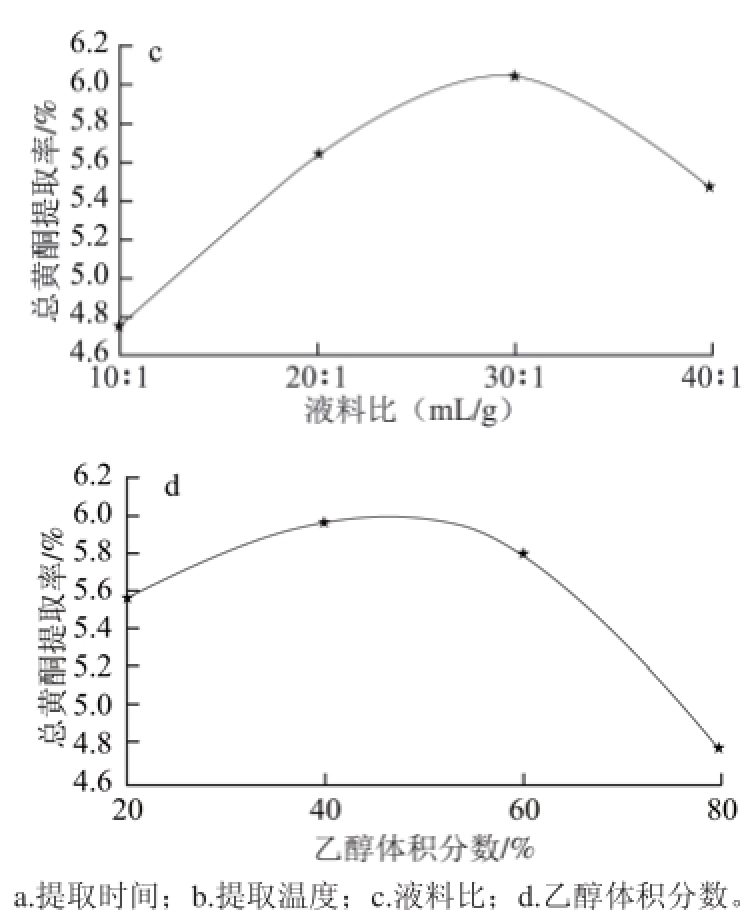
图 1 各单因素对莲蓬壳总黄酮提取率的影响
Fig.1 Effects of different extraction parameters on fl avonoid yield
由图1a可知,超声处理后,莲蓬壳总黄酮提取率随着提取时间的延长而升高,当提取时间超过40 min后,总黄酮提取率随着时间的延长反而呈下降趋势,可能是其他物质如蛋白质、糖类大量溶出影响了总黄酮的溶出率,故选择40 min作为总黄酮的最佳提取时间。由图1b可以看出,随着超声提取温度的升高,莲蓬壳总黄酮提取率总体趋势是升高,这是由于温度升高可以加快分子间运动速率,进而增大黄酮分子与乙醇水溶液的接触面积,使得黄酮化合物更易溶出。而当提取温度超过50 ℃,黄酮提取率略有下降,可能是由于莲蓬壳总黄酮中存在不稳定化合物,温度过高被氧化造成的,故选择50 ℃为最佳提取温度。由图1c可以看出,随着液料比的增大总黄酮提取率逐渐升高。这主要是由于溶剂中溶质浓度差逐渐在增大,使得黄酮溶解量也不断在升高。当液料比达到30∶1(mL/g)时,增大溶剂用量,黄酮提取率反而下降。从节约成本方面考虑,故选择料液比为30∶1(mL/g)。由图1d可以看出,随着乙醇体积分数的增大,总黄酮提取率也逐渐增大,当乙醇体积分数达到40%时,总黄酮提取率达到最大值。继续增大乙醇体积分数,总黄酮提取率反而呈下降趋势,可能因为随着乙醇体积分数的增大,一些醇溶性杂质溶出量也有所增加,使得黄酮浸出量受到影响,从而导致总黄酮提取率降低,故选择40%为最佳乙醇体积分数。
2.2 响应面试验结果
2.2.1 Box-Behnken试验设计及结果
采用Design-Expert 7.0软件,在单因素试验的基础上,以总黄酮提取率为响应值,根据Box-Behnken试验设计原理,设计四因素三水平响应面试验,试验设计及结果见表2。
表2 响应面试验设计及结果
Table 2 Response surface design with experimental results

试验号 A提取时间B提取温度 C液料比 D乙醇体积分数Y总黄酮提取率/% 1 -1 1 0 0 8.02 2 0 0 0 0 7.36 3 0 0 -1 1 6.36 4 1 0 1 0 7.27 5 0 1 0 1 6.36 6 0 -1 0 -1 5.74 7 -1 0 0 -1 6.12 8 0 1 0 -1 6.18 9 0 0 0 0 6.38 10 0 0 -1 -1 6.35 11 -1 0 -1 0 6.11 12 0 -1 1 0 7.31 13 1 0 0 -1 6.70 14 0 0 1 -1 5.68 15 0 1 -1 0 7.82 16 0 1 1 0 7.12 17 1 0 -1 0 7.16 18 -1 0 1 0 6.38 19 1 1 0 0 8.01 20 0 0 1 1 5.43 21 0 0 0 0 6.14 22 -1 0 0 1 6.47 23 0 0 0 0 5.56 24 1 -1 0 0 7.35 25 1 0 0 1 5.91 26 -1 -1 0 0 5.73 27 0 -1 -1 0 5.81 28 0 0 0 0 5.99 29 0 -1 0 1 5.15
2.2.2 回归模型的建立与显著性分析
表3 方差分析表
Table 3 Analysis of variance of regression equation
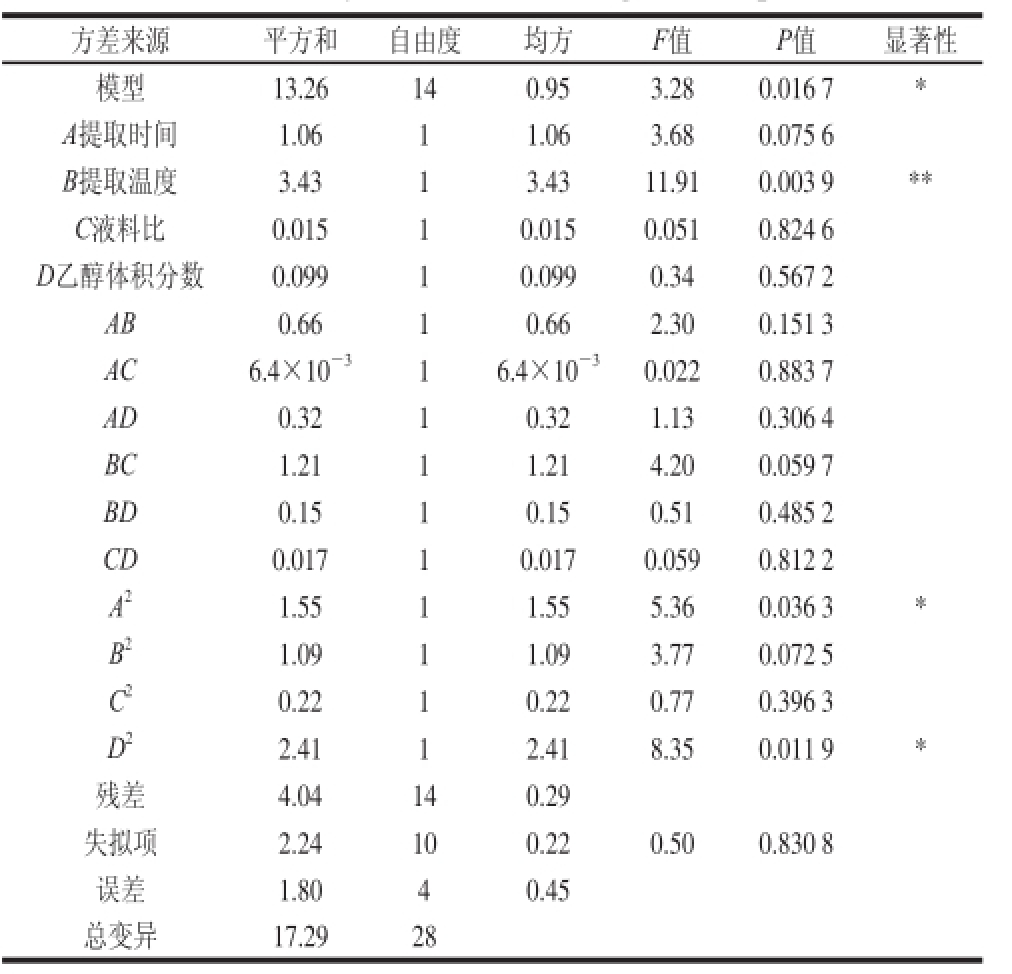
注:**. P<0.01,差异极显著;*. P<0.05,差异显著。
方差来源 平方和 自由度 均方 F值 P值 显著性模型 13.26 14 0.95 3.28 0.016 7 * A提取时间 1.06 1 1.06 3.68 0.075 6 B提取温度 3.43 1 3.43 11.91 0.003 9 ** C液料比 0.015 1 0.015 0.051 0.824 6 D乙醇体积分数 0.099 1 0.099 0.34 0.567 2 AB 0.66 1 0.66 2.30 0.151 3 AC 6.4×10 -3 1 6.4×10 -3 0.022 0.883 7 AD 0.32 1 0.32 1.13 0.306 4 BC 1.21 1 1.21 4.20 0.059 7 BD 0.15 1 0.15 0.51 0.485 2 CD 0.017 1 0.017 0.059 0.812 2 A 2 1.55 1 1.55 5.36 0.036 3 * B 2 1.09 1 1.09 3.77 0.072 5 C 2 0.22 1 0.22 0.77 0.396 3 D 2 2.41 1 2.41 8.35 0.011 9 *残差 4.04 14 0.29失拟项 2.24 10 0.22 0.50 0.830 8误差 1.80 4 0.45总变异 17.29 28
从方差分析表3可知,由试验数据所得模型的F值为3.28,P值为0.016 7,表示该模型显著。由模型拟合所得回归方程:Y=6.29+0.30A+0.53B-0.035C-0.091D-0.41AB-0.04AC-0.28AD-0.55BC+0.19BD-0.065CD+ 0.49A 2+0.41B 2+0.18C 2-0.61D 2。方程中显著项有一次项B,二次项A 2、D 2,交互项均不显著,且影响莲蓬壳总黄酮提取率的因素依次是:B>A>D>C。由此可知,各影响因素与响应值并不是简单的线性关系。方程的失拟度0.50,与绝对误差相比失拟度并不显著,说明该回归方程可以较好地描述各因素与响应值之间的真实关系,可以用其确定最佳提取工艺条件。
2.2.3 响应面分析与工艺优化
根据提取温度、乙醇体积分数、提取时间和液料比4 个因素及其交互作用对莲蓬壳总黄酮提取率的影响,绘制等高线图。根据等高线椭圆形状可反映出交互效应的强弱趋势,如果等高线呈椭圆形表示两因素交互作用显著,圆形则与之相反。任两个因素交互作用等高线见图2。
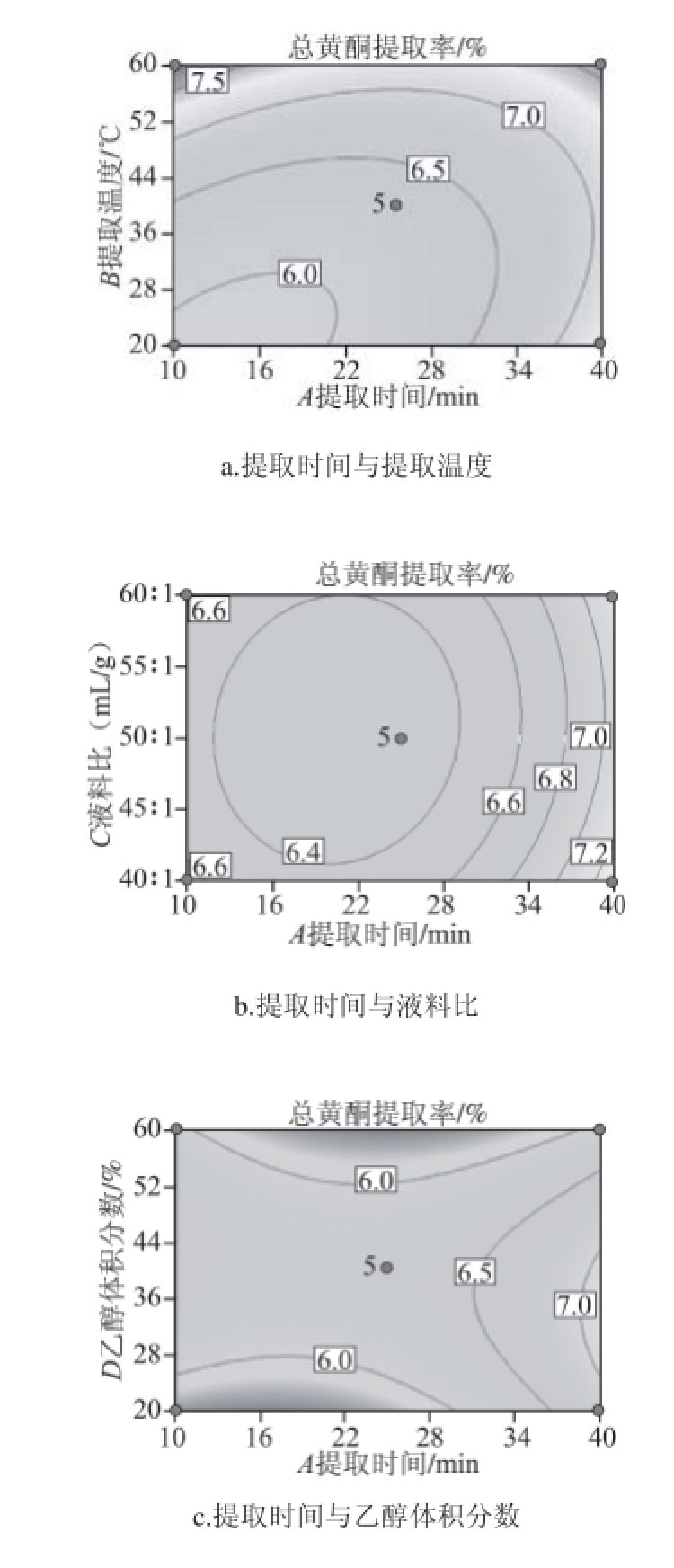
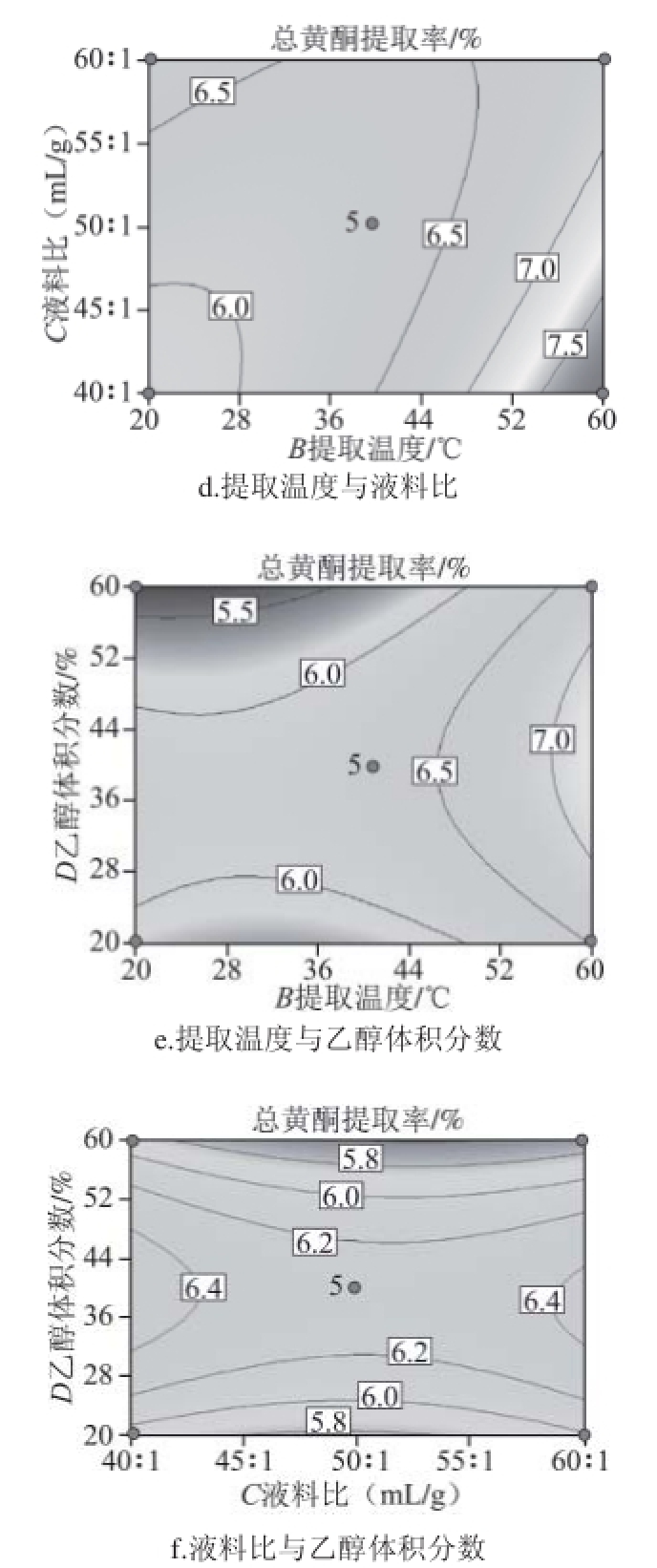
图 2 各交互作用对总黄酮提取率影响的等高线
Fig.2 Contour plots showing the effects of extraction conditions on fl avonoid yield
确定回归模型预测的最优提取工艺为:提取时间10 min、提取温度60 ℃、乙醇体积分数48%、液料比40∶1(mL/g),莲蓬壳总黄酮提取率理论值为8.64%。为检验该最优提取工艺的可靠性,进行验证实验,得到总黄酮的提取率为8.32%。莲蓬壳总黄酮提取率的验证值与理论值较接近,因此认为利用响应面法优化莲蓬壳总黄酮的提取工艺有效可行。
2.3 莲蓬壳提取物抗氧化作用
2.3.1 莲蓬壳提取物对DPPH自由基清除能力
DPPH自由基是一种稳定的以氮为中心的自由基,当存在抗氧化物质时,其孤电子被配对,吸收消失或减弱,导致深紫色溶液颜色变浅,在5l7 nm波长处的吸光度变小。DPPH法测定简便易行,灵敏可靠,重现性好,被广泛用于评价天然产物的自由基清除活性 [21-23]。由图3可知,莲蓬壳清除DPPH自由基能力随着质量浓度的升高也逐步增强,它们的自由基消除能力大小依次为VC>莲蓬壳总黄酮>BHT。
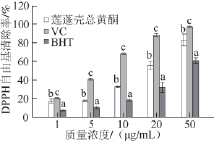
同一质量浓度不同字母表示差异显著(P<0.05)。图4同。
图3 莲蓬壳总黄酮对DPPH自由基消除能力
Fig.3 DPPH free radical-scavenging activity of fl avonoids from lotus receptacle
2.3.2 莲蓬壳提取物还原能力
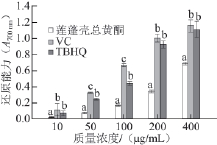
图 4 莲蓬壳总黄酮FFee
33++还原能力
Fig.4 Reducing power of fl avonoids from lotus receptacle
还原力是评价物质抗氧化活性的重要指标,该方法的机理是抗氧化剂将Fe 3+还原成Fe 2+的形式,从而中断自由基的链式反应。还原能力的大小可以通过在波长700 nm处的吸光度来检测,吸光度越大还原力越大,抗氧化能力越强 [24-25]。由图4可知,莲蓬壳总黄酮、VC和TBHQ均具有一定的还原力,还原力随着体系质量浓度的增大而增强,且呈明显的量效关系。
2.3.3 莲蓬壳提取物对CCD-986sk细胞氧化损伤保护作用

字母不同表示差异显著(P<0.05)。图6同。
图 5 莲蓬壳总黄酮对CCD-986sk细胞存活率的影响
Fig.5 Cytotoxicity activity of fl avonoids from lotus receptacle on CCD-986sk cells
如图5所示,与正常组相比,加入多不同质量浓度的莲蓬壳总黄酮的各组中细胞存活率分别为:(98.56±9.57)%、(96.32±8.62)%、(97.53±16.43)%、(94.37±17.32)%。经统计学分析,组间差异没有统计学意义,在实验质量浓度范围内,莲蓬壳总黄酮对细胞的毒性作用不会影响其对H 2O 2诱导的皮肤纤维细胞损伤的保护作用研究。

图6 莲蓬壳总黄酮HH
2O
2引起CCD-986sk细胞毒性保护作用
Fig.6 Cytoprotective activity of fl avonoids from lotus receptacle on H
2O
2induced CCD-986sk cell injury
如图6所示,与对照组比较,模型细胞存活率显著降低。说明模型组CCD-986sk细胞经过1 mmol/L H 2O 2作用6 h后,细胞损伤明显,活力显著降低。由图6可以看出,莲蓬壳总黄酮质量浓度5 μg/mL时,对H 2O 2造成的氧化损伤并无保护作用,而当莲蓬壳总黄酮质量浓度不小于10 μg/mL,则表现出明显的保护作用。
结果表明,选择提取时间10 min、提取温度60 ℃、乙醇体积分数48%、液料比40∶1(mL/g),莲蓬壳总黄酮提取率可达8.32%。该提取物能清除DPPH自由基能力与还原力均随质量浓度增加而增强,同时可显著抑制H 2O 2诱导的人皮肤纤维细胞氧化应激损伤,是一种极具开发潜力的天然抗氧化剂。下一步的研究工作将对提取物进一步的分离、纯化和鉴定,探讨发挥抗氧化活性的主要单体成分。
参考文献:
1] 曹杨, 徐虹, 王静, 等. 莲天然产物及其生物活性研究[J]. 食品工业科技, 2012, 33(8): 402-405.
2] 凌智群, 谢笔钧. 莲房原花青素对氧自由基和脂质过氧化的作用[J].营养学报, 2002, 24(2): 121-125.
3] 陈超群, 吴春艳, 刘霞, 等. 莲房中原花青素的药理作用研究进展[J].中成药, 2014, 36(8): 1734-1738.
4] 廖立, 舒展, 李笑然, 等. 莲类药材的化学成分和药理作用研究进展[J].上海中医药杂志, 2010, 44(12): 82-84.
5] 禹华娟, 孙智达, 谢笔钧. 酶辅助提取莲房原花青素工艺及其抗氧化活性研究[J]. 天然产物研究与开发, 2010, 22(1): 154-158.
6] 汪志慧, 孙智达, 谢笔钧. 响应曲面法优化双酶法提取莲房原花青素[J]. 食品科学, 2011, 32(4): 64-68.
[7] KIM J M, SHIN S H. Antioxidative effects of lotus seed and seedpod extracts[J]. Food Science and Biotechnology, 2012, 21(6): 1761-1766.
[8] DUAN Yuqing, ZHANG Haihui, XU Feifei, et al. Inhibition effect of procyanidins from lotus seedpod on mouse B 16melanoma in vivo and in vitro[J]. Food Chemistry, 2010, 122: 84-91.
[9] XU Jiqu, RONG Shuang, XIE Bijun, et al. Procyanidins extracted from the lotus seedpod ameliorate scopolamine-induced memory impairment in mice[J]. Phytotherapy Research, 2009, 23: 1742-1747.
[10] XIAO Juan, SUI Yong, LI Shuyi, et al. Combination of proanthocyanidins extracted from lotus seedpod and L-cysteine ameliorates memory impairment induced by alcohol and scopolamine in mice[J]. European Food Research Technology, 2013, 236: 671-679.
[11] 陈红梅, 谢翎. 莲房黄酮微波辅助提取工艺优化及其抗氧化性能[J].食品工业科技, 2013, 34(4): 224-228.
[12] 郑丽鋆, 吴岩斌, 王亚贤, 等. 莲房多酚的超声提取工艺研究[J]. 福建中医药大学学报, 2011, 21(3): 39-41.
[13] 张堃, 张双灵, 张忍. 超声波辅助提取荷叶和槐米黄酮的工艺研究[J].现代食品科技, 2013, 29(3): 583-587.
[14] 吕萍, 李茜, 薛波, 等. 超声波辅助提取燕竹笋壳中多酚的工艺优化[J].现代食品科技, 2012, 28(12): 1734-1738.
[15] 王振伟, 申森, 胡晓冰. 刺梨中黄酮的超声提取及HPLC测定[J]. 湖北农业科学, 2014, 53(19): 4684-4687.
[16] 宋宏新, 邢红香, 李楠. 超声提取贯叶连翘中总黄酮和金丝桃素的工艺研究[J]. 陕西科技大学学报: 自然科学版, 2014, 32(1): 119-147. [17] 杨凤杰, 沈素媚, 冯文婕. 响应面法优化超声提取食药用猴头菇多糖的工艺研究[J]. 山东化工, 2015, 44(8): 22-27.
[18] HOSSAIN M A, KALBANI M S A, FARSI S A J A, et al. Comparative study of total phenolics, flavonoids contents and evaluation of antioxidant and antimicrobial activities of different polarities fruits crude extracts of Datura metel L[J]. Asian Pacific Journal of Tropical Disease, 2014, 4(5): 378-383.
[19] SI Chuanling, SHEN Ting, JIANG Yunyao, et al. Antioxidant properties and neuroprotective effects of isocampneoside Ⅱ on hydrogen peroxide-induced oxidative injury in PC12 cells[J]. Food and Chemical Toxicology, 2013, 59: 145-152.
[20] HU Weicheng, HAN W, HUANG Chaoqing. Protective effect of the methanolic extract from Duchesnea indica against oxidative stress in vitro and in vivo[J]. Environmental Toxicology and Pharmacology,2011, 31: 42-50.
[21] 曾维才, 石碧. 天然产物抗氧化活性的常见评价方法[J]. 化工进展,2013, 32(6): 1205-1213.
[22] HU Weicheng, HUANG Chaoqing, WANG M H. Chemical composition, nutritional value, and antioxidant constituents of Kalopanax pictus leaves[J]. Food Chemistry, 2012, 131(2): 449-455.
[23] ZHANG Yulin, SHEN Yixiao, ZHU Yongchao. Assessment of the correlations between reducing power, scavenging DPPH activity and anti-lipid-oxidation capability of phenolic antioxidants[J]. LWT-Food Science and Technology, 2015, 63(1): 569-574.
[24] 万利秀, 肖更生, 徐玉娟, 等. 柑橘皮黄酮纯化前后抗氧化性比较研究[J]. 食品科学, 2011, 32(5): 87-91.
[25] SHAHWARA D, RAZA M A, BUKHARI S, et al. Ferric reducing antioxidant power of essential oils extracted from Eucalyptus and Curcuma species[J]. Food Chemistry, 2012, 131(2): 449-455.
Optimization of the Extraction Process for Flavonoids from Lotus (Nelumbo nucifera Gaertn.) Receptacle and Their Antioxidant Activities
HU Weicheng
1, WANG Xinfeng
1, SHEN Ting
1, WANG Yuning
2, CHEN Ming
1, YOU Long
1, JI Lilian
1,*, LI Pengxia
2,*
(1. Jiangsu Key Laboratory for Eco-Agricultural Biotechnology around Hongze Lake, Jiangsu Collaborative Innovation Center of Regional
Modern Agriculture & Environmental Protection, Huaiyin Normal University, School of Life Science, Huaiyin Normal University,Huai'an 223300, China; 2. Institute of Agro-product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Key words:response surface methodology; lotus receptacle; total fl avnoids; ultrasound-assisted extraction; free radicals
中图分类号:Q501
文献标志码:A
文章编号:1002-6630(2015)24-0051-06
doi:10.7506/spkx1002-6630-201524009
收稿日期:2015-05-17
基金项目:江苏省农业科技自主创新资金项目(CX(13)3079)
作者简介:胡卫成(1984—),男,副教授,博士,研究方向为食品分子营养学 。E-mail:hu_weicheng@163.com
*通信作者:纪丽莲(1965—),女,教授,博士,研究方向为微生物与生化药学。 E-mail:jll2663@sina.com
李鹏霞(1976—),女,研究员,博士,研究方向为果蔬保鲜与加工。E-mail:lpx213@126.com