
图 1 流动注射测定抗坏血酸实验装置示意图
Fig.1 Schematic diagram of the fl ow injection system for the determination of AA
石文兵,贺 薇
*,万帮江
(无机特种功能材料重庆市重点实验室,长江师范学院化学化工学院,重庆 408100)
摘 要:基于抗坏血酸抑制纳米二氧化铈-过氧化氢-鲁米诺体系的发光强度,建立流动注射化学发光法检测抗坏血酸含量的新方法。考察过氧化氢浓度、鲁米诺浓度、纳米二氧化铈质量浓度及pH值对发光强度的影响。在优化条件下,该方法对抗坏血酸检测的线性范围为0.001~1.0 μg/mL(r = 0.983 1),检出限(3 σ)为0.2 ng/mL,对质量浓度为1.0 μg/mL的抗坏血酸进行11 次平行测定,相对标准偏差为2.9%。该法已成功用于水果、果汁和蔬菜中抗坏血酸含量的测定,方法简单、灵敏、快速。
关键词:纳米二氧化铈;化学发光;抗坏血酸
抗坏血酸又称VC,是一种水溶性好的抗氧化剂,在氧化还原代谢反应中起调节作用,缺乏抗坏血酸可引起坏血病。然而,抗坏血酸不能在体内合成,人体的摄入主要来源于蔬菜、水果等天然食物中。其主要作用是提高免疫力,预防癌症、心脏病、中风,保护牙齿和牙龈等。另外,坚持按时服用抗坏血酸还可以使皮肤黑色素沉着减少,从而减少黑斑和雀斑,使皮肤白皙。鉴于其独特的营养和临床价值,准确测定食物中抗坏血酸的含量,对饮食健康、医疗保健都具有十分重要意义。
抗坏血酸常见的分析方法有高锰酸钾滴定法 [1]、分光光度法 [2-3]、比色法 [4]、高效液相色谱法 [5-8]、电化学法 [9-14]、磷光法 [15]、荧光法 [16-17]、表面增强共振拉曼散射法 [18]等。化学发光具有线性范围宽、灵敏度高、仪器设备简单的优点,已被用于抗坏血酸的分析。如基于抗坏血酸抑制鲁米诺-高碘酸-过氧化氢体系的化学发光构建了其化学发光分析法,该法具有较高的灵敏度(60 nmol/L) [19];Chen Hui等 [20]利用抗坏血酸抑制过氧化氢-碳酸氢钠-CdSe/CdS量子点发光体系,建立了分析抗坏血酸的分析方法(灵敏度为67 nmol/L)。本实验合成了一种水溶性好的纳米二氧化铈,将其催化鲁米诺-过氧化氢发光体系,基于抗坏血酸抑制该发光体系的发光强度,构建了一种化学发光分析法。与其他化学发光分析法相比,该法具有更高的灵敏度,已成功应用于水果、果汁和蔬菜中抗坏血酸含量的测定。
1.1 材料与试剂
市购枣子、猕猴桃、芒果、青椒、苦瓜、土豆、水溶C100、农夫果园和统一鲜橙多,以上水果和蔬菜洗净晾干备用。
过氧化氢 重庆东方试剂厂;浓氨水(30%)重庆川东化工集团有限公司试剂厂;六水硝酸铈、抗坏血酸 国药集团化学试剂有限公司;聚丙烯酸 上海晶纯试剂有限公司;其他试剂均为分析纯,实验用水为去离子超纯水。
鲁米诺储备液:准确称取1.772 g鲁米诺,用1.0 mmol/L NaOH溶液溶解并定容至1 000 mL即得0.01 mol/L储备液,需用时取适量用0.8 mol/L碳酸钠溶液稀释至所需质量浓度;纳米二氧化铈:其合成和表征参照前期工作 [21],需用时用水稀释2.633 g/L纳米二氧化铈储备液至所需质量浓度。
1.2 仪器与设备
RFL-1型超微弱化学发光/生物发光检测仪 西安瑞迈电子科技有限公司;TPS-7000型ICP单道扫描光谱仪北京普析通用仪器有限责任公司;Tensor27型红外光谱仪 德国Bruker公司;85-2型恒温磁力搅拌器 上海司乐仪器有限公司;800型离心沉淀器 上海手术机械厂;蠕动泵(15 r/min,30 r/min) 上海仪表电机厂;流动注射系统各部件利用聚四氟乙烯管(内径0.8 mm)连接;ICP单道扫描光谱仪;红外光谱仪。
1.3 方法
1.3.1 流路

图 1 流动注射测定抗坏血酸实验装置示意图
Fig.1 Schematic diagram of the fl ow injection system for the determination of AA
按图1所示流路,在蠕动泵的推动下,载流(超纯水)将样品(抗坏血酸)带到T(三通)点与鲁米诺-过氧化氢-纳米二氧化铈溶液汇合,混合后进入反应盘管F抑制鲁米诺-过氧化氢-纳米二氧化铈发光体系的化学发光强度,实验参数由RFL-1型超微弱化学发光/生物发光检测仪设定。
1.3.2 标准曲线的绘制
准确移取一定量的抗坏血酸标准储备液100 μg/mL于一系列5 mL比色管中,用去离子水稀释至刻度配制成0.001~1.0 μg/mL的系列抗坏血酸标准溶液。按图1装好流路,开启蠕动,待基线稳定后测定,以峰高定量。
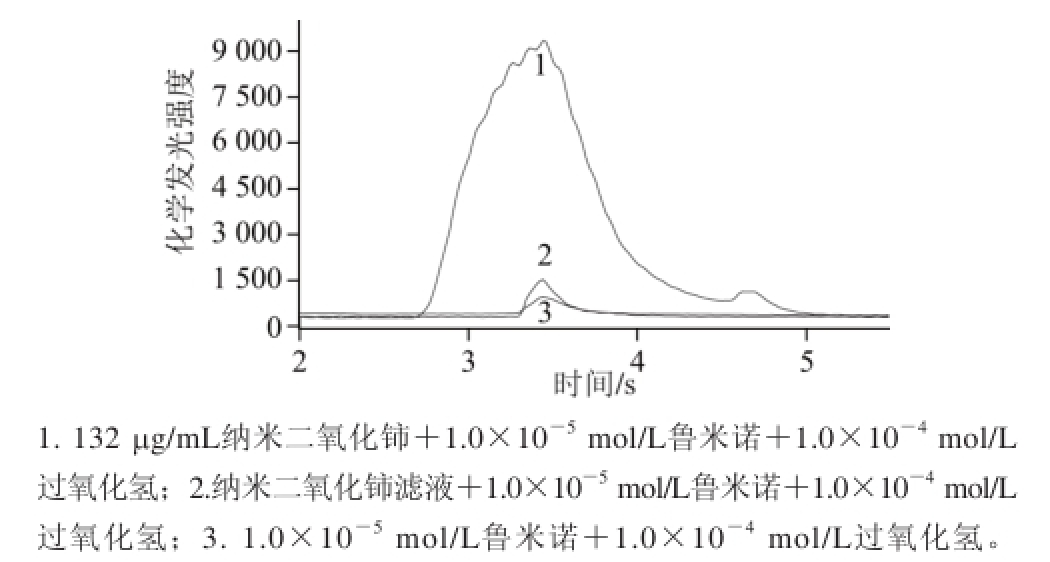
图 2 纳米二氧化铈对鲁米诺-过氧化氢发光体系的影响
Fig.2 Effect of nano-ceria on the chemiluminescence intensity of luminol-H
2O
2system
2.1 纳米二氧化铈对过氧化氢-鲁米诺发光体系的增敏作用考察加入纳米二氧化铈前后过氧化氢-鲁米诺发光体系的发光强度变化,结果如图2所示,加入纳米二氧化铈之后,鲁米诺-过氧化氢体系的发光强度得到极大增强(图2中线1)。为验证此增敏效果非游离的Ce 3+
所致,用0.5 mol/L的盐酸使纳米二氧化铈沉淀下来,于
15 000 r/min高速离心后,离心液用Na 2CO 3调至中性,将其作为催化剂,在相同的实验条件(与未处理的纳米二氧化铈溶液相同)下测定其催化性能。结果表明(图2中线2),该滤液的催化效果与纳米二氧化铈相比可以忽略不记,说明催化效果来源于纳米二氧化铈。
2.2 抗坏血酸对纳米二氧化铈-过氧化氢-鲁米诺发光体系的抑制作用
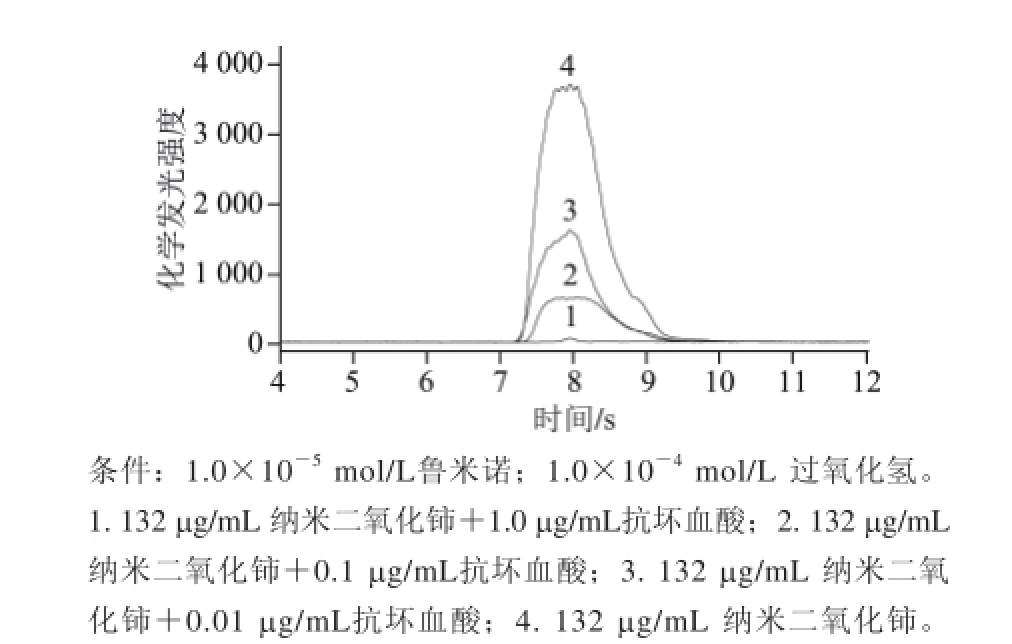
图 3 抗坏血酸对纳米二氧化铈-过氧化氢-鲁米诺发光体系的影响Fig.3 Effect of AA concentration on the chemiluminescence intensity of nano-ceria-luminol-H 2O 2system
为考察抗坏血酸对该发光体系的影响,选择3 个抗坏血酸质量浓度0.01、0.1 μg/mL和1.0 μg/mL,实验结果(图3)表明,抗坏血酸能够有效地抑制该发光体系,而且随着抗坏血酸质量浓度的增高,化学发光强度降低越强,当抗坏血酸质量浓度降低到0.01 μg/mL仍有显著的抑制效果,这使得该法在检测抗坏血酸时可获得极高的灵敏度。
2.3 其他发光条件对发光强度的影响
鲁米诺浓度、过氧化氢浓度和纳米二氧化铈质量浓度对该体系的影响尤为显著,详细考察了以上条件对发光强度的影响。在鲁米诺1.0×10 -6~5. 0×10 -4mol/L范围内,发光强度随着鲁米诺浓度的增加而增强,当鲁米诺浓度达到1.0×10 -5mol/L时,发光强度增加趋势缓慢,为节省试剂,在实验选择鲁米诺的浓度为1.0×10 -5mol/L。当过氧化氢浓度小于1.0×10 -4mol/L时,发光强度随过氧化氢浓度的升高而升高,然而当过氧化氢浓度超过该浓度时化学发光信号反而降低,故本实验选择过氧化氢最佳浓度为1.0×10 -4mol/L。纳米二氧化铈为本实验的催化剂,其质量浓度的大小直接影响着发光强度的影响。考察了5.3~1 316.5 μg/mL质量浓度范围内纳米二氧化铈对发光强度的影响,实验发现,当其质量浓度为132 μg/mL时发光信号达最大值,故选择为最佳质量浓度。
2.4 线性范围与检出限
在上述优化试验条件下,在0.001~1.0 μg/mL (0.005 7~5.7 μmol/L)范围内抗坏血酸质量浓度与化学发光强度呈良好的线性关系,lgΔI = 0.516lgc+4.029 1 (r = 0.983 1)(n=9)(ΔI为化学发光强度;c为抗坏血酸质量浓度/(μg/mL);r为相关系数)。根据IUPAC的建议算出的检出限(3σ)为0.2 ng/mL(1.4 nmol/L),对质量浓度为1.0 μg/mL的抗坏血酸平行测定11次,相对标准偏差为2.9%。与其他化学发光方法相比(表1),本方法具有更宽的线性范围和更高的灵敏度。
表1 本法与其他化学发光法对抗坏血酸的响应特性比较
TTable 1 Comparison of response to AA between the developed methodand other chemiluminescence methods

测定抗坏血酸(发光体系) 线性范围/(μmol/L) 检出限/(nmol/L) 文献过氧化氢-碳酸氢钠-CdSe/CdS量子点-抗坏血酸 0.1~100 6.7 [20]鲁米诺-K 3[Fe(CN) 3-抗坏血酸 3.0~600 1 300 [22]可溶性锰(IV)甲醛-抗坏血酸 0.06~20 20 [23]高锰酸钾-抗坏血酸 0.28~57 28 [24]铈(VI)-过氧化氢-鲁米诺-抗坏血酸 0.008~160 8.0 [25]过氧化氢-鲁米诺-KIO 4-抗坏血酸 0.1~10 60 [26]鲁米诺-铁氰化钾-抗坏血酸 0.057~4.56 31 [27]本法 0.005 7~5.7 1.4
2.5 干扰实验结果
在选定的最佳实验条件下,对1.0 μg/mL抗坏血酸进行干扰实验,相对误差在5.0%以内,从表2可以看出,常见的无机离子和有机物不干扰其测定,本法对检测抗坏血酸具有良好的选择性。2.6 实际样品检测结果
表2 干扰实验结果
Table 2 Results of interference experiments

干扰物 倍数 干扰度/% 干扰物 倍数 干扰度/% 干扰物 倍数 干扰度/%柠檬酸 1 000 4.36 H 2PO 4 - 1 000 1.98 Zn 2+ 1 000 0.46乳糖 1 000 -2.22 NO 3 - 1 000 -0.52 Mg 2+ 1 000 1.56葡萄糖 1 000 -1.28 SO 4 2- 1 000 0.46 Ni 2+ 100 0.88草酸 1 000 -1.46 CO 3 2- 1 000 -3.29 Pb 2+ 50 -1.24乳酸 100 -2.91 PO 4 3- 50 -0.68 Cd 2+ 100 -3.03淀粉 800 -5.72 Ca 2+ 50 -1.41 Cr 3+ 10 3.12水杨酸 80 -4.05 Na + 1 000 0.78 EDTA 500 -2.44 Cl - 1 000 0.76 K + 1 000 -0.56 NH 4 + 500 0.07 HPO 4 2- 1 000 0.16 Al 3+ 1 000 -0.52
果汁样品的分析:选取3 种不同品牌的果汁,准确移取一定体积的原果汁,将其稀释10 倍后用截留分子质量为500 D的超滤管于4 000 r/min条件下超滤,取滤液再稀释1 000 倍后按标准曲线方法测定,同时与碘滴定法作比较,结果见表3,两种测定方法的结果相当吻合。
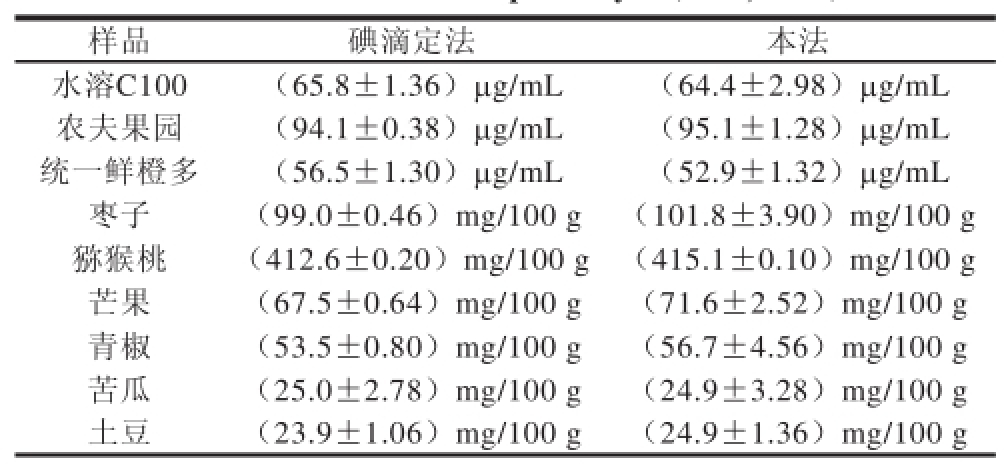
表3 样品测定结果(
 ±s,n == 33)
±s,n == 33)
Table 3 Results of sample analysis
 ± ss, n == 33)
± ss, n == 33)
蔬菜和水果样品的分析:分别选取3 种不同蔬菜和水果,将果蔬样品洗净,用纱布拭干其外部所附着的水分。对于水果,先纵切为4~8等分,取其20~30 g为一份,除去不能食用部分,切碎。对于叶菜,沿中脉切分为二分,取其一分切碎。称取20 g作分析用。将称取的样品放研钵中,加5~10 mL去离子水,研磨至呈浆状。小心无损地移研钵中样品于100 mL容量瓶中,研钵用去离子水洗净后,亦倒入量瓶中,并加去离子水至100 mL,充分混合。用清洁干燥二层纱布过滤入干燥的烧杯中,再用截留分子质量为500 D的超滤管于4 000 r/min转速下超滤,取滤液稀释1 000 倍后按标准曲线方法测定,同时与碘滴定法作比较,结果见表3,两种测定方法的结果相当吻合。
本实验基于抗坏血酸抑制纳米二氧化铈-鲁米诺-过氧化氢发光体系的原理构建了抗坏血酸的化学发光分析法。该法线性范围宽、灵敏度高、仪器设备简单及操作简便,可成功用于测定水果、果汁和蔬菜中抗坏血酸,其结果与标准方法相当吻合。
3
参考文献:
[1] 王建国, 王瑞斌. 高锰酸钾滴定法快速测定蔬菜中抗坏血酸含量[J].食品科学, 2008, 29(10): 471-473.
[2] 刘瑛, 田志壮, 朱逸雯, 等. 阻抑动力学分光光度法快速测定保健品中的维生素C[J]. 食品科学, 2011, 32(12): 251-253.
[3] KUKOC-MODUN L, BIOCIC M, RADIC N. Indirect method for spectrophotometric determination of ascorbic acid in pharmaceutical preparations with 2,4,6-tripyridyl-S-triazine by flow-injection analysis[J]. Talanta, 2012, 96: 174-179.
[4] RASTEGARZADEH S, ABDALI S. Colorimetric determination of thiram based on formation of gold nanoparticles using ascorbic acid[J]. Talanta, 2013, 104: 22-26.
[5] 张清, 李刚. RP-HPLC法测定功能性饮料水溶性维生素含量[J]. 食品科学, 2010, 31(14): 212-215.
[6] KHAN A, KHAN M I, IQBAL Z, et al. A new HPLC method for the simultaneous determination of ascorbic acid and aminothiols in human plasma and erythrocytes using electrochemical detection[J]. Talanta,2011, 84(3): 789-801.
[7] GARNERO C, LONGHI M. Development of HPLC and UV spectrophotometric methods for the determination of ascorbic acid using hydroxypropyl-beta-cyclodextrin and triethanolamine as photostabilizing agents[J]. Analytica Chimica Acta, 2010, 659(1/2): 159-166.
[8] BARROS A, SILVA A P, GONCALVES B, et al. A fast, simple, and reliable hydrophilic interaction liquid chromatography method for the determination of ascorbic and isoascorbic acids[J]. Analytical and Bioanalytical Chemistry, 2010, 396(5): 1863-1875.
[9] 孙登明, 田相星, 马伟. 银掺杂聚L-酪氨酸修饰电极同时测定多巴胺、肾上腺素和抗坏血酸[J]. 分析化学, 2011, 38(12): 1742-1746.
[10] PING Jianfeng, WANG Yixian, WU Jian, et al. Determination of ascorbic acid levels in food samples by using an ionic liquid-carbon nanotube composite electrode[J]. Food Chemistry, 2012, 135(2): 362-367.
[11] SHENG Z H, ZHENG X Q, XU J Y, et al. Electrochemical sensor based on nitrogen doped graphene: simultaneous determination of ascorbic acid, dopamine and uric acid[J]. Biosensors and Bioelectronics, 2012, 34(1): 125-131.
[12] YUE Yun, HU Guangzhi, ZHENG Mingbo, et al. A mesoporous carbon nanofiber-modified pyrolytic graphite electrode used for the simultaneous determination of dopamine, uric acid, and ascorbic acid[J]. Carbon, 2012, 50(1): 107-114.
[13] LI Shinming, YANG Shinyi, WANG Yusheng, et al. Controllable synthesis of nitrogen-doped graphene and its effect on the simultaneous electrochemical determination of ascorbic acid, dopamine, and uric acid[J]. Carbon, 2013, 59: 418-429.
[14] DU Jiao, YUE Ruirui, REN Fangfang, et al. Novel graphene fl owers modified carbon fibers for simultaneous determination of ascorbic acid, dopamine and uric acid[J]. Biosensors and Bioelectronics, 2014,53: 220-224.
[15] BIAN Wei, MA Jing, GUO Wenrong, et al. Phosphorescence detection of L-ascorbic acid with surface-attached N-acetyl-L-cysteine and L-cysteine Mn doped ZnS quantum dots[J]. Talanta,2013, 116: 794-800.
[16] LIU Siyu, HU Junjie, SU Xingguang. Detection of ascorbic acid and folic acid based on water-soluble CuInS 2quantum dots[J]. Analyst,2012, 137(19): 4598-4604.
[17] ZHAO Yirong, LI Yinhui, WANG Yijun, et al. A new strategy for fl uorometric detection of ascorbic acid based on hydrolysis and redox reaction[J]. Rsc Advances, 2014, 4(66): 35112-35115.
[18] KAYAT M, VOLKAN M. New approach for the surface enhanced resonance raman scattering (SERRS) detection of dopamine at picomolar (pM) levels in the presence of ascorbic acid[J]. Analytical Chemistry, 2012, 84(18): 7729-7735.
[19] 李峰. 流动注射化学发光抑制法测定抗坏血酸[J]. 分析化学, 2000,28(12): 1523-1526.
[20] CHEN Hui, LI Ruibo, LIN Ling, et al. Determination of L-ascorbic acid in human serum by chemiluminescence based on hydrogen peroxide-sodium hydrogen carbonate-CdSe/CdS quantum dots system[J]. Talanta, 2010, 81(4/5): 1688-1696.
[21] 石文兵, 刘希东, 张小丹, 等. 二氧化铈纳米微粒过氧化物酶活性及其在葡萄糖检测中的应用[J]. 中国科学: 化学, 2014, 44(10): 1633-1640.
[22] ZHAO Shulin, HUANG Yong, LIU Yiming. Microchip electrophoresis with chemiluminescence detection for assaying ascorbic acid and amino acids in single cells[J]. Journal of Chromatography A, 2009, 39: 6746-6751.
[23] ZHU Xinghua, HE Yunhua, LIU Mei, et al. Chemiluminescence determination of trace ascorbic acid with soluble manganese(Ⅳ)-formaldehyde system[J]. Chinese Journal of Analytical Chemistry, 2004, 32(6): 752-754.
[24] HUANG Yuming, ZHANG Zhujun. Chemiluminescence fl ow-through sensor for the determination of ascorbic acid with an immobilized reagent[J]. Analytical Letters, 2003, 36(13): 2783-2792.
[25] LI Feng, ZHU Guoyi. Chemiluminescence determination of trace ascorbic acid with chromium (Ⅵ)-H 2O 2-luminol system[J]. Chinese Journal of Analytical Chemistry, 2002, 30(5): 580-582.
[26] ZHOU Yanxiu, NAGAOKA T, LI Feng, et al. Evaluation of luminol-H 2O 2-KIO 4chemiluminescence system and its application to hydrogen peroxide, glucose and ascorbic acid assays[J]. Talanta, 1999, 48(2): 461-467.
[27] ZHANG Zhujun, QIN Wei. Chemiluminescence flow sensor for the determination of ascorbic acid with immobilized reagents[J]. Talanta, 1996, 43(1): 119-124.
SHI Wenbing, HE Wei *, WANG Bangjiang
(Chongqing Key Laboratory of Inorganic Special Functional Materials, College of Chemistry and Chemical Engineering,Yangtze Normal University, Chongqing 408100, China)
Abstract:A new fl ow injection chemiluminescence (CL) method based on the inhibition of ascorbic acid on nano-ceria-H 2O 2-luminol CL system has been developed for the determination of ascorbic acid (AA). The effects of concentrations of H 2O 2, luminol and nano-ceria, and pH on CL intensity were investigated respectively. Under the optimum conditions, the linear range of the method was 0.001-1.0 μg/mL (r = 0.983 1), and the detection limit (3σ) was 0.2 ng/mL. The relative standard deviation (RSD) for 11 repetitive determinations of 1.0 μg/mL AA was 2.9%. The method is simple, sensitive and fast and has been successfully applied to determine ascorbic acid in fruits, juices and vegetables.
Key words:nano-ceria; chemiluminescence; ascorbic acid
中图分类号:O657.39
文献标志码:A
文章编号:1002-6630(2015)24-0112-04
doi:10.7506/spkx1002-6630-201524019
收稿日期:2015-01-11
基金项目:国家自然科学基金面上项目(21275021);重庆市教委科学研究项目(KJ1401201;KJ1401220);长江师范学院青年科研人才成长支持计划项目
作者简介:石文兵(1976—),男,副教授,博士,主要从事化学发光分析研究。E-mail:swb02182001@126.com
*通信作者:贺薇(1983—),女,讲师,硕士,主要从事化学发光及光散射分析研究。E-mail:heweiyznu@163.com