
图1 不同pH值对CML峰形的影响
Fig.1 Effects of pH on CML peak shape
贾寒冰,申明月,谢俊华,刘玲玲,聂少平*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:采用高效液相色谱-三重四极杆质谱联用技术建立了一种操作简单、稳定性好的检测中式菜肴糖醋排骨中羧甲基赖氨酸(N ε-(carboxymethyl)lysine,CML)的方法。样品用正己烷去脂肪,硼氢化钠还原,盐酸水解蛋白,Oasis MCX固相萃取小柱净化。以5 mmol/L的乙酸铵溶液和甲醇-水(80∶20,V/V)溶液作为流动相,采用
Phenomenex Synergi 4 μ Hydro-RP 80A色谱柱,在正离子模式下采用多重反应监测分析,同位 素内标法定量。该方法检出限为1.40 μg/g,加标回收率为90.94%~105.26%,相对标准偏差为5.80%~15.46%。采用该分析方法对中式菜肴糖醋排骨加工过程中CML的含量变化进行分析,结果表明,加工温度和加热时间以及糖和油脂的添加均可以显著影响糖醋排骨中CML 的含量。
关键词:晚期糖基化末端产物;羧甲基赖氨酸;糖醋排骨;高效液相色谱-三重四极杆质谱联用技术;多重反应监测
晚期糖基化末端产物(advanced glycation end products,AGEs)是糖类和蛋白质、氨基酸等大分子物质的非酶糖基化产物,主要在美拉德反应中期阶段产生 [1]。人体内的AGEs部分来源于饮食,有研究表明饮食摄入人体的AGEs大约1/10进入血液循环,其中只有1/3通过肾脏排出体外,剩下的2/3通过共价键和组织结合留在体内,从而诱发人体各种疾病的产生 [2-4],如糖尿病、肾病(尿毒症)、动脉粥样硬化、衰老、心血管疾病和阿茨海默尔等疾病 [5-7]。目前在生物和医药领域已经分离鉴定出多种AGEs,其中羧甲基赖氨酸(N ε-(carboxymethyl)lysine,CML)是AGEs的主要成员之一,由于CML在食品中广泛存在且对人体潜在危害性大,因此将CML作为AGEs的研究代表具有重要意义 [8]。
目前用于检测CML的技术主要有酶联免疫(enzymelinked immunosorbent assay,ELISA)法 [9-10]、高效液相色谱(high performance liquid chromatography,HPLC) [10-11]、气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)法 [12]、LC-MS [13]等。不同检测方法都有自身的优越性,同时也会存在不足的地方,或者会受到检测限制 [14]。如ELISA法对抗体特异性要求较高,对测定不同生物样品差异性大;对于HPLC、GC-MS检测方法而言,往往需要通过对CML进行柱前 衍生,步骤相对繁琐,且会降低检测灵敏度 [15-18]。因此,检测不同样品选择相适应的检测方法显得尤为重要。HPLC-MS法检测CML不需要进行柱前衍生化处理,预处理步骤简单,而且保留时间稳定,重复性好 [14]。
中华美食色香味俱全,闻名中外,中式菜肴烹饪技术种类繁多,包括炒、炸、炖、煎等 [19]。传统中式菜肴菜色丰富,菜品都是通过主料、辅料的搭配再加以调味而成的,正所谓是“一菜一味,百菜百味” [20]。中式菜肴独特的制作方法为CML的生成提供依据。目前我国没有研究报道中式菜肴加工过程对CML生成的影响。淮扬菜在国内享有盛誉,是招待国际政要的首选菜系 [21]。糖醋排骨是经典淮扬菜之一,其选用新鲜仔排为主料,肉质鲜嫩,口味酸甜适中,色泽红亮油润,是江南一带的大众流行菜 [22]。因此,本实验选择以CML为检测目标,建立HPLC-MS/MS法研究探讨糖醋排骨加工过程对CML含量变化的影响。
1.1 材料与试剂
排骨、米醋、镇江香醋、白醋、料酒、白糖、老抽、葱、姜 市购;压榨花生油 山东鲁花集团有限公司;超纯水 屈臣氏集团(香港)有限公司;CML标品、d 4-CML内标(纯度均大于98%) 加拿大TRC公司;甲醇、甲酸、乙酸铵(均为色谱级) 上海Aladdin试剂有限公司。
1.2 仪器与设备
1290/6460A LC-MS/MS仪 美国Agilent公司;Synergi 4 μ Hydro-RP 80A色谱柱(2 mm×250 mm,4 μm) 美国Phenomenex公司;3K15冷冻高速离心机美国Sigma公司;KQ-50B/KQ 3200E超声波清洗器 昆山市超声仪器有限公司;BCD-179K超低温冰箱 青岛海尔电冰箱股份有限公司;DHG-9023A电热恒温干燥箱上海一恒科技有限公司;XS-105电子分析天平 瑞士梅特勒-托利多集团;MD 200氮吹仪 上海摩亿科贸有限公司;HGC-8固相萃取仪 广州智真生物科技有限公司;12L Freeze Dry System冷冻干燥机 美国Labconco公司;OASIS系列MCX固相萃取柱(6 mL,150 mg)美国Waters公司;JYL-D051料理机 九阳股份有限公司;C21-SK011电磁灶 杭州九阳生活电器有限公司。1.3 方法
1.3.1 糖醋排骨加工过程及取样
按照经典淮扬菜糖醋排骨的制作方法 [22],将400 g排骨剁成长约3 cm的段,加100 g葱、100 g姜、40 g料酒腌制30 min;在沸水中煮3 min,焯去葱姜等杂质,捞出沥干;投入到热油(120 ℃)中油炸6 min,此时肋排表面呈金黄色,大约八成熟,两端露出尖尖的骨头;炒糖色,加入15 g油,30 g糖,150℃ 2 min,快速升温至180 ℃ 1 min,炒至糖色状态,倒入50 mL水,120 ℃ 1 min熬成红亮的糖色,此时放入炸好的排骨,加入老抽20 g,米醋40 g,倒入清水没过排骨,150 ℃烧至沸腾,然后90 ℃加盖焖40 min,开盖后加入镇江香醋20 g,180 ℃大火收干汤汁,淋入白醋10 g,出锅即成。
分别取未处理、腌制后、沸水煮后、炸至金黄色、炒糖色、大火烧沸、出锅后的排骨适量,粉碎机绞碎,冷冻干燥,再次粉碎后低温保存。
1.3.2 样品前处理
参考Assar等 [23]的研究进行样品前处理。称取60 mg样品,加入2 mL正己烷,摇匀后以4 000 r/min离心3 min,弃上清液,重复3 次以彻底除去脂肪。加入1.5 mL硼酸钠缓冲液(0.2 mol /L、pH 9.4)和1 mL硼氢化钠溶液(1 mol/L含0.01 mol/L氢氧化钠),混匀后在4 ℃冰箱中还原6 h。根据Folch等 [24]的方法,加入4 mL三氯甲烷-甲醇(2∶1,V/V)溶液除去样品中的油脂,同时使蛋白质沉淀。5 000 r/min离心10 min后,在沉淀物中加入4 mL盐酸溶液(6 mol/L),于烘箱中110 ℃酸水解24 h。用氮气将酸解液吹干,于2 mL甲醇-水(80∶20,V/V)溶液中复溶,加入20 μL内标(50 ng/mL)。分别用3 mL甲醇和3 mL水洗净和活化MCX小柱,取上述样品溶液过柱,依次用3 mL水和3 mL甲醇洗净杂质后,用5 mL体积分数5%氨水的甲醇溶液洗脱,收集的洗脱液经氮吹浓缩后,复溶于1 mL甲醇-水(80∶20,V/V)溶液中,过0.22 μm水系滤膜后,用于HPLC-MS分析。
1.3.3 HPLC-MS检测条件
Phenomenex Synergi 4 μ Hydro-RP 80A色谱柱(250 mm×2 mm,4 μm);流动相:A为5 mmol/L的乙酸铵溶液,甲酸调节pH 4.0;B为甲醇;进样量10 μL;流动相速率0.2 mL/min;柱温35 ℃。
MS条件:电离方式:电喷雾离子源正模式;检测方式:多反应监测驻留时间500 ms;毛细管电压3.00 kV;离子源温度100 ℃;脱溶剂气温度300 ℃;锥孔气流量50 L/h;进样锥电压20 V;脱溶剂气和锥孔气为氮气,碰撞气体为氩气。
2.1 流动相的选择
选择CML标准溶液(1 μg/mL)进样,通过实验首先比较了乙腈-水溶液和甲醇-水溶液对CML的洗脱效果,结果表明乙腈作为流动相时出现倒峰,而甲醇作为流动相时不会出现倒峰,但是峰形不佳;接着在水相中加入5 mmol/L乙酸铵溶液,用甲酸调pH值分别为4.0、5.0、6.0,结果表明,当pH 4.0时,峰形显著改善,如图1所示。同时实验还优化了不同的流动相比例对CML保留时间和峰形的影响,分别选取了体积分数50%、70%、80%甲醇溶液作为流动相。结果在确保色谱柱对CML的保留效果的同时,体积分数80%甲醇溶液得到的CML峰形最优,对称性最好,如图2所示。

图1 不同pH值对CML峰形的影响
Fig.1 Effects of pH on CML peak shape
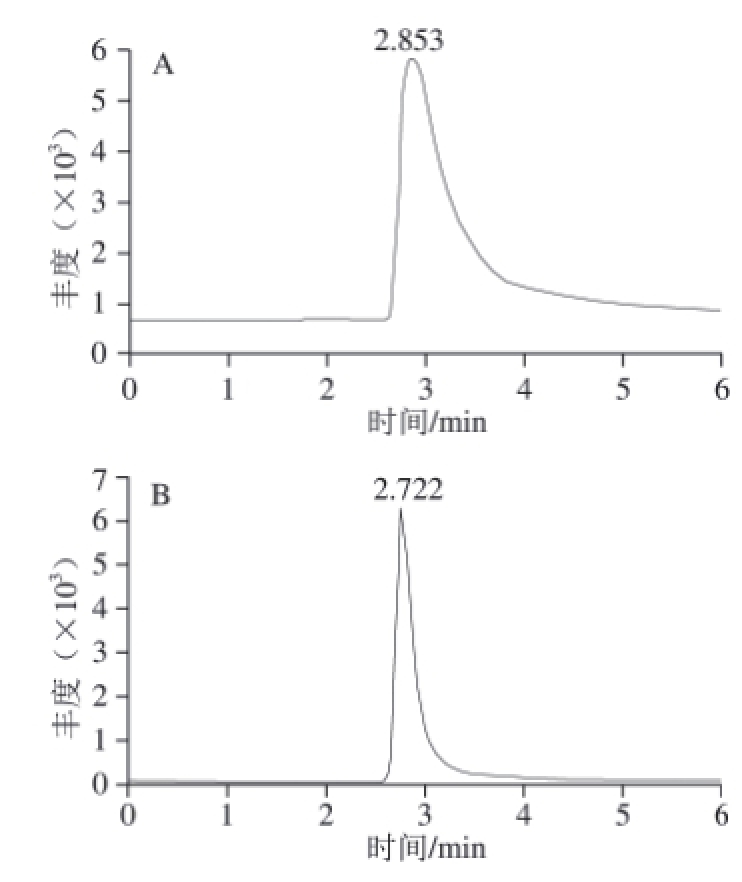

图2 不同流动相比例对CML峰形的影响
Fig.2 Effect of mobile phase composition on CML peak shape
2.2 质谱条件的优化
表1 各物质的质谱参数设置
Taabbllee 11 MMaasss parameters in multiple-reaction monitoring (MRM)mode for CML and d
4--CCMMLL

最佳碰撞能/eV CML 205 130 84 100 9(Ⅰ)11(Ⅱ)d 4-CML 209 134 88 100 9(Ⅰ)11(Ⅱ)化合物 母离子(m/z)子离子Ⅰ(定性)(m/z)子离子Ⅱ(定量)(m/z)最佳锥孔电压/V
在全扫描模式下,确定母离子及其分子质量,见表1;选择离子监测模式下,在100~200 V每隔10 V分别对CML进行监测,从而确定各个单标的最佳锥孔电压;在子离子扫描模式下,确定最佳碰撞能、定性子离子和定量子离子;最后,在多重反应监测模式下,应用并检验以上确定的MS条件,见图3。
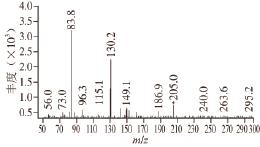
图3 CML的二级质谱图
Fig.3 MS-MS fragments of CML
2.3 样品前处理时硼氢化钠还原时间的选择

图 4 不同反应时间对CML含量的影响
Fig.4 Effect of reaction time on the content of CML
有文献[12,13,18]报道,部分阿玛多利重排产物,例如果糖基赖氨酸在酸水解时会转化成CML,为了提高检测的准确性,通常采用硼氢化钠将果糖基赖氨酸等物质进行还原。因此实验按照1.3.2节方法分别取糖醋排骨成品6 份进行样品前处理,还原时间分别为0、2、4、6、8、10 h。实验结果表明,还原时间在6 h左右时,CML的含量基本稳定如图4所示,与He Jialiang等 [13]研究报道结果一致。因此实验最终选择1 mol/L硼氢化钠还原6 h。
2.4 净化样品时固相萃取柱的选择
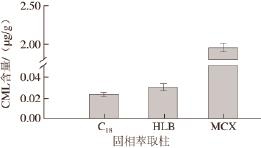
图 5 不同类型固相萃取柱对CML含量的影响
Fig.5 Effect of solid phase extraction columns on CML content
根据CML的结构,选取Sep-Pak C 18、Oasis HLB、Oasis MCX 3 种固相萃取小柱对糖醋排骨成品进行净化处理,然后测定CML含量。如图5所示,MCX柱净化富集效果明显比C 18柱和HLB柱好。根据相关文献[25-26]报道,因此推断,由于CML属于两性电离物质,较强极性,C 18固相萃取柱对CML吸附能力弱,容易与杂质一起被洗脱;HLB固相萃取柱对极性和非极性物质有一个平衡的吸附效果,对酸性、中性和碱性物质都可以简单地吸附在材料表面,因此物质不同的极性和pH值对吸附效率影响较大;MCX混合型固相萃取柱可以同时通过反相机制保留干扰物和离子交换选择性保留CML,最后通过离子置换将CML洗脱。
2.5 线性关系与检出限
甲醇-水(80∶20,V/V)溶液梯度稀释标准液,以不同质量浓度CML标品峰面积与一定质量浓度内标d 4-CML峰面积比值为横坐标,CML质量浓度为纵坐标,制作标准曲线,以3 倍信噪比为检出限。由表2可知,在线性范围内,峰面积与质量浓度有良好的线性关系(R 2>0.999),检出限为1.40 μg/g,与已报道 [27]的方法相比,本方法具有较高的灵敏度。
表2 CML的线性范围、线性方程、相关系数及检出限
TTaabbllee 22 LLiinneeaarr eeqquuaattiioons, correlation coefficients, limits of detectio
(LODs) and limits of quantifi cation (LOQs) for CML

化合物 线性范围/线性方程(μg/L)CML 10~800 Y=0.311 7X-0.340 8相关系数R 2 检出限/(μg/g)0.999 3 1.40
2.6 精密度与回收率结果
取制作完成的糖醋排骨为原料,添加3 个不同质量浓度的混合标准溶液进行回收率和精密度实验。未加标准品的糖醋排骨和加标糖醋排骨肉样按照优化后的方法进行测定,每个水平重复测定6 次。结果显示,原料的加标回收率在90.94%~105.26%之间,相对标准偏差(relative standard deviation,RSD)在5.80%~15.46%之间。以上结果表明,该方法准确可靠,可用于实际样品的测定,见表3。n
表 3 添加回收率及RSD结果(n==66)
Taabbllee 33 RReessuullttss ooff rreeccoovveerryy aanndd rreellaattiivvee ssttaannddaarrdd ddeevviiaattiioonn (n==66)
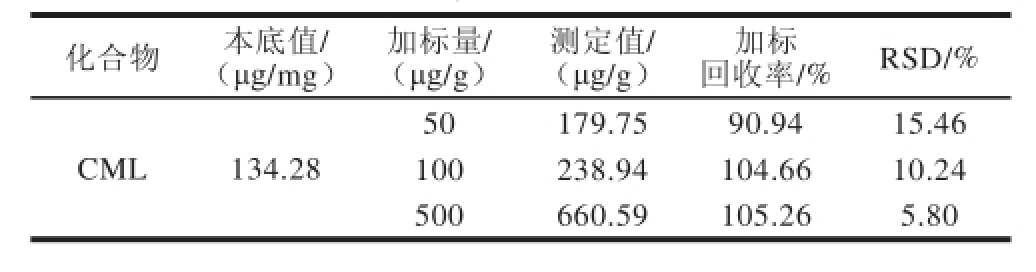
化合物 本底值/ (μg/mg)加标量/ (μg/g)测定值/ (μg/g)加标回收率/% RSD/% CML 134.28 50 179.75 90.94 15.46 100 238.94 104.66 10.24 500 660.59 105.26 5.80
2.7 糖醋排骨各加工阶段样品CML的含量
表 4 糖醋排骨各加工阶段CML检测结果
TTaabbllee 4 CML contents of sweet and sour pork ribs during different processing stages μg/g
加工阶段 未处理 腌制后 沸水煮后 炸至金黄色 炒糖色 大火烧沸 出锅后CML含量 24.72±2.75 17.46±1.64 38.76±3.90 68.40±7.11 85.65±8.82 126.24±13.49 136.37±14.06
取适量上述糖醋排骨各加工阶段样品进行CML检测(n=3),如表4所示。实验结果表明,随着加热强度、时间和原料的不同直接影响CML含量的变化,沸水煮后较腌制后增加21.3 μg/g,油炸后较沸水煮后增加29.64 μg/g;在加入白糖后,大火烧沸较炒糖色急剧增加40.59 μg/g。结合相关文献[28],推断由于肉在热加工前,由机体本身和贮藏过程中生成的主要是游离态CML,而肉在漂洗和腌制过程时,部分游离态CML溶解在水和料酒中,导致CML含量在腌制后含量有所降低。CML产生途径包括美拉德反应、葡萄糖的自氧化降解和脂质的自氧化降解等 [14],因此糖醋排骨在加入油和糖后CML含量显著增加。房红娟 [29]研究结果也表明,加工温度和加热时间以及糖和油脂的添加均可以显著影响糖醋排骨中CML的含量。如低乳糖牛奶CML含量为5.47 μg/mL比牛奶CML含量(4.26 μg/mL)高,而脱脂牛奶CML含量为3.64 μg/mL低于牛奶CML含量,由于低乳糖牛奶中还原糖增加促进了CML的产生而脱脂牛奶减少了由脂质过氧化物生成CML。在发酵食品中,由于蛋白质水解为游离氨基酸、多糖水解为寡糖和单糖,CML含量相对更高,如腐乳中达124.92 μg/g;富含赖氨酸的豆奶五谷粉生产中加入大量糖且为粉末状态,因此在喷雾干燥或长期贮存过程产生的CML达到67.49 μg/g [28]。一些经过中温条件加工且蛋白含量低的面食制品如挂面、水饺皮等CML含量相对更少,分别为4.13、8.34 μg/g;而经过油炸的食品如方便面、油条的CML含量分别高达38.77、32.69 μg/g [28];另外经过高温烘烤的食品如小麦面包皮、硬质饼干中CML含量分别为94.29、117.53 μg/g [13]。
本研究采用高效液相色谱-三重四极杆质谱联用技术建立了一种操作简单、稳定性好、回收率高的检测中式菜肴糖醋排骨中CML的方法。该方法中样品经正己烷去脂肪,硼氢化钠还原,酸水解蛋白,Oasis MCX固相萃取小柱净化。该方法检出限为1.40 μg/g,加标回收率为90.94%~105.26%,RSD为5.80%~15.46%。采用该分析方法对中式菜肴糖醋排骨加工过程中CML的含量变化进行了分析,结果表明,加工温度和加热时间以及糖和油脂的添加均可以显著影响糖醋排骨中CML的含量。因此,如何改善糖醋排骨的加工工艺也是控制CML生成的一个重要途径。
参考文献:
[1] VLASSARA H, BROWNLEE M, CERAMI A. Accumulation of diabetic rat peripheral nerve myelin by macrophages increases with the presence of advanced glycosylation endproducts[J]. The Journal of Experimental Medicine, 1984, 160(1): 197-207.
[2] GOLDBERG T, CAI Weijing, PEPPA M, et al. Advanced glycoxidation end products in commonly consumed foods[J]. Journal of the American Dietetic Association, 2004, 104(8): 1287-1291.
[3] URIBARRI J, WOODRUFF S, GOODMAN S, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet[J]. Journal of the American Dietetic Association, 2010,110(6): 911-916.
[4] YAMAGISHI S, MATSUI T, NAKAMURA K. Possible link of foodderived advanced glycation end products (AGEs) to the development of diabetes[J]. Medical Hypotheses, 2008, 71(6): 876-878.
[5] 冯建勋, 李红艳, 田建伟. 饮食中晚期糖基化终产物对健康SD大鼠肾脏的影响[J]. 中国临床康复, 2006, 36 (10): 116-119.
[6] LOSSO J N, BAWADI H A, CHINTALAPATI M. Inhibition of the formation of advanced glycation end products by thymoquinone[J]. Food Chemistry, 2011, 128(1): 55-61.
[7] KRAUTWALD M, MÜNCH G. Advanced glycation end products as biomarkers and gerontotoxins-A basis to explore methylglyoxallowing agents for Alzheimer's disease[J]. Experimental Gerontology,2010, 45(10): 744-751.
[8] FU M X, REQUENA J R, JENKINS A J, et al. The advanced glycation end product, N-(epsilon)(carboxymethyl)lysine, is a product of both lipid peroxidation and glycoxidation reactions[J]. Journal of Biological Chemistry, 1996, 271(17): 9982-9986.
[9] BEAULIEU L P, HARRIS C S, SALEEM A, et al. Inhibitory effect of the Cree traditional medicine wiishichimanaanh (Vaccinium vitisidaea) on advanced glycation endproduct formation: identifi cation of active principles[J]. Phytotherapy Research, 2010, 24(5): 741-747.
[10] DITTRICH R, HOFFMANN I, STAHL P, et al. Concentrations of N-epsilon-carboxymethyllysine in human breast milk, infant formulas,and urine of infants[J]. Journal of Agricultural and Food Chemistry,2006, 54(18): 6924-6928.
[11] VANDEMERBEL N. Liquid chromatographic method for the quantitative determination of N ε-carboxymethyllysine in human plasma proteins[J]. Journal of Chromatography B, 2004, 808(2): 163-168. [12] CHARISSOU A, AIT-AMEUR L, BIRLOUEZ-ARAGON I. Evaluation of a gas chromatography/mass spectrometry method for the quantifi cation of carboxymethyllysine in food samples[J]. Journal of Chromatography A, 2007, 1140(1/2): 189-194.
[13] HE Jialiang, ZENG Maom ao, ZHENG Zongpin, et al. Simultaneous determination of N ε-(carboxymethyl) lysine and N ε-(carboxyethyl)lysine in cereal foods by LC-MS/MS[J]. European Food Research and Technology, 2014, 238(3): 367-374.
[14] 付全意. 食品模拟体系糖化反应过程中羧甲基赖氨酸的形成和抑制[D]. 广州: 华南理工大学, 2012: 62-124.
[15] DELGADO-ANDRADE C, SEIQUER I, NAVARRO M P, et al. Maillard reaction indicators in diets usually consumed by adolescent population[J]. Molecular Nutrition and Food Research, 2007, 51(3): 341-351.
[16] HARTKOPF J, PAHLKE C, LÜDEMANN G, et al. Determination of N ε-carboxymethyllysine by a reversed-phase high-performance liquid chromatography method[J]. Journal of Chromatography A, 1994,672(1): 242-246.
[17] DRUSCH S, FAIST V, ERBERSDOBLER H F. Determination of N εcarboxymethyllysine in milk products by a modifi ed reversed-phase HPLC method[J]. Food Chemistry, 1999, 65(4): 547-553.
[18] BÜSER W, ERBERSDOBLER H F, LIARDON R. Identification and determination of N ε-carboxymethyllysine by gas-liquid chromatography[J]. Journal of Chromatography A, 1987, 387: 515-519.
[19] 陈永清. 风味与菜点质构[J]. 四川烹饪高等专科学校学报, 2007(1): 12-14.
[20] 赵钜阳, 孔保华, 刘骞, 等. 中式传统菜肴方便食品研究进展[J]. 食品安全质量检测学报, 2015(4): 1342-1349.
[21] 关向峰. 译介淮扬菜系, 促进淮扬饮食文化走向世界[J]. 沧桑,2013(4): 226-228.
[22] 杜宪, 江天舒. 经典淮扬菜100 款[M]. 济南: 山东出版传媒股份有限公司, 2014: 18.
[23] ASSAR S H, MOLONEY C, LIMA M, et al. Determination of N ε-(carboxymethyl)lysine in food systems by ultra performance liquid chromatography-mass spectrometry[J]. Amino Acids, 2009, 36(2): 317-326.
[24] FOLCH J, LEES M, SLOANE S G H. A simple method for the isolation and purifi cation of total lipides from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1): 497-509.
[25] BENAVENTE F, MEDINA-CASANELLAS S, BARBOSA J, et al. Investigation of commercial sorbents for the analysis of opioid peptides in human plasma by on-line SPE-CE[J]. Journal of Separation Science, 2010, 33(9): 1294-1304.
[26] NA Guangshui, GU Jia, GE Linke, et al. Detection of 36 antibiotics in coastal waters using high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Oceanology and Limnology,2011(5): 1093-1102.
[27] 高畅, 何志勇, 曾茂茂, 等. SPE-LC-MS/MS法检测肉制品中羧甲基赖氨酸与羧乙基赖氨酸[J]. 2014, 7(19): 1986-1991.
[28] 卞华伟, 李玉婷, 李冰, 等. 国内常见食品中羧甲基赖氨酸含量分析[J].现代食品科技, 2014, 30(11): 223-228.
[29] 房红娟. 食品加工过程中晚期糖基化末端产物形成及控制研究[D].西安: 西北农林科技大学, 2013: 1-39.
Establishment of Analytical Method for N ε-(carboxymethyl)lysine in Sweet and Sour Pork Ribs and Its Dynamic Change during the Cooking Process
Abstract:In this study, high performance liquid chromatography-triple quadrupole mass spectrometry (HPLC-MS/ MS) was used to establish a simple and stable method for the detection of advanced glycation end products (AGEs) of Nε-(carboxymethyl)lysine (CML) in sweet and sour pork ribs. Samples were reduced by sodium borohydride after removing lipid. HCl was then added to hydrolyze the protein in the samples. After hydrolysis, the target compounds were cleaned up by Oasis MCX SPE cartridges and then separated by Phenomenex Synergi 4 μ Hydro-RP 80A column with ammonium acetate aqueous solution and methanol solution as mobile phases. HPLC-MS analysis was conducted using electron spray ionization (ESI) in the positive ion mode (ESI +) and quantifi cation was performed in multiple-reaction monitoring (MRM)mode by stable isotope dilution method. The limit of detection was 1.40 μg/g and the average recoveries of CML ranged from 90.94% to 105.26% with relative standard deviation (RSD) in the range of 5.80%-15.46%. The contents of CML in Huaiyang style sweet and sour spareribs were analyzed. The results showed that heating time, heating temperature and the addition of sugar and oil caused a signifi cant increase in CML content.
Key words:advanced glycation end products; N ε-(carboxymethyl)lysine; sweet and sour pork ribs; high performance liquid chromatography triple quadrupole mass spectrometry; multiple reaction monitoring
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2015)24-0142-05
doi:10.7506/spkx1002-6630-201524025
收稿日期:2015-06-23
基金项目:“十二五”国家科技支撑计划项目(2014BAD04B03);国家重点基础研究发展计划(973计划)项目(2012CB720805);教育部“新世纪优秀人才支持计划”项目(NCET-12-0749)
作者简介:贾寒冰(1991—),女,硕士研究生,研究方向为食品质量安全。E-mail:hbjia6@163.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品营养与安全、食品复杂碳水化合物。E-mail:spnie@ncu.edu.cn