能 静,项延楠,孙培龙*
(浙江工业大学海洋学院,浙江 杭州 310014)
摘 要:采用拉曼光谱法直接监测灵芝孢子油中氧化酸败过程中不饱和双键特征峰的变化规律,研究了特征峰的强度与孢子油氧化酸败程度的关系。结果表明,特征峰强度随孢子油酸值、过氧化值的增加而下降,特征峰的面积与孢子油酸值之间存在着良好的线性关系,并进一步测定了灵芝孢子油氧化酸败的动力学参数。建立了用拉曼光谱快速检测灵芝孢子油氧化酸败度的新方法。对该方法的有效性进行评估,并用该方法筛选出有效的灵芝孢子油抗氧化剂。
关键词:拉曼光谱法;灵芝孢子油;氧化酸败;快速检测
灵芝又称灵芝草,是多孔菌科植物赤芝或紫芝的全株,自古以来就被推崇为中药上品,在《神农本草经》等中医药典籍就早有记载。经数十年的现代药理学研究证明,灵芝对于增强人体免疫力、抑制肿瘤、调节血糖、控制血压、辅助化疗、保肝护肝,促进睡眠等方面均具有显著疗效 [1]。灵芝孢子是灵芝的有性生殖细胞,一般呈淡褐色至黄褐色,卵形,大小一般在(8.5~11.2) μm×(5.2~6.9) μm(长×宽)之间,内含灵芝孢子油。灵芝孢子油集中了灵芝有效成分的精华,富含三萜类灵芝酸、灵芝多糖、核苷、氨基酸、饱和与不饱和脂肪酸、有机锗以及其他微量元素等多种活性成分 [2]。众多研究已经表明,灵芝孢子油具有增强细胞免疫、增强NK细胞活性、降血脂、免疫调节等功能,能直接抑杀肿瘤干细胞,抑制肿瘤细胞增殖和诱导肿瘤细胞的凋亡 [3-5],抗氧化 [6]和减轻膀胱堵塞 [7],以及抗艾滋病毒的活性的能力 [8-9]。同时由于其不饱和脂肪酸含量很高,更具有改善心脑血管疾病、抗动脉硬化、降血脂、降胆固醇的作用 [10]。
由于灵芝孢子油功效显著,价格昂贵,所以市场上相关产品的质量参差不齐,严重影响了消费者的利益。灵芝孢子油富含不饱和双键,孢子油在储存、运输过程中,尤其在高温、高湿的条件下极易氧化,主要发生由活性氧自由基攻击双键引起降解,产生多种醛、酮、醇、酸及羟酸等有害氧化物、过氧化物,生成强烈的刺激性气味(氧化酸败) [11]。这些氧化物、过氧化物被人体摄取后,将破坏机体正常的生理生化功能(如引起机体氧化应激反应,降低机体免疫功能、导致小肠、肝脏等器官肥大等),严重损害身体健康 [12]。
因此,检测灵芝孢子油氧化酸败度是灵芝孢子油质量控制的一个关键。目前,业内通常采用食用油的质量监控指标即过氧化值、酸值作为孢子油的主要质量监控指标 [13]。测定灵芝孢子油酸值、过氧化值的传统方法主要是标准酸碱滴定和氧化还原滴定,但滴定法多少存在以下缺陷:如操作繁杂,需专业人员在实验室进行分析;耗时长,检测需数小时完成;不便携,难以户外现场检测;灵敏度不够高,消耗样品量多(5~10 g),检测成本高。如根据中国药典一部中对酸败法测定的规定 [14]以及GB/T 5009.37—2003《食用植物油卫生标准的分析方法》 [15],每次滴定操作需消耗灵芝孢子油0.5 g和1.5 g来分别测定其酸值和过氧化值,3 次重复滴定至少消耗孢子油6.0 g。因此,开发一种简单、快速、灵敏度高、样品消耗量少、检测成本低的孢子油酸值和过氧化值检测新技术对保障灵芝孢子油的生产质量、规范灵芝孢子油销售市场、开发新的灵芝深加工产品都具有十分重要的意义。
近年来引起国内外广泛关注的拉曼光谱技术为开发灵芝孢子油氧化酸败检测新技术提供了契机。拉曼光谱是1928年印度物理学家拉曼发现的一种分子振动光谱,传统高效液相色谱、核磁共振波谱、气相色谱-质谱联用、荧光光谱等方法相比,拉曼光谱技术具有诸多优点,如能够直接对样品无损伤的定量、定性分析,无需对样品进行复杂预处理,样品用量少,操作简便,测定时间短,灵敏度高,谱峰尖锐,可明显表征特定分子的结构等,因而近年来拉曼光谱技术已广泛用于食品分析 [16-22]、环境监测 [23]、药物分析 [24-25]、医学鉴定等领域 [26-28]。为此,本实验将利用拉曼光谱技术建立一种灵芝孢子油氧化酸败的动态监测方法以及灵芝孢子油酸值、过氧化值的快速检测新技术,并利用该方法测定灵芝孢子油氧化酸败的动力学参数,筛选出高效的灵芝孢子油抗氧化剂。
1.1 材料与试剂
灵芝孢子油样品 浙江金华寿仙谷医药股份有限公司。
茶多酚、生育酚(VE)、特丁基对苯二酚(tertiary butylhydroquinone,TBHQ)、邻苯二甲酸氢钾、重铬酸钾(均为分析纯) 阿拉丁试剂(上海)有限公司;酚酞、淀粉、碘化钾、氢氧化钠、硫代硫酸钠、无水碳酸钠、乙醇、乙醚、氯仿、冰醋酸(均为分析纯) 华东医药试剂股份有限公司。
1.2 仪器与设备
DeltaNu ®Advantage 785型近红外拉曼光谱仪(波长785 nm、激光功率120 mW、分辨率4 cm -1、带NuScope数字显微镜和XYZ三维载物台) 美国DeltaNu公司;MK-20干式恒温器(控温范围:-10~100 ℃) 杭州奥盛仪器有限公司;RCT磁力搅拌器 德国IKA ®RCT Basic公司;BSA224S型电子天平 德国Sartorius AG公司。
1.3 方法
1.3.1 灵芝孢子油酸值的检测
根据GB/T 5009.37—2003,用氢氧化钠标准滴定法测灵芝孢子油酸值:在250 mL锥形瓶中事先加入乙醇、乙醚各25.0 mL混合,精确称取灵芝孢子油样品0.500 g加入锥形瓶中,振荡使其完全溶解。用氢氧化钠滴定液(0.1 mol/L)滴定至粉红色并连续30 s不褪色,读取消耗氢氧化钠滴定液体积(mL)。
酸值的计算见公式(1):
式中:AV为酸值/(mg NaOH/g);A为消耗氢氧化钠滴定液(0.1 mol/L)的体积/mL;W为试样取样量/g;5.61为每毫升氢氧化钠滴定液(0.1 mol/L)相当于氢氧化钠的毫克数,可根据标定后氢氧化钠滴定液的准确浓度进行校正。
乙醚和乙醇的混合物配制:取乙醇、乙醚各25.0 mL于250 mL锥形瓶混匀,临用前先加0.5%的酚酞指示液1 mL,摇匀,滴加氢氧化钠滴定液适量,调至微显粉红色。
0.1 mol/L氢氧化钠滴定液的配制:先配制氢氧化钠饱和溶液,称取过量氢氧化钠固体溶于蒸馏水中,其中氢氧化钠固体溶解度为111 g(20 ℃),移液管准确移取上清液1.4 mL于250 mL容量瓶中用新煮沸冷却的无二氧化碳蒸馏水定容。
氢氧化钠滴定液的标定:精确称取在105 ℃干燥至质量恒定的基准邻苯二甲酸氢钾约0.600 g,加新沸过的冷水50.0 mL振摇,使其尽量溶解;加0.5%酚酞指示液2 滴,用本液滴定至溶液显粉红色。每1 mL的氢氧化钠滴定液(0.1 mol/L)相当于20.42 mg的邻苯二甲酸氢钾。标定浓度(C)结果的计算见公式(2):

式中:W为邻苯二甲酸氢钾的称样量/g;V为标定时消耗氢氧化钠滴定液的体积/mL。
0.5%酚酞溶液的配制:称取0.50 g酚酞,溶解于100 mL 95%的乙醇溶液中,无需加水。实验重复3 次并计算其平均值。
1.3.2 灵芝孢子油过氧化值的检测
在250 mL干燥碘瓶中加入1.500 g的灵芝孢子油,之后混入按调制的氯仿-冰醋酸(1∶1,V/V)的混合液30.0 mL,通过不断振荡摇匀样品。待充分摇匀后加入约1.0 mL新配制的碘化钾饱和溶液,加入后轻轻摇动半分钟时间,待摇匀后放置于暗处静置5 min。随后向碘瓶内加水80.0 mL,使之混匀,然后用标准硫代硫酸钠滴定液(0.1 mol/L)滴定,先滴定至溶液呈现浅黄色,然后加入淀粉溶液,作为反应指示剂,滴定至蓝色消失,此时达到的即为滴定终点。以硫代硫酸钠溶液的体积消耗数,计算油脂的过氧化值。每次实验重复3 次并计算其平均值。计算见公式(3):
式中:POV为过氧化值/(mmol/kg);V 1为样品消耗的标准硫代硫酸钠体积/mL;V 2为空白实验消耗的标准硫代硫酸钠体积/mL;M为样品质量/g。
硫代硫酸钠标准滴定液配制:称取硫代硫酸钠26.0 g,与无水碳酸钠0.20 g,加新沸过的冷水溶解成1 000 mL,摇匀,放置1 个月,过滤后备用。
硫代硫酸钠标准滴定液的标定:精确称取在120 ℃干燥至质量恒定的基准重铬酸钾0.150 g,放置于碘量瓶中。加水50 mL溶解,加碘化钾2.0 g,轻轻振摇溶解,加稀硫酸40 mL,摇匀,在暗处放置10 min,加水250 mL稀释,用本液滴定近终点时,加淀粉指示液3 mL,继续滴定到蓝色消失而显亮绿色,并将滴定的结果用空白实验校正。每1 mL的 硫代硫酸钠滴定液(0.1 mol/L)相当于4.903 mg的重铬酸钾。根据本液消耗量与重铬酸钾的用量,算出本液的准确质量浓度(F),计算见公式(4):(4)
式中:M s为重铬酸钾的质量/g;V为滴定所耗硫代硫酸钠滴定液的体积/mL;V 0为空白实验所耗硫代硫酸钠滴定液的体积/mL。
1.3.3 灵芝孢子油拉曼光谱检测
取200 μL孢子油置于200 μL样品管中,放入拉曼光谱仪样品池中,激光强度选择高档,激光聚焦点为样品管中心,激光照射时间设定为10 s,仪器自动环境杂散光校准和基线校正。每个样品由仪器连续扫描5 次,仪器自动平均后得到灵芝孢子油的拉曼光谱图。仪器可以自动连续测定样品,从而可以对样品进行动态监测。
1.3.4 灵芝孢子油氧化酸败的动态监测
影响灵芝孢子油酸值和过氧化值的重要因素是温度、光线、空气,且温度的影响大于空气和光线的影响 [29]。参照Schaal烘箱加速法 [30],准确称取5 份灵芝孢子油,一份置于冰箱中密封避光条件下做为对照样保存,其他4 份分别置于10、35、50、70 ℃恒温器中避光敞口保存,每隔24 h搅拌一次混匀,定期取样,用拉曼光谱仪测定灵芝孢子油的拉曼光谱图,并根据中国药典一部 [14-15]中对油脂测定的规定测定各自的酸值和过氧化值,实验重复3 次并计算其平均值。
1.3.5 抗氧化剂对灵芝孢子油稳定性的影响
根据GB 2760—2011《食品添加剂使用标准》的规定,TBHQ在油脂中的最大许可使用量为0.02%,所以本实验选择TBHQ、VE、茶多酚3 种抗氧化剂并分别按0.02%的剂量添加。参照Schaal烘箱加速法 [30],准确称取4 份灵芝孢子油,一份不添加抗氧剂做为对照样,其他3 份分别添加TBHQ、VE和茶多酚,置于70 ℃恒温器中避光敞口保存,每隔24 h搅拌一次混匀,定期取样,用拉曼光谱仪测定灵芝孢子油的拉曼光谱图。并根据中国药典一部 [14]中对油脂测定的规定测定各自的酸值和过氧化值,实验重复3 次并计算其平均值。
2.1 灵芝孢子油的拉曼光谱分析
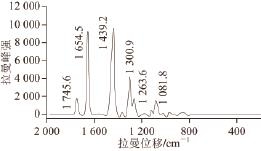
图 1 灵芝孢子油的拉曼光谱图
Fig.1 Raman spectrum of Ganoderma lucidum spore oil
如图1所示,根据参考文献[31-32],对其中的主要特征峰对应的分子结构官能团指认如下。1 745.6 cm -1对应于分子中羰基C=O的伸缩振动峰,1 654.5 cm -1对应于不饱和双键的伸缩振动峰,1 439.2 cm -1对应于烃基碳氢键CH剪式振动峰,1 300.9 cm -1对应于烃基的变形振动峰。在拉曼光谱中,碳-碳双键通常以很强的特征峰出现,峰的强度在一定浓度范围内与双键的浓度呈正比关系,当双键发生氧化降解酸败时,峰的强度下降,从而可以通过测定碳-碳双键的特征拉曼峰强度来直接检测碳-碳双键的降解程度。根据文献[11,33-34]研究,不饱和油脂、植物油及灵芝孢子油等氧化酸败的本质主要是其中含有的不饱和双键发生氧化降解酸败的结果 [11]。孢子油拉曼谱图中1 655 cm -1双键伸缩振动峰的强度在一定浓度范围内与双键浓度呈比例关系,所以可以通过检测1 655 cm -1的双键峰强度来对灵芝孢子油的氧化酸败进行定量分析。
2.2 灵芝孢子油氧化酸败过程的动态监测
灵芝孢子油氧化酸败的本质是其中含有的不饱和双键发生氧化的结果 [11]。孢子油拉曼谱图中位于1 655 cm -1的双键伸缩振动峰的强度在一定浓度范围内与双键的浓度呈正比,所以可以通过检测1 655 cm -1的双键峰强度来动态监测孢子油的氧化酸败过程。相比于其他监测孢子油氧化酸败的技术手段(如核磁、高效液相色谱、质谱等),拉曼光谱技术更具有简单、直接、快捷,受氧化中间产物(如醛、酮)的影响小,样品无需复杂预处理等优点。
在恒温50 ℃条件下,灵芝孢子油暴露在空气中,于5、7、14、2、28、35 d取样时的拉曼光谱图如图2所示。可以看出,50 ℃时灵芝孢子油从第7天起就发生了明显的氧化酸败,14 d后大约2/3的不饱和双键酸已经破坏,说明50 ℃温度条件下灵芝孢子油氧化酸败的速度很快。
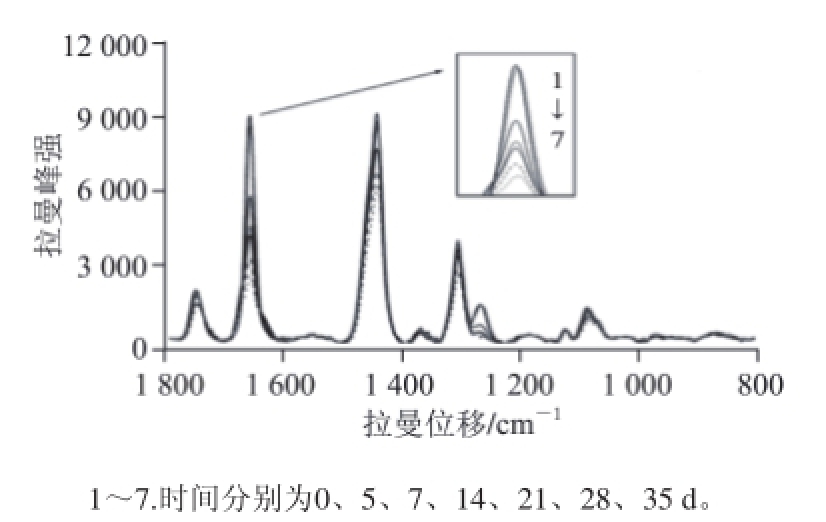
图 2 灵芝孢子油在50 ℃时长时间氧化酸败的拉曼光谱监测图
Fig.2 Raman spectra showing the oxidative rancidity of
Ganoderma lucidum spore oil at 50 ℃
以拉曼光谱图中双键峰的积分强度对时间作图得到灵芝孢子油随时间变化的酸败曲线,将不同反应温度条件下(10、35、50、70 ℃)得到酸败曲线绘于图3a中,可以看出,温度对孢子油氧化酸败的速度影响十分明显,10 ℃时灵芝孢子油经过20 d氧化酸败也很少,而70 ℃时经过数小时大部分孢子油即发生了酸败。由酸败曲线的斜率求出初始反应速率常数,根据阿伦尼乌斯定律,以反应速率常数(lnk)对温度的倒数(1/T)作图,如图3b所示,计算得到氧化酸败反应的表观活化能为∆E = 44.35 kJ/mol。
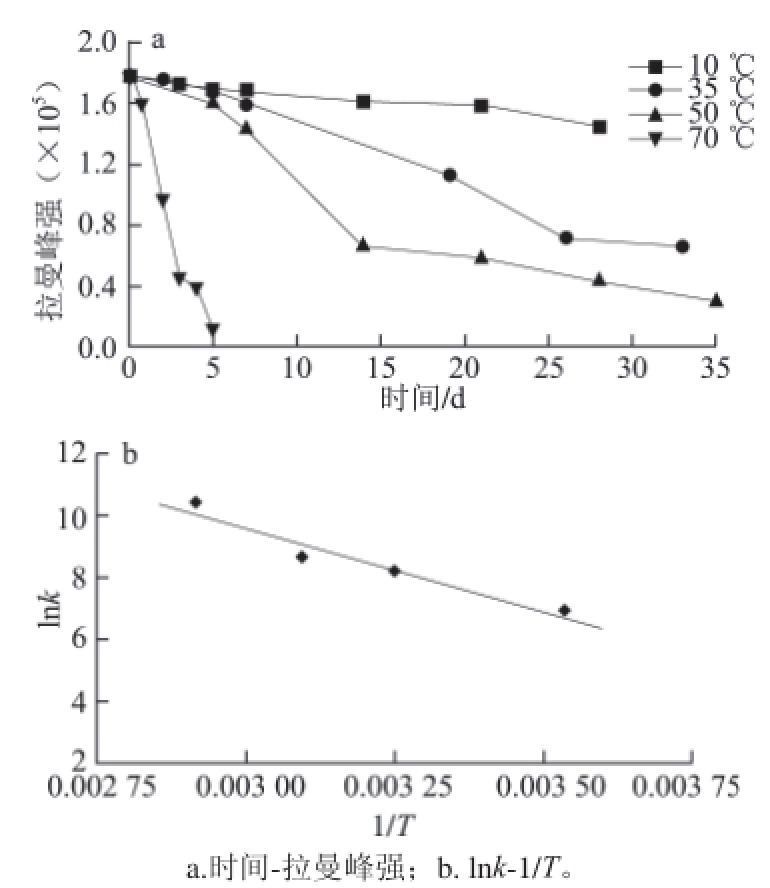
图 3 反应温度对灵芝孢子油氧化酸败反应的影响
Fig.3 Effect of temperature on the oxidative rancidity of Ganoderma lucidum spore oil
2.3 灵芝孢子油抗氧化剂的筛选

图 4 添加不同抗氧化剂的灵芝孢子油氧化酸败随时间变化曲线
Fig.4 Time courses of oxidative rancidity of Ganoderma lucidum spore added with different antioxidants
由于采用拉曼光谱技术可以简单、快捷、直接地监测灵芝孢子油氧化酸败过程,从而可以通过高温加速实验进行孢子油抗氧化剂的快速筛选。如图4所示,在70 ℃条件下,监测添加0.02%抗氧剂和不加抗氧剂孢子油的氧化酸败速率,很显然,不加抗氧剂的孢子油数小时内很快被氧化,抗氧化效果:VE>茶多酚>TBHQ,添加VE
的孢子油6 d后(双键峰强度下降约5%)才出现轻微氧化酸败。根据前面得到活化能数据(∆E = 44.35 kJ/mol),可以计算出在室温条件下(20 ℃)灵芝孢子油货架期可达90 d左右。在密闭低温的环境中,增加VE用量,可进一步显著延长孢子油的货架期。
2.4 灵芝孢子油酸值、过氧化值的快速检测

图 5 孢子油氧化酸败后产生的酸值(a)以及过氧化值(bb)与双键拉曼峰的积分强度关系
Fig.5 Plots of Raman peak intensity versus acid value (a) and peroxide value (b) for oxidative rancidity of Ganoderma lucidum spore oil added with different antioxidants
根据图4的结果,以孢子油双键拉曼峰的积分强度与用标准滴定法测出孢子油酸值作图,如图5a所示,可以看出,无论添加抗氧化剂与否,双键拉曼峰的积分强度与其酸值都有十分良好的线性关系,表明可以利用拉曼光谱法对孢子油氧化酸败过程中产生的酸值进行快速定量检测。根据文献[35-36]的研究,传统酸碱滴定法检测油脂酸值具有如下局限性:1)酸碱滴定的终点依赖于指示剂颜色的微弱变化,不同个体间终点判断差异较大,特别当油脂带有颜色时误差更大;2)所需油脂样品消耗量大(5~10 g),溶液配制、标定、滴定耗费时间长(几小时);3)该法所需化学试剂与药品多,需要繁琐配制标定溶液,难以实现现场快速检测的要求。而拉曼光谱法无需人工终点判定与溶液配制标定,检测时间快(几分钟),样品消耗量少(普通样品管:0.2 mL,毛细样品管:0.02 mL),操作简单便捷,可现场快速检测,从而使该检测方法具有相当大的实际应用前景。
用同样的方法,以孢子油双键拉曼峰的积分强度与用滴定法测出孢子油过氧化值作图,如图5b所示。虽然拉曼强度与过氧化值不呈现线性关系,但仍然可以通过非线性 拟合(软件:Origin 8.0,S拟合)通过内插值的方式对灵芝孢子油的过氧化值进行快速测定。
综上结果,本实验利用拉曼光谱技术直接检测灵芝孢子油中不饱和双键来监测不同温度条件下的灵芝孢子油氧化酸败过程,发现温度对孢子油的氧化酸败速率影响十分明显,计算出氧化酸败反应表观活化能为44.35 kJ/mol,通过高温加速实验筛选出VE做为孢子油的有效抗氧化剂,在室温开口的环境下使孢子油的货架期达到90 d,在密闭低温的环境中货架期更长。
通过与传统标准滴定法对比,发现双键拉曼峰的积分强度与孢子油的酸值之间存在良好线性关系,从而可利用拉曼光谱法对孢子油氧化酸败过程中产生的酸值进行定量检测。相比于传统酸碱滴定,该方法简单、方便、快捷,用样量少,成本低廉,具有实际应用前景。
参考文献:
[1] 叶锦先, 高鹤, 高炜, 等. 灵芝孢子的药理和临床疗效[J]. 药膳食疗研究, 2000(1): 3-5.
[2] 胡瞬, 易有金, 熊兴耀, 等. 灵芝孢子油的研究进展[J]. 安徽农业科学, 2010, 38(17): 9214-9215.
[3] GAO Pei, HIRANO T, CHEN Zhiqing, et al. Isolation and identification of C-19 fatty acids with anti-tumor activity from the spores of Ganoderma lucidum (reishi mushroom)[J]. Fitoterapia, 2012,83(3): 490-499.
[4] XIE Yizhen, LI Senzhu, YEE A, et al. Ganoderma lucidum inhibits tumour cell proliferation and induces tumour cell death[J]. Enzyme and Microbial Technology, 2006, 40(1): 177-185.
[5] FU Yujie, LIU Wei, ZU Yuangang, et al. Breaking the spores of the fungus Ganoderma lucidum by supercritical CO 2[J]. Food Chemistry,2009, 112(1): 71-76.
[6] DEEPALAKSHMI K, MIRUNALINI S, KRISHNAVENI M, et al. In vitro and in vivo antioxidant potentials of an ethanolic extract of Ganoderma lucidum in rat mammary carcinogenesis[J]. Chinese Journal of Natural Medicines, 2013, 11(6): 621-627.
[7] PATERSON R R M. Ganoderma: a therapeutic fungal biofactory[J]. Phytochemistry, 2006, 67(18): 1985-2001.
[8] El-MEKKAWY S, MESELHY M R, NAKAMURA N, et al. Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum[J]. Phytochemistry, 1998, 49(6): 1651-1657.
[9] MIN B S, NAKAMURA N, MIYASHIRO H, et al. Triterpenes from the spores of Ganoderma lucidum and their inhibitory activity against HIV-1 protease[J]. Chemical and Pharmaceutical Bulletin, 1998,46(10): 1607-1612.
[10] 李森柱, 谢意珍, 周静文, 等. 灵芝孢子油主要活性成分及降血脂功能的研究[J]. 中国食用菌, 2006, 25(5): 40-42.
[11] 陈体强, 吴锦忠, 徐洁, 等. 灵芝孢子油脂肪酸组分的分析[J]. 菌物研究, 2005, 3(2): 35-38.
[12] 王改琴, 王恬. 油脂氧化酸败对畜禽机体功能影响及其氧化防控措施[J]. 中国油脂, 2010, 35(7): 46-49.
[13] 何志平, 庞林江. 油脂氧化检测方法研究进展[J]. 安徽农业科学,2010, 38(21): 11460-11462.
[14] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2010: 附录54-57.
[15] 国家标准化管理委员会. GB/T 5009.3—2003 食用植物油卫生标准的分析方法[S]. 2003.
[16] ZHANG Yuanyuan, LAI Keqiang, ZHOU Jinglie, et al. A novel approach to determine leucomalachite green and malachite green in fish fillets with surface-enhanced Raman spectroscopy (SERS) and multivariate analyses[J]. Journal of Raman Spectroscopy, 2012, 43(9): 1208-1213.
[17] CHEUNG W, SHADI I, XU Yun, et al. Quantitative analysis of the banned food dye Sudan-1 using surface enhanced Raman scattering with multivariate chemometrics[J]. Journal of Physical Chemistry C,2010, 114(16): 7285-7290.
[18] LIN M, HE L, AWIKA J, et al. Detection of melamine in gluten, chicken feed, and processed foods using surface enhanced Raman spectroscopy and HPLC[J]. Journal of Food Science, 2008, 73(8): 129-134.
[19] 郝勇, 孙旭东, 耿响. 山茶油中脂肪酸的拉曼光谱定量分析[J].食品科学, 2013, 34(18): 137-140. doi: 10.7506/spkx1002-6630-201318027.
[20] WU Xiaomei, XU Chao, TRIPP R A, et al. Detection and differentiation of foodborne pathogenic bacteria in mung bean sprouts using fi eld deployable label-free SERS devices[J]. Analyst, 2013,138: 3005-3012.
[21] 李言, 谢云飞, 钱和, 等. 表面增强拉曼光谱快速检测赤藓红[J]. 食品工业科技, 2013, 34(11): 307-312.
[22] 周红武, 蔡志坚, 吴建宏. 非法食品添加剂拉曼检测中的荧光抑制[J].中国激光, 2013, 40(9): 223-228.
[23] 龚继来, 吕璞, 曾光明. 表面增强拉曼光谱在环境分析中的研究进展[J]. 化学传感器, 2009, 29(3): 8-12.
[24] LI Xiaozhou, YU Zhuang, YANG Tianyue, et al. Detection of organophosphorus pesticide residue on the surface of apples using SERS[J]. Spectroscopy and Spectral Analysis., 2013, 33(10): 2711-2714.
[25] ZHU Yiqun, LI Mingqiang, YU Daoyang, et al. A novel paper rag as ‘D-SERS' substrate for detection of pesticide residues at various peels[J]. Talanta, 2014, 128: 117-124.
[26] RAVINDRANATH S P, WANG Yuling, IRUDAYARAJ J. SERS driven cross-platform based multiplex pathogen detection[J]. Sensors and Actuators B: Chemical, 2011, 152(2): 183-190.
[27] NENG Jing, HARPSTER M H, ZHANG Hao, et al. A versatile SERS-based immunoassay for immunoglobulin detection using antigencoated gold nanoparticles and malachite green-conjugated protein A/ G[J]. Biosensors and Bioelectronics, 2010, 26(3): 1009-1015.
[28] NENG Jing, HARPSTER M H, WILSON W C, et al. Surfaceenhanced Raman scattering (SERS) detection of multiple viral antigens using magnetic capture of SERS-active nanoparticles[J]. Biosensors and Bioelectronics, 2013, 41: 316-321.
[29] 王青青, 吴水生. 灵芝孢子油的氧化稳定[J]. 福建中医药大学学报,2011, 21(1): 50-51.
[30] 魏东. 微胶囊多不饱和脂肪酸粉末的氧化稳定性研究[J]. 食品工业科技, 2007, 28(7): 88-93.
[31] 朱明华, 胡坪. 仪器分析[M]. 北京: 高等教育出版社, 2009: 330-332. [32] 齐川. 不同来源灵芝主要活性成分变异[D]. 杭州: 浙江农林大学,2012: 24-27.
[33] 金虎, 王卫东, 耿梅艳, 等. 亚油酸的拉曼光谱分析[J]. 安徽农业科学, 2009, 32(15): 6827-6828.
[34] FAN Ya, LI Shuang, XU Dapeng. Raman spectra of oleic acid and linoleic acid[J]. Spectroscopy and Spectral Analysis, 2013, 33(12): 3240-3243.
[35] 李书国, 张惠, 薛文通, 等. 一种简捷、快速、准确测定植物油酸值方法的研究[J]. 粮油加工, 2007(10): 83-86.
[36] 王勇, 刘宝林, 王欣, 等. 滴定法滴定稻米油酸值的影响分析[J]. 中国油脂, 2014, 39(11): 79-81.
Rapid Detection of Oxidative Rancidity of Ganoderma lucidum Spore Oil by Raman Spectroscopy
NENG Jing, XIANG Yannan, SUN Peilong
*
(Ocean College, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:In this work, Raman spectroscopy was employed to directly monitor the changes in the characteristic peaks of the unsaturated double bonds of Ganoderma lucidum spore oil during oxidative rancidity and the relationship between the peak intensity and oxidative rancidity was discussed. Raman scattering intensity decreased with increasing acid value and peroxide value and a linear correlation between acid value and the area of the characteristic peaks was determined. The kinetic parameters for the oxidative rancidity of Ganoderma lucidum spore oil were also determined. As a result, a new and fast approach for the detection of oxidative rancidity in Ganoderma lucidum spore oil by Raman spectroscopy was established. This method was further validated and used to measure the kinetic parameters of oxidative rancidity and screen antioxidants for Ganoderma lucidum spore oil.
Key words:Raman spectroscopy; Ganoderma lucidum spore oil; oxidative rancidity; rapid detection
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2015)24-0200-05
doi:10.7506/spkx1002-6630-201524037
收稿日期:2015-01-19
基金项目:国家自然科学基金青年科学基金项目(31301483);浙江省食药用菌产业创新战略联盟建设项目(2011LM201);浙江省教育厅科研项目(Y201329221)
作者简介:能静(1985—),女,讲师,博士,研究方向为食品安全与检测。E-mail:nengjing@zjut.edu.cn
*通信作者:孙培龙(1964—),男,教授,博士,研究方向为食品化学与资源利用。E-mail:sun_pl@zjut.edu.cn