
图 1 柚子茶加工工艺流程及取样点设计图
Fig.1 Scheme for pomelo tea processing with design of sampling points
刘雁雨 1,龚 蕾 1,张耀海 1,苏学素 2,焦必宁 1,3,4,*
(1.西南大学柑桔研究所,农业部柑桔产品质量安全风险评估实验室,
农业部柑桔及苗木质量监督检验测试中心,重庆 400712;2.西南大学化学化工学院,重庆 400715;3.国家柑桔工程技术研究中心,重庆 400712;4.柑桔学重庆市重点实验室,重庆 400712)
摘 要:为了解柚子茶加工过程中三唑磷残留的变化动态,通过田间喷施5 倍最高推荐剂量的三唑磷溶液以强化农药在柚子上的残留,然后按照柚子茶加工工艺进行加工,采用QuEChERS前处理技术结合气相色谱法检测三唑磷的含量,考察柚子茶加工过程对三唑磷残留量的影响。结果表明:三唑磷主要残留于柚的外果皮中,其残留量为全果的7.3 倍,而果肉中的残留量不足全果的3%。清洗可去除全果中28.5%的残留量;脱苦与浸糖处理均可显著降低外果皮中三唑磷的残留量,其加工因子分别为0.83和0.60;柚子茶成品中三唑磷残留量为0.18 mg/kg,最终加工因子为0.069。
关键词:三唑磷;柚子茶;加工因子
我国是世界第一大柚类生产国,主产区集中于福建、广东、广西、四川等地,目前年产量已达370万 t,并呈持续增长态势。柚类不仅用于鲜食,还可加工成多种产品,其中,柚子茶因具有营养丰富、风味独特等优点成为时下流行的养生饮品 [1-2]。然而,由于柚类在种植过程中常常发生多种病虫害,为保证果实的产量与品质,杀虫剂的使用不可避免。三唑磷化学名称为O,O-二乙基-O-(1-苯基-1,2,4-三唑-3-基)硫代磷酸酯,是一种中等毒性广谱有 机磷杀虫剂,不仅具有强烈的触杀和胃毒作用,而且渗透性较强,杀虫效果好,在柑橘种植过程中广泛使用。使用量的增加导致三唑磷残留超标问题凸 现,并成为制约我国柚类出口的瓶颈,为此,三唑磷成为我国和欧盟重点监测对象之一 [3]。欧盟规定柚子中三唑磷的最大残留限量(maximum residue limit,MRL)值为0.01 mg/kg [4],而我国三唑磷在柑橘中的MRL值为0.2 mg/kg [5]。一般来说,目前农产品MRL标准主要针对的是初级农产品(raw agricultural commodities,RAC),并不能反映加工食品(processed food commodities,PFC)中农药残留的真实值 [6]。大量研究表明,加工过程对农药残留会有不同程度的影响 [7-8]。残留升高、降低或者发生代谢转化与农药本身的化学性质、处理方式以及是否与基质发生反应等多种因素相关 [9]。因此,通过研究加工过程对农药残留的影响,不仅可以为优化加工工艺提供依据,还可以为农药残留监测提供数据支撑 [10]。
目前,有关三唑磷的报道主要集中在田间残留动态研究 [11-12],何宗桃等 [11]通过田间试验研究了三唑磷在柑橘和土壤中的消解规律,结果表明,三唑磷在果皮、全果及土壤中的半衰期分别为29.3、28.9 d和10.0 d,表现出明显的接触性残留规律,建议安全间隔期定为20 d。加工过程对三唑磷的影响研究相对较少:赖珏琼等 [13]研究了烹调对黄瓜等10 种蔬菜中三唑磷等5 种农药残留的去除作用,经过烹调处理后农药残留量均有不同程度的降低,其加工因子介于0.08~0.88之间,与乙酰甲胺磷、毒死蜱、杀螟硫磷及乐果相比,烹调处理对降低三唑磷的效果最小;毛雪飞等 [14]研究了三唑磷等16 种农药在橙汁加工过程中的残留行为,结果发现清洗和精滤是有效降低橙汁中三唑磷残留水平的关键操作。目前,有关三唑磷在柑橘糖制品中的残留动态仍处于空白状态。文献报道显示,果皮是农药残留富集的主要组织,而果皮又是柚子茶生产的主要原料之一。基于此,本实验选取三唑磷为供试农药,拟通过田间试验强化三唑磷在鲜果中的残留,模拟家庭制作柚子茶的工艺流程研究三唑磷在柚子茶加工过程中的残留变化规律,以期为加工工艺的优化及膳食暴露风险评估提供数据支撑。
1.1 材料与试剂
乙腈(色谱纯)和N-丙基乙二胺(粒径40~63 μm,孔径60 Å) 德国CNW Technologies GmbH公司;丙酮(色谱纯) 成都市科龙化工试剂厂;氯化钠、无水硫酸镁(均为分析纯) 国药集团化学试剂有限公司;三唑磷标准品(纯度>99%,CAS号:24017-47-8) 德国Dr. Ehrenstorfer GmbH公司;19.5%三唑磷水乳剂 成都科利隆生化有限公司。
1.2 仪器与设备
7890气相色谱仪(配火焰光度检测器)、DB-17毛细管柱(30 m×0.53 mm,1.00 μm) 美国安捷伦公司;KS260摇床、Vortex Genius 3涡旋混合器 德国IKA公司;CL31/CL31R多用途离心机 美国Thermo Fisher公司;WS-16D卫士电动喷雾器 山东卫士植保机械有限公司;XS205 电子天平(感量0.01 mg)、PB3002-S/ FACT分析天平(感量0.01 g) 瑞士梅特勒-托利多公司;电磁炉 广东美的生活电器制造有限公司。
1.3 方法
1.3.1 田间试验
研究加工过程对农药残留的影响时,为保证加工产品中均有农残检出,需通过田间试验强化初级农产品中的农药残留 [15]。选择福建文旦为供试柚子品种,田间试验于2014年10月8—24日在中国农科院柑桔研究所国家果树种质重庆柑橘圃进行,按照《农药残留试验准则》的相关方法划定试验小区,分别设试验区、隔离区及对照区。试验区设3 个重复小区,每小区3 棵果树,采用农用背式喷雾器进行喷药处理。三唑磷的推荐使用剂量为300~360 mg/kg,按照5 倍最高推荐剂量(1 800 mg/kg)兑水喷雾施药,每隔一周喷施一次,连续强化3 次,最后一次施药后间隔24 h采样并及时进行柚子茶加工实验 [16]。1.3.2 柚子茶的加工工艺及操作要点
按照参考文献[2]中柚子茶加工工艺流程进行柚子茶的模拟加工实验。加工时,将所采鲜果分为2个平行批次进行加工,并分别于清洗、去皮、脱苦、浸糖、配料及浓缩步骤后按照随机方式进行取样,所有样品经制样后贮于-20 ℃冰箱中待测。柚子茶加工工艺流程及取样点的设置如图1所示。

图 1 柚子茶加工工艺流程及取样点设计图
Fig.1 Scheme for pomelo tea processing with design of sampling points
清洗:将柚子全果置于流动的自来水下冲洗5 min。去皮:洗净后的全果用刀削去外果皮,去掉白皮层、囊衣和种子,将剥出来的果肉切碎打浆混匀。脱苦:将外果皮切成约1~2 cm长,宽度0.1~0.2 cm的细丝,按照料液比为1∶3将切好的外果皮置于5% NaCl溶液中煮沸20 min,清水漂洗5 次以除去残留的盐,挤干水分备用。浸糖:将脱苦后的外果皮放入含糖量50 °Brix的糖水溶液中浸泡24 h,料液比为1∶3。配料:将经过前处理的外果皮、果肉浆及白砂糖按大约1∶8.5∶7.5的比例配料,混合均匀。熬制:将配好的原料,加热到90 ℃,不断搅拌,保持20~30 min左右,熬制至可溶性固形物量达65 °Brix时,柚子皮变得透亮即可起锅。
1.3.3 标准溶液的配制
将1 mL 1 000 mg/L的三唑磷标准溶液用丙酮稀释10 倍,得到100 mg/L的三唑磷标准储备液,该质量浓度条件下三唑磷标准储备液可有效保存1 a,使用时根据需要稀释成相应质量浓度的标准溶液。
1.3.4 样品前处理
采用QuEChERS(quick, easy, cheap, effective, rugged,safe) [17]前处理样品。准确称取5 g样品(浸糖后的外果皮及柚子茶加2 mL水)于50 mL离心管中,加入10 mL乙腈,振荡提取5 min;加入2 g无水硫酸镁和0.5 g氯化钠,快速摇动使其分散于基质中,10 000 r/min离心5 min;取3 mL上清液,转入加有50 mg N-丙基乙二胺和150 mg无水硫酸镁的离心管中,涡旋1 min,3 000 r/min离心5 min;取1.6 mL上清液,氮吹近干,移取0.8 mL丙酮至样品瓶,涡旋后供气相色谱分析。每个样品检测平行设3 个重复。
1.3.5 色谱条件
DB-17毛细管柱;进样口温度:220℃;火焰光度检测器温度:250 ℃;柱温:150 ℃以50 ℃/min升温至250 ℃,保持10 min;载气:氮气(纯度≥99.999%),流速5.0 mL/min,恒流模式;燃气:氢气(纯度≥99.999%),流速75 mL/min;助燃气:空气,流速100 mL/min;进样方式:不分流进样;进样体积为1 μL。
上述色谱条件下,三唑磷的保留时间约为8.09 min。柚子茶空白基质、0.1 mg/L柚子茶基质标准溶液及产品柚子茶的色谱图见图2。
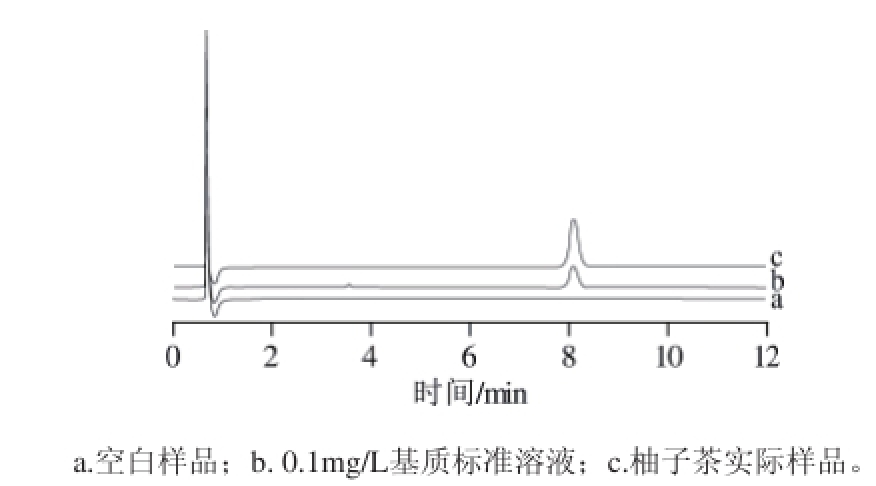
图 2 柚子茶的色谱图
Fig.2 Chromatograms of pomelo tea
1.3.6 添加回收实验
称取5.0 g均质空白样品(全果、果皮、果肉、柚子茶)于50 mL聚四氟乙烯离心管中,分别添加三唑磷标准溶液,添加量均为0.01、0.2 mg/kg和1 mg/kg,每个水平重复6 次,按1.3.4节方法前处理后进行添加回收率的测定。
1.4 数据处理与分析
采用加工因子(processing factors,PF)表示加工过程对农药残留的影响,其公式如下 [16]:
实验结果由SPSS 19.0统计分析软件进行单因素方差分析,用最小显著性差异检验法检验数据的差异性。
2.1 方法验证
2.1.1 基质效应
基质效应是指样品基质中某些共提取物组分对待测物质量浓度或质量测定准确度的影响 [18]。本实验采用溶剂和基质空白溶液分别配制10、5、1、0.5、0.1、0.05、0.01、0.005 mg/L的三唑磷标准工作溶液,以峰面积为纵坐标、质量浓度为横坐标绘制标准曲线,通过基质匹配标准曲线与溶剂标准曲线的斜率之比考察基质效应的强弱。如表1所示,两者斜率之比介于0.86~1.06之间,即三唑磷在全果、果皮、果肉及柚子茶中均存在不同程度的基质效应。为了提高定量的准确性,采用空白基质配制标准溶液绘制标准曲线 [19]。
表1 不同空白基质中三唑磷的线性方程、相关系数、检出限和
定量限(n==66)
TTaabbllee 11 RReeggrreessssiioonn eeqquuaattiioonn wwiitthh ccoorrrreellaattiioonn ccooeeffffi i cciieenntt, LLOODD aanndd LOQ for triazophos in different blank matrices (n == 66)
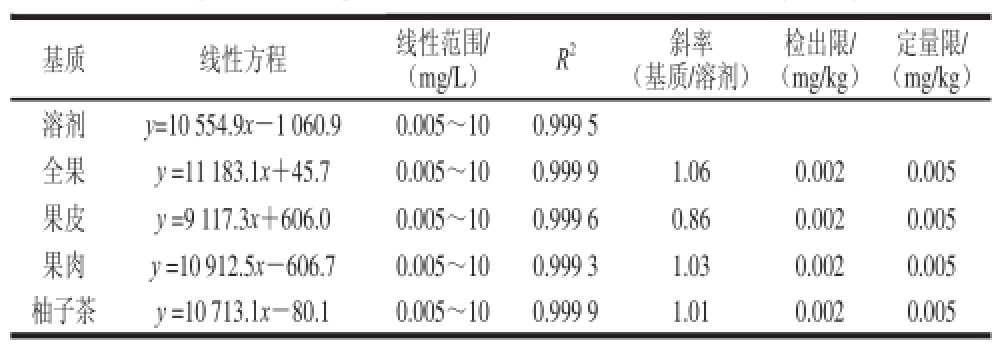
基质 线性方程 线性范围/ (mg/L) R 2 斜率(基质/溶剂)检出限/ (mg/kg)定量限/ (mg/kg)溶剂 y=10 554.9x-1 060.9 0.005~10 0.999 5全果 y =11 183.1x+45.7 0.005~10 0.999 9 1.06 0.002 0.005果皮 y =9 117.3x+606.0 0.005~10 0.999 6 0.86 0.002 0.005果肉 y =10 912.5x-606.7 0.005~10 0.999 3 1.03 0.002 0.005柚子茶 y =10 713.1x-80.1 0.005~10 0.999 9 1.01 0.002 0.005
2.1.2 线性关系和灵敏度
如表1所示,线性相关系数的平方均大于0.999 3,方法的检出限和定量限分别以3 倍信噪比(R SN=3)和10 倍信噪比(R SN=10)确定,分别为0.002 mg/kg和0.005 mg/kg,满足农药残留定量分析的要求。
2.1.3 方法的准确度和精密度
如表2所示,在添加量为0.01~1 mg/kg范围内,三唑磷在全果中的添加回收率为92.3%~101.2%(相对标准偏差为1.8%~4.4%),在果皮中的添加回收率为96.5%~107.0%(相对标准偏差为2.1%~3.0%),在果肉中的添加回收率为93.9%~99.7%(相对标准偏差为0.9%~6.6%),在柚子茶中的添加回收率为92.3%~99.1%(相对标准偏差为4.3%~5.9%)。三唑磷在各基质中的添加回收率和相对标准偏差均符合农药残留实验准则的要求 [20]。
表2 三唑磷在不同空白基质中的添加回收率及相对标准偏差(n==66)TTaabbllee 22 RReeccoovveerriieess aanndd RRSSDDss ooff ttrriiaazzoopphhooss ssppiikkeedd iinnttoo ddiiffffeerreenntt blank matriceess (n == 66)

基质 加标量/ (mg/kg)平均回收率/% 相对标准偏差/%全果0.01 92.3 3.1 0.2 98.0 4.4 1 101.2 1.8果皮0.01 107.0 2.1 0.2 96.5 2.9 1 106.4 3.0果肉0.01 99.7 5.2 0.2 93.9 0.9 1 97.1 6.6柚子茶0.01 97.5 5.9 0.2 99.1 4.3 1 92.3 4.6
2.2 三唑磷在柚全果中的残留分布由表3可知,经田间农药强化的原料果中,三唑磷在全果中的残留量为2.60 mg/kg,其中外果皮、白皮层、囊衣及果肉中的残留量分别为18.88、0.19、0.013、
表3 三唑磷在柚子中的残留分布(n==33)
TTaabbllee 33 DDiissttrriibbuuttiioonn ooff ttrriiaazzoopphhooss rreessiidduueess iinn vvaarriioouuss ppaarrttss ooff pomelo f r uiitt (n == 33)
mg/kg
全果 外果皮 白皮层 囊衣 果肉2.60±0.091 18.88±0.92 0.19±0.033 0.013±0.001 20.073±0.003 7
0.073 mg/kg,可见三唑磷主要残留于柚的外果皮中,果肉中的三唑磷残留量很低,不足全果的3%。残留在各组织中的分布主要与农药的理化性质如水/脂溶性、辛醇/水分配系数(K ow值)及农药的作用方式如渗透性等相关,一般情况下,K ow值越大其脂溶性和渗透性越强。三唑磷的K ow值为2 200,其脂溶性、渗透性较强,能穿透外果皮中蜡质层在果皮中富集,阻止残留进入果肉中,因此,果肉中含量低。
2.3 柚子茶加工过程中三唑磷的残留量变化及加工因子
表 4 样品中三唑磷的残留量及不同加工过程的加工因子(n==33)
TTaabbllee 44 TThhee rreessiidduuee lleevveellss ooff ttrriiaazzoopphhooss iinn rreeaall ssaammpplleess aanndd PPFFss ffoorr different processing stages of pomelo tea (nn == 33)

注:不同小写字母的数值间差异显著(P<0.05)。
加工过程 样品 三唑磷残留量/(mg/kg) 加工因子原料果 2.60 a±0.11清洗 清洗后的原料果 1.86 a±0.02 0.72去皮 外果皮 12.65 b±0.75 4.87果肉 0.076 c±0.004 2 0.029脱苦 脱苦后的外果皮 10.52 d±1.22 0.83浸糖 浸糖后的外果皮 7.64 e±0.57 0.60糖液 0.17±0.021配料 处理后的外果皮与果肉按比例混合 0.55 f±0.044熬制 柚子茶 0.18 f±0.015 0.069
柚子茶加工主要包括清洗、去皮、外果皮的前处理、配料及熬制5 步,表4所列为整个加工过程中三唑磷残留量的变化情况及各操作单元的加工因子。
2.3.1 清洗
由表4可见,清洗前后全果中三唑磷的残留量分别为2.60 mg/kg和1.86 mg/kg,即清洗可去除全果中28.5%的三唑磷残留,其加工因子为0.72。清洗对农药残留的去除效果与农药理化性质,如极性、水/脂溶性、K ow值、蒸汽压直接相关 [21-22]。20 ℃时三唑磷在水中的溶解度为30~40 mg/L,且其lgK ow值为3.34,具有一定的水溶性,清洗在一定程度上能降低三唑磷残留。
2.3.2 去皮
去皮对农药残留的去除率通常可达60%~100% [23]。本实验中,去皮处理后果肉中的三唑磷残留仅为0.076 mg/kg,其加工因子为0.029,针对全果来讲,去皮对三唑磷的去除率高达97.1%;外果皮中的三唑磷残留量达12.65 mg/kg,加工因子为4.87,表现出显著的富集效应。柚果皮约占果实质量30%,包括外果皮和白皮层。外果皮富含精油、柚苷等成分,白皮层富含果胶等,可用来制作蜜饯和提取精油及柚苷等功能成分。故在果皮的综合利用时应充分考虑农药富集带来的安全性问题。
2.3.3 外果皮前处理
由于外果皮中残留量较高,且含柚苷等苦味成分,前处理尤为重要。一般前处理工艺包括脱苦与浸糖两步。实验发现按照料液比1∶3脱苦前后三唑磷的残留量分别为12.65 mg/kg和10.52 mg/kg,脱苦处理可去除16.8%的三唑磷残留;经脱苦处理的果皮按相同料液比浸糖后其残留量降至7.64 mg/kg,去除率达27.4%。两步处理均显著降低三唑磷的残留量,加工因子为0.60。脱苦与浸糖能有效降低残留量的原因除了高温作用外,也可能与渗透压有关,实验发现糖液中三唑磷的残留量为0.17 mg/kg,即浸糖过程中部分残留在渗透压的作用下由果皮组织进入糖液中。
2.3.4 配料
配料是将前处理好的外果皮、果肉及白砂糖按一定比例混合,结果发现,混合后的原料中三唑磷残留量为0.55 mg/kg,远远低于外果皮中的残留量。原因在于果肉中三唑磷残留量较低,与少量残留量较高的外果皮混合后,相当于对果皮中残留的三唑磷进行了稀释,从而导致残留量下降。
2.3.5 熬制
熬制浓缩是柚子茶生产的关键环节,本实验中浓缩前后三唑磷的残留量分别为0.55 mg/kg和0.18 mg/kg,即经过熬制处理其残留量降低了67.3%,这可能是在熬制过程中三唑磷发生水解而降低产品中的残留。有研究报道 [3],三唑磷水溶液的降解过程符合一级反应动力学方程,并且温度提高,其水解速率有所加快。
三唑磷主要残留于外果皮中,其残留量为全果中的
7.3 倍,而果肉中残留量不足全果的3%。清洗能去除全果中28.5%的三唑磷残留量;外果皮前处理可显著降低三唑磷残留量,其加工因子为0.60;加热熬制对三唑磷的去除效果显著,达67.3%。经家庭柚子茶加工工艺制成的成品中三唑磷含量从原料果的2.60 mg/kg降低至0.18 mg/kg,最终加工因子为0.069。本实验采用5 倍推荐高剂量强化了柚中三唑磷残留,远高于实际柚果生产中的使用质量浓度,因此,利用安全使用剂量下生产的柚子制作柚子茶,其残留量还要显著降低,可安全食用。
参考文献:
[1] 郑淑娟, 罗金辉. 中国柚类产业现状与发展分析[J]. 广东农业科学,2010, 22(1): 192-194.
[2] 吴厚玖. 柑橘加工及综合利用技术[M]. 重庆: 重庆出版社, 2007: 52-55.
[3] HOLDEN A J, LI Chen, SHAW I C. Thermal stability of organophosphorus pesticide triazophos and its relevance in the assessment of risk to the consumer of triazophos residues in food[J]. Journal of Agricultural and Food Chemistry, 2001, 49(1): 103-106.
[4] Food and Agriculture Organization. Pesticide residues in food[R]. Geneva, Switzerland: FAO, 2005.
[5] 卫生部. GB 2763—2014 食品中农药最大残留限量[S]. 北京: 中国标准出版社, 2014.
[6] 李安, 潘立刚, 王纪华, 等. 农药残留加工因子及其在膳食暴露评估中的应用[J]. 食品安全质量检测学报, 2014, 5(2): 309-315.
[7] WEI Peng, ZHAO Liuwei, LIU Fengmao, et al. Effect of paste processing on residue levels of imidacloprid, pyraclostrobin,azoxystrobin and fipronil in winter jujube[J]. Food Additives and Contaminants: Part A, 2014, 31(9): 1562-1567.
[8] LIU Na, DONG Fengshou, LIU Xingang, et al. Effect of household canning on the distribution and reduction of thiophanate-methyl and its metabolite carbendazim residues in tomato[J]. Food Control, 2014,43(1): 115-120.
[9] GONZALEZ-RODRIGUEZ R M, RIAL-OTERO R, CANCHOGRANDE B, et al. A review on the fate of pesticides during the processes within the food-production chain[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(2): 99-114.
[10] 李云成, 张耀海, 陈卫军, 等. 橙汁加工过程对农药炔螨特残留的影响[J]. 农业工程学报, 2012, 28(9): 270-275.
[11] 何宗桃, 龚道新, 贺兰, 等. 三唑磷在柑橘和土壤中残留行为的研究[J].湖南农业科学, 2009, 21(9): 100-102.
[12] 陈萱. 三唑磷在柑桔中的残留分析方法及其动态研究[D]. 长沙: 湖南农业大学, 2005.
[13] 赖珏琼, 田子华, 潘康标, 等. 烹调因子在农药残留膳食暴露评估中应用[J]. 中国公共卫生, 2009, 25(4): 402-404.
[14] 毛雪飞, 焦必宁, 钱永忠, 等. 加工过程对水果及其制品中农药残留的影响[J]. 核农学报, 2008, 22(1): 71-76.
[15] BfR. BfR compilation of processing factor for pesticide residues[R/OL]. [2011-10-20]. http://www.bfr.bund.de/en/search.html.
[16] Organization for economic co-operation and development. Magnitude of the pesticide residues in processed commodities[R]. OECD guideline for the testing of chemicals, 2008.
[17] LEHOTAY S J, KOK A, HIEMSTRA M, et al. Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection[J]. Journal of AOAC International, 2005,88(2): 595-614.
[18] 杨旭, 汤佳峰, 巢文军. 基质效应对有机磷农药测定的影响及其解决方法[J]. 分析测试学报, 2009, 28(12): 1368-1372.
[19] DU Pengqiang, LIU Xingang, GU Xiaojun, et al. Residue behaviour of six pesticides in button crimini during home canning[J]. Food Additives and Contaminants: Part A, 2014, 31(6): 1081-1088.
[20] 农业部. NY/T 788—2004 农药残留试验准则[S]. 北京: 中国农业出版社, 2004.
[21] BAJWA U, SANDHU K S. Effect of handling and processing on pesticide residues in food: a review[J]. Journal of Food Science and Technology, 2014, 51(2): 201-220.
[22] AMVRAZI E G. Fate of pesticide residues on raw agricultural crops after postharvest storage and food processing to edible portions[M]. Intech Open Access Publisher, 2011.
[23] HAN Yongtao, XU Jun, DONG Fengshou, et al. The fate of spirotetramat and its metabolite spirotetramat-enol in apple samples during apple cider processing[J]. Food Control, 2013, 34(2): 283-290.
Effect of Home Processing on Triazophos Residues in Pomelo Tea
LIU Yanyu
1, GONG Lei
1, ZHANG Yaohai
1, SU Xuesu
2, JIAO Bining
1,3,4,*
(1. Citrus Research Institute, Laboratory of Quality and Safty Risk Assessment for Citrus Products, Quality Supervision and Testing Centre for Citrus and Seedling, Ministry of Agriculture, Southwest University, Chongqing 400712, China; 2. College of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China; 3. National Citrus Engineering Research Center,Chongqing 400712, China; 4. Chongqing Municipal Key Laboratory for Citrus, Chongqing 400712, China)
Abstract:The effect of home processing of pomelo tea on triazopho residues was investigated. The pesticide residues were strengthened by spraying triazophos at fivefold higher dosage in the field trials and detected using Quick, Easy, Cheap,Effective, Rugged, Safe (QuEChERS) pretreatment combined with gas chromatography (GC). The results showed that the triazophos residues were mainly distributed in pomelo peel, in which its concentration was 7.3 times higher than that of the whole fruit while its residues in fl esh accounted for less than 3% of the total residues in the whole fruit. The washing step decreased the concentration of triazophos in peel by 28.5%. Debittering and sugar-dipping gave signifi cantly reduced triazophos residues with processing fact ors (PFs) of 0.83 and 0.60, respectively. The whole process can reduce the residue of triazophos to 0.18 mg/kg in pomelo tea with a PF value of 0.069.
Key words:triazophos; pomelo tea; processing factor
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2015)24-0209-05
doi:10.7506/spkx1002-6630-201524039
收稿日期:2015-02-27
基金项目:国家现代农业(柑桔)产业技术体系建设专项(CARS-27);国家农产品质量安全风险评估重大专项(GJFP2015004);重庆市自然科学基金(重点)项目(cstc2013jjB80009)
作者简介:刘雁雨(1988—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:liuyanyu229@163.com
*通信作者:焦必宁(1964—),男,研究员,本科,研究方向为果蔬贮藏加工技术与质量安全。E-mail:bljiao@tom.cn