表1 流动相梯度洗脱程序Table 1 Mobile phase gradients

时间/min A-B(V/V)0 10∶90 2~6.5 90∶10 6.6~7.5 10∶90
虞 淼 1,吴淑春 2,*
(1.浙江省农药检定管理所,浙江 杭州 310020;2.浙江医学高等专科学校,浙江 杭州 310053)
摘 要:建立一种高效液相色谱-串联质谱同时测定草莓和杨梅中20 种植物生长调节剂残留的分析方法。样品经含1%乙酸的乙腈溶液提取后,以Phenomenex XB-C 18(100 mm×2.1 mm,2.6 μm)为分析色谱柱,甲醇和5 mmol/L乙酸铵-0.1%乙酸缓冲溶液为流动相进行梯度洗脱,基质匹配标准溶液外标法定量。结果表明,20种植物调节剂在各自的质量浓度范围内线性关系良好(r≥0.990 0),草莓和杨梅中3 个添加量的回收率为70.0%~114.8%,相对标准偏差(n=5)为1.25%~11.1%,检出限在0.14~2.9 μg/kg之间。该方法操作简单、提取效果好,具有良好的灵敏度、回收率和重复性。
关键词:高效液相色谱-串联质谱;植物生长调节剂;草莓;杨梅;残留
植物生长调节剂是仿照植物激素的化学结构,人工合成的具有植物激素活性的物质。植物生长调节剂具有许多优越性,如高效、甚至痕量就能调控植物细胞分化、组织与器官形成、种子休眠与萌发、叶子衰老与脱落 [1-3]。根据功能不同,植物生长调节剂分为生长素、赤霉素、生长抑制剂、细胞分裂素4 类 [4]。
植物生长调节剂在现代农业中发挥了重要的作用,也在世界范围内得到了广泛的应用,但对食品安全和人类健康带来的危害也同样引起了世界各国的重视 [5]。国际食品法典委员会、欧盟、美国、日本等纷纷制定了水果中植物生长调节剂的最大残留限量标准 [6-8]。我国在GB 2763—2014《食品中农药最大残留限量标准》中,制定了13 种植物生长调节剂在某些农产品中的最大残留限量指标 [9]。虽然植物生长调节剂残留引起了我国的重视,但我国还没有关于植物生长调节剂残留的标准分析方法,这不仅会危及到我国的食品安全及国民健康,更不利于我国农作物在出口贸易中打破贸易壁垒。
植物生长调节剂残留量检测方法的报道已经很多,主要采用液相色谱法 [3,10-12]和液相色谱-质谱联用法 [5,13-21]。这些报道的检测方法中绝大多数只研究了单一组分、单一种类或少数种类的检测,而同时检测4 类、20 种及以上植物生长调节剂的报道却很少。本研究的目的在于建立一种样品前处理简单有效、快速、可靠的高效液相色谱-串联质谱(high performance liquid chromatographytandem mass spectrometry,HPLC-MS/MS)检测方法,该方法可以同时检测杨梅、草莓中4 类、20 种植物生长调节剂,应用于日常检测能大大缩短检测周期,降低检测成本,具有实际应用价值。
1.1 材料与试剂
乙腈(色谱级) 美国Tedia公司;甲醇(色谱级) 德国Merck公司;QuEChERS(quick, easy, cheap,effective, rugged, safe)提取试剂包(6.0 g硫酸镁、1.5 g醋酸钠)、QuEChERS净化试剂包(150 mg硫酸镁、50 mg N-丙基乙二胺固相吸附剂、50 mg C 18)、Strata NH 2柱(500 mg/6 mL) 美国Phenomenex公司;乙酸铵(色谱纯) 美国Fisher公司;乙酸(分析纯)浙江中星化工试剂有限公司;20 种植物生长调节剂标准物质:赤霉酸GA 3、脱落酸、2,4-二氯苯氧乙酸、对氯苯氧乙酸、对氟苯氧乙酸、6-苄氨基嘌呤、N6-异戊烯基腺嘌呤、3-吲哚丁酸、3-吲哚乙酸 德国Dr. Ehrenstorfer GmbH公司;矮壮素、甲哌鎓、多效唑、烯效唑、氯吡脲、噻苯隆、莠去津、氯苯胺灵、西玛津、甲萘威、反式-玉米素 美国Sigma-Aldrich公司,纯度不低于98%。
标准溶液配制:分别准确称取20 种植物生长调节剂标准物质,用甲醇配成质量浓度为100 mg/L的单标储备溶液。再以甲醇稀释成质量浓度分别为10 mg/L(赤霉酸GA 3、脱落酸、2,4-二氯苯氧乙酸、对氯苯氧乙酸、对氟苯氧乙酸、矮壮素、甲哌鎓)和5 mg/L(多效唑、烯效唑、氯吡脲、6-苄氨基嘌呤、噻苯隆、莠去津、氯苯胺灵、N6-异戊烯基腺嘌呤、3-吲哚丁酸、西玛津、甲萘威、3-吲哚乙酸、反式-玉米素)的混合标准溶液。
1.2 仪器与设备
Xevo TQD HPLC-MS-MS(配电喷雾电离源) 美国Waters公司;PL202-L(Ⅲ)电子天平 瑞士Mettler公司;组织匀浆仪、混合器 德国IKA公司;Milli-Q超纯水净化系统 美国Millipore公司;N-EVAP 112氮吹仪 美国Organonation Associates Jnc公司;电热恒温水浴锅 上海浦东荣丰科学仪器有限公司;3-15离心机 德国Sigma公司;微孔有机过滤膜(0.22 μm)。1.3 方法
1.3.1 HPLC条件
色谱柱:Phenomenex XB-C 18(100 mm×2.1 mm,2.6 μm);流动相A:甲醇,流动相B:5 mmol/L乙酸铵-0.1%乙酸缓冲溶液;流速:0.2 mL/min;进样量:5 μL;柱温:35 ℃。梯度洗脱程序见表1。1.3.2 MS条件
表1 流动相梯度洗脱程序Table 1 Mobile phase gradients

时间/min A-B(V/V)0 10∶90 2~6.5 90∶10 6.6~7.5 10∶90
离子源:电喷雾离子源(electrospray ionization,ESI);离子源温度:150 ℃;监测方式:多反应监测(multiple reac tion monitoring,MRM);毛细管电压:3.0 kV;脱溶剂气(氮气)温度:500 ℃;脱溶剂气流速:800 L/h;锥孔反吹气(氮气)流速:40 L/h;碰撞气(氩气)流速:0.15 mL/min;定量方式:外标法。其他MS条件如表2所示。
表2 20 种植物生长调节剂的质谱条件
Taabbllee 22 PPaarraammeetteerrss ffoorr ssiimmuullttaanneeoouuss ddeetteerrmmiinnaattiioonn ooff 2200 ppllaanntt ggrroowwtthh regulators by HPLC-MS//MMSS
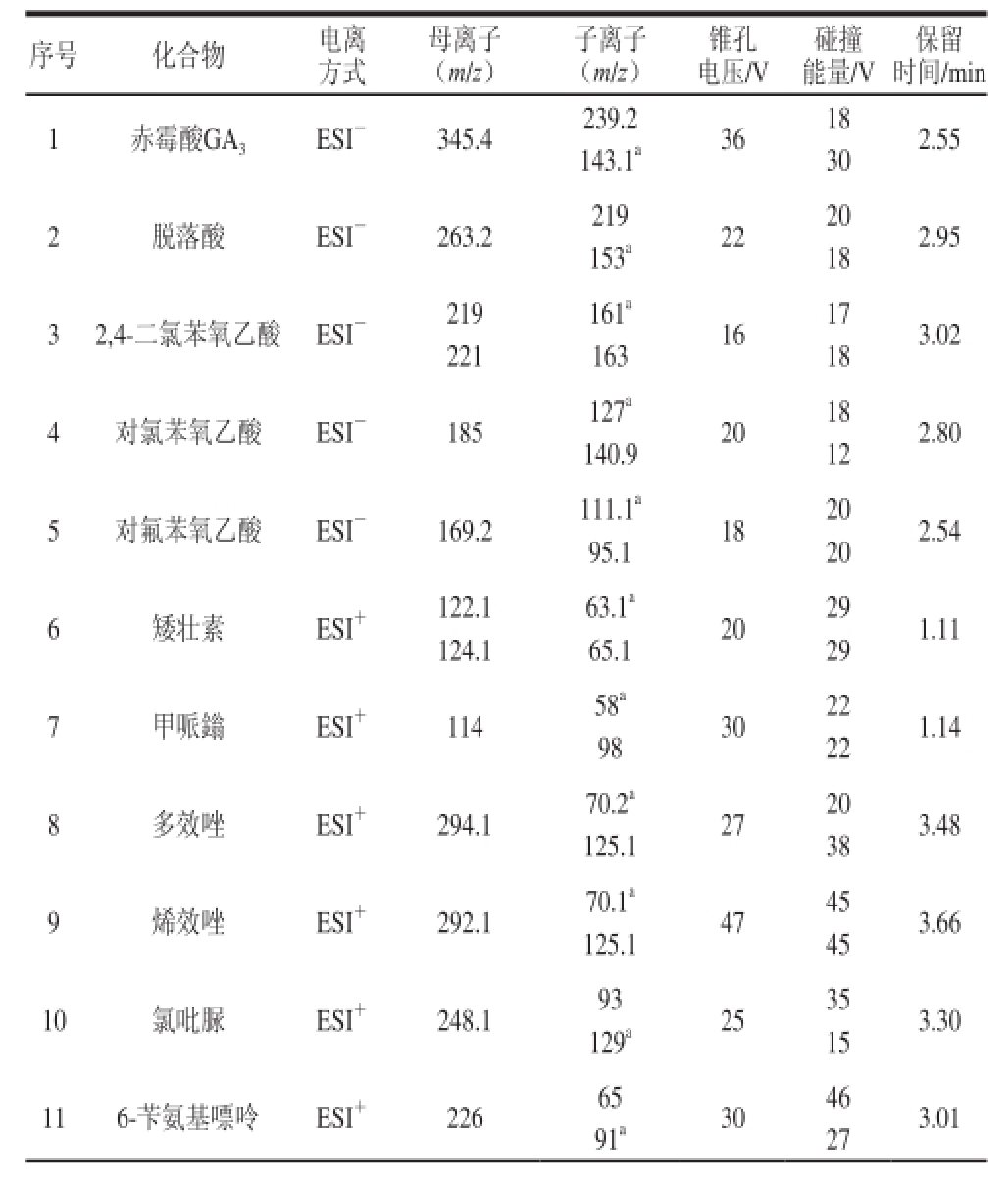
序号 化合物 电离方式母离子(m/z)子离子(m/z)锥孔电压/V碰撞能量/V保留时间/min 1 赤霉酸GA 3 ESI - 345.4 239.2 36 18 2.55 143.1 a 30 2 脱落酸 ESI - 263.2 219 22 20 2.95 153 a 18 3 2,4-二氯苯氧乙酸 ESI - 219 161 a16 17 3.02 221 163 18 4 对氯苯氧乙酸 ESI - 185 127 a20 18 2.80 140.9 12 5 对氟苯氧乙酸 ESI - 169.2 111.1 a18 20 2.54 95.1 20 6 矮壮素 ESI + 122.1 63.1 a20 29 1.11 124.1 65.1 29 7 甲哌鎓 ESI + 114 58 a30 22 1.14 98 22 8 多效唑 ESI + 294.1 70.2 a27 20 3.48 125.1 38 9 烯效唑 ESI + 292.1 70.1 a47 45 3.66 125.1 45 10 氯吡脲 ESI + 248.1 93 25 35 3.30 129 a 15 11 6-苄氨基嘌呤 ESI + 226 65 30 46 3.01 91 a 27
s
续表2
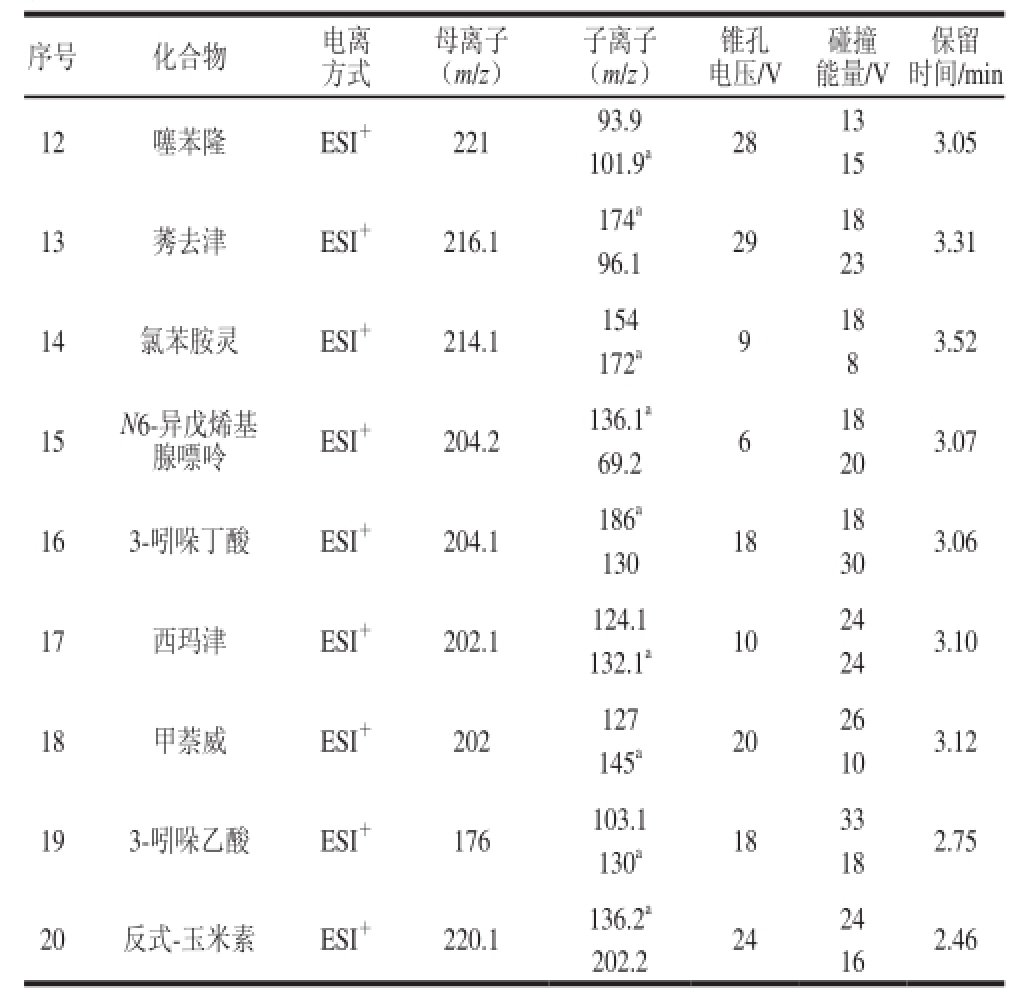
注:a.定量离子。
?
1.3.3 样品前处理
称取15 g试样(精确至0.01 g)于50 mL具塞离心管中,加入15 mL含1%乙酸的乙腈溶液,涡旋振荡2 min;再加入提取试剂包(含6.0 g硫酸镁、1.5 g醋酸钠),涡旋振荡2 min后,以5 000 r/min的转速离心5 min,吸取上清液1.0 mL,过0.22 μm有机滤膜,待测。
2.1 样品前处理条件的优化
2.1.1 提取剂的选择
这20 种植物生长调节剂的极性范围差异较大,可以选用对不同极性物质均有较好溶解度的乙腈作为提取剂,乙腈还具有有效降低色素等干扰物质的功能,适合多组分同时检测 [22]。另外在乙腈中加入1%乙酸,模拟水果的酸性环境,避免pH值变化引起碱不稳定化合物的降解。
QuEChERS方法是目前应用较多的果蔬样品前处理方法,其提取试剂中硫酸镁与醋酸钠4∶1的质量混合比例,能避免果糖等干扰物一同被提取出来 [23],适合于水果等果糖含量较高的食品样品前处理。
2.1.2 净化方式的选择
水果类样品,在植物生长调节剂提取时,容易将色素等低挥发性杂质共提取出来,固相萃取是除去色素的有效方式。本实验比较了QuEChERS净化、氨基柱净化和不净化样品的回收率,见图1。采用QuEChERS净化试剂处理后发现虽然能有效去除色素等杂质,但也造成了部分植物生长调节剂被吸附;采用氨基柱净化后的回收率虽符合分析要求,但也存在部分植物生长调节剂被吸附和部分植物生长调节剂响应信号被放大的现象。这两种净化方法不适合20 种组分的同时分析,所以最终采用不净化,提取后直接用于分析。

图 1 20 种植物生长调节剂净化效果比较
Fig.1 Effects of two adsorbents on the clean-up 20 plant growth regulators
2.1.3 提取方式的选择
比较了涡旋振荡提取、超声提取和冷提取3 种提取方式,结果表明这3 种提取方式所得的20 种植物生长调节剂的回收率差别不大。故选用耗时短,操作简便的涡旋振荡作为提取方式,这一结论与文献[15]相符。
2.2 检测条件的优化
2.2.1 色谱条件的优化
色谱柱和流动相的选择是植物生长调节剂多组分分析的前提条件。样品组分多且分析物极性差异较大时,大粒径和大内径的色谱柱对农药的分离度不够理想 [24-25]。本实验选用Phenomenex XB-C 18(100 mm×2.1 mm,2.6 μm)小粒径色谱柱,可在5 min之内完成20 种植物生长调节剂的分离检测。
本实验考察了乙腈-水、甲醇-水以及甲醇-0.1%乙酸溶液、甲醇-0.1%乙酸-乙酸铵缓冲溶液等作流动相时的分离情况。有机相选择结果表明甲醇和乙腈都能达到分离度要求,但峰形还不理想,从经济考虑,选择甲醇作为有机相。在甲醇中加入0.1%乙酸调节pH值后,提高了监测灵敏度,但分离效果和峰形仍然欠佳。乙酸铵具有增强离子化效率,改善各化合物峰形的作用,于是在流动相中继续加入乙酸铵溶液。本实验考察了3 个水平:2、5、10 mmol/L,结果发现5 mmol/L乙酸铵溶液效果最好。浓度太低,不能有效调整峰形。浓度太高又抑制了电离,降低灵敏度。因此流动相采用甲醇和5 mmol/L乙酸铵-0.1%乙酸缓冲溶液,采用梯度洗脱的方式(表1),达到较好的分离效果及灵敏度。各植物生长调节剂混合加标草莓样品溶液的MRM色谱图见图2。
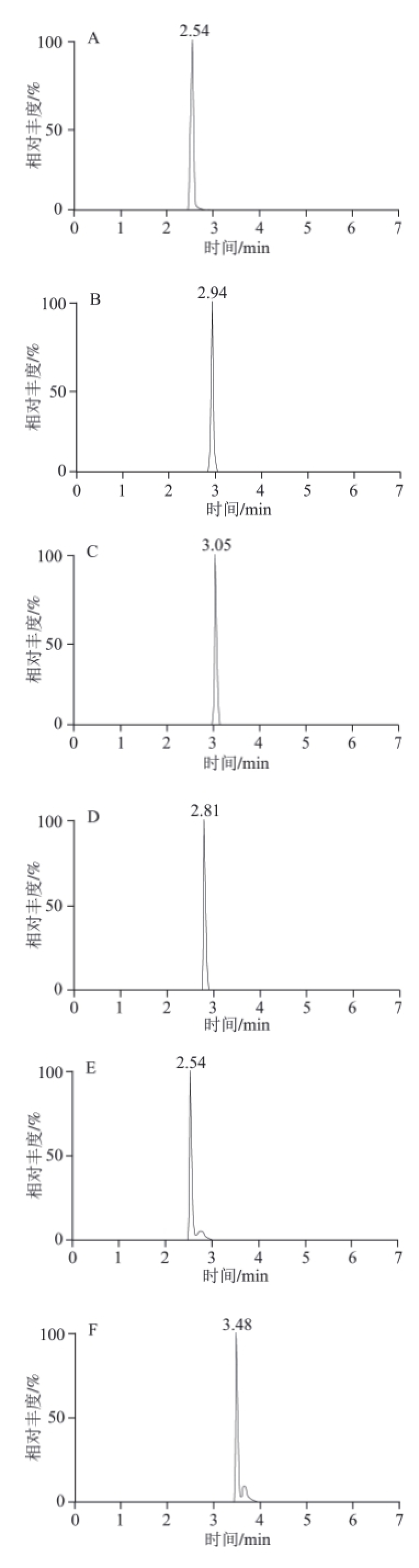
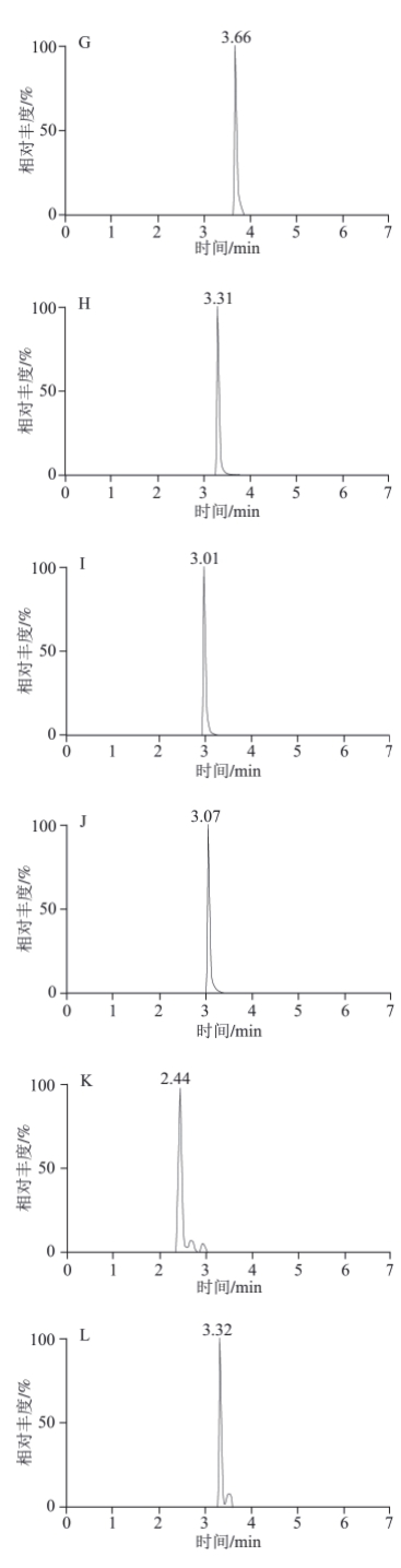
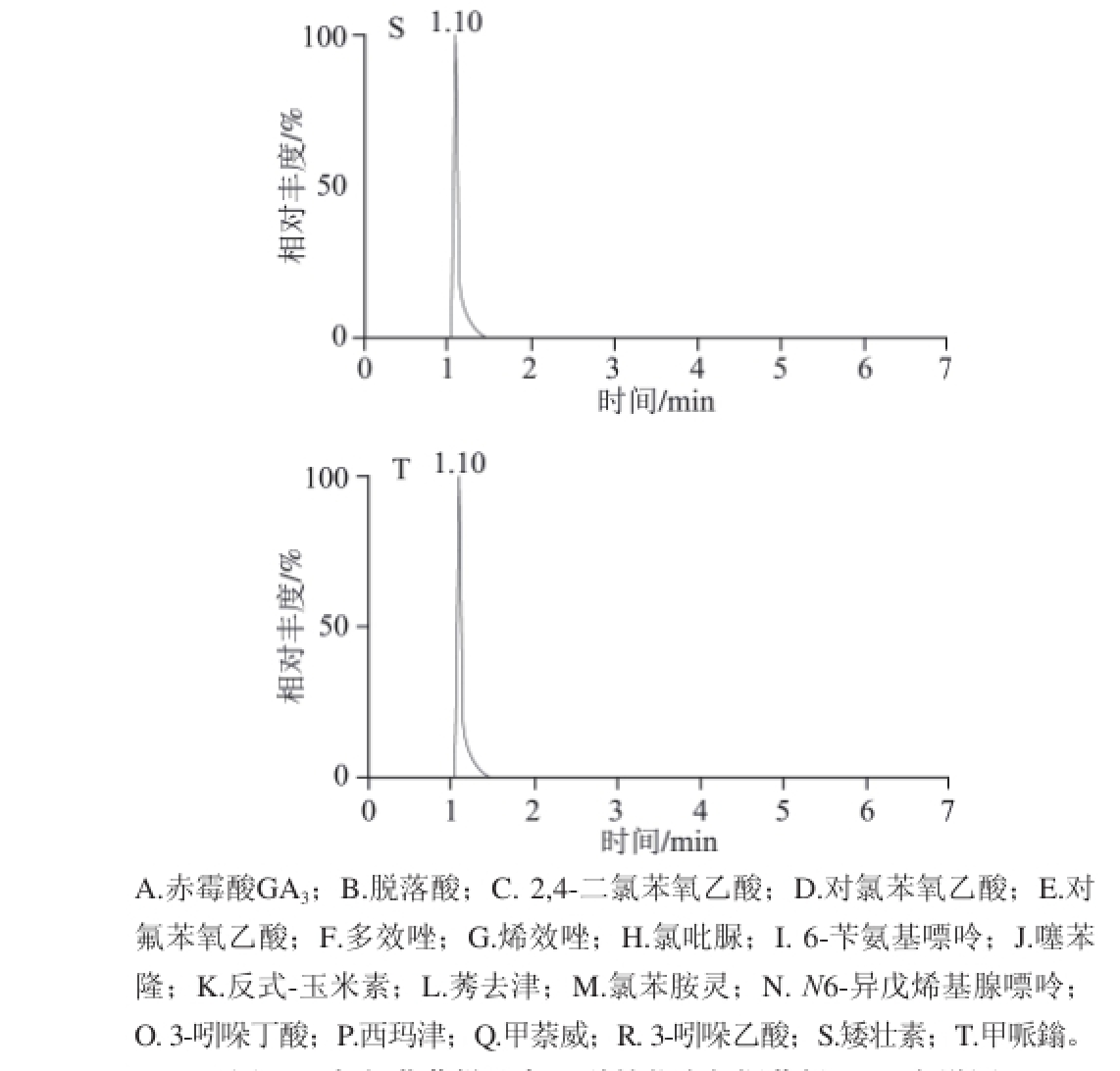
图2 加标草莓样品中20 种植物生长调节剂MRM色谱图
Fig.2 MRM chromatograms of 20 plant growth regulators spiked in strawberry sample
2.2.2 MS条件的优化
选用ESI进行电离,在正、负离子监测模式下,通过全扫描和MRM模式,优化锥孔电压、碰撞能量等条件,选择最佳的定性和定量离子对,相关MS分析参数见表2。
2.3 分析方法的评价
2.3.1 方法的线性范围与检出限
表3 植物生长调节剂的基质匹配线性方程、相关系数、
检出限和定量限(n==55)
TTaabbllee 33 MMaattrriixx--mmaattcchheedd ssttaannddaarrdd ccuurrvveess ffoorr 2200 ppllaanntt ggrroowwtthh regulatoorrss (nn == 55)
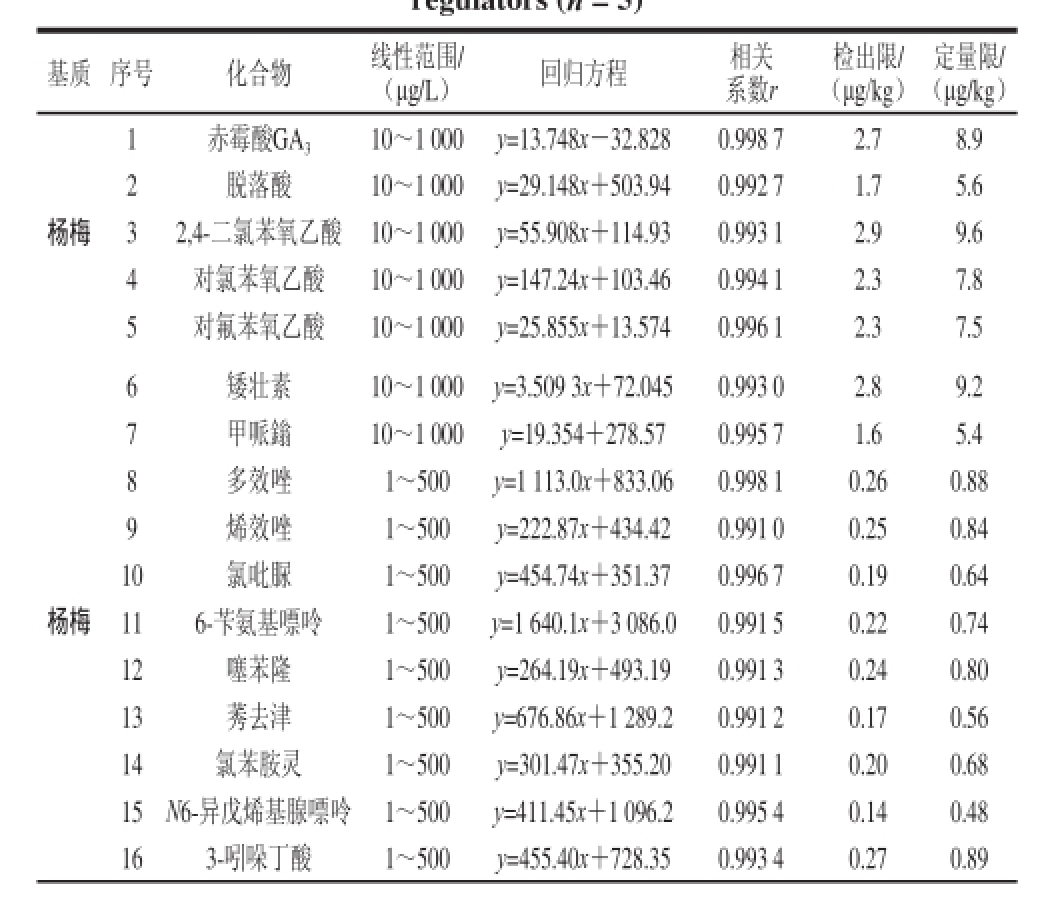
基质 序号 化合物 线性范围/ (μg/L) 回归方程 相关系数r检出限/ (μg/kg)定量限/ (μg/kg)杨梅1 赤霉酸GA 3 10~1 000 y=13.748x-32.828 0.998 7 2.7 8.9 2 脱落酸 10~1 000 y=29.148x+503.94 0.992 7 1.7 5.6 3 2,4-二氯苯氧乙酸 10~1 000 y=55.908x+114.93 0.993 1 2.9 9.6 4 对氯苯氧乙酸 10~1 000 y=147.24x+103.46 0.994 1 2.3 7.8 5 对氟苯氧乙酸 10~1 000 y=25.855x+13.574 0.996 1 2.3 7.5杨梅6 矮壮素 10~1 000 y=3.509 3x+72.045 0.993 0 2.8 9.2 7 甲哌鎓 10~1 000 y=19.354+278.57 0.995 7 1.6 5.4 8 多效唑 1~500 y=1 113.0x+833.06 0.998 1 0.26 0.88 9 烯效唑 1~500 y=222.87x+434.42 0.991 0 0.25 0.84 10 氯吡脲 1~500 y=454.74x+351.37 0.996 7 0.19 0.64 11 6-苄氨基嘌呤 1~500 y=1 640.1x+3 086.0 0.991 5 0.22 0.74 12 噻苯隆 1~500 y=264.19x+493.19 0.991 3 0.24 0.80 13 莠去津 1~500 y=676.86x+1 289.2 0.991 2 0.17 0.56 14 氯苯胺灵 1~500 y=301.47x+355.20 0.991 1 0.20 0.68 15 N6-异戊烯基腺嘌呤 1~500 y=411.45x+1 096.2 0.995 4 0.14 0.48 16 3-吲哚丁酸 1~500 y=455.40x+728.35 0.993 4 0.27 0.89
续表3
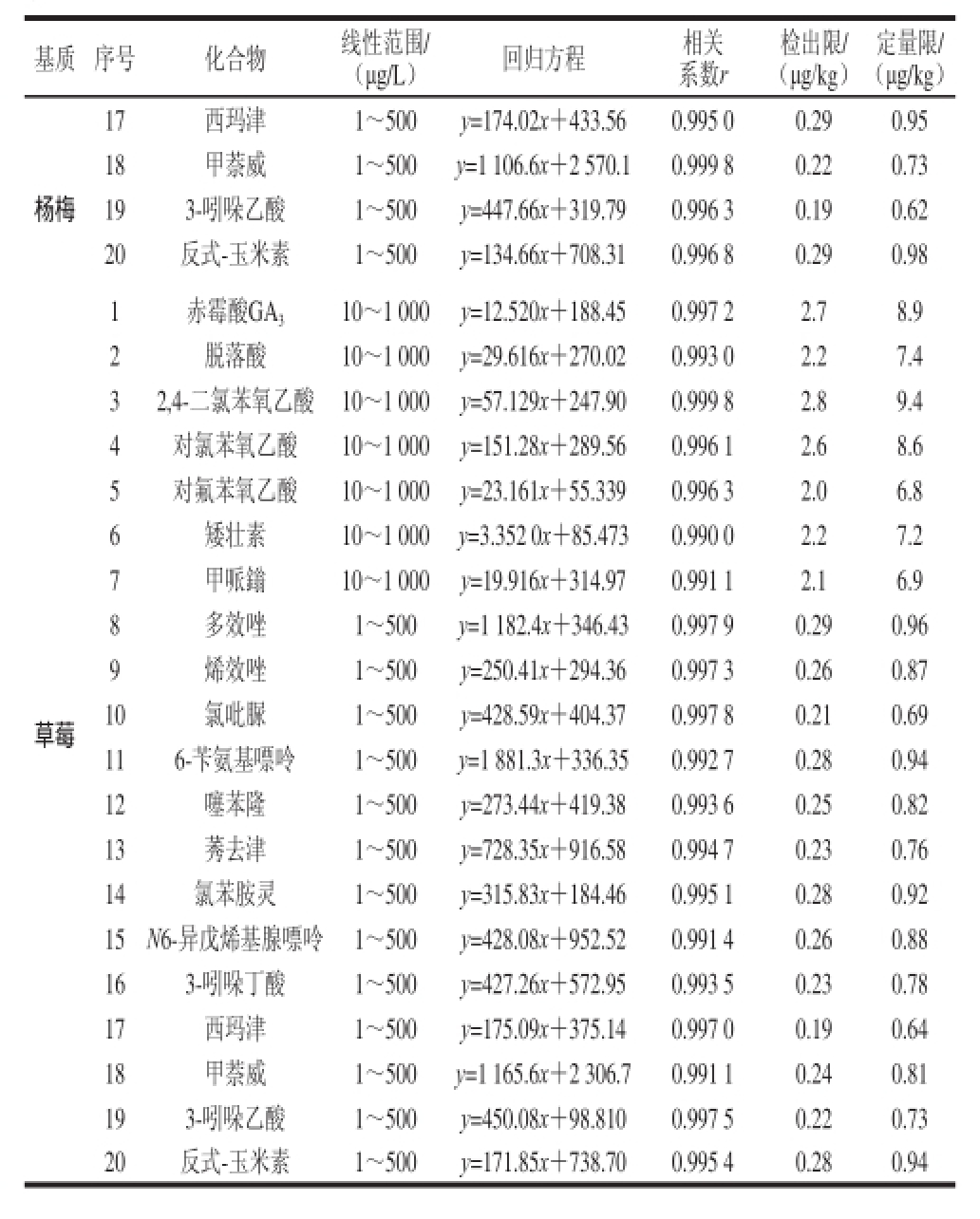
基质 序号 化合物 线性范围/ (μg/L) 回归方程 相关系数r检出限/ (μg/kg)定量限/ (μg/kg)17 西玛津 1~500 y=174.02x+433.56 0.995 0 0.29 0.95杨梅18 甲萘威 1~500 y=1 106.6x+2 570.1 0.999 8 0.22 0.73 19 3-吲哚乙酸 1~500 y=447.66x+319.79 0.996 3 0.19 0.62 20 反式-玉米素 1~500 y=134.66x+708.31 0.996 8 0.29 0.98草莓1 赤霉酸GA 3 10~1 000 y=12.520x+188.45 0.997 2 2.7 8.9 2 脱落酸 10~1 000 y=29.616x+270.02 0.993 0 2.2 7.4 3 2,4-二氯苯氧乙酸 10~1 000 y=57.129x+247.90 0.999 8 2.8 9.4 4 对氯苯氧乙酸 10~1 000 y=151.28x+289.56 0.996 1 2.6 8.6 5 对氟苯氧乙酸 10~1 000 y=23.161x+55.339 0.996 3 2.0 6.8 6 矮壮素 10~1 000 y=3.352 0x+85.473 0.990 0 2.2 7.2 7 甲哌鎓 10~1 000 y=19.916x+314.97 0.991 1 2.1 6.9 8 多效唑 1~500 y=1 182.4x+346.43 0.997 9 0.29 0.96 9 烯效唑 1~500 y=250.41x+294.36 0.997 3 0.26 0.87 10 氯吡脲 1~500 y=428.59x+404.37 0.997 8 0.21 0.69 11 6-苄氨基嘌呤 1~500 y=1 881.3x+336.35 0.992 7 0.28 0.94 12 噻苯隆 1~500 y=273.44x+419.38 0.993 6 0.25 0.82 13 莠去津 1~500 y=728.35x+916.58 0.994 7 0.23 0.76 14 氯苯胺灵 1~500 y=315.83x+184.46 0.995 1 0.28 0.92 15 N6-异戊烯基腺嘌呤 1~500 y=428.08x+952.52 0.991 4 0.26 0.88 16 3-吲哚丁酸 1~500 y=427.26x+572.95 0.993 5 0.23 0.78 17 西玛津 1~500 y=175.09x+375.14 0.997 0 0.19 0.64 18 甲萘威 1~500 y=1 165.6x+2 306.7 0.991 1 0.24 0.81 19 3-吲哚乙酸 1~500 y=450.08x+98.810 0.997 5 0.22 0.73 20 反式-玉米素 1~500 y=171.85x+738.70 0.995 4 0.28 0.94
采用基质匹配-外标法定量分析20 种植物生长调节剂。分别以杨梅、草莓的空白样品提取液配制不同质量浓度范围的植物生长调节剂混合标准溶液,在优化的色谱和质谱条件下进行测定,以质量浓度为横坐标(x,μg/L),定量离子对的峰面积(y)为纵坐标作图,绘制标准曲线,所得线性关系良好(r≥0.990 0),以3 倍信噪比(R SN=3)确立方法的检出限为0.14~2.9 μg/kg,以10 倍信噪比(R SN=10)确立方法的定量限为0.48~9.6 μg/kg,见表3。
2.3.2 方法的回收率与精密度
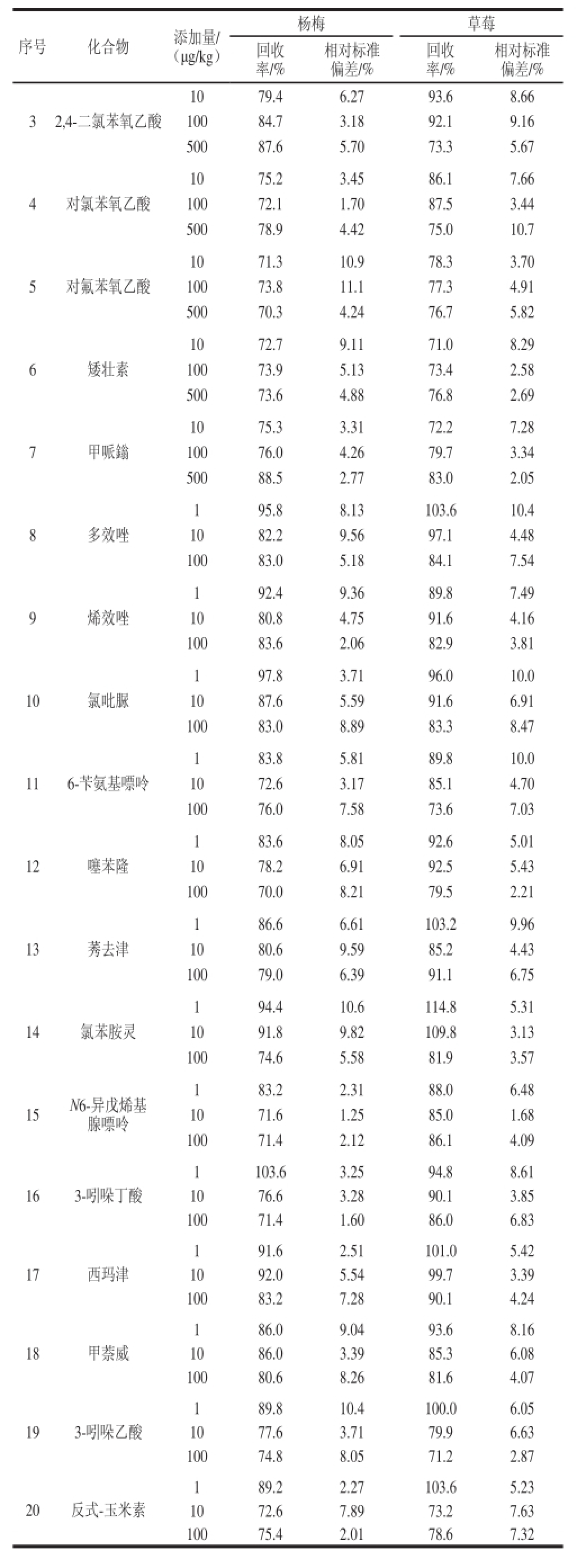
分别在阴性的杨梅、草莓样品基质中添加3 个添加量的植物生长调节剂标准,进行添加回收率和精密度实验。3 个添加量的回收率为70.0%~114.8%,相对标准偏差(n=5)为1.25%~11.1%,见表4。
表 4 20 种植物生长调节剂的平均回收率与精密度(n ==55)
TTaabbllee 44 RReeccoovveerriieess ooff 2200 ppllaanntt ggrroowwtthh rreegguullaattoorrss ssppiikkeedd iinn ssttrraawwbbeerrrryy and Chinese bayberryy (n ==55)
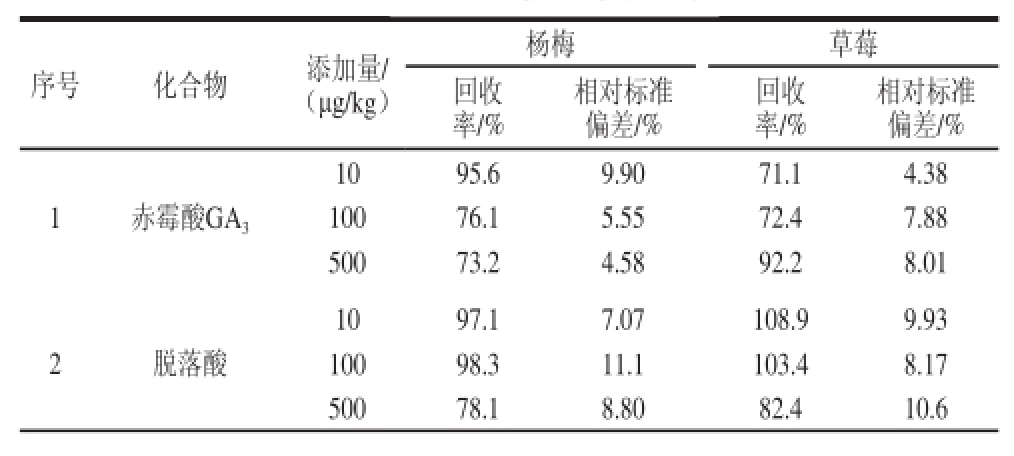
序号 化合物 添加量/ (μg/kg)杨梅 草莓回收率/%相对标准偏差/%回收率/%相对标准偏差/% 1 赤霉酸GA 310 95.6 9.90 71.1 4.38 100 76.1 5.55 72.4 7.88 500 73.2 4.58 92.2 8.01 2 脱落酸10 97.1 7.07 108.9 9.93 100 98.3 11.1 103.4 8.17 500 78.1 8.80 82.4 10.6
续表4
序号 化合物 添加量/ (μg/kg)杨梅 草莓回收率/%相对标准偏差/%回收率/%相对标准偏差/% 3 2,4-二氯苯氧乙酸10 79.4 6.27 93.6 8.66 100 84.7 3.18 92.1 9.16 500 87.6 5.70 73.3 5.67 4 对氯苯氧乙酸10 75.2 3.45 86.1 7.66 100 72.1 1.70 87.5 3.44 500 78.9 4.42 75.0 10.7 5 对氟苯氧乙酸10 71.3 10.9 78.3 3.70 100 73.8 11.1 77.3 4.91 500 70.3 4.24 76.7 5.82 6 矮壮素10 72.7 9.11 71.0 8.29 100 73.9 5.13 73.4 2.58 500 73.6 4.88 76.8 2.69 7 甲哌鎓10 75.3 3.31 72.2 7.28 100 76.0 4.26 79.7 3.34 500 88.5 2.77 83.0 2.05 8 多效唑1 95.8 8.13 103.6 10.4 10 82.2 9.56 97.1 4.48 100 83.0 5.18 84.1 7.54 9 烯效唑1 92.4 9.36 89.8 7.49 10 80.8 4.75 91.6 4.16 100 83.6 2.06 82.9 3.81 10 氯吡脲1 97.8 3.71 96.0 10.0 10 87.6 5.59 91.6 6.91 100 83.0 8.89 83.3 8.47 11 6-苄氨基嘌呤1 83.8 5.81 89.8 10.0 10 72.6 3.17 85.1 4.70 100 76.0 7.58 73.6 7.03 12 噻苯隆1 83.6 8.05 92.6 5.01 10 78.2 6.91 92.5 5.43 100 70.0 8.21 79.5 2.21 13 莠去津1 86.6 6.61 103.2 9.96 10 80.6 9.59 85.2 4.43 100 79.0 6.39 91.1 6.75 14 氯苯胺灵1 94.4 10.6 114.8 5.31 10 91.8 9.82 109.8 3.13 100 74.6 5.58 81.9 3.57 15 N6-异戊烯基腺嘌呤1 83.2 2.31 88.0 6.48 10 71.6 1.25 85.0 1.68 100 71.4 2.12 86.1 4.09 16 3-吲哚丁酸1 103.6 3.25 94.8 8.61 10 76.6 3.28 90.1 3.85 100 71.4 1.60 86.0 6.83 17 西玛津1 91.6 2.51 101.0 5.42 10 92.0 5.54 99.7 3.39 100 83.2 7.28 90.1 4.24 18 甲萘威1 86.0 9.04 93.6 8.16 10 86.0 3.39 85.3 6.08 100 80.6 8.26 81.6 4.07 19 3-吲哚乙酸1 89.8 10.4 100.0 6.05 10 77.6 3.71 79.9 6.63 100 74.8 8.05 71.2 2.87 20 反式-玉米素1 89.2 2.27 103.6 5.23 10 72.6 7.89 73.2 7.63 100 75.4 2.01 78.6 7.32
2.4 基质效应
在农药残留分析时,样品基质中的共提取物可能会抑制或增大分析物的响应信号,为消除基质效应,本研究以杨梅、草莓的空白基质溶液和甲醇分别稀释一系列标准溶液,进行HPLC-MS/MS分析,分别计算基质标准曲线与甲醇标准曲线的斜率比值,结果见表5。由表5可知,基质标准曲线斜率与甲醇标准曲线斜率的比值在0.221~1.64范围内,说明基质对各种植物生长调节剂的电离存在一定抑制或增强效应,因此,在实际样品检测中应采用空白基质提取液配制标准曲线,以减少基质效应带来的误差。
表5 基质标准曲线斜率与甲醇标准曲线斜率比值
TTaabbllee 55 RRaattiiooss ooff ssllooppeess ooff mmaattrriixx--mmaattcchheedd aanndd mmeetthhaannooll ssttaannddaarrdd ccuurrvveess

序号 化合物 杨梅 草莓1赤霉酸GA 3 0.758 0.691 2脱落酸 0.683 0.694 3 2,4-二氯苯氧乙酸 0.718 0.734 4对氯苯氧乙酸 0.740 0.760 5对氟苯氧乙酸 0.776 0.695 6矮壮素 0.553 0.529 7甲哌鎓 1.21 1.24 8多效唑 0.916 0.973 9烯效唑 0.771 0.866 10 氯吡脲 0.726 0.685 11 6-苄氨基嘌呤 1.11 1.27 12 噻苯隆 0.720 0.746 13 莠去津 0.329 0.345 14 氯苯胺灵 0.892 0.928 15 N6-异戊烯基腺嘌呤 1.03 0.962 16 3-吲哚丁酸 0.269 0.271 17 西玛津 1.61 1.64 18 甲萘威 0.361 0.363 19 3-吲哚乙酸 0.273 0.221 20 反式-玉米素 1.60 1.72
2.5 实际样品检测结果
应用该方法分别测定10 份市售杨梅和草莓样品中的植物生长调节剂残留量。其中一份草莓样品检出赤霉酸GA 3(含量为18.6 μg/kg),一份草莓检出脱落酸(含量为20.3 μg/kg),杨梅样品均未检出植物生长调节剂残留。
本实验建立了HPLC-MS/MS同时检测草莓和杨梅等水果中20 种植物生长调节剂残留的分析方法,该法样品前处理简单方便,线性关系良好,精密度、准确度较高、抗干扰性强,能够对植物生长调节剂残留量进行准确的定性及定量,可用于草莓和杨梅等水果中植物生长调节剂残留的检测。
参考文献:
[1] CHEN Hao, GUO Xiaofeng, ZHANG Huashan, et al. Simultaneous
determination of phytohormones containing carboxyl in crude extracts of fruit samples based on chemical derivatization by capillary electrophoresis with laser-induced fl uorescence detection[J]. Journal of Chromatography B, 2011, 879(20): 1802-1808.
[2] SHI Xiaomei, JIN Fen, HUANG Yuting, et al. Simultaneous determination of five growth regulators in fruits by modified quick,easy, cheap, effective rugged and safe (QuEChERS) extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2012, 60(1): 60-65.
[3] GUPTA V, KUMAR M, BRAHMBHATT H, et al. Simultaneous determination of different endogenetic plant growth regulators in common green seaweeds using dispersive liquid-liquid microextraction method[J]. Plant Physiology and Biochemistry,2011, 49(11): 1259-1263.
[4] 史晓梅. 多效唑等5 种植物生长调节剂检测技术及多效唑在桃上的残留研究[D]. 北京: 中国农业科学院, 2012.
[5] MA Liyan, ZHANG Hongyan, XU Wentao et al. Simultaneous determination of 15 plant growth regulators in bean sprout and tomato with liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Food Analytical Methods, 2013, 6: 941-951.
[6] 刘新艳, 欧阳喜辉, 潘灿平. 草莓等水果中生长调节剂残留分析方法概述[C]//北京农药学会. 农药与环境安全国际会议论文集. 2005: 290-296.
[7] 张宏军, 段丽芳, 李贤宾, 等. 我国植物生长调节剂限量标准与CAC限量标准的比对分析[J]. 农业科学与管理, 2013, 34(11): 1-5.
[8] 史晓梅, 金芬, 黄玉婷, 等. 水果中常用植物生长调节剂的研究进展[J].食品工业科技, 2012, 33(4): 417-422; 426.
[9] 国家卫生和计划生育委员会, 农业部. GB 2763—2014 食品中农药最大残留限量[S]. 北京: 中国标准出版社, 2014.
[10] 张莹, 鹿毅, 杨涛, 等. 高效液相色谱法测定果蔬中八种植物生长促进剂残留[J]. 分析测试学报, 2012, 31(4): 442-447.
[11] CAI Xiaoming, ZHAO Hua, WU Min, et al. Determining hydrogen cyanamide in fruit by derivatization with 6-aminoquinolyl-N-hydroxysuccinimidyl carbamate and HPLC with fluorescence detection[J]. Chromatographia, 2012, 75: 1069-1074.
[12] 符继红, 褚金芳, 王吉德, 等. 固相萃取反相高效液相色谱荧光检测法测定拟南芥中的生长素[J]. 分析化学, 2009, 37(9): 1324-1327.
[13] 赵瑛博, 周艳明, 忻雪, 等. 高效液相色谱-串联质谱法测定水果、蔬菜中赤霉素残留[J]. 食品科学, 2011, 32(6): 209-212.
[14] 徐生坚, 曹慧, 陈小珍. 超高效液相色谱-串联质谱法测定粮谷中6 种植物生长调节剂残留[J]. 食品科学, 2013, 34(18): 218-222. doi: 10.7506/spkx1002-6630-201318044.
[15] 牟艳莉, 郭德华, 丁卓平, 等. 高效液相色谱鄄串联质谱法测定瓜果中11 种植物生长调节剂的残留量[J]. 分析化学, 2013, 41(11): 1640-1646.
[16] 刘靖靖, 宫萍, 张晓梅, 等. 液相色谱-四极杆飞行时间质谱法快速测定草莓中6 种植物生长调节剂的残留量[J]. 色谱, 2012, 30(10): 1012-1016.
[17] CHO S K, El ATY A M A, PARK K H, et al. Simple multiresidue extraction method for the determination of fungicides and plant growth regulator in bean sprouts using low temperature partitioning and tandem mass spectrometry[J]. Food Chemistry, 2013, 136: 1414-1420.
[18] LI Minmin, LIU Xingang, DONG Fengshou, et al. Simultaneous determination of hexanoic acid 2-(diethylamino) ethyl ester and mepiquat chloride by ultra-performance liquid chromatography coupled to tandem mass spectrometry[J]. Analytical Methods, 2014, 4: 3804-3809.
[19] TRINE H, RENÉ K J, GYRITE B, et al. Analysis of the plant growth regulator chlormequat in soil and water by means of liquid chromatography-tandem mass spectrometry, pressurised liquid extraction, and solid-phase extraction[J]. Journal of Chromatography A, 2009, 1216: 2504-2510.
[20] ZHANG Fengzu, ZHAO Pengyue, SHAN Weili, et al. Development of a method for the analysis of four plant growth regulators (PGRS) residues in soybean sprouts and mung bean sprouts by liquid chromatography-tandem mass spectrometry[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 89: 674-679.
[21] XUE Jiaying, WANG Suli, YOU Xiangwei, et al. Multiresidue analysis of plant growth regulators in grapes by triple quadrupole and quadrupole-time of flight-based liquid chromatography mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2011,25: 3289-3297.
[22] 申秀丽, 孙宝利, 董一威, 等. QuEChERS-GC/ECD法分析土壤中残留有机氯农药[J]. 现代科学仪器, 2009(1): 84-87.
[23] WILKOWSKA A, BIZIUK M. Determination of pesticide residues in food matrices using the QuEChERS methodology[J]. Food Chemistry,2011, 125(3): 803-812.
[24] 李岩, 郑锋, 王明林, 等. 液相色谱-串联质谱法快速筛查测定浓缩果蔬汁中的156 种农药残留[J]. 色谱, 2009, 27(2): 127-137.
[25] 朱永哲, 冯雅男, 金正汉. 超高效液相色谱-串联质谱法同时测定土壤中239 种农药的残留量[J]. 色谱, 2013, 33(9): 850-861.
Simultaneous Determination of 20 Plant Growth Regulator Residues in Strawberry and Chinese Bayberry (Myrica rubra) by High Performance Liquid Chromatography-Tandem Mass Spectrometry
YU Miao
1, WU Shuchun
2,*
(1. Institute for the Control of Agrochemicals Zhejiang Province, Hangzhou 310020, China;2. Zhejiang Medical College, Hangzhou 310053, China)
Abstract:The present paper describes the development and validation of a method for the simultaneous determination of 20 plant growth regulator residues in strawberry and Chinese bayberry (Myrica rubra) by using high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). The plant growth regulator residues in 15 g of samples were extracted with acetonitrile (containing 1% acetic acid) and then analyzed using HPLC-MS/MS. The chromatographic analysis was carried out on a Phenomenex XB-C 18(100 mm × 2.1 mm, 2.6 μm) column with methanol and 5 mmol/L ammonium acetate solution containing 0.1% acetic acid as the mobile phases with a gradient program, and the analytes were quantified by matrix-matched external standard method. The recoveries of 20 plant growth regulators in strawberry and Chinese bayberry at three spiked levels were 70.0%-114.8%, with relative standard deviation (RSD) between 1.25% and 11.1%. The limits of detection of the method ranged from 0.14 to 2.9 μg/kg. The method is simple, rapid, sensitive, accurate and repeatable. These figures of merit meet the requirements for the detection of 20 plant growth regulator residues in strawberry and Chinese bayberry.
Key words:high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); plant growth regulator;strawberry; Chinese bayberry (Myrica rubra); residue
中图分类号:O657.63
文献标志码:A
文章编号:1002-6630(2015)24-0246-07
doi:10.7506/spkx1002-6630-201524046
收稿日期:2015-01-31
基金项目:浙江省科技厅分析测试科技计划项目(2013C37069);浙江省教育厅高等学校访问工程师校企合作项目(FW2013009)
作者简介:虞淼(1981—),男,农艺师,硕士,研究方向为农产品质量安全、农药残留检测。E-mail:yumiao2020@sina.com
*通信作者:吴淑春(1982—),女,讲师,硕士,研究方向为食品卫生理化检验。E-mail:w_sc@163.com