樊晓博,谢兰心
(渭南职业技术学院 渭南市农产品食品检验检测研究中心,陕西 渭南 714000)
摘 要:固相包被恩诺沙星抗体,辣根过氧化物酶标记的抗原与标准品(或样品)中氟喹诺酮药物竞争结合抗体,建立了高效、高灵敏的氟喹诺酮药物直接竞争酶联免疫吸附分析检测方法。优化反应条件后,得到方法的IC 50为2.04 μg/L,灵敏度为0.15 μg/L,线性范围0.3~15 μg/L;方法可以检测12 种氟喹诺酮药物,在生乳、鸡肉、鱼肉和虾肉4 种样品中12 种药物的回收率为70%~121.5%。
关键词:氟喹诺酮;酶标抗原;多残留检测;直接竞争酶联免疫吸附分析
氟喹诺酮类(fluoroquinolones,FQs)药物,为广谱性动物抗生素,主要包括环丙沙星、恩诺沙星(enrofloxacin,ENR)、诺氟沙星等,此类药物杀菌活力强,具有高效、毒副作用小、不易产生耐药性等优点 [1-2]。近年来,FQs药物在畜牧和水产养殖中广泛应用,造成动物食品原料的药物残留日益严重 [3]。此类药物具有良好的脂溶性,会损害中枢神经系统,并引起过敏反应和肝脏毒性 [4-5]。因此,欧盟对食品中FQs残留限量做了严格的规定,我国农业部也针对该类药物制定了相关的标准 [6-8]。
目前,动物性食品中FQS的检测方法主要有分子印迹-固相萃取法 [9]、毛细血管法 [10]、高效液相法 [11-13]、液相色谱-质谱联用法 [14-16]等。仪器法检测准确、可靠,但仪器设备昂贵,前处理和操作复杂,一般仅作为可疑样品的验证,不适用于大批量样品筛查。而免疫学方法特异性强,操作简单、快速、经济,能够适用于大通量样品的检测。近年来,酶联免疫吸附(enzyme-linked immunoassay,ELISA)分析方法成为检测动物性食品中药物残留的研究热点 [17]。检测FQS的ELISA方法从单个药物残留的检测 [18-20]逐渐发展到多药物残留免疫检测 [21-22],多残留检测依靠抗体对药物具有广泛的交叉反应来实现 [23-24]。本研究在单克隆抗体的基础上,标记抗原,优化提取方法,建立直接竞争ELISA方法,检测动物食品中至少12 种FQS药物残留,为动物食品的安全提供更加有效的技术保障。
1.1 材料与试剂
ENR、环丙沙星、培氟沙星、诺氟沙星、单诺沙星、氧氟沙星、恶喹酸、氟甲喹、加替沙星、洛美沙星、依诺沙星、氟罗沙星、左氧氟沙星、色拉沙星、萘啶酸标准品、辣根过氧化物酶(horseradish peroxidase,HRP) 美国Sigma公司;ENR-卵清蛋白(ovalbumin,OVA)、抗ENR单克隆抗体 本实验室自制;96孔微量反应板 美国雷博公司;其他化学试剂均为国产市售分析纯。
1.2 仪器与设备
恒温培养箱 美国Shell Lab公司;P200微量可调移液枪 法国吉尔森公司;Wellwash MK-2洗板机、MK-3 ELISA检测仪 美国Thermo公司;恒温振荡器 上海智城分析仪器制造有限公司;1-13型快速离心机 美国Sigma公司;DC-12型水浴氮吹仪 上海安普科学仪器有限公司。
1.3 方法
1.3.1 ENR-OVA酶标记物的制备 [25]
溶解5 mg HRP于1 mL、0.2 mol/L醋酸盐缓冲液中(pH 5.6)中,加入新配制的0.1 mol/L过碘酸钠溶液0.5 mL,置4 ℃冰箱反应30 min。反应完后加0.5 mL 2.0%的乙二醇溶液,4 ℃反应30 min。向活化的酶溶液中加入0.5 mL、3 mg/mL ENR-OVA(20%甲醇溶液溶解)溶液混匀,于4 ℃先用蒸馏水透析2次,再换用0.01 mol/L磷酸盐缓冲液(pH 7.4)透析2 d。透析完毕后取出,3 000 r/min离心30 min,除去沉淀,上清液即为酶标记物。
1.3.2 固相包被抗体制备
将单克隆抗体用碳酸盐缓冲液(pH 9.6)稀释至适宜质量浓度,96 孔微孔板每孔中各加入200 μL,37 ℃放置过夜,弃去包被液,加入封闭液,每孔220 μL,封闭3 h。弃去封闭液,烘干,备用。
1.3.3 酶标记物效价测定
将标记好的酶标记物从稀释度1∶100开始倍比稀释,包被抗体板条中每孔依次加入100 μL倍比稀释的酶标记物,室温避光反应1 h,加入显色液100 μL反应20 min,终止后,在波长450 nm处测定每孔吸光度。以蒸馏水为空白对照。
1.3.4 反应条件优化
将单克隆抗体以1∶2 000、1∶4 000、1∶8 000、1∶12 000、1∶16 000五种稀释度包被,加入100 μL标准品和100 μL ENR-OVA酶标记物,确定最佳包被稀释度。用最佳包被稀释度包板,加入100 μL标准品和100 μL质量浓度为0.1、0.3、0.6、0.9、1.2 mg/L的酶标记物,确定最佳的酶标记物质量浓度。
1.3.5 直接竞争ELISA操作步骤
取包被好的板条,加入100 μL标准品(或处理好的样品)到相应的微孔中,加入分析缓冲液稀释的酶标记物100 μL,室温避光反应50 min,将微孔中的反应液甩掉,再将清洗液加满每一微孔后甩掉,重复洗3次。在每一微孔加入底物溶液100 μL后,在室温条件下避光静置20 min。每一微孔加入100 μL反应终止液,酶标仪以单波长450 nm或双波长450 nm/650 nm判读。
1.3.6 样品处理
生乳:取4 mL待测生乳加入50 μL 3 mol/L盐酸,振荡混合后,3 000 r/min离心15 min,取澄清液以0.01 mol/L磷酸盐(pH 7.4)稀释3 倍后检测。
组织样品(鸡肉、猪肉、鱼、虾):将1 g已均质样品放入15 mL离心管中,再加入3 mL 80%甲醇溶液,振荡混合约1 min,再以上下转动充分混合约10 min。3 000 r/min离心15 min,取1 mL上层液于玻璃管中,50 ℃条件下利用氮气将有机溶剂吹干。向玻璃管中加入0.5 mL、4%甲醇溶液,先将残余物完全溶解,再加入正己烷1 mL,振荡混合约20~30 s。3 000 r/min离心15 min,利用吸管吸去包含中间乳化层部分的上层液(正己烷),再吸取下层液检测。1.3.7 考核指标
灵敏度:测定IC 10得到最低检测限,确定体系线性检测范围(IC 20~IC 80) [26]。
式中:B为标准溶液或样本溶液的平均吸光度;B 0为质量浓度为0时的平均吸光度。
特异性:将FQs各种药品配成不同质量浓度的溶液作为待测样品,采用ELISA方法检测,按式(2)计算交叉反应率。

回收率:向各种阴性样品中分别添加不同质量浓度的FQS标准品,处理后用ELISA方法检测,每个质量浓度作3 个平行测定。
1.3.8 与拜发R-Biopharm氟喹诺酮试剂盒的对比
选择本方法与对照试剂盒均可以检测的FQs药物,针对这些药物选择相同的样品用2 种方法同时测定,以拜发试剂盒检测结果为基准计算回收率,判断其相关性。
2.1 酶标记物效价
由图1可知,酶标记抗原后,酶的活性仍很高,酶标记物的效价达到102 400以上,可以满足反应体系的质量浓度要求,表面酶标记物制备成功。

图 1 酶标记物效价曲线
Fig.1 The titer curve of HPR-ENR-OVA
2.2 反应条件优化
抗原和抗体的质量浓度对免疫检测方法的灵敏度和特异性有重要的影响,因此有必要对合适的抗体和抗原的质量浓度进行探索。
2.2.1 包被缓冲液的优化
不同pH值的缓冲体系对包被效果有很大的影响。以最高吸光度(A max)、IC 50和A max/IC 50为综合参考指标,对比0.05 mol/L、pH 9.6碳酸盐缓冲液、0.05 mol/L、pH 7.6磷酸盐缓冲液和0.05 mol/L、pH 7.6 Tris-盐酸缓冲液3 种包被液的包被效果。由表1可知,pH 9.6的碳酸盐缓冲液作为包被液时,与其他2 种缓冲液相比,A max最大,IC 50最小,体系的灵敏度最高,因此选择0.05 mol/L、pH 9.6碳酸盐缓冲液作为抗体包被液。
表1 包被液的优化
Table 1 Optimization of coating buffer
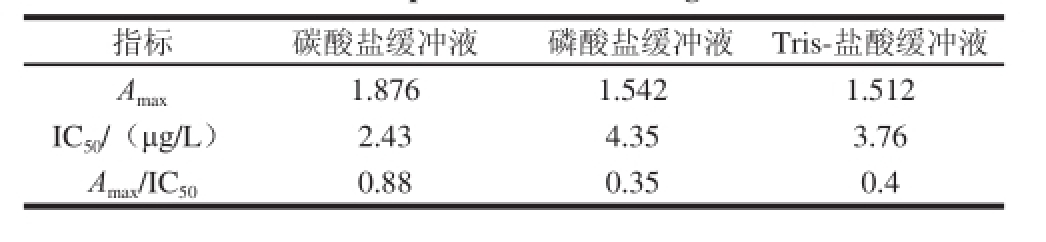
指标 碳酸盐缓冲液 磷酸盐缓冲液 Tris-盐酸缓冲液A max 1.876 1.542 1.512 IC 50/(μg/L) 2.43 4.35 3.76 A max/IC 50 0.88 0.35 0.4
2.2.2 最佳抗体稀释度的确定
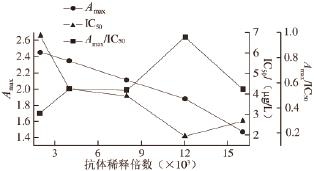
图 2 包被抗体稀释度曲线
Fig.2 Dilution curve of antibody by dc-ELISA
A max与包被抗体质量浓度呈正比,抗体质量浓度过高时,抗体与抗原结合过多,方法的灵敏度下降。由图2可知,当抗体稀释度为1∶12 000时,表示灵敏度的A max/IC 50数值最大,IC 50最低,说明灵敏度最高,其A max也在适宜的范围内,所以选择包被抗体的稀释度为1∶12 000。
2.2.3 最佳酶标抗原质量浓度确定
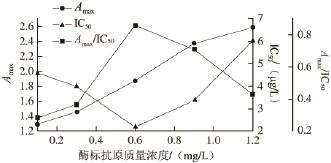
图3 ENR-OVA酶标抗原质量浓度曲线
Fig.3 Selection of optimal HRP-ENR-OVA concentration by dc-ELISA
选择包被抗体稀释度为1∶12 000,选择不同质量浓度的酶标抗原做直接竞争ELISA实验,结果如图3所示。随着酶标抗原的质量浓度降低,A max随之下降,在酶标抗原质量浓度为0.6 mg/L时,A max/IC 50最大,IC 50最小,此质量浓度条件下体系的灵敏度最高,A max在合适的范围内。故选择此质量浓度为最佳的酶标抗原质量浓度。
2.2.4 甲醇体积分数对反应的影响
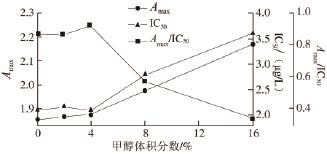
图 4 甲醇体积分数对dc-ELISA的影响
Fig.4 Infl uence of methanol concentration on dc-ELISA
有机溶剂会对反应体系中抗原抗体结合产生影响,实验中使用甲醇作为提取溶剂,因此需考察其体积分数对整个反应体系灵敏度的影响。由图4可知,当甲醇体积分数不超过4%时,对体系的A max与IC 50均没有显著的影响,当甲醇体积分数超过8%后,A max与IC 50都开始逐渐上升,体系灵敏度下降,因此,在样品检测中使用4%的甲醇溶液。
2.3 ELISA方法考核
2.3.1 方法灵敏度
在优化的条件下以ENR标准溶液质量浓度(0、0.1、0.3、1.1、3.3、10、30 μg/L)的对数值做横坐标,以抑制率为纵坐标绘制标准曲线,得到曲线方程为y=61.443 34-35.845 76x,R 2=0.993 9。在一系列条件优化基础上,ELISA方法的灵敏度(IC 10)为0.15 μg/L,IC 50为2.04 μg/L,线性关系良好,线性检测范围为0.3~15 μg/L。
2.3.2 方法的特异性
表2 交叉反应率
Table 2 Cross-reactivity of antibody against FQs

药物名称 IC 50/(μg/L) 交叉反应率/% ENR 2.04 100环丙沙星 1.94 105培氟沙星 2.4 86诺氟沙星 2.91 70单诺沙星 3.14 65氧氟沙星 3.4 60恶喹酸 3.71 55氟甲喹 4.08 50加替沙星 4.34 47洛美沙星 6.58 31依诺沙星 8.16 25氟罗沙星 13.6 15左氧氟沙星 22.67 9色拉沙星 51 4萘啶酸 34 6
将FQs的各种药物物配成不同质量浓度的溶液作为被测物,采用ELISA方法测定。如表2所示,dc-ELISA方法具有广泛的交叉反应,与环丙沙星、培氟沙星等8 种交叉反应率超过50%,检测体系可以灵敏地检测出动物食品中此类的药物残留;加替沙星、洛美沙星等4 种药物的交叉反应率在15%~47%之间,可在中质量浓度时检测药物残留;左氧氟沙星、色拉沙星、萘啶酸3 种药物交叉反应率较低,在实验室条件下未进行检测,但鉴于畜牧水产养殖时使用FQs药物质量浓度较高,因此本检测体系具有非常广泛的检测范围,可以实现药物残留的广谱检测。
2.3.3 方法的回收率
ELISA的批内和批间差异均低于10%。加标回收实验室评价ELISA检测方法准确度的一个重要指标。选择生乳、鸡肉、鱼肉和虾肉等常规检测样品进行添加回收率测定,选取ENR、环丙沙星等交叉反应率较高的9 种药物添加质量浓度梯度进行检测,添加质量浓度为2、6、15 μg/L三个水平,对交叉反应率相对较低的3 种药物添加高质量浓度,添加质量浓度为20 μg/L,根据1.3.6节的方法进行样品处理计算不同水平的回收率。由表3可见,12 种FQs药物的回收率在70%~121.5%之间,变异系数(coeffi cient of variation,CV)在3.7%~9.7%之间,说明该方法重复性好、精确度高,用于样品分析准确、可靠。
表3 动物食品样品添加回收率(n==33)
TTaabbllee 33 RReeccoovveerriieess ooff ffl l uuoorrooqquuiinnoolloonneess ssppiikkeedd iinnttoo aanniimmaall--ddeerriivveedd food sampleess (n == 33)
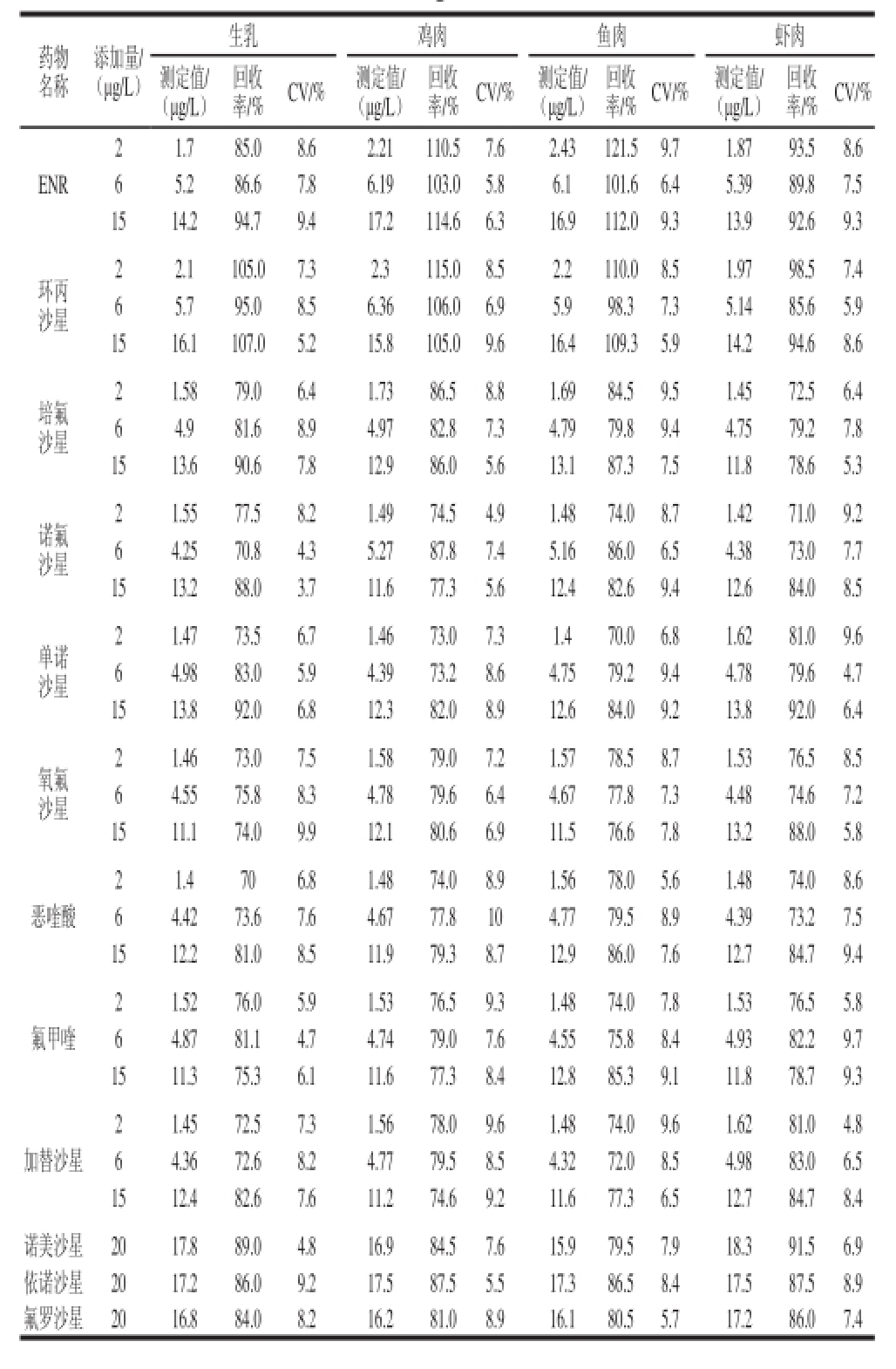
药物名称添加量/ (μg/L)生乳 鸡肉 鱼肉 虾肉测定值/ (μg/L)回收率/% CV/% 测定值/ (μg/L)回收率/% CV/% 测定值/ (μg/L)回收率/% CV/% 测定值/ (μg/L)回收率/% CV/% ENR 2 1.7 85.0 8.6 2.21 110.5 7.6 2.43 121.5 9.7 1.87 93.5 8.6 6 5.2 86.6 7.8 6.19 103.0 5.8 6.1 101.6 6.4 5.39 89.8 7.5 15 14.2 94.7 9.4 17.2 114.6 6.3 16.9 112.0 9.3 13.9 92.6 9.3环丙沙星2 2.1 105.0 7.3 2.3 115.0 8.5 2.2 110.0 8.5 1.97 98.5 7.4 6 5.7 95.0 8.5 6.36 106.0 6.9 5.9 98.3 7.3 5.14 85.6 5.9 15 16.1 107.0 5.2 15.8 105.0 9.6 16.4 109.3 5.9 14.2 94.6 8.6培氟沙星2 1.58 79.0 6.4 1.73 86.5 8.8 1.69 84.5 9.5 1.45 72.5 6.4 6 4.9 81.6 8.9 4.97 82.8 7.3 4.79 79.8 9.4 4.75 79.2 7.8 15 13.6 90.6 7.8 12.9 86.0 5.6 13.1 87.3 7.5 11.8 78.6 5.3诺氟沙星2 1.55 77.5 8.2 1.49 74.5 4.9 1.48 74.0 8.7 1.42 71.0 9.2 6 4.25 70.8 4.3 5.27 87.8 7.4 5.16 86.0 6.5 4.38 73.0 7.7 15 13.2 88.0 3.7 11.6 77.3 5.6 12.4 82.6 9.4 12.6 84.0 8.5单诺沙星2 1.47 73.5 6.7 1.46 73.0 7.3 1.4 70.0 6.8 1.62 81.0 9.6 6 4.98 83.0 5.9 4.39 73.2 8.6 4.75 79.2 9.4 4.78 79.6 4.7 15 13.8 92.0 6.8 12.3 82.0 8.9 12.6 84.0 9.2 13.8 92.0 6.4氧氟沙星2 1.46 73.0 7.5 1.58 79.0 7.2 1.57 78.5 8.7 1.53 76.5 8.5 6 4.55 75.8 8.3 4.78 79.6 6.4 4.67 77.8 7.3 4.48 74.6 7.2 15 11.1 74.0 9.9 12.1 80.6 6.9 11.5 76.6 7.8 13.2 88.0 5.8恶喹酸2 1.4 70 6.8 1.48 74.0 8.9 1.56 78.0 5.6 1.48 74.0 8.6 6 4.42 73.6 7.6 4.67 77.8 10 4.77 79.5 8.9 4.39 73.2 7.5 15 12.2 81.0 8.5 11.9 79.3 8.7 12.9 86.0 7.6 12.7 84.7 9.4氟甲喹2 1.52 76.0 5.9 1.53 76.5 9.3 1.48 74.0 7.8 1.53 76.5 5.8 6 4.87 81.1 4.7 4.74 79.0 7.6 4.55 75.8 8.4 4.93 82.2 9.7 15 11.3 75.3 6.1 11.6 77.3 8.4 12.8 85.3 9.1 11.8 78.7 9.3加替沙星2 1.45 72.5 7.3 1.56 78.0 9.6 1.48 74.0 9.6 1.62 81.0 4.8 6 4.36 72.6 8.2 4.77 79.5 8.5 4.32 72.0 8.5 4.98 83.0 6.5 15 12.4 82.6 7.6 11.2 74.6 9.2 11.6 77.3 6.5 12.7 84.7 8.4诺美沙星 20 17.8 89.0 4.8 16.9 84.5 7.6 15.9 79.5 7.9 18.3 91.5 6.9依诺沙星 20 17.2 86.0 9.2 17.5 87.5 5.5 17.3 86.5 8.4 17.5 87.5 8.9氟罗沙星 20 16.8 84.0 8.2 16.2 81.0 8.9 16.1 80.5 5.7 17.2 86.0 7.4
2.3.4 与拜发R-Biopharm氟喹诺酮试剂盒的对比
表 4 2 种ELISA方法比较(n==33)
Taabbllee 44 CCoommppaarriissoonn ooff tthhee rreessuullttss oobbttaaiinneedd ffoorr cchhiicckkeenn aanndd sshhrriimmpp with two different ELISA kits (n == 33)
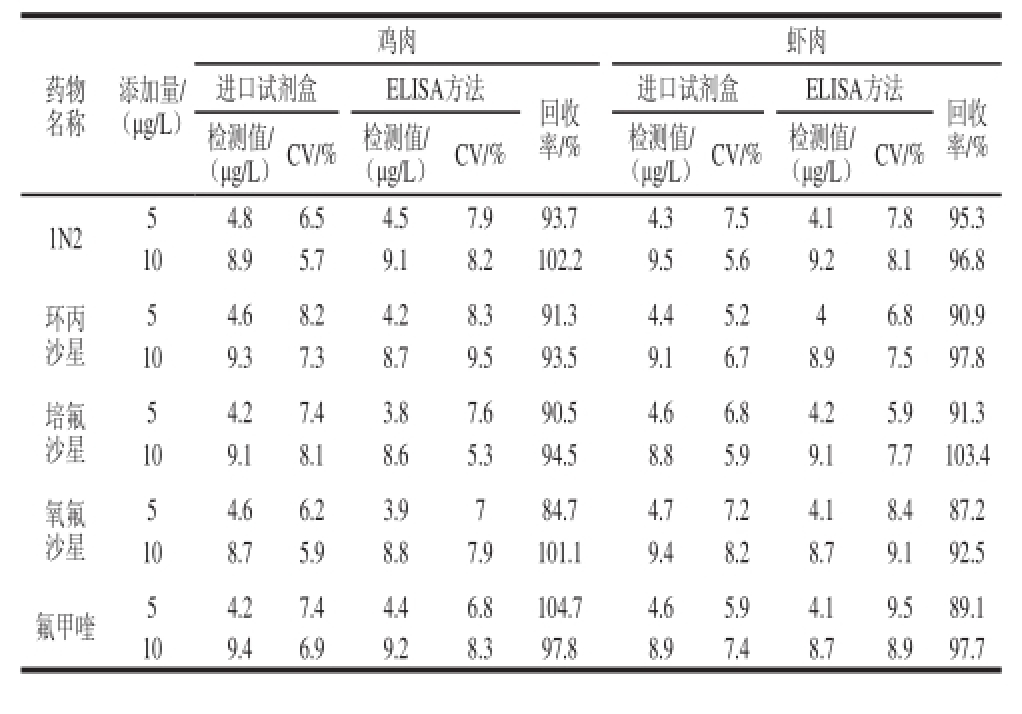
药物名称添加量/ (μg/L)鸡肉 虾肉进口试剂盒 ELISA方法 回收率/%进口试剂盒 ELISA方法 回收率/%检测值/ (μg/L)CV/% 检测值/ (μg/L) CV/% 检测值/ (μg/L)CV/% 检测值/ (μg/L)CV/% 1N2 5 4.8 6.5 4.5 7.9 93.7 4.3 7.5 4.1 7.8 95.3 10 8.9 5.7 9.1 8.2 102.2 9.5 5.6 9.2 8.1 96.8环丙沙星5 4.6 8.2 4.2 8.3 91.3 4.4 5.2 4 6.8 90.9 10 9.3 7.3 8.7 9.5 93.5 9.1 6.7 8.9 7.5 97.8培氟沙星5 4.2 7.4 3.8 7.6 90.5 4.6 6.8 4.2 5.9 91.3 10 9.1 8.1 8.6 5.3 94.5 8.8 5.9 9.1 7.7 103.4氧氟沙星5 4.6 6.2 3.9 7 84.7 4.7 7.2 4.1 8.4 87.2 10 8.7 5.9 8.8 7.9 101.1 9.4 8.2 8.7 9.1 92.5氟甲喹 5 4.2 7.4 4.4 6.8 104.7 4.6 5.9 4.1 9.5 89.1 10 9.4 6.9 9.2 8.3 97.8 8.9 7.4 8.7 8.9 97.7
参考拜发氟喹诺酮试剂盒的检测参数,选择ENR、环丙沙星、培氟沙星、氧氟沙星、氟甲喹作为检测药物,2 种方法同时检测含有5 种FQs药物的鸡肉和虾肉样品同时进行测定,设置两个质量浓度水平。如表4所示,以进口试剂盒测定的药物质量浓度为基准,2 种检测样品中5 种药物的回收率在84.7%~104.7%之间,2 种方法之间有很高的相关性,建立的方法检测结果准确、可靠,可以作为动物食品样品中FQs药物残留的定量检测方法。
本研究利用HRP成功标记了抗原,标记后酶标记物的效价可以满足检测要求,建立了直接竞争氟喹诺酮ELISA分析方法。该方法在优化体系条件后,检测线性范围为0.3~15 μg/L,最低检测限为0.15 μg/L,IC 50为2.04 μg/L,抗体对15 种FQs药物具有交叉反应,对其中至少12 种FQs药物可以进行准确的检测,4 种动物食品样品中回收率在70%~121.5%之间。相比现有的ELISA检测方法,本方法检测速度快、灵敏度和稳定性有了明显的提高,药物检测范围广。与进口试剂盒进行比较,检测结果准确可靠,可以满足现有的检测需要,具有良好的应用前景。
参考文献:
[1] MOEMA D, NINDI M M, DUBE S. Development of dispersive liquid-liquid microextraction method for the determination of fluoroquinolones in chicken liver by high performance liquid chromatography[J]. Analytica Chimica Acta, 2012, 730: 80-86.
[2] 魏东, 李振华, 张乃生. 氟喹诺酮类药物的不良反应[J]. 安徽农业科学, 2006, 27(7): 105-107.
[3] ALI A K. Peripheral neuropathy and Guillain-Barré syndrome risks associated with exposure to systemic fluoroquinolones: a pharmacovigilance analysis[J]. Annals of Epidemiology, 2014, 24(4): 279-285.
[4] LIU Yanzhou, ZHAO Guoxue, WANG Ping, et al. Production of the broad specific monoclonal antibody against sarafloxacin for rapid immunoscreening of 12 fluoroquinolones in meat[J]. Environmental Science and Health B, 2013, 48(2): 139-146
[5] DANIEL F, VIVIENNE Z, ERICA V, et al. Exposure to oral fluoroquinolones and the risk of retinal detachment: retrospective analyses of two large healthcare databases[J]. Drug Safety, 2014, 37 (3): 171-182.
[6] BURKIN M A. Enzyme-linked immunosorbent assays of fluorquinolones with selective and group specificities[J]. Food and Agricultural Immunology, 2008, 19(2): 131-140.
[7] LEIVO J, CHAPPUIS C, LAMMINMAKI U, et al. Engineering of a broad-specificity antibody: detection of eight fluoroquinolone antibiotics simultaneously[J]. Analytical Biochemistry, 2011, 409(1):14-21.
[8] 农业部公告第235号. 动物性食品中兽药最高残留限量[EB/OL]. (2002-12-24)[2015-04-22]. http://www.moa.gov.cn/zwllm/tzgg/ gg/200302/t20030226_59300.htm.
[9] SUN Xiaoli, WANG Jincheng,YUN Li, et al. Novel dummy molecularly imprinted polymers for matrix solid-phase dispersion extraction of eight fl uoroquinolones from fi sh samples[J]. Journal of Chromatography A, 2014, 1359: 9-16.
[10] HERMANDEZ M, AGUILAR C, BORRULL F, et al. Determination of ciprofl oxacin, enrofl oxacin and fl umequine in pig plasma samples by capillary isotachophoresis-capillary zone electrophoresis[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2002, 772(1): 163-172.
[11] ZHAO Sijun, JIANG Haiyang, LI Xuelian, et al. Simultaneous determination of trace levels of 10 quinolones in swine, chiken, and shrimp muscle tissues using HPLC with programmable fl uorescence detection[J]. Journal of Agricultural and Food Chemistry, 2007,55(10): 3829-3834.
[12] CHRISTODOULOU E A, SAMANIDOU F V, PAPADOYANNIS I N. Development of an HPLC multi-residue method for the determination of ten quinolones in bovine liver and porcine kidney according to the European Union Decision 2002/657/EC[J]. Journal of Separation Science, 2008, 31(1): 119-127.
[13] XIA Qinghai, YANG Jiao, WEI Xiong, et al. Development of a precolumn derivatization procedure prior to ultrasound-assisted cloud point extraction for sensitive determination of fluoroquinolones in eggs by high-performance liquid chromatography with fluorescence detection[J]. Food Analytical Methods, 2014, 7(5): 1130-1138.
[14] HERMO M P, NEMUTLU E, KIR S, et al. Improved determination of quinolones in milk at their MRL levels using LC-UV, LC-FD, LC-MS and LC-MS/MS and validation in line with regulation 2002/657/EC[J]. Analytica Chimica Acta, 2008, 613(1): 98-107.
[15] KANTIANI L, FARRE M, BARCELO D. Rapid residue analysis of fl uoroquinolones in raw bovine milk by online solid phase extraction followed by liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(50): 9019-9027.
[16] 黄优生, 刘波平, 朱筱玲, 等. 高效液相色谱-串联质谱法快速测定鱼肉中4 种氟喹诺酮类药物残留[J]. 食品科学, 2010, 31(2): 127-130.
[17] SHEN Yudong, DENG Xinfei, XU Zhenlin, et al. Simultaneous determinantion of malachite green, brilliant green and crystal violet in grass carp tissues by a broad-spcifi city indrrect competitive enzymelinked immunosobent assay[J]. Analytica Chimica Acta, 2011,707(1/2): 148-154.
[18] KUN Huang, XUAN Yun, JIANG Yousheng, et al. Monoclonal antibody based on enzymelinked immunosorbent assay for the specifi c detection of ciprofl ocaxin and enrofl oxacin residues in fi shery products[J]. Aquaculture, 2010, 310: 8-12.
[19] LEIVO J, CHAPPUIS C, LAMMINMAKI U, et al. Engineering of a broad-specificity antibody: detection of eight fluoroquinolone antibioties simultaneously[J]. Analytical Chemistry, 2011, 409: 14-21. [20] JIANG Jingqing, ZHANG Haitang, WANG Ziliang. Multiresidue determination of sarafl oxacin, difl oxacin, norfl oxacin, and pefl oxacin in fish using an enzyme-linked immunosorbent assay[J]. Procedia Environmental Sciences, 2011, 8: 301-306.
[21] BUCKNALL S, SILVERLIGHT J, COLDHAM N, et al. Antibodies to the quinolones and fluoroquinolones for development of generic and specifi c immunoassays for detection of these residues in animal products[J]. Food Additives and Contaminants, 2003, 20(3): 221-228.
[22] ZHANG Bo, DU Daolin, MENG Meng, et al. A magnetic particlebased competitive enzyme immunoassay for rapid determination of ciprofloxacin: a potential method for the general detection of fl uoroquinolones[J]. Analytical Letters, 2014, 47(7): 1134-1146.
[23] PINACHO D G, SANCHEZ-BAEZA F, MARCO M P. Molecular modeling assisted Hapten design to produce broad selectivity antibodies for fluoroquinolone antibiotics[J]. Analytical Chemistry,2012, 84(10): 4527-4534.
[24] WANG Zhanhui, ZHU Yan, DING Shuangyang, et al. Development of a monoclonal antibody-based broad-specificity ELISA for fl uoroquinolone antibiotics in foods and molecular modeling studies of cross-reactive compounds[J]. Analytical Chemistry, 2007, 79: 4471-4483.
[25] 王黎丽, 余为一. 2 种制备三聚氰胺酶标抗原方法的比较[J]. 安徽农业科学, 2011, 39(22): 13273-13274.
[26] LEI Hongtao, SHEN Yudong, SONG Lijun, et al. Monitoring of organophosphorus pesticides in vegetables using monoclonal antibodybased direct competitive ELISA followed by HPLC-MS/MS[J]. Food Chemistry, 2012, 131(4): 1569-1576.
Direct Competitive ELISA with HRP-Labeled Antigen for Multiresidue Determination of Fluoroquinolones in Animal-Derived Food
FAN Xiaobo, XIE Lanxin
(Weinan Testing and Inspection and Research Center of Agricultural Products and Food,Weinan Vocational and Technical College, Weinan 714000, China)
Abstract:In this study, a rapid and high sensitive direct competitive enzyme-linked immunoassay (dc-ELISA) method based on antigen labeled by horseradish peroxidase (HRP) was established and successfully applied to detect fl uoroquinolones (FQs)in animal-derived food. In the direct competitive assay, monoclonal antibody was bound to the surface of a microtiter plate,and the standards (or the sample) competed with antigen for the antibody binding sites. Under optimized assay conditions,the IC 50of dc-ELISA was 2.04 μg/L, the limit of detection was 0.15 μg/L, and the linear range was 0.3-15 μg/L. This method could detect 12 kinds of FQs with recoveries from milk, chicken, fi sh and shrimp in the range from 70% to 121.5%. Key words: fl uoroquinolones; horseradish peroxidase (HRP)-labeled antigen; multiresidue determination; direct competitive ELISA (dc-ELISA)
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2015)24-0265-05
doi:10.7506/spkx1002-6630-201524049
收稿日期:2015-03-02
基金项目:渭南职业技术学院青年科研基金项目(WZYQ201405)
作者简介:樊晓博(1984—),女,讲师,硕士,研究方向为食品快速检测技术。E-mail:shine2786@163.com