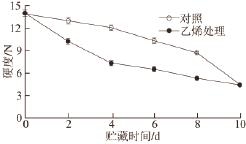
图 1 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中硬度的影响
Fig.1 Effect of exogenous ethylene on peach hardness during postharvest storage
阚 娟,张庆庆,万 冰,刘 俊,金昌海
*
(扬州大学食品科学与工程学院,江苏 扬州 225127)
摘 要:以硬溶质型桃果实‘加纳岩’为试材,研究外源乙烯处理对桃果实采后贮藏过程中呼吸速率、乙烯释放量、细胞色素氧化酶(cytochrome C oxidase,COX)活性以及线粒体编码的COX 3 种亚基(COXⅠ、COXⅡ、COXⅢ)基因表达量的影响。结果表明:外源乙烯处理加速了硬溶质型桃果实‘加纳岩’在采后贮藏过程中硬度的下降,促进了呼吸作用和内源乙烯释放,使呼吸高峰和乙烯释放高峰提前出现。同时外源乙烯抑制了COX酶活性,抑制了贮藏后期COXⅠ和COXⅡ亚基基因的表达,抑制了整个贮藏过程中COXⅢ亚基基因的表达。外源乙烯处理抑制了COX途径的呼吸,加速了果实的软化衰老。
关键词:桃;乙烯;线粒体;呼吸速率;细胞色素氧化酶
线粒体是植物细胞的主要细胞器,是细胞能量代谢和物质转换的中枢。线粒体除了能量转换作用,还参与了4 种呼吸酶复合物的形成,包括NADH-CoQ还原酶、泛醌-细胞色素C还原酶、细胞色素氧化酶(cytochrome C oxidase,COX)和ATP合成酶 [1]。其中COX存在于线粒体内膜上,是线粒体呼吸酶的标志酶,也是线粒体呼吸链上氧化磷酸化过程中的关键酶,把呼吸底物的电子经过细胞色素系统直接传递给分子态氧,是线粒体呼吸控制的主要部位 [2]。COX有13 个亚基,为一多亚基、多形式、多基因组来源的酶蛋白复合体,其中最大的3 个亚基(COXⅠ、COXⅡ、COXⅢ)由线粒体DNA(mtDNA)编码,是酶活性不可缺少的部分。目前有研究人员从活性氧代谢的角度,通过蛋白质组学、蛋白免疫杂交以及其他生理生化分析,证明了线粒体蛋白氧化损伤与果实成熟衰老的关系 [3]。一系列实验表明,细胞衰老时线粒体功能会发生退行性改变 [4]。COX是呼吸链末端酶,其活性大小可直接影响线粒体功能,反映出生物体的有氧呼吸代谢水平。乙烯是5 大类植物激素之一,参与了植物从种子萌发到成熟以及衰老的一系列生命过程的调节及逆境条件下植物的胁迫反应。有研究证明外源乙烯是通过乙烯的自我催化而诱导内源乙烯生成的,乙烯的生理作用可能是通过调节植物体内活性氧水平来实现 [5]。在对绿豆黄化幼苗研究中发现外源乙烯能显著提高活性氧产生速率,同时使得线粒体呼吸高峰提前出现,从侧面表明乙烯对线粒体呼吸的促进作用可能是通过提高线粒体活性氧的产生速率实现的 [6]。当细胞色素氧化酶途径受阻时,抗氰呼吸产生或加强,而乙烯与抗氰呼吸上升有平行的关系,乙烯刺激抗氰呼吸,诱发呼吸跃变产生 [7]。
目前外源乙烯对果实线粒体内呼吸作用、COX活性及基因表达影响的研究还鲜见报道。本实验以外源乙烯处理的硬溶质型‘加纳岩’桃果实为试材,通过对外源乙烯处理后果实在贮藏过程中线粒体内呼吸作用、乙烯释放、COX活性以及COX 3 种亚基的表达的研究,了解桃果实在贮藏过程中外源乙烯对其呼吸作用及线粒体中关键酶COX的影响,从而为乙烯与COX在桃果实采后软化衰老中作用研究提供一定的实验依据。
1.1 材料与试剂
供试品种为硬溶质型‘加纳岩’桃果实,盛花后95 d,桃果实褪绿,基本全红,顶部暗红,果实较硬。
焦碳酸二乙酯(diethy pyrocarbonate,DEPC)、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-巯基乙醇、LiCl、三羟甲基氨基甲烷(Tris)、亚精胺、3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(3-[(3-cholamidopropyl)dimethyl-amino]-1-propanesulfonate,CHAPS)、二硫苏糖醇(DL-dithiothreitol,DTT)、苯甲基 磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、还原型细胞色素C 生工生物工程(上海)股份有限公司;PrimeScript TM1st Strand cDNA Synthesis Kit反转录试剂盒、TaKaRa Taq TMDNA聚合酶、DL2000 DNA Marker宝生物工程(大连)有限公司;NaCl、HCl、氯仿、异戊醇、蔗糖、氯化镁均为分析纯。
1.2 仪器与设备
GY-1型果实硬度计 牡丹江市机械研究所;5804R高速冷冻离心机、5341梯度聚合酶链反应(polymerase chain reaction,PCR)仪 德国Eppendorf公司;7300荧光定量仪 美国ABI公司;GC-14B气相色谱仪 日本岛津公司。
1.3 方法
1.3.1 材料处理
一部分材料以 7~8 个为单位,装在聚乙烯薄膜塑料袋中,20 ℃(95%以上的相对湿度)贮藏。实验处理包括:1)对照,在20 ℃条件下密闭处理12 h;2)20 ℃条件下用50 μL/L外源乙烯密闭处理12 h。处理后的果实于20 ℃条件下贮藏 0、2、4、6、8、10 d 后,取部分鲜果测定硬度、呼吸速率及乙烯释放量后再取果肉部分切成小块,用液氮处理后装在聚乙烯薄膜塑料袋中,并保存在-75 ℃超低温冰箱中用于分析实验。实验3 次重复。1.3.2 果实硬度的测定
采用GY-1型果实硬度计(调头直径3.5 mm),测定鲜果去除果皮后果肉的硬度。每个果实胴部不同部位对称均匀选取6 个点,每次测量6 个果实,均匀取平均值。1.3.3 呼吸速率的测定
采用静置法 [8]。
1.3.4 乙烯释放量的测定
参照Jin Changhai等 [9]的方法。气相色谱条件为:氢焰离子化检测器,SPB-1毛细管柱(0.25 mm×30 m)。采用GC-14B气相色谱仪,载气为N 2,柱温40 ℃,检测器温度120 ℃,实验重复3 次。
1.3.5 线粒体的提取
参照Bonner [10]、Liang Wusheng [11]等方法。
1.3.6 COX活性的测定
取上述提取的线粒体制备液1 mL,COX活性的测定参照Errede等 [12]的方法。
1.3.7 桃果实总RNA提取
参照Meisel等 [13]方法提取。
1.3.8 COXⅠ、COXⅡ、COXⅢ基因的荧光定量PCR (real-time PCR)
根据NCBI上COXⅠ、COXⅡ、COXⅢ基因序列信息(GenBank登录号分别为M16884.1,Z 1 1 9 8 0.1,X 1 5 1 3 1.1),用P r i m e r p r e m i e r 5.0 软件设计引物荧光定量P C R引物C O XⅠ(5'-G A C A C C C G A G C C T A C T T T A C-3')和(5'-GCTATGATGGCGAATACTGC-3'),COXⅡ(5'-GCTTACAAGACGCCACATCACC-3')和(5'-CGTAGGGAGGGAAGGGCAAT-3'),COXⅢ(5'-CAGCCTAGTTCCTACCCACGAC-3')和(5'-CCCGTTGCTATGAAGAATGTTG-3')用于扩增目的基因。Actin(5'-CCTCTATGCCAACACAGTGC-3')和(5'-GTACTCCTGCTTGCTGATCC-3')用于内参基因。
1.4 数据分析
所有数据用SPSS软件进行统计分析。

图 1 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中硬度的影响
Fig.1 Effect of exogenous ethylene on peach hardness during postharvest storage
2.1 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中硬度变化的影响如图1所示,经外源乙烯处理的‘加纳岩’桃果实在贮藏的6 d内硬度有明显的下降,之后硬度下降趋于平缓。桃果实贮藏到第10天时,对照组‘加纳岩’桃果实与外源乙烯处理组的桃果实硬度相近。外源乙烯处理明显加快了‘加纳岩’桃果实硬度下降,但对果实的最终软化程度影响不明显。
2.2 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中呼吸速率的影响
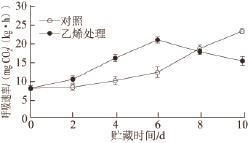
图 2 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中呼吸速率的影响
Fig.2 Effect of exogenous ethylene on mitochondrial respiration rate of ‘Jianayan' peach during postharvest storage
如图2所示,经外源乙烯处理的‘加纳岩’桃果实在贮藏前期呼吸速率迅速升高,在贮藏到第6天时达最大值后有所下降。而对照组的呼吸速率在整个贮藏过程中一直增加。在整个贮藏过程中两者呼吸速率都存在显著性差异。外源乙烯加快了‘加纳岩’桃果实呼吸高峰的到来。2.3 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中乙烯释放量的影响
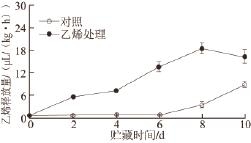
图 3 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中乙烯释放量的影响
Fig.3 Effect of exogenous ethylene on ethylene production of ‘Jianayan' peach during postharvest storage
如图3所示,经外源乙烯处理的‘加纳岩’桃果实在贮藏过程中乙烯释放量要明显高于对照组。且在贮藏到第8天时,外源乙烯处理的桃果实乙烯释放量达到峰值,之后乙烯释放量下降。外源乙烯处理的‘加纳岩’桃果实和对照组在同贮藏时期乙烯释放量存在极显著差异(P<0.01)。外源乙烯诱导了硬溶质型桃果实中内源乙烯的释放。
2.4 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中线粒体内COX活性的影响
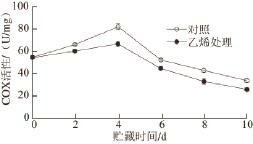
图 4 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中
线粒体内COX活性的影响
Fig.4 Effect of exogenous ethylene on mitochondrial COX activity of ‘Jianayan' peach during postharvest storage
如图4所示,经外源乙烯处理的‘加纳岩’桃果实在贮藏过程中COX活性整体比对照组低,桃果实COX活性在贮藏前4 d不断升高,之后不断下降。两者在同一贮藏时期COX活性都存在显著性差异(P<0.05)。外源乙烯处理抑制了桃果实采后贮藏过程中COX活性,但对COX
活性变化趋势无显著影响。
2.5 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中
COXⅠ亚基基因表达水平的影响
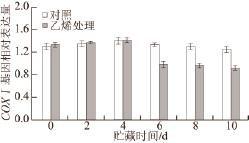
图 5 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中CCOOXXI基因表达的影响
Fig.5 Effect of exogenous ethylene on the expression of CCOOXXI in ‘Jianayan' peach during postharvest storage
如图5所示,对照和外源乙烯处理组桃果实贮藏过程中COXⅠ均有表达,且变化趋势相似,COXⅠ的相对表达量在贮藏前4 d相近。说明外源乙烯处理硬溶质型桃果实‘加纳岩’桃果实后,对于其在贮藏前期COXⅠ基因表达无显著影响。但到贮藏后期(6~10 d)外源乙烯处理显著抑制了COXⅠ基因表达(P<0.05)。
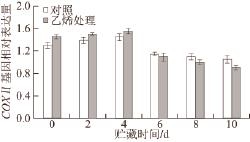
图 6 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中COXCOXⅡ基因表达的影响
Fig.6 Effect of exogenous ethylene on the expression of COXCOXⅡ in ‘Jianayan' peach during postharvest storage
2.6 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中COXⅡ亚基基因表达水平的影响如图6所示,硬溶质型桃果实‘加纳岩’桃果实采后贮藏时COXⅡ基因相对表达量在贮藏前期(0~4 d)都明显低于外源乙烯处理组,而到贮藏后期(6~10 d)外源乙烯处理的COXⅡ基因相对表达量比对照组低,外源乙烯抑制了‘加纳岩’桃果实贮藏后期COXⅡ基因的相对表达量。外源乙烯处理组与对照组在贮藏过程中COXⅡ基因相对表达量变化趋势一致,都是随着贮藏时间的延长先增加后减小。
2.7 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中COXⅢ亚基基因表达水平的影响
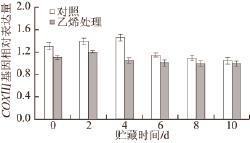
图 7 外源乙烯处理对‘加纳岩’桃果实采后贮藏过程中CCOOXXⅢ
基因表达的影响
Fig.7 Effect of exogenous ethylene on the expression of CCOOXXⅢ in ‘Jianayan' peach during postharvest storage
如图7所示,外源乙烯抑制了硬溶质桃果实贮藏过程中COXⅢ基因的表达。对照组COXⅢ基因相对表达量随贮藏时间的延长先增加后减小,而外源乙烯处理组COXⅢ在贮藏到第2天时,其基因相对表达量达到最大,之后快速下降,到第6天时趋于平缓。
有研究 [14-15]认为乙烯对果实采后贮藏过程中成熟衰老起着重要的调节作用,影响着机体的酶活性、激素水平和呼吸速率等。经外源乙烯处理的硬溶质型桃果实‘加纳岩’在贮藏过程中软化进程加快,但贮藏到后期桃果实仍然和对照组有相近的硬度(图1),对果实最终的软化程度无明显影响。
在果蔬中,线粒体电子传递链主要有细胞色素主路和抗氰交替支路两条途径 [16],其中抗氰呼吸途径是以交替氧化酶为末端氧化酶的氰不敏感电子传递链途径,从线粒体内膜电子传递链的主呼吸途径的泛醌处分支,电子不进行跨膜运输直接传递到末端氧化酶,并催化分子氧还原成水,不产生质子电化学势能,不能驱动ATP的合成,只能产生少量的能量 [17]。在果实呼吸跃变时,以抗氰呼吸为主,呼吸跃变后主要以细胞色素途径为主,果实采后贮藏过程中的成熟衰老时伴随着总呼吸的加强 [18]。已有研究 [19]证明,乙烯处理可以诱导多种植物组织抗氰呼吸能力的发生。本研究中经外源乙烯处理的桃果实在贮藏前期呼吸速率与对照组呈现迅速上升的趋势,到贮藏的中后期经外源乙烯处理的桃果实呼吸作用又迅速下降,而对照组呼吸速率在贮藏过程中一直呈现上升趋势,且在贮藏后期呼吸速率高于乙烯处理组,乙烯处理显著促进了‘加纳岩’贮藏前期和中期的呼吸速率,使呼吸高峰提前出现(图2)。在贮藏过程中外源乙烯处理的桃果实乙烯释放速率显著高于贮藏同时期的对照组(图3),外源乙烯处理显著诱导了‘加纳岩’桃果实采后贮藏中内源乙烯的释放。
COX在线粒体呼吸链电子传递中发挥着极其重要的作用 [20-21]。其中COXⅠ、COXⅡ及COXⅢ 3 种亚基基因共同构成了COX的核心结构,共同影响着COX的活性,而COX活性直接影响到线粒体功能状态,一旦线粒体功能受损,就会促使呼吸链产生大量的活性氧,导致机体受损 [22]。本研究中,在桃果实采后贮藏过程中,经外源乙烯处理的硬溶质型桃果实‘加纳岩’COX活性要比对照组低(图4)。外源乙烯抑制了COX活性,抑制了细胞色素氧化酶途径的呼吸。植物中虽然存在多条电子传递途径,但是 细胞色素氧化酶途径和抗氰呼吸途径为两条主要途径,植物对这两条途径有协调控制现象,即当细胞色素氧化酶途径受阻时,抗氰呼吸产生或加强,乙烯生成增加,加速了果实的成熟衰老。本研究中外源乙烯可能通过抑制桃果实在贮藏过程中COX活性,从而使果实呼吸代谢从细胞色素途径转向抗氰呼吸途径,最终促进果实衰老。
COX的蛋白表达受mtDNA和COX亚基基因的影响,COX最大的3 个亚基(COXⅠ、COXⅡ及COXⅢ)是酶活性不可缺少的部分 [23-24],因此研究COX基因表达可以为从分子水平上探明COX对果实成熟软化的作用提供理论依据。有研究证明,COX的表达量大小会关系到COX活性的大小 [25],而COX活性一旦受到影响,就会直接影响线粒体功能状态,从而影响果实线粒体的呼吸代谢作用,导致活性氧的积累、果实的衰老等。本研究中,COXⅠ和COXⅡ两种亚基基因相对表达量在桃果实贮藏前期(0~4 d)经外源乙烯处理的要比对照组高,而在贮藏后低于对照组(图5和图6)。可见,果实在采后贮藏过程中,外源乙烯在贮藏后期抑制COXⅠ和COXⅡ这两个亚基的表达,与贮藏后期COX活性不断下降密切相关(图4)。经外源乙烯处理的COXⅢ基因在果实采后贮藏各个时期都要比对照组低(图7),与外源乙烯处理后COX活性变化趋势相似,这可能与COXⅢ基因对COX活性调控起重要作用存在一定关系。
研究了外源乙烯对硬溶质型桃果实贮藏过程中线粒体呼吸作用及呼吸代谢关键酶COX的影响。研究表明:外源乙烯能使桃果实更快软化,但不能改变果实最终的硬度;外源乙烯促进了呼吸速率和乙烯释放,使得桃果实的呼吸高峰和乙烯释放高峰提前到来,加速了桃果实贮藏过程中的成熟衰老。外源乙烯抑制了COX活性,对线粒体编码的COX 3 种亚基表达都有一定程度的影响,抑制了COX途径的呼吸,增加了抗氰呼吸,加速了果实的软化衰老。
参考文献:
[1] INOUE J G, MIYA M, TSUKAMOTO K, et al. Complete mitochondrial DNA sequence of Conger myriaster (teleostei: Anguilliformes): novel gene order for vertebrate genomes and the phylogenetic implications for anguilliform families[J]. Journal of Molecular Evolution, 2001, 52(4): 311-320.
[2] KADENBACH B, RAMZAN R, VOGT S. Degenerative diseases,oxidative stress and cytochrome C oxidase function[J]. Trends in Molecular Medicine, 2009, 15(4): 139-148.
[3] QIN Guozheng, MENG Xianghong, WANG Qing, et al. Oxidative damage of mitochondrial proteins contributes to fruit senescence: a redox proteomics analysis[J]. Journal of Proteome Research, 2009,8(5): 2449-2462.
[4] KATAOKA M, FUKURA Y, SHINOHARA Y, et al. Analysis of mitochondrial membrane potential in the cells by microchip flow cytometry[J]. Electrophoresis, 2005, 26(15): 3025-3031.
[5] SCARIOT V, PARADISO R, ROGERS H. Ethylene control in cut fl owers: classical and innovative approaches[J]. Postharvest Biology and Technology, 2014, 97: 83-92.
[6] 柯德森, 王爱国, 罗广华. 乙烯促进线粒体呼吸过程中活性氧的作用[J]. 热带亚热带植物学报, 1999, 7(2): 140-145.
[7] MAKKUMRAI W, ANTHON G E, SIVERTSEN H, et al. Effect of ethylene and temperature conditioning on sensory attributes and chemical composition of ‘Bartlett' pears[J]. Postharvest Biology and Technology, 2014, 97: 44-61.
[8] 李正国, 曾凯芳, 黄琼珍, 等. 农产品贮藏运销学实验教程[M]. 重庆:西南农业大学, 1997.
[9] JIN Changhai, KASHIWAGI T, MIZUNO M, et al. Structural changes in the cell wall pectic polysacchar-ides accompanied by softening of apple (Malus pumila Mill) cultivars Fuji and Kinsei[J]. Food Preservation Science, 1999, 25: 293-300.
[10] BONNER W D. A general method for the preparation of plant mitochondria[J]. Methods in Enzymology, 1967, 10: 126-133.
[11] LIANG Wusheng, PAN Juan, LIANG Hongguo. Activation of cyanideresistant respiration by pyruvate in mitochondria of aged potato tuber slices[J]. Plant Physiology and Plant Molecular Biology, 2003,29: 317-321.
[12] ERREDE B, KAMEN M D, HATEFI Y. Preparation and properties of complex Ⅳ (ferrocytochrome c: oxygen oxidoreductase EC 1. 9. 3. 1)[J]. Methods in Enzymology, 1978, 53: 40-47.
[13] MEISEL L, FONSECA B, GONZÁLEZ S, et al. A rapid and effi cient method for purifying high quality total RNA from peachs (Prunus persica) for functional genomics analyses[J]. Biological Research,2005, 38: 83-88.
[14] BAPAT V A, TRIVEDI P K, GHOSH A, et al. Ripening of fleshy fruit: molecular insight and the role of ethylene[J]. Biotechnology Advances, 2010, 28(1): 94-107.
[15] MAURA B, GEORGE A M, CLAUDIO B, et al. Different postharvest conditions modulate ripening and ethylene biosynthetic and signal transduction pathways in stony hard peaches[J]. Postharvest Biology and Technology, 2008, 48: 84-91.
[16] ARNHOLDT-SCHMITT B, COSTA J H, de MELO D F. AOX-a functional marker for efficient cell reprogramming under stress[J]. Trends in Plant Science, 2006, 11(6): 281-287.
[17] JUNG C R, KIM Y. Different types of fruit damages of three internal apple feeders diagnosed with mitochondrial molecular markers[J]. Journal of Asia-Pacifi c Entomology, 2013, 16(2): 189-197.
[18] HIWASA K, KINUGASA Y, SATOM I. Ethylene is required for both the initiation and progression of softening in pear fruit[J]. Journal of Experimental Botany, 2003, 54(383): 771-779.
[19] MURAYAMA H, ARIKAWA M, SASAKI Y, et al. Effect of ethylene treatment on expression of polyuronide-modifying genes and solubilization of polyuronides during ripening in two peach cultivars having different softening characteristics[J]. Postharvest Biology and Technology, 2009, 52: 196-201.
[20] FRANCISCA D. Cytochrome C oxidase defi ciency: patients and animal models[J]. Biochimica et Biophysica Acta, 2010, 1802: 100-110.
[21] VYGODINA T V, ZAKIRZIANOVA W, KONSTANTINOV A A. Inhibition of membrane-bound cytochrome C oxidase by zinc ions: high-affi nity Zn 2+-binding site at the P-side of the membrane[J]. FEBS Letters, 2008, 582(30): 4158-4162.
[22] WAKATSUKI A, KITAZAKI K, KATO S, et al. An intact mitochondrial COXⅠ gene and a pseudogene with different genomic confi gurations are present in apple cultivars ‘Golden Delicious' and ‘Delicious': evolutionary aspects[J]. Scientia Horticulture, 2011, 130: 49-53.
[23] FRANCISCA D. Cytochrome C oxidase defi ciency: patients and animal models[J]. Biochimica et Biophysica Acta, 2010, 1802: 100-110.
[24] KADENBACH B, RAMZAN R, VOGT S. Degenerative diseases,oxidative stress and cytochrome C oxidase function[J]. Trends in Molecular Medicine, 2009, 15(4): 139-148.
[25] POYTON R O, BELLUS G, MCKEE E E, et al. In organello mitochondrial protein and RNA synthesis systems from Saccharomyces cereuisiae[J]. Methods of Enzymology, 1996, 264: 36-42.
Effect of Exogenous Ethylene on Mitochondrial Cytochrome C Oxidase during Postharvest Storage of Peach Fruit
KAN Juan, ZHANG Qingqing, WAN Bing, LIU Jun, JIN Changhai
*
(College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
Abstract:The effect of exogenous ethylene on respiration rate, ethylene production, cytochrome C oxidase (COX) activity and the gene expression levels of mitochondrial DNA-encoded subunits Ⅰ, Ⅱ and Ⅲ of cytochrome C oxidase in fruits of the stony-hard peach (Prumus persica) cultivar ‘Jianayan' was determined during postharvest storage. The results showed that exogenous ethylene accelerated the decline of fi rmness and promoted the respiration rate and ethylene production of peach fruits during postharvest storage and resulted in earlier appearance of the peaks of respiration and ethylene production. Meanwhile, exogenous ethylene inhibited COX activity and the expression level of COX Ⅲ gene throughout the storage process and suppressed the expression of COX Ⅰ and COX Ⅱ genes in the later stage of the storage period. Exogenous ethylene inhibited the respiration via COX pathway and accelerated the softening and senescence of fruit.
Key words:peach; ethylene; mitochondria; respiration rate; cytochrome C oxidase
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2015)24-0302-05
doi:10.7506/spkx1002-6630-201524056
收稿日期:2015-05-25
基金项目:国家自然科学基金青年科学基金项目(31101586);江苏省科技计划项目(BC2013401);
江苏省自然科学基金项目(BK2010310)
作者简介:阚娟(1980—),女,副教授,博士,研究方向为农产品贮藏与加工。E-mail:kanjuan@yzu.edu.cn
*通信作者:金昌海(1963—),男,教授,博士,研究方向为农产品贮藏与加工。E-mail:chjin@yzu.edu.cn