‘红富士’苹果气调贮藏期间果皮色泽变化及花青苷合成相关基因相对表达量的差异比较
陈 磊,郭玉蓉*,白 鸽,袁 莉
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
摘 要:研究采收时苹果果皮颜色对气调贮藏期间果皮色泽及花青苷合成相关基因相对表达量的影响,为苹果贮藏保鲜提供理论依据。以2 种不同色泽的‘红富士’苹果为试材,采用色差仪、紫外分光光度计和荧光定量聚合酶链式反应法分别测定贮藏期间果皮色值、花青苷、叶绿素含量及花青苷相关合成基因的相对表达量变化。贮藏过程中, 花青苷含量出现波动变化,其中着色好的苹果果皮中花青苷含量下降幅度为51.36%~69.51%,而着色差的苹果花青苷含量下降幅度为74.45%~95.30%;着色好的叶绿素含量下降显著高于着色差的苹果。采收时着色好的苹果果皮中花青苷合成相关基因除LDOX外,相对表达量均显著高于着色差的苹果;随着贮藏时间的延长,2 种不同色泽的苹果果皮中花青苷合成相关基因的相对表达量均显著降低;但在贮藏后期着色差的苹果果皮中CHI、F3H、DFR、ANR相对表达量显著高于着色好的苹果。随着贮藏时间的延长,花青苷合成相关基因的相对表达量显著降低,导致花青苷合成速率下降,花青苷降解,果实发生果皮褪色现象。采收时着色差的‘红富士’苹果在气调贮藏期间比着色好的苹果更容易发生果皮褪色现象。
关键词:苹果;花青苷;叶绿素;基因表达;采后
苹果的外观色泽直接影响其商品价值,尤其在中国这种以鲜食苹果为主的消费群体中,着色好的苹果往往更容易被消费者所接受
[1-2]。苹果基因型
[3]、采收时果实颜色
[4]及贮藏条件
[5-7]等因素均会影响果皮色泽。研究
[8-10]表明,花青苷积累的多少和分布状况决定着苹果果皮红色着色程度,叶绿素与类胡萝卜素含量决定着果皮的底色的亮度。贮藏过程中,苹果果皮花青苷的合成与降解过程是并存的
[11],当苹果体内花青苷的合成速度小于降解速度时,表现为花青苷降解,进而导致“果皮褪色。采后苹果花青苷的含量变化除了受外因(如:采收时苹果果皮色泽、果实损伤情况、1-甲基环丙烯(1-methylcyclopropene,1-MCP)、CO
2、温度、乙烯等
[4-7,12-13]的影响外,还受到花青苷合成相关基因协调表达的调节作用
[9,12,14]。苹果花青苷的生物合成途径是
[ 15-18]以苯丙氨酸为前体物质,历经3 个阶段:第1阶段由苯丙氨酸到4-香豆酰辅酶A,这是许多次生代谢共有的,该步骤受苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)基因活性调控;第2阶段由4-香豆酰辅酶A和丙二酰辅酶A到二氢黄酮醇,此步骤是在查尔酮合成酶(chalcone synthase,CHS)、查尔酮异构酶(chalcone isomerase,CHI)和黄烷酮3-羟化酶(flavanone-3βhydroxylase,F3H)调控的类黄酮代谢关键步骤,并可进一步转化为花青素和其他类黄酮物质;第3阶段是各种花青素的合成,至少有3 个酶:二氢黄酮醇-4-还原酶(dihydroflavonol-4-reductase,DFR)将无色的二氢黄酮醇转化成无色花青素,再在无色花青素双加氧酶/花青素合成酶(leucoanthocyanidin dioxygenase,LDOX)的催化下形成花青素;花青素经一系列的糖基化修缮及向液泡的转运,最终成为显红、紫等多种色调的花青苷,或经花青素还原酶(anthocyanidin reductase,ANR)将花青素转化成表儿茶素。矢车菊素-3-半乳糖苷占苹果果皮花青苷总量80%以上,因此推测是尿苷二磷酸葡萄糖-类黄酮葡萄糖基转移酶(UDP-glycose: flavonoid-3-O-glucosyltransferase,UFGT)是形成花青苷的关键酶
[8,19]。本实验在前人研究的基础上,针对苹果贮藏期间果皮褪色生理现象,结合我国‘红富士’苹果贮藏生产实际情况,研究采收时2 种不同色泽的‘红富士’苹果在气调贮藏过程中果皮花青苷合成基因及调节基因的相对表达量,同时测定果皮色泽和花青苷含量变化,以期通过上述研究,为苹果贮藏保鲜提供理论参考和实验依据。
1 材料与方法
1.1 材料及贮藏条件
实验于2013—2014年在陕西华圣果业有限公司贮藏室和陕西师范大学食品学院实验室进行,材料为陕西洛川一个管理良好的农家果园的不套袋‘红富士’(Malus×domestica ‘Red Fuji')苹果,选择大小基本一致、果形端正、成熟度一致的无损伤、无病虫危害的果实,并按照果皮颜色将其分成2 组:着色好(红色不小于80%)和着色差(红色不大于20%)。
每组3 筐苹果(每筐60 个)均放入陕西华圣果业有限公司的气调库((0±0.5) ℃;O
2体积分数:2.5%~3.0%;CO
2体积分数:1.0%~1.1%;相对湿度:90%~95%;1-MCP:1.01 μL/L密闭处理24 h)进行贮藏,贮藏期间完全按照陕西华圣果业贮藏条件进行管理。两组苹果在贮藏中均设置3个重复。贮藏过程中,每组每个重复每2 个月取10 个果实,取出后立即用冰壶带回实验室,并测定色差值后,将果实皮(厚度约0.5 mm)、肉分开,并用液氮速冻,然后保存到-80 ℃冰箱贮藏,用以后续实验。
1.2 试剂与仪器
M-MuLV第一链cDNA试剂盒 上海生物工程公司;Maxima SYBR Green qPCR Master Mix(2X)试剂盒美国Thermo公司;其他试剂为国产分析纯。
Multiskan Go全波长酶标仪、NANODROP 2000超微量核酸质量检测仪、PIKO REAL 96实时荧光定量聚合酶链式反 应法(quantitative real-time polymerase chain reaction,qRT-PCR)仪 美国Thermo公司;CR-400色差仪 柯尼卡-美能达投资有限公司。
1.3 方法
1.3.1 苹果果皮色泽、叶绿素及花青苷含量的测定
L*、a*、b*、H值测定:采用CR-400色差仪测定2 组苹果在不同贮藏时期时果皮颜色的L*、a*、b*、H值;苹果果皮叶绿素含量测定:参照潘增光等
[20]的方法。
苹果果皮花青苷含量测定:参照文献[21-22]的方法稍加改动。用液氮研磨样品,按料液比1∶4加入 1% HCl-甲醇溶液,4 ℃冰箱黑暗浸提24 h,将提取液在4 ℃、12 000 r/min离心10 min,上清液用全波长酶标仪测定553 nm 和600 nm波长处吸光度。以每克果皮鲜质量的提取液的吸光度变化值A
553 nm-A
600 nm= 0.01 作为1 个花青苷单位,以U表示。
1.3.2 相关基因的实时荧光定量分析
1.3.2.1 苹果果皮总RNA的提取及cDNA 模板的制备
采用改良的CTAB-LiCl
[23]法提取苹果果皮总RNA,用超微量核酸分析仪对RNA的质量浓度及纯度进行检测,并将质量浓度统一稀释至100 ng/mL;根据Sangon Biotech公司生产的M-MuLV第一链cDNA试剂盒将说明书合成cDNA,-80 ℃保存备用。
1.3.2.2 引物设计合成
根据待测基因的序列,用Primer 5.0软件设计引物,并参考相关文章
[4,12]的引物序列,选择最优引物序列,由上海生物工程公司合成,采用HPLC纯化,内参采用Actin (UBQ:U74358)引物序列,见表1。
表1 ‘红富士’苹果花青苷合成相关基因相对表达量测定特异性引物TTaabbllee 11 GGeennee--ssppeecciiffi ic primers used to assess the expression levels of anthocyanin biosynthesis-related genes in ‘Red FFuujjii' apples by qRT-PCR

基因名称 上游引物(5'-3') 下游引物(5'-3')PAL TGCACTGTGCCAAGCTATTGA TCAACAACCCTGAGGAGGTCT CHS CHI GCAAGTGTTGTCAGATTACGG GCTACAAATGCGGTGATAGAA TGATACTGGTGTCTTCAAGCAG TACCTTGGTTTCCAATTTTTCATT DFR ANR CAAGTACAGCTTGGAGGACAT GGCATCGAAGAAATATATGACCA TCCAAGCTGGTAAATGTAAAACA AATTTACGGTAAGCCAGACAATA F3H GAAGATGAGCAAGGATCTTGAG TTCCACAAAGAGCTTTCAAGTG UFGT CCACCGCCCTTCCAAACACTCT CACCCTTATGTTACGCGGCATGT LDOX CCAAGTGAAGCGGGTTGTGCT CAAAGCAGGCGGACAGGAGTAGC MYB10 TGCCTGGACTCGAGAGGAAGACA CCTGTTTCCCAAAAGCCTGTGAA Actin CTCCGTGGTGGTTTTTAAGTG AGGAGGCAGAAACAGTACCAT
1.3.2.3 qRT-PCR扩增
qRT-PCR反应体系配制按Maxima SYBR Green qPCR Master Mix (2X)说明书进行操作,采用10 μL体系:5.0 μL SYBR premix Ex Taq
TM(2*)反应液,上、下游引物各0.4 μL,cDNA模版1 μL,加ddH
2O补至10 μL。混匀,离心,放入PCR仪扩增。反应程序为:1)50.0 ℃预处理2 min;2)95 ℃ 预变性10 min;3)95 ℃ 变性15 s;4)退火60 s(不同基因的退火温度不同,其中PAL 59 ℃、CHS 54 ℃、CHI 56.5 ℃、DFR 56.5 ℃、ANR 56.5 ℃、F3H 60 ℃、UFGT 61 ℃、LDOX 62.5 ℃和MYB10 59.5 ℃;5)40个循环;6)延伸30 s;7)n-95 ℃ 15 s;8)20 ℃ 10 s。每个样品重复3次,采用PiKo Real Software 2.0 进行数据记录及分析。
1.4 数据处理
实验数据采用Excel 进行数据处理和作图,SPSS 18.0软件进行显著性分析。
2 结果与分析
2.1 ‘红富士’苹果贮藏期间果皮色值的变化

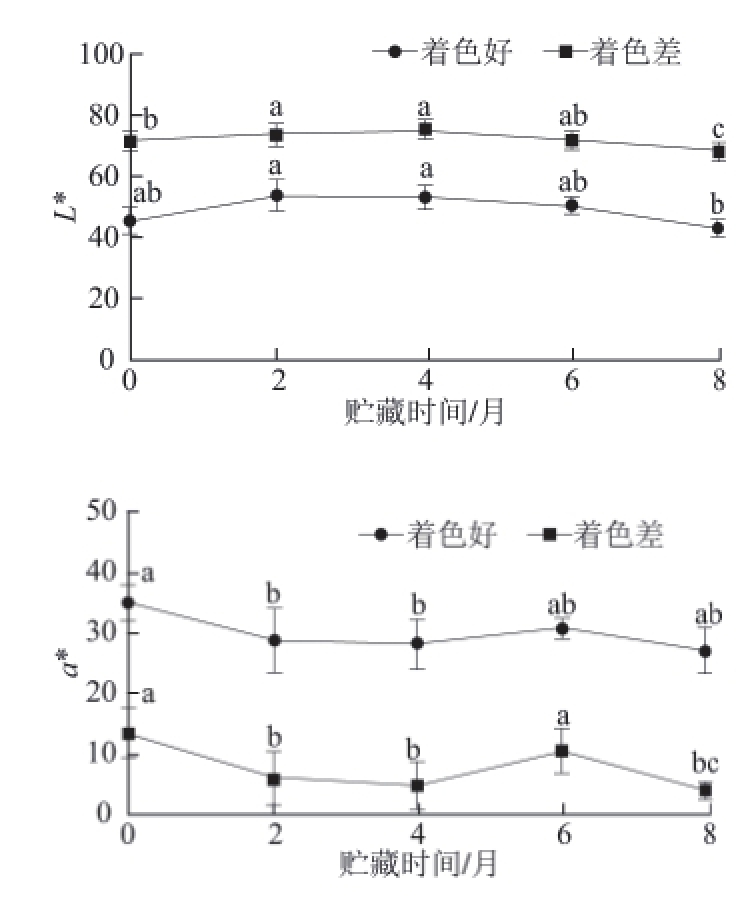
图 1 2 种不同色泽‘红富士’苹果贮藏期间果皮颜色变化
Fig.1 Color changes of two kinds of colored ‘Red Fuji' apples during storage
由图1可以知,采收时2 种不同色泽的‘红富士’苹果在贮藏期间颜色值随着贮藏时间的延长均发生变化,L*值均呈先升高后降低的变化趋势,但着色好的苹果在贮藏4个月时达到L*值最大值,而着色差的在贮藏2个月时达到L*值最大值;a*值均呈先降低后升高(6个月时达到峰值)再降低的变化趋势;b *值呈升高趋势,且着色差的果实波动幅度较小;H值呈先升高后降低再升高的变化趋势。综上所述采收时2 种不同颜色的‘红富士’苹果随着贮藏时间的延长,均表现出亮度变暗,红色减弱,黄色增强的果皮褪色现象。
2.2 ‘红富士’苹果贮藏期间果皮花青苷和叶绿素含量的变化
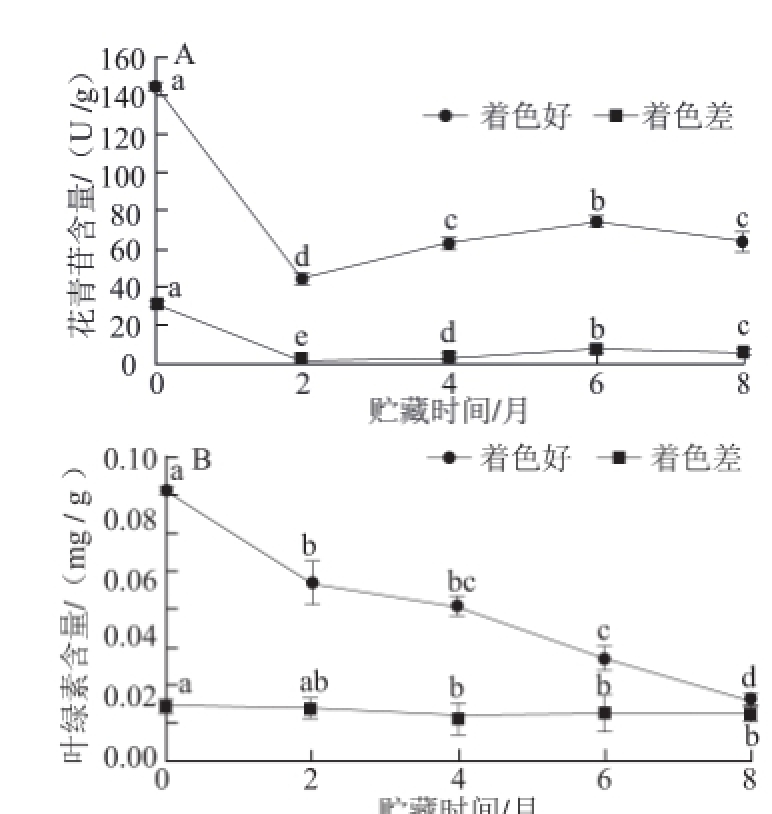
图 2 2 种不同色泽‘红富士’苹果贮藏期间果皮花青苷(A)和叶绿素(B)含量的变化
Fig.2 Changes in the contents of anthocyanin (A) and chlorophyll (B)in two kinds of colored ‘Red Fuji' apples during storage
由图2A可知,2 种不同颜色的‘红富士’苹果果皮花青苷含量有显著差异,着色好的‘红富士’苹果采收时果皮花青苷含量为144.56 U/g,而着色差的只有31.10 U/g。着色好的‘红富士’苹果贮藏2 个月时花青苷含量降至44.08 U/g,为采收时含量的30.49%,随着贮藏时间的延长花青苷含量逐渐增加,到贮藏6 个月时含量为74.25 U/g,为采收时含量的51.36%,贮藏8 个月时花青苷含量为64.25 U/g,为采收时含量的44.44%。着色差的‘红富士’苹果贮藏2 个月时花青苷含量降至1.46 U/g,为采收时含量的4.69%,随着贮藏时间的延长花青苷含量也逐渐升高,贮藏6个月时含 量为7.94 U/g,为采收时含量的25.53%,贮藏8 个月时花青苷含量为5.75 U/g,仅为采收时含量的18.49%。上述趋势与图1中的a*值变化趋势吻合,进一步证明花青苷含量是决定苹果红色的主要因素之一。
由图2B可知,2 种不同颜色的‘红富士’苹果叶绿素含量在采收存在显著差异;着色好的‘红富士’苹果随着贮藏时间的延长,果皮叶绿素含量由0.086 mg/g下降至0.01 9 mg/g,呈持续下降趋势;而着色差的‘红富士’苹果叶绿素含量波动不大,其含量由采收时的0.017 mg/g下降至贮藏8 个月时的0.015 mg/g,这也在一定程度上解释了,与着色好的苹果相比,着色差的苹果贮藏期间b*值波动更小。
2.3 ‘红富士’苹果贮藏期间果皮花青苷合成相关基因相对表达量的变化
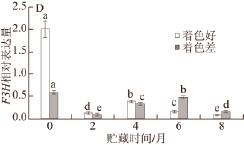
图 3 2 种不同颜色‘红富士’苹果贮藏期间PPAALL(AA) 、CCHHSS(BB)、CCHHII(CC) 和FF33HH(D)相对表达量
Fig.3 Relative expression levels of (A) PAL, (B) CHS, (C) CHI, and (D)F3H genes in two kinds of colored ‘Red Fuji' apples during storage
由图3A可知,2 种颜色的‘红富士’苹果采收时果皮的PAL相对表达量无显著差异,贮藏过程中虽然2 种颜色苹果果皮中PAL相对表达量均呈先下降后升高在下降的趋势,但二者又有显著的不同,随着贮藏时间的延长,着色差的苹果在贮藏4 个月时PAL相对表达量达到峰值,着色好的苹果在贮藏6 个月时PAL相对表达量达到峰值,且贮藏6 个月后着色好的PAL相对表达量显著高于着色差的PAL表达。CHS、CHI和F3H协调作用下将查尔酮转化成二氢黄酮醇是苹果花青苷代谢途径的重要步骤。由图3B~D可知,采收时CHS、CHI和F3H在着色好的苹果果皮中的相对表达量均显著高于着色差的。贮藏过程中,着色差的苹果果皮CHS相对表达量呈先升高(贮藏2 个月时达到峰值)后降低的趋势,着色好的苹果果皮CHS相对表达量呈先降低后升高(贮藏4 个月时达到峰值)再降低的趋势;2 种不同颜色的苹果果皮CHI相对表达量均呈先降低后升高(贮藏4 个月时达到峰值)再降低的变化趋势;着色好的苹果果皮F3H相对表达量呈先降低后升高(贮藏4 个月时达到峰值)再降低的趋势,着色差的苹果果皮F3H相对表达量呈先升高(贮藏6 个月时达到峰值)后降低的趋势。
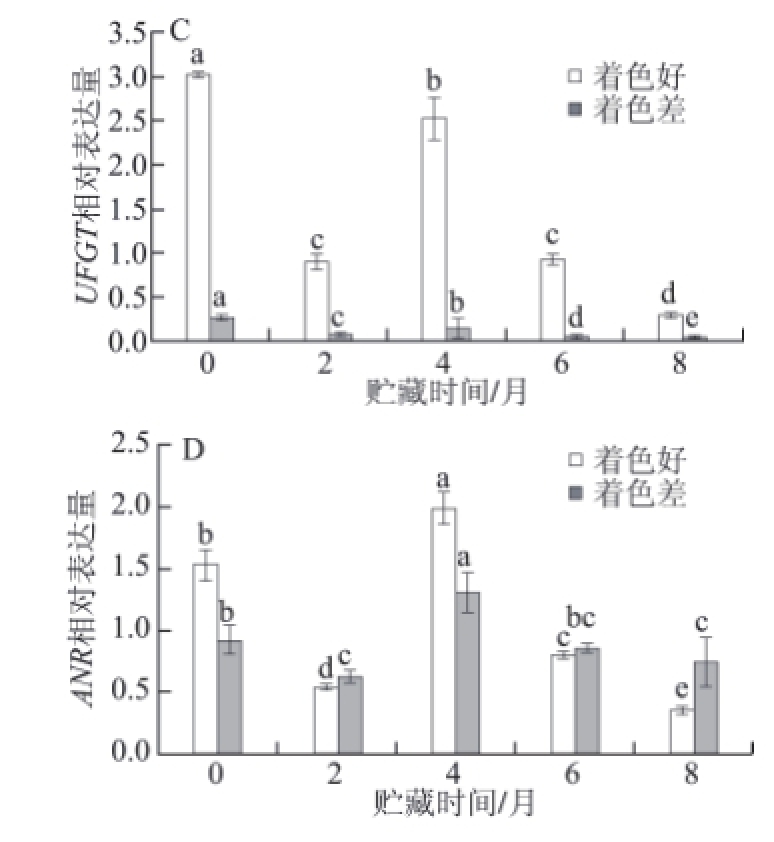
图 4 2 种不同颜色‘红富士’苹果贮藏期间DDFFRR(AA) 、LLDDOOXX (BB) 、UUFFGGTT(CC) 和AANNRR(D)相对表达量
Fig.4 Relative expression levels of (A) DFR, (B) LDOX, (C) UFGT, and (D) ANR genes in two kinds of colored ‘Red Fuji' apples during storage
由图4可以看出,采收时,着色好的苹果果皮中除LDOX的相对表达量低于着色差的外,DFR、UFGT和ANR相对表达量均显著高于着色差的。贮藏过程中,DFR、UFGT和ANR的相对表达量均呈先降低后升高(贮藏4个月时达到峰值)再下降的变化趋势,且在贮藏4 个月时着色差苹果果皮DFR相对表达量开始显著高于着色好的苹果(图4A);贮藏6 个月时,着色差苹果果皮ANR相对表达量开始显著高于着色好的苹果(图4D),着色好的苹果UFGT相对表达量均显著高于着色差的苹果(图4C);着色差的苹果果皮中的LDOX相对表达量呈下降趋势,着色好的相对表达量呈先降低后升高(贮藏4 个月时达到峰值)再降低的变化趋势(图4B);贮藏6 个月时ANR在着色差的果实中的相对表达量开始高于着色好的苹果(图4D)。
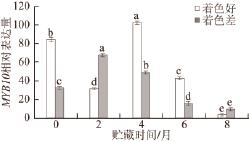
图 5 2 种不同颜色‘红富士’苹果贮藏期间转运抑制MMYYBB1100相对表达量
Fig.5 Relative expression levels of MYB transcription factor (MYB10)genes in two kinds of colored ‘Red Fuji' apples during storage
由图5可以看出,MYB10在2 种颜色的‘红富士’苹果果皮中的表达存在显著差异,着色好的是着色差的2.29 倍。贮藏2 个月时,着色差的果实果皮中MYB10相对表达量高于着色好的;贮藏后期,着色差的相对表达量远低于着色好的,二者差异2.10~2.80 倍,随着贮藏时间的延长,果皮中的MYB10相对表达量均呈先升高后降低的趋势。
3 讨 论
贮藏过程中苹果的衰老,不仅仅表现在延缓果实硬度下降、pH值升高等内在品质上,还体现在果实的果皮颜色变化上。花青苷和叶绿素是苹果果皮色素的主要成分
[10,24]。研究中发现2 种色泽的‘红富士’苹果在气调贮藏过程中果皮花青苷含量均呈先降低后升高再降低的变化趋势,叶绿素含量呈显著下降的变化趋势,而李秀芳等
[11]在研究中发现,‘红富士’苹果采后果皮花青苷的含量呈先升高后下降,叶绿素含量呈显著下降的变化趋势。此外,本研究还发现着色差的苹果果皮花青苷含量降解速度大于着色好的苹果,这与Harb等
[3]的研究结果相同。
大量研究表明,苹果的花青苷合成是在转录因子调节下的花青苷合成结构基因协调表达的过程。Ju Zhiguo等
[25]发现,红色苹果幼期PAL活性很高,但无花青苷合成或者很少合成,随着果实的发育,PAL活性逐渐降低,但花青苷含量逐渐增加,可见PAL不是花青苷合成的关键酶,而本研究也发现,贮藏过程中2 种不同颜色的苹果PAL相对表达量变化趋势与色素的变化趋势无显著相关性。Ardi等
[26]在研究鳄梨中发现乙烯能提高CHS活性,El-Kereamy等
[27]进一步发现用乙烯处理成熟的葡萄时可提高CHS的相对表达量,因此着色好苹果在贮藏4 个月时CHS相对表达量显著提高。贮藏后期(贮藏4 个月以后)着色差苹果果皮中的CHI、DFR、ANR和F3H的相对表达量高于着色好的苹果果皮中的相对表达量,这一结果与Harb等
[4]的结果相同。考虑到花青苷作为苹果果皮多酚中主要的抗氧化剂之一,因此预测造成上述现象的原因是果实为抵御果皮色素降解的生理紊乱现象而需合成更多多酚化合物而产生的一种自身防御机制。考虑到苹果花青苷的主要成分为矢车菊素-3-半乳糖,因此推测UFGT控制合成的UFGT是形成花青苷的关键酶之一,本研究测定2 种不同颜色的‘红富士’苹果贮藏期间UFGT的相对表达量变化与花青苷含量变化之间的关系也证实了这一观点。MYB10作为控制苹果果皮颜色的主要转录因子
[14,18],MYB10在着色好苹果中的相对表达量显著高于着色差的苹果,在本研究中,着色差的苹果果皮中MYB10的相对表达量与其花青苷含量的变化趋势一致,但着色好的苹果贮藏4 个月后花青苷含量开始回升,而MYB10的相对表达量持续下降,因此推测,MYB10不是贮藏期间花青苷合成的关键基因。
‘红富士’苹果贮藏期间发生的果皮褪色现象,是造成果实商业价值降低的主要原因之一,其机制十分复
杂,不仅与采收时果皮色泽及贮藏过程中花青苷合成相关基因转录水平有关,还与果实自身的细胞所在环境及花青苷的合成前提物质及相关降解酶活性等因素有关,因此‘红富士’苹果贮藏期间果皮色素降解机制仍需进一步研究,以确定贮藏期间启动花青苷合成关键基因,为苹果贮藏品质的研究提供理论依据。
参考文献:
[1] SAURE M. External control of anthocyanin formation in apple: a review[J]. Scientia Horticulturae, 1990, 42(3): 181-218.
[2] JU Zhiguo. Fruit bagging, a useful method for studying anthocyanin synthesis and gene expression in apple[J]. Scientia Horticulturae,1998, 77: 145-154.
[3] HARB J, KITTEMANN D, NEUWALD D A, et al. Correlation between changes in polyphenol composition of peels and incidence of CO
2skin burning of ‘Cameo' apples as influenced by controlled atmosphere storage[J]. Journal of Agricultural and Food Chemistry,2013, 61: 3624-3630.
[4] HARB J, SALEH O, KITTEMANN D, et al. Upregulation of polypenolrelated genes prevents ‘skin burning' of well-colored ‘Cameo' apples stored under stressful controlled atmosphere conditions[J]. Postharvest Biology and Technology, 2013, 77: 121-127.
[5] FAWBUSH F, NOCK J, WATKINS C. Antioxidant contents and activity of 1-methylcyclopropene (1-MCP)-treated ‘Empire' apples in air and controlled atmosphere storage[J]. Postharvest Biology and Technology, 2009, 52: 30-37.
[6] JOHNSTON J, HEWETT E, HERTOG M. Postharvest softening of apple (Malus domestica) fruit: a review[J]. New Zealand Journal of Crop and Horticultural Scienc, 2002, 30: 145-160.
[7] SINGH Z, SHAFIQ M. Training systems and pre-harvest ethred application affect fruit colour development and quality of ‘Pink Lady' apple at harvest and in controlled atmosphere storage[J]. Acta Horticulturae, 2008, 774: 165-172.
[8] HONDA C, KOTODA N, WADA M, et al. Anthocyanin biosynthetic genes are coordinately expressed during red coloration in apple skin[J]. Plant Physiology and Biochemistry, 2002, 40: 955-962.
[9] BEN-YECHUDAH G, KORCHINSKY R, REDEL G, et al. Colour accumulation patterns and the anthocyanin biosynthetic pathway in ‘Red Delicious' apple variants[J]. Journal of Horticultural Science and Biotechnology, 2005, 80: 187-192.
[10] 李秀菊, 刘用生, 束怀瑞. 红富士苹果套袋果实色泽与激素含量的变化[J]. 园艺学报, 1998, 25(3): 209-213.
[11] 李秀芳, 饶景萍, 马秋诗, 等. 红富士苹果采后1-MCP处理对果皮色素及其相关酶活性的影响[J]. 园艺学报, 2014, 41(3): 447-455.
[12] FENG Fengjuan, LI Mingjun, MA Fengwang, et al. The effects of bagging and debagging on external fruit quality, metabolites, and the expression of anthocyanin biosynthetic genes in ‘Jonagold' apple (Malus domestica Borkh.)[J]. Scientia Horticulturae, 2014, 165: 123-131.
[13] LI Yuanyuan, MAO Ke, ZHAO Cheng, et al. MdCOP1 ubiquitin E3 ligases interact with MdMYB1 to regulate light-induced anthocyanin biosynthesis and red fruit coloration in apple[J]. Plant Physiology,2012, 160: 1011-1022.
[14] ESPLEY R V, BRENDOLISE C, CHAGNE D, et al. Red colouration in apple fruit is due to the activity of the MYB transcription factor MdMYB10[J]. Plant Journal, 2007, 11: 462-466.
[15] WEI Yongzan, HU Fuchu, HU Guibing, et al. Differential expression of anthocyanin biosynthetic genes in relation to anthocyanin accumulation in the pericarp of litchi Chinensis Sonn[J]. PloS One,2011, 6(4): e19455.
[16] GOODRICH J, CARPENTER R, COEN E. A common gene regulates pigmentation pattern in diverse plant species[J]. Cell, 1992, 68: 955-964.
[17] KONDO S, HIRAOKA K, KOBAY ASHI S, et al. Changes in the expression of anthocyanin biosynthetic genes during apple development[J]. Journal of the American Society for Horticultural Science, 2002, 127: 971-976.
[18] TAKOS A, ROBINSON S, WALKER A. Transcriptional regulation of the flavonoid pathway in the skin of dark grown ‘Cripps' Red’apples in response to sunlight[J]. Journal of Horticultural Science and Biotechnology, 2006, 81: 735-744.
[19] LI Pengmin, MA Fengwang, CHENG Lailiang. Primary and secondary metabolism in sun-exposed peel and the shaded peel of apple fruit[J]. Physiologia Plantarum, 2013, 148: 9-24.
[20] 潘增光, 范晖, 束怀瑞. 苹果果实花青素形成与乙烯释放的关系[J].植物生理学通讯, 1995, 31(5): 338-340.
[21] 王延玲, 张艳敏, 冯守千, 等. 新疆红肉苹果果皮果肉呈色差异机理[J].中国农业科学, 2012, 45(13): 2771-2778.
[22] XIE L, WANG Z H, CHENG X H, et al. 5-Aminolevulinic acid promotes anthocyanin accumulation in ‘Fuji' apples[J]. Plant Growth Regulation, 2012, 69: 295-303.
[23] GASIC K, HERNANDEZ K, KORBAN S S. RNA extraction from different apple tissues rich in polyphenols and polysaccharides for cDNA library construction[J]. Plant Molecular Biology Reporter,2004, 22: 437a-437g.
[24] BEE R N, LEE S K. Infl uence of chlorophyll, internal ethylene, and PAL on anthocyanin synthesis in ‘Fuji' apple[J]. Korean Society Horticultural Science, 1995, 36(3): 361-370.
[25] JU Zhiguo, LIU Chenglian, YUAN Yongbing. Activity of chalcone synthase and UDPGal: falvonoid-3-glycosytransferase in relation to anthocyanin synthesis in apple[J]. Scientia Horticulturase, 1995, 63:175-185.
[26] ARDI R, KOBILER I, JACOBY B, et al. Involvement of epicatechin biosynthesis in the activation of the mechanism of resistance of avocado fruits to Colletotrichum gloeosporioides[J]. Physiological and Molecular Plant Pathology, 1998, 53: 269-285.
[27] El-KEREAMY A, CHERVIN C, ROUSTAN J P, et al. Exogenous ethylene stimulates the long-term expression of genes related to anthocyanin biosynthesis in grape berries[J]. Physiologia Plantarum,2003, 119: 175-182.
Changes in Pericarp Color and the Expression of Anthocyanin Biosynthesis-Related Genes of Two Kinds of Colored ‘Red Fuji' Apples during Controlled Atmosphere Storage
CHEN Lei, GUO Yurong
*, BAI Ge, YUAN Li
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi'an 710119, China)
Abstract:The aim of this study was to explore the effects of harvest color on the pericarp pigment and the expression levels of anthocyanin biosynthesis-related genes of two kinds of colored ‘Red Fuji' apples during controlled atmosphere (CA) storage. The changes in color values, the contents of anthocyanin and chlorophyll in apple peel and the transcriptional profi les of anthocyanin biosynthesis-related genes were measured by colorimeter, UV spectrophotometry, and quantitative real-time polymerase chain reaction (qRT-PCR) during storage, respectively. During storage, the content of anthocyanin changed whereas the content of anthocyanin declined by 51.36%-69.51% in well-colored apple and by 74.45%-95.30% in bad-colored apple. The content of chlorophyll in well-colored ap ple significantly decreased compared to bad-colored apple. At harvest time, the expression levels of anthocyanin biosynthesis-related genes including chalcone isomerase (CHI), dihydroflavonol-4-reductase (DFR), anthocyanidin reductase (ANR), and flavanone 3-hydroxylase (F3H) except leucoanthocyanidin dioxy genase (LDOX) were significantly higher in well-colored apples than in bad-colored apples. During storage, the expression levels of anthocyanin biosynthesis-related genes were si gnifi cantly reduced. After storage for four months, the expression levels of CHI, DFR, ANR, and F3H were signifi cantly higher in bad-colored apples. With the extension of storage time, the expression levels of anthocyanin biosynthesis-related genes were signifi cantly r educed,resulting in decreased rate of anthocyanin synthesis. “Skin burning” more likely happened in bad-colored ‘Red Fuji' apples than in well-colored ones during CA storage.
Key words:apple; anthocyanin; chlorophyll; gene expression; postharvest
中图分类号:S661.1
文献标志码:A
文章编号:1002-6630(2015)24-0326-06
doi:10.7506/spkx1002-6630-201524060
收稿日期:2015-01-15
基金项目:国家现代农业产业技术体系建设专项(GK661001)
作者简介:陈磊(1988—),男,硕士,主要从事食品生物技术与食品储藏研究。E-mail:chen122148@163.com
*通信作者:郭玉蓉(1962—),女,教授,博士,主要从事食品生物加工研究。E-mail:guoyurong730@163.com