
闫利国,唐善虎 *,王 柳,李思宁,白菊红,卢付青,水旭亭
(西南民族大学生命科学与技术学院,四川 成都 610041)
摘 要:探讨在普通包装和真空包装冻藏条件下的牦牛背最长肌和股二头肌的肌原纤维蛋白氧化变化。结果表明:羰基含量60 d时显著增加(P<0.05),除股二头肌普通包装组在90 d保藏时的羰基含量显著升高外,其他处理组都呈下降趋势(P>0.05);总巯基含量在冻藏60 d内总体上升(P<0.05),60 d之后呈下降趋势;采用真空包装的两个处理组的表面疏水性在冷冻贮藏90 d以后都比普通包装的低;背最长肌的Ca 2+-ATP酶活性比股二头肌的低,而K-ATP酶活性则无显著差异。背最长肌肌原纤维蛋白溶解性在整个实验周期中有显著变化(P<0.05),股二头肌肌原纤维蛋白溶解性的变化不显著(P>0.05)。此外,冷冻贮藏期间的蛋白质条带发生了变化,肌球蛋白重链和肌动蛋白随着冻藏时间的延长都发生了不同程度的降解。该结果说明随着冷冻贮藏时间的延长,肌原纤维蛋白发生了氧化。且随时间延长,蛋白氧化越严重,表面疏水性和溶解性越低,总巯基含量、K-ATP酶活性和Ca-ATP酶活性含量越高。
关键词:牦牛肉;肌原纤维蛋白;氧化;理化特性
牦牛是高寒地区特有的牛种,主要产于青藏高原海拔3 000 m以上的地区,生活在无污染的天然环境中,牦牛肉属于“高蛋白、低脂肪肉类”,蛋白质含量在21%~22%之间,脂肪含量仅为2%~3%。其必需氨基酸含量和非必需氨基酸含量均高于黄牛、夏洛莱牛、西门塔尔牛等 [1],且饱和脂肪酸含量低于黄牛,单不饱和脂肪酸和多不饱和脂肪酸含量高于黄牛,还含有黄牛肉中没有的功能性脂肪酸二十碳五烯酸和二十二碳六烯酸 [2],非常符合人类营养学认为的标准 [3]。随着人们对绿色健康食品观念的不断增强,国内牛肉制品消费将有广阔的市场前景 [4]。牦牛肉是一种高营养的天然、绿色、无污染肉食品,但由于地理因素及养殖技术的制约,其消费目前还大多集中在偏远的牧区,大中城市的消费份额相对较少,且大多是风干的牦牛肉干等休闲食品,还不能真正走进普通消费家庭的餐桌上,牦牛肉的运输及加工成为了研究的热点。
冷冻贮藏是长期保存新鲜肉类最常用的技术手段。然而,研究发现,冻藏对肌肉蛋白质羰基含量以及肉的品质如保水性、颜色和质构有显著影响 [5-7],不同的解冻方式也会引起肉类脂质及蛋白质氧化 [8],且随着冷冻-解冻循环次数的增加,肉中蛋白质和脂肪氧化程度加深,肌原纤维蛋白的表面疏水性、溶解度、乳化性和凝胶特性均下降 [9],进而影响肉类产品的风味、色泽、质地(黏性、弹性、嫩度)等食用品质,降低了蛋白质消化性和营养价值。除了上述的外部因素外,肉类蛋白质氧化敏感性还容易受一些内部因素的影响,比如蛋白质、脂类、金属离子、还原糖等的含量和特征,肌肉的代谢和抗氧化酶类如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶-还原酶系统 [10]。羟自由基对肌原纤维蛋白中的氨基酸具有氧化选择性,半胱氨酸、酪氨酸及蛋氨酸容易被氧化,而甘氨酸、亮氨酸及天冬氨酸等不易被氧化 [11]。铜离子通过使蛋白质巯基交联形成二硫键诱导肌原纤维蛋白聚合,铁离子则诱导脂肪氧化,增加肌肉的黄度值(b*) [12],促进羰基的生成。Utrera等 [13]研究背最长肌、腰大肌和股四头肌3 个不同部位牛肉制作的牛肉饼在-18 ℃冻藏20 周后的氧化特性,结果表明,冷冻贮藏对不同部位牛肉制作的牛肉饼的氧化稳定性具有显著的影响。血红素铁含量、抗氧化酶活性和多不饱和脂肪酸的含量可能极大地影响牛肉饼的氧化势能。其中,股四头肌做的肉饼最容易受到脂质和蛋白质氧化的影响,工艺处理也增加了牛肉饼氧化敏感性和品质损失。这些研究表明,不同的外部因素及肉的内在特性与其氧化稳定性具有一定关系,这些内源性影响因子对蛋白质氧化的发生、程度和性质的影响的认识还很有限,需要详细的研究。
目前针对牦牛肉冷冻贮藏特性的研究还很少,而关于冻藏期间的蛋白质氧化特性的研究鲜见报道。基于以上认识,本课题着重探讨牦牛肉蛋白质在冻藏条件下的氧化对于肉品本身品质的影响,为进一步制定控制肉类氧化的方案及找出合理的肉制品长期储藏方法提供研究参考。该研究取牦牛背最长肌和股二头肌两种肉,分别采用普通包装和真空包装,于-18 ℃冷冻贮藏,采用自然解冻的方式,研究不同内在特性及外部因素对牦牛肉的氧化特性的影响。
1.1 材料与试剂
1.1.1 材料
选取自然放牧、健康无病的3 岁成年公牦牛,屠宰后现场采集背最长肌和股二头肌各1 kg,装入洁净保鲜袋中密封,-18 ℃冰箱急冻2 h,在0~4 ℃条件下运往西南民族大学生命科学与技术学院食品科学实验室。
1.1.2 试剂
5,5′-二硫代双(2-硝基苯甲酸)、丙烯酰胺、十二烷基磺酸钠、三羟甲基氨基甲烷、N,N'-甲叉双丙烯酰胺(Bis)、N,N,N',N'-四甲基乙二胺、过硫酸铵、甘氨酸、考马斯亮蓝R-250、G-250、标准牛血清蛋白 美国Sigma试剂公司;2,4-二硝基苯肼、乙二胺四乙酸二钠成都科龙化工试剂厂;溴酚蓝 天津市天新精细化工开发中心;ATP酶测试盒 南京建成生物有限公司;十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)标准蛋白上海生化试剂公司。
1.2 仪器与设备
UV2100紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;DYY-12型电脑三恒多用电泳仪 北京市六一仪器厂;Mini电泳槽 美国Bio-Rad公司;FSH-2A可调高速组织匀浆机 金坛市华城海龙实验仪器厂;5804R高速冷冻离心机 德国Eppendorf公司;PL303分析天平 梅特勒-托利多有限公司;MP511 Lab pH 计上海三信仪表厂;DZ350台式真空包装机 温州鑫空包装机械有限公司;实验室常用仪器设备。
1.3 方法
1.3.1 实验设计
尸僵后的牦牛背最长肌和股二头肌各1 kg,取部分肉提取肌原纤维蛋白作为对照组,测定相关指标,其余部分平均分成4 份,分为4 个处理组,处理组1:背最长肌普通包装;处理组2:背最长肌真空包装;处理组3:股二头肌普通包装;处理组4:股二头肌真空包装。所有样品放入-18 ℃冰箱中冷冻,经0、30、60、90 d和120 d冻藏后,在每个处理组中取一份测其理化指标和功能指标。主要测定结构变化(羰基含量、总巯基含量、表面疏水性和SDS-PAGE)和生化变化(蛋白质ATP酶活性和溶解性)。
1.3.2 牦牛肉肌原纤维蛋白的提取
提取方法参考Park等 [14]并稍作修改。取冻藏肉20 g,室温解冻,剔除脂肪和结缔组织,切成2 mm×2 mm×2 mm大小的肉粒;装入高速组织匀浆机里,加入4 倍体积的磷酸缓冲液(0.1 mol/ L NaCl溶液、5 mmol/L乙二胺四乙酸溶液,pH 7.0),高速匀浆至均质液,离心(2 000×g、4 ℃)15 min,弃上清液,重复2 次。加入4 倍体积的0.1 mol/L NaCl漂洗液,高速匀浆30 s,离心15 min,倒掉上清液,加入8 倍体积的漂洗液后匀浆,用4 层纱布过滤除去结缔组织;用0.1 mol/L HCl调整滤液的pH值为6.0,离心15 min,倒掉上清液,将沉淀密封保存于冰盒中,24 h内测定相关指标。蛋白质质量浓度的测定采用考马斯亮蓝G-250法,以标准牛血清白蛋白做标准曲线。
1.3.3 牦牛肉肌原纤维蛋白羰基含量的测定
参考Oliver等 [15]的测定方法。取1 mL质量浓度为4 mg/mL蛋白质溶液放入聚乙烯离心管中,每管中加入1 mL 10 mmol/L 2,4-二硝基苯肼溶液,并设一组空白对照。将各反应体系置于黑暗中室温(25 ℃)反应40 min,每隔5 min漩涡振荡一次。然后加入1 mL 20%的三氯乙酸溶液,振荡后离心(12 000×g,4 ℃,10 min),弃上清液。沉淀用1 mL的乙醇-乙酸乙酯溶液(1∶1,V/V)洗涤3 次。最后的沉淀溶解于3 mL 6 mol/L盐酸胍溶液中,37 ℃水浴15 min,12 000×g离心5 min,设定波长为370 nm,空白管调零,测定样品吸光度,蛋白质羰基衍生物的含量用摩尔消光系数为22 000 L/(mol·cm)计算。
1.3.4 蛋白总巯基含量的测定
总巯基含量的测定采用Ellman [16]试剂法。取1 mL质量浓度约为4 mg/mL的蛋白溶液加入4 mL含有6 mol/L盐酸胍的Tris-HCl缓冲液,混匀后取4.5 mL样品溶液加入0.5 mL 5,5-二硫代双(2-硝基苯甲酸)溶液混合,在25 ℃条件下静置25 min,对照组用提取缓冲液代替样品,在412 nm波长处测定其吸光度。巯基含量使用摩尔吸光系数13 600 L/(mol· cm)计算。
1.3.5 表面疏水性的测定
参考Chelh等 [17]的方法测定肌原纤维蛋白的表面疏水性。将肌原纤维蛋白溶于20 mmol/L pH 6.0的磷酸盐溶液中,使蛋白质量浓度为5 mg/mL。取1 mL的蛋白溶液加入200 μL的溴酚蓝(1 mg/mL),混匀,室温条件下搅拌10 min,然后7 000 r/min离心15 min,上清液稀释10 倍后在595 nm波长处测定吸收度A。空白样为未加样品的磷酸盐缓冲液。
表面疏水性用公式(1)表示:

1.3.6 肌原纤维蛋白SDS-PAGE
参考Laemmli [18]的方法,电泳条件:分离胶质量分数10%,浓缩胶质量分数4%,开始电压80 V、10 mA,30 min后加大至120 V、20 mA至电泳结束,待测蛋白质(质量浓度1 mg/mL)和5×样品缓冲液(60 mmol/L Tris-HCl pH 6.8、25%甘油、2% SDS、5% β-巯基乙醇、0.1%溴酚蓝)以3∶1(V/V)混合,沸水浴5 min,冷却后上样,上样量为10 μL。电泳结束后用0.2%的考马斯亮蓝染色液染色2 h,最后用含7.5%甲醇和7.5%醋酸的脱色液脱色至背景清晰。使用Bio-Rad凝胶成像仪拍照,分析肌原纤维蛋白聚集与降解变化。
1.3.7 肌原纤维蛋白ATP酶活性的测定
采用南京建成生物工程研究所提供的超微量ATP酶测试盒和紫外-可见分光光度计。蛋白膏用0.6 mol/L的NaCl溶液稀释成质量浓度约为1 mg/mL。酶活力表示为μmol Pi/(mg·10 min)。
1.3.8 肌原纤维蛋白溶解性的测定
将肌原纤维蛋白与NaCl浓度为0.6 mol/mL的磷酸缓冲溶液混合,使蛋白质质量浓度为6 mg/mL。将混合液振荡,使蛋白颗粒均匀分散,然后将混合液在4 ℃的冰箱中放置2 h;取出混合样,在7 300×g离心10 min,取上清液,测定蛋白液质量浓度,蛋白质溶解度根据公式(2)计算。

1.4 数据统计
本实验所有数据均为3 次重复的平均值,数据处理使用SPSS 21.0统计分析软件进行方差分析(One way anova)、显著性分析(Tukey)和相关性分析(Pearson),不同显著性数据用不同字母或星号标记。
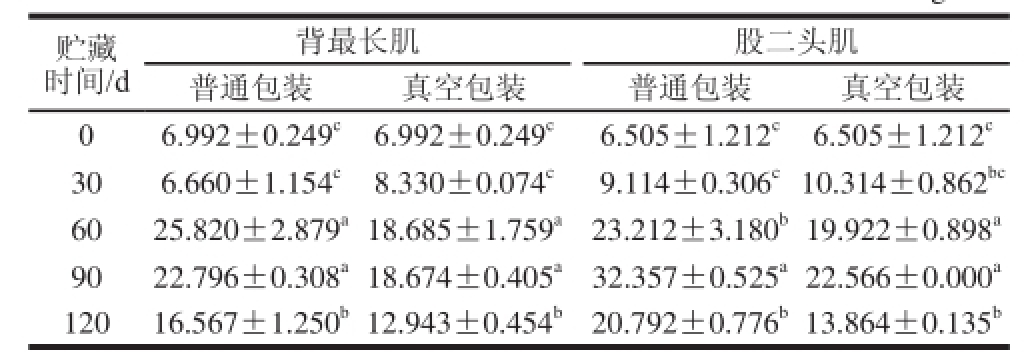
2.1 氧化对肌原纤维蛋白羰基含量的影响羰基是标识蛋白质氧化的主要指示性物质,通常由易受自由基攻击的带有NH或NH 2的氨基酸侧链及肽键的断裂产生 [19]。从表1可以看出,未氧化的牦牛肌原纤维蛋白的羰基含量在6.505~6.992 nmol/mg之间,这比报道的猪肉 [14]中的羰基含量高大约5 倍,与李艳青 [20]报道的值接近。所有处理组羰基含量在冷冻贮藏30 d时增加不显著(P>0.05),60 d时显著增加(P<0.05),这可能是由于细胞器破裂引起氧化酶和促氧化剂的释放所致,同时Liu等 [21]研究发现,大部分羰基的生成都是在肌原纤维蛋白接触到氧化剂的最初一段时间内完成的,24 h
表1 不同贮藏时间下肌原纤维蛋白羰基含量的变化(x ±s)
TTaabbllee 11 CChhaannggeess iinn ccarbonyl content of yak myofi brillar protein under ddiifffferent packaging treatments during frozen storage (x ± ss)nmol/mg蛋白
注:同一列肩标有不同小写字母表示不同时间差异显著(P<0.05)。下同。
贮藏时间/d背最长肌 股二头肌普通包装 真空包装 普通包装 真空包装0 6.992±0.249 c 6.992±0.249 c 6.505±1.212 c 6.505±1.212 c30 6.660±1.154 c 8.330±0.074 c 9.114±0.306 c10.314±0.862 bc60 25.820±2.879 a18.685±1.759 a23.212±3.180 b19.922±0.898 a90 22.796±0.308 a18.674±0.405 a32.357±0.525 a22.566±0.000 a120 16.567±1.250 b12.943±0.454 b20.792±0.776 b13.864±0.135 b
之后的羰基生成量很少,这也从侧面证明了牦牛肉氧化程度增强的突跃是从冻藏60 d后开始的。90 d时除股二头肌普通包装组的羰基含量显著升高外,其他处理组都呈下降趋势(P>0.05)。120 d时所有处理组的羰基含量都显著下降,这与之前的研究报道 [14]一致。新生成的羰基会攻击蛋白质中的亲核物质,发生羰氨缩合反应,导致羰基含量降低 [22]。同时可以看出,采用真空包装处理组的羰基含量小于普通包装处理组,总体差异不显著(P>0.05),表明真空包装能在一定程度上减少肌原纤维蛋白的氧化;背最长肌普通包装处理组和真空包装处理组的羰基含量都小于股二头肌对应的处理组,这可能与两种肉的内在特性有关,股二头肌氧化敏感性比背最长肌要高。
2.2 氧化对肌原纤维蛋白总巯基含量的影响
表2 不同贮藏时间下肌原纤维蛋白总巯基含量的变化(
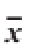 x ±s)
x ±s)
TTaabbllee 22 CChhaannggeess iinn ttootal sulfhydryl content of yak muscle myofi brillar
protein at different frozen storage times (
 ± ss)nmol/mg蛋白
± ss)nmol/mg蛋白
贮藏时间/d背最长肌 股二头肌普通包装 真空包装 普通包装 真空包装0 41.565±13.575 b41.565±13.575 b38.480±3.862 e38.480±3.862 c30 48.516±0.323 b52.041±0.534 ab61.818±1.831 d65.878±2.015 b60 97.092±0.227 a83.269±0.000 a120.214±2.750 a82.464±0.377 a90 71.111±0.054 ab71.746±2.284 ab91.288±1.681 b87.640±2.094 a120 56.300±0.240 b53.350±0.777 ab75.590±0.523 c46.280±0.224 c
肌球蛋白占肌原纤维蛋白的50%~55%,肌动蛋白约占肌原纤维蛋白的20%,是肌原纤维蛋白的主要组成蛋白,肌球蛋白分子中含有大约40 个巯基,肌动蛋白分子中约含有12 个巯基。二硫键的形成和相关共价化合物的产生可降低分子中总巯基的含量,通常蛋白质氧化程度越高总巯基含量越低 [23]。由表2可以看出,各处理组在冻藏60 d内总巯基含量总体上升(P<0.05),60 d之后呈下降趋势,这与模拟体系中总巯基含量逐渐减少的变化趋势不一致。Lametsch [24]研究指出,肌球蛋白中自由巯基氧化是一个快速的反应,同时具有pH值依赖性,在快速氧化阶段对pH值不敏感,之后的慢反应阶段过高或过低的pH值都使巯基氧化加快。说明牦牛肉肌原纤维蛋白在冻藏60 d时发生了快速的氧化,这与羰基含量的测定结果一致,同时表明,牦牛肉冻藏期间控制肉的pH值具有现实意义,需要做进一步的研究。比较两种肉总巯基含量变化趋势可以看出,背最长肌处理组的总巯基含量小于股二头肌处理组,差异不显著;普通包装处理组的总巯基含量总体上大于真空包装处理组,表明真空包装处理组肌原纤维蛋白并不能有效地维持肌原纤维蛋白的巯基。
2.3 氧化对肌原纤维蛋白表面疏水性的影响蛋白质的表面疏水性代表蛋白质表面疏水性氨基酸的相对含量,也能反映蛋白质结构展开程度。Li等 [25]研究发现蛋白质结构伸展一般使表面疏水性增强,而聚集或交联则使其表面疏水性降低。由表3可以看出,贮藏时间为30 d时,各组肌原纤维蛋白表面疏水性都呈现上升的趋势,表明氧化改变了肌原纤维蛋白的构象,使更多的疏水性氨基酸残基暴露在分子表面。同时可以看出背最长肌两个处理组表面疏水性上升不显著,股二头肌两个处理组均上升显著。比较两种包装处理组,采用普通包装的两个处理组的表面疏水性在冷冻贮藏90 d以后都呈上升趋势,而真空包装组则呈下降趋势。股二头肌普通包装组表面疏水性显著高于其他处理组,这可能与贮藏后期脂肪与蛋白质交联有关 [26]。真空包装有助于降低冷冻贮藏肌原纤维蛋白的表面疏水性,股二头肌随着氧化的加剧,其表面疏水性总体上大于背最长肌处理组。
表3 不同贮藏时间下肌原纤维蛋白表面疏水性的变化(
 ±s)TTaabbllee 33 CChhaannggeess iinn surface hydrophobicity of yak muscle myofi brillar
±s)TTaabbllee 33 CChhaannggeess iinn surface hydrophobicity of yak muscle myofi brillar
protein at different frozen storage times (
 ± ss)
± ss)
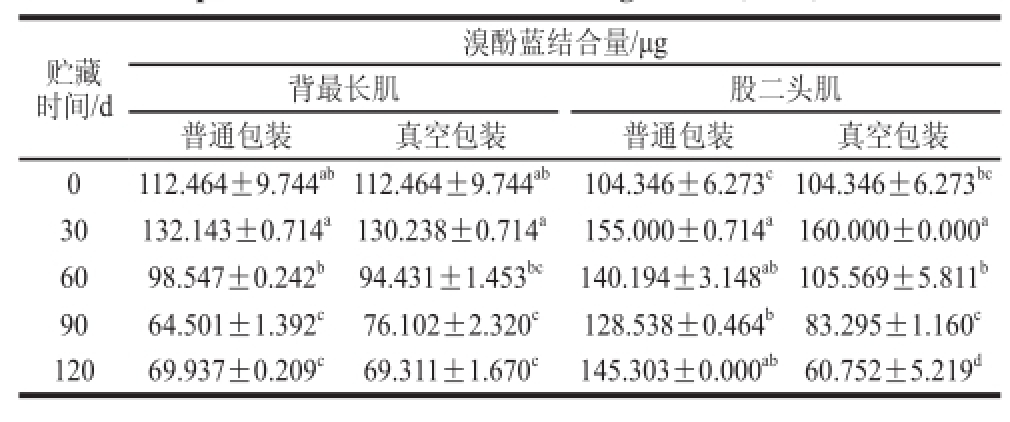
贮藏时间/d溴酚蓝结合量/μg背最长肌 股二头肌普通包装 真空包装 普通包装 真空包装0 112.464±9.744 ab112.464±9.744 ab 104.346±6.273 c104.346±6.273 bc30 132.143±0.714 a130.238±0.714 a 155.000±0.714 a160.000±0.000 a60 98.547±0.242 b 94.431±1.453 bc 140.194±3.148 ab105.569±5.811 b90 64.501±1.392 c 76.102±2.320 c 128.538±0.464 b 83.295±1.160 c120 69.937±0.209 c 69.311±1.670 c 145.303±0.000 ab60.752±5.219 d
2.4 肌原纤维蛋白质分子聚集和降解变化
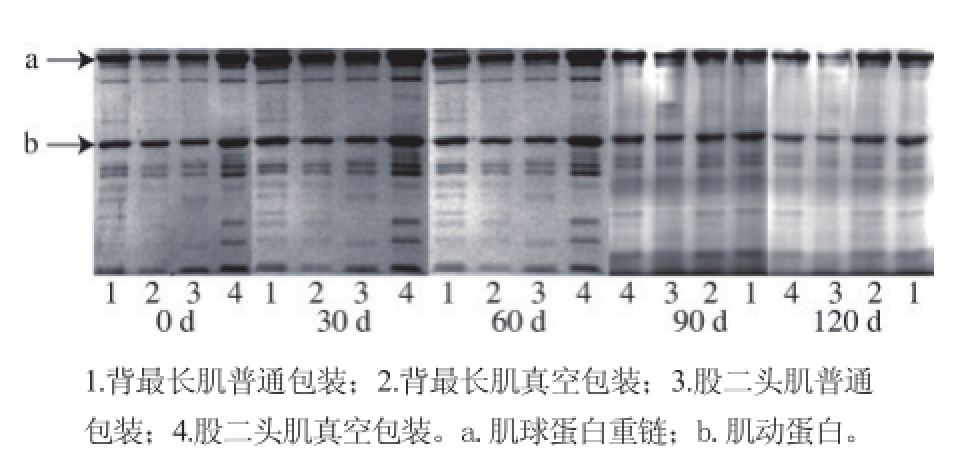
图 1 4 个处理组不同冻藏时间肌原纤维蛋白SDS-PAGE电泳图谱Fig.1 SDS-PAGE patterns of four treatments during frozen storage
通常情况下,蛋白质氧化的主要形式就是蛋白聚集或者降解成片段 [27]。由图1可以看出,冷冻贮藏期间的蛋白质条带发生了变化。肌球蛋白重链和肌动蛋白随着冻藏时间的延长都发生了不同程度的降解。其中肌球蛋白在冻藏前期发生了聚集,分子质量增大,条带颜色变深,60 d后条带颜色显著变浅,可能发生了降解。肌动蛋白在冻藏前期聚集不明显,在贮藏后期也发生了显著的降解,条带颜色变浅。由此推测,股二头肌普通包装组的肌原纤维蛋白降解程度最大。
2.5 氧化对肌原纤维蛋白K-ATP和Ca-ATP酶活性的影响
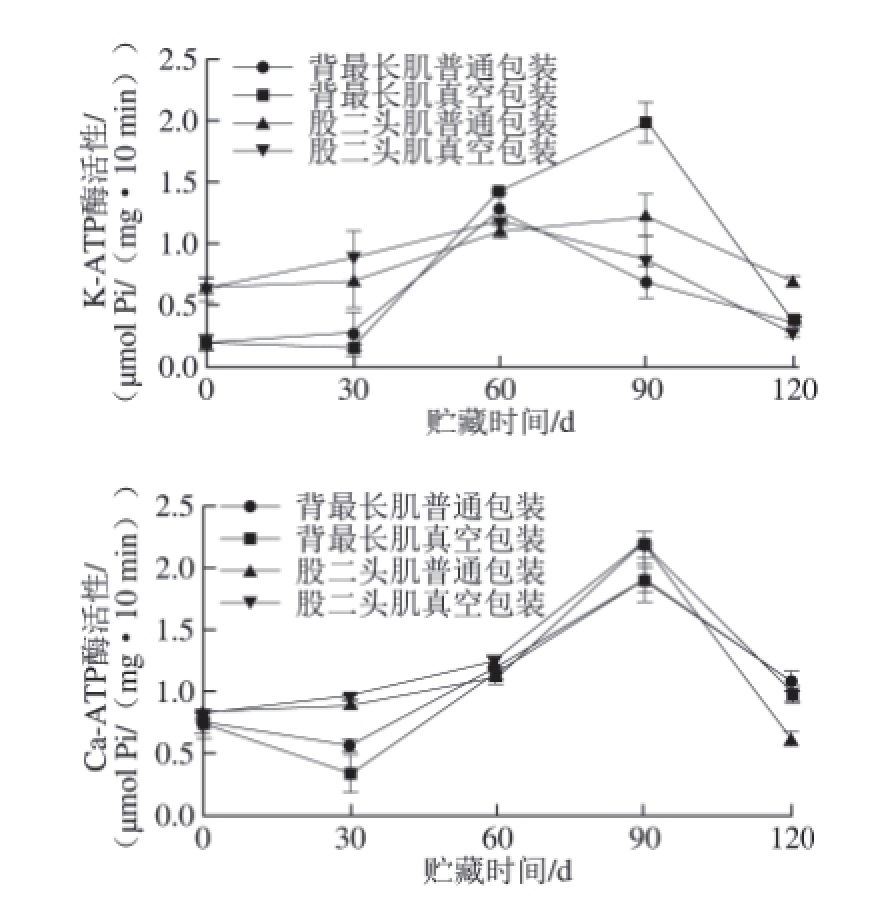
图 2 冻藏条件下不同处理组肌原纤维蛋白K-ATP酶活性和
Ca-ATP酶活性的变化
Fig.2 K-ATPase and Ca-ATPase activities of four treatments during frozen storage
肌球蛋白头部的K-ATP酶和Ca-ATP酶活性部位都含有巯基,酶活性的变化可以反映出肌球蛋白氧化后结构的变化 [28]。从图2可以看出,冷冻贮藏30 d内,股二头肌的K-ATP酶和Ca-ATP酶活力均大于背最长肌的。贮藏60 d内各处理组Ca-ATP酶活性均有所增加,90 d时显著上升,90 d后均显著下降。同时可以看出,背最长肌处理组的Ca-ATP酶活性比股二头肌处理组的低,而K-ATP酶活性则无显著差异,表明Ca-ATP酶活性主要与肌肉部位有关,而与氧化程度关系不明显。
2.6 氧化对肌原纤维蛋白溶解性的影响
表面疏水性和酶活性的实验结果都证实了肌原纤维蛋白在冻藏期间其结构发生了改变,而结构的改变必然引起蛋白溶解度的变化。从表4可以看出,在冷冻贮藏30 d时,肌原纤维蛋白溶解性上升,说明适度氧化可以提高其溶解性。30 d之后4 个处理组都呈现下降的趋势,表明氧化使肌原纤维蛋白的溶解性下降。同时可以看出,背最长肌在贮藏30 d时溶解性上升显著(P<0.05),股二头肌的溶解性在整个实验周期中的变化不显著(P>0.05)。适度的氧化可以使肌原纤维蛋白大分子链断裂成小片段,因此溶解性有所上升,氧化后期,肌原纤维蛋白趋向于聚集和共价连接,降低其溶解性。对4 个处理组冻藏期间的溶解性进行比较可以看出,总体上是4<2<3<1,各处理组之间差异不显著,真空包装处理组肌原纤维蛋白质溶解性小于普通包装处理组,股二头肌的小于背最长肌对应处理组的。
表 4 不同贮藏时间下肌原纤维蛋白溶解性的变化(
 ±s)
±s)
TTaabbllee 44 CChhaannggeess iinn mmyyofi brillar protein solubility at different frozen storage t i mes (
 ± ss)%
± ss)%
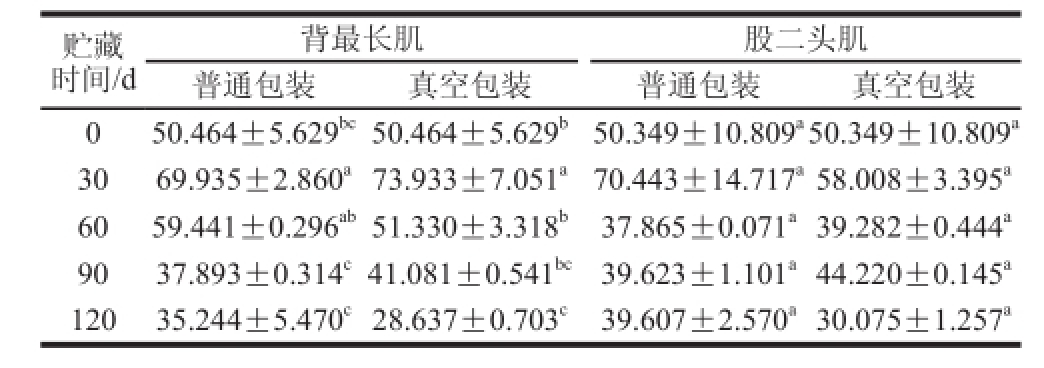
贮藏时间/d背最长肌 股二头肌普通包装 真空包装 普通包装 真空包装0 50.464±5.629 bc50.464±5.629 b50.349±10.809 a50.349±10.809 a30 69.935±2.860 a73.933±7.051 a70.443±14.717 a58.008±3.395 a60 59.441±0.296 ab51.330±3.318 b 37.865±0.071 a39.282±0.444 a90 37.893±0.314 c41.081±0.541 bc39.623±1.101 a44.220±0.145 a120 35.244±5.470 c28.637±0.703 c 39.607±2.570 a30.075±1.257 a
2.7 各指标相关性分析
表5 各指标相关性分析
Table 5 Correlation coeffi cients (r) between physicochemical and functional properties of yak myofi brillar protein
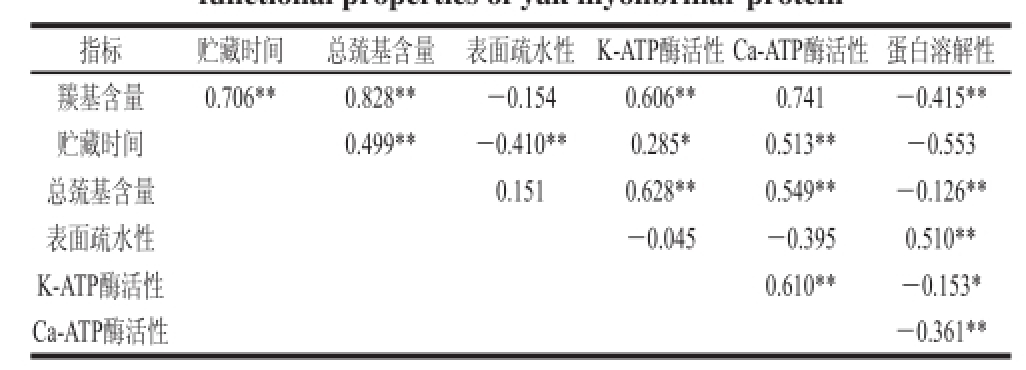
注:**.在0.01水平(双侧)上显著相关;*.在0.05水平(双侧)上显著相关。
指标 贮藏时间 总巯基含量 表面疏水性 K-ATP酶活性Ca-ATP酶活性 蛋白溶解性羰基含量 0.706** 0.828** -0.154 0.606** 0.741 -0.415**贮藏时间 0.499** -0.410** 0.285* 0.513** -0.553总巯基含量 0.151 0.628** 0.549** -0.126**表面疏水性 -0.045 -0.395 0.510** K-ATP酶活性 0.610** -0.153* Ca-ATP酶活性 -0.361**
从表5可以看出,贮藏时间与肌原纤维蛋白羰基含量、总巯基含量、Ca-ATP酶活性极显著正相关(P<0.01),与表面疏水性极显著负相关(P<0.01),与K-ATP酶活性显著相关(P<0.05);羰基含量与总巯基含量、K-ATP酶活性极显著正相关(P<0.01),与蛋白溶解性极显著负相关(P<0.01),表明随着冷冻贮藏时间的延长,肌原纤维蛋白发生了氧化,且蛋白氧化越严重,表面疏水性和蛋白溶解性越低,总巯基含量、K-ATP酶活性和Ca-ATP酶活性越高。由各指标相关性可知,氧化后肌原纤维蛋白的理化及结构指标与各功能性指标是高度相关的。
真空包装处理组的肌原纤维蛋白在整个冻藏期间具有较低的羰基和巯基含量,且其疏水性和溶解性都比普通包装处理组的低。
背最长肌具有较低的羰基和巯基含量,蛋白疏水性、K-ATP酶活性和Ca-ATP酶活性都比股二头肌相对应处理组的低,而股二头肌肌原纤维蛋白质的溶解性比背最长肌相对应的低。
在蛋白质氧化的评价指标中,羰基、巯基含量和蛋白疏水性与氧化程度方面有较高的相关性;而Ca-ATP酶活性和K-ATP酶活性与氧化程度相关性不高。
总之,真空包装能有效地降低冻藏期间肌原纤维蛋白的氧化程度,但对于维持其理化特性效果不理想;股二头肌由于有较多的肌间脂肪而发生了较为严重的氧化。
参考文献:
[1] 郭淑珍, 牛小莹, 赵君, 等. 甘南牦牛肉与其他良种牛肉氨基酸含量对比分析[J]. 中国草食动物, 2009, 29(3): 58-60.
[2] 田甲春, 余群力, 保善科, 等. 不同地方类群牦牛肉营养成分分析[J].营养学报, 2011, 33(5): 531-533.
[3] GUY F, PRACHE S, THOMAS A, et al. Prediction of lamb meat fatty acid composition using near-infrared refl ectance spectroscopy (NIRS)[J]. Food Chemistry, 2011, 127(3): 1280-1286.
[4] 杨斌, 陈峰, 魏彦杰, 等. 牦牛肉加工与发展现状[J]. 肉类研究, 2010,24(6): 3-5.
[5] ESTÉVEZ M, VENTANAS S, HEINONEN M, et al. Protein carbonylation and water-holding capacity of pork subjected to frozen storage: effect of muscle type, premincing, and packaging[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 5435-5443.
[6] UTRERA M, ARMENTEROS M, VENTANAS S, et al. Pre-freezing raw hams affects quality traits in cooked hams: potential infl uence of protein oxidation[J]. Meat Science, 2012, 92: 596-603.
[7] UTRERA M, RODRÍGUEZ-CARPENA J G, MORCUENDE D,et al. Formation of lysine-derived oxidation products and loss of tryptophan during processing of porcine patties with added avocado by products[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 3917-3926.
[8] XIA Xiufang, KONG Baohua, LIU Jing, et al. Infl uence of different thawing methods on physicochemical changes and protein oxidation of porcine longissimus muscle[J]. LWT-Food Science and Technology,2012, 46(1): 280-286.
[9] XIA Xiufang, KONG Baohua, XIONG Youling, et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science,2010, 85(3): 481-486.
[10] ESTÉVEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89: 259-279.
[11] 李银, 张春晖, 李侠, 等. ·OH对肌原纤维蛋白中敏感氨基酸的氧化效应分析[J]. 分析测试学报, 2013, 32(9): 1038-1043.
[12] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al. The effect of metal ions on lipid oxidation, colour and physicochemical properties of cuttlefi sh (Sepia pharaonis) subjected to multiple freezethaw cycles[J]. Food Chemistry, 2006, 95(4): 591-599.
[13] UTRERA M, PARRA V, ESTÉVEZ M. Protein oxidation during frozen storage and subsequent processing of different beef muscles[J]. Meat Science, 2014, 96(2): 812-820.
[14] PARK D, XIONG Youling, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofi brillar protein[J]. Food Chemistry, 2007, 101(3):1239-1246.
[15] OLIVER C N, AHN B W, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry, 1987,262(12): 5488-5491.
[16] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[17] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[18] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[19] STADTMAN E R. Protein oxidation and aging[J]. Science, 1992, 257:1220-1224.
[20] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013.
[21] LIU G, XIONG Y L, BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey-and soyprotein isolates[J]. Journal of Food Science, 2000, 65(5): 811-818.
[22] LIU Gang, XIONG Youling. Oxidatively induced chemical changes and interactions of mixed myosin, β-lactoglobulin and soy 7S globulin[J]. Journal of the Science of Food and Agriculture, 2000,80(11): 1601-1607.
[23] XIONG Youling, PARK D, OOIZUMI T. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J]. Journal of Agricultural and Food Chemistry, 2008,57(1): 153-159.
[24] LAMETSCH M L. Protein oxidation in meat during chill storage[D]. Københavns: Københavns Universitet, 2012.
[25] LI C E, NAKAI S, WOOD D F. Relationship between functional (fat binding, emulsifying) and physicochemical properties of muscle proteins. Effects of heating, freezing, pH and species[J]. Journal of Food Science, 1985, 50(4): 1034-1040.
[26] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al. Effect of frozen storage on chemical and gel-forming properties of fish commonly used for surimi production in Thailand[J]. Food Hydrocolloids, 2005, 19(2): 197-207.
[27] 薛梅. 蛋白质氧化对牛肉成熟过程肌原纤维蛋白降解和食用品质的影响[D]. 南京: 南京农业大学, 2012.
[28] HUSS H H, GRAM L. Quality assurance in the fi sh industry[M]. FMF,1994.
Oxidation-Induced Changes of Myofi brillar Protein Structure of Yak Muscles during Frozen Storage
YAN Liguo, TANG Shanhu*, WANG Liu, LI Sining, BAI Juhong, LU Fuqing, SHUI Xuting
(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
Abstract:The objectives of this study were to investigate the myofi brillar protein oxidation of longissimus dorsi and biceps femoris in ordinary or vacuum packaging under the frozen storage conditions. Myofi brillar protein extraction, myofi brillar protein K-ATPase activity, Ca 2+-ATPase activity, total sulfhydryl content, protein solubility, protein carbonyl content and surface hydrophobicity were measured, and the changes of protein electrophoresis were analyzed. The results showed that the carbonyl content signifi cantly increased at 60 days of storage (P < 0.05), but decreased in all other treatment groups at 90 days except for a signifi cant increase observed for biceps femoris under ordinary packaging (P > 0.05). The total sulfhydryl content signifi cantly increased in general during the storage period for 60 days (P < 0.05) but displayed a decreasing trend
on the 60th onward. For both muscles, hydrophobic surface with ordinary packaging was higher than that with vacuum packaging when the storage period exceeded 90 days. Myofi brillar protein Ca 2+-ATPase activty of longissimus dorsi was higher than that of biceps femoris, yet no signifi cant difference in K-A TPase activity was observed. Myofi brillar protein solubility of longissimus dorsi changed significantly (P < 0.05), while the changes in myofibrillar protein solubility of
biceps femoris were not statistically signifi cant (P > 0.05). Additionally, we found that protein bands changed during frozen storage. Myosin heavy chain and actin were degraded to varying degrees with prolonging the frozen storage time. This study indicates that with prolonged frozen storage time, oxidation occurs on myofi brillar protein of yak meat, which provides a strong basis for further clarifying the mechanism of muscle protein oxidation.
Key words:yak meat; myofi brillar protein; oxidation; physicochemical properties
中图分类号:TS201.2.1
文献标志码:A
文章编号:1002-6630(2015)24-0337-06
doi:10.7506/spkx1002-6630-201524062
收稿日期:2014-11-26
基金项目:西南民族大学研究生创新性重点项目(CX2014SZ85);四川省重大科技专项(2012NZ0047)
作者简介:闫利国(1989—),男,硕士研究生,研究方向为畜产品加工与安全。E-mail:achxy@hotmail.com
*通信作者:唐善虎(1964—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:stang01@126.com