陈 霞,李 敏,张 波,张建华,赵婉珍,李 蔚,韩舜愈 *
(甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
摘 要:以‘蛇龙珠’葡萄为试材,通过扩展青霉(Penicillium expansum)侵染,测定其所酿制的葡萄酒中棒曲霉素的含量及对理化指标和挥发性风味物质的影响。结果表明,使用采后扩展青霉侵染的葡萄原料生产的葡萄酒棒曲霉素含量低于SN/T 2008—2007中高效液相色谱法检出限(10 μg/L)水平,并未造成棒曲霉素的积累和超标,但处理对葡萄酒的理化指标及挥发性风味物质却产生影响,使得葡萄酒的色度、单宁、总酚和总花色苷含量均显著上升(P<0.05),而酒精体积分数则有所下降。同时对挥发性成分的检测发现,处理样品和对照酒样在风味物质数量和含量上均存有差别,其中1-辛烯-3-醇、3-甲硫基丙醇和辛酸等在处理中的含量较高(P<0.05),而乙酸苯乙酯、大马士酮和α-松油醇等化合物含量则低于对照(P<0.05)。利用物质的风味阈值和感官特征分析认为,扩展青霉侵染将造成葡萄酒原有的特色与风味发生改变,使葡萄酒存在品质劣变的风险。
关键词:扩展青霉;‘蛇龙珠’葡萄酒;棒曲霉素;理化品质;挥发性物质
葡萄中的微生物生态是由多样化的微生物种群构成的,包括丝状真菌、酵母等。丝状真菌的污染不仅会降低葡萄的产量,部分真菌种类还可在葡萄成熟过程中代谢产生真菌毒素和不良的挥发性物质,进而影响葡萄酒的安全性和风味品质 [1]。因此,研究并控制真菌的侵染已成为葡萄种植和葡萄酒酿造中备受关注的一项任务。
研究发现,侵染果蔬的真菌种类很多,其中扩展青霉(Penicillium expansum)作为一种常见的侵染果实的多细胞丝状真菌,广泛存在于自然界中 [2]。目前已从苹果、梨、杏、樱桃、猕猴桃、油桃、梨和番茄等多种植物中分离鉴定到 [2-3]。此外Donoso等 [4]从健康的酿酒葡萄簇上也检测出扩展青霉,扩大了其侵染的宿主范围。研究 [5]认为,扩展青霉可引发果蔬采后的青霉病,导致果蔬腐烂,使病部组织带有霉味。同时扩展青霉侵染还会产生棒曲霉素,增大了食用者罹患“三致”反应(致畸、致癌和致突变)的风险。并且棒曲霉素在酸性条件下十分稳定,通过一般的加工过程无法将其完全去除,这将最终导致生产的商品中棒曲霉素含量的超标,对人体健康构成威胁 [6]。实验发现,通过在苹果、桃、梨、杏、草莓和猕猴桃等果实中人为接种扩展青霉,将引起果实的腐烂和棒曲霉素的积累 [7]。并且由于微生物的介入和作用,果实的理化品质也会受到影响,并最终影响产品的质量和价值 [8]。Stéphane等 [9]研究表明,扩展青霉菌株可在察氏培养基上产生土臭味素,而且当扩展青霉与灰霉协同侵染葡萄果实时,也会产生上述的不良风味,使得所酿造的葡萄酒存在风味品质劣变的风险。因此,重视寄主果实青霉病害及对棒曲霉素的控制和研究,将从根本上保障农产品的品质和食用安全。减少果实的微生物制腐,掌握致病微生物的侵染途径和致病规律早已成为科研工作者的研究重点,同时欧盟还制定了严格的规定,加强对产毒微生物毒素的监管。例如,棒曲霉素在果汁中的最高限量为50 μg/L,在固态苹果制品中的限量为25 μg/kg,而在婴儿食品中则不超过10 μg/kg [10]。此外,欧盟在2004年颁布了第455/2004号指令,以限制含棒曲霉素食品的进口。与此相比,国内对扩展青霉及棒曲霉素虽有一定的研究,但还存在一定的差距,特别是使用扩展青霉污染后的加工原料生产食品方面,有关的研究和报道数量有限。
本实验以‘蛇龙珠’葡萄为原料,通过扩展青霉侵染培养,检测所酿成品酒中棒曲霉素含量,并对其理化指标和挥发性物质进行分析,以期为扩展青霉的安全性及对葡萄酒品质的影响提供科学参考和数据支持。
1.1 材料与试剂
‘蛇龙珠’葡萄于2014年采收于甘肃省民勤县,糖度为22°Brix;扩展青霉菌株M18于2013年分离自甘肃河西走廊酿酒葡萄产区。
酿酒酵母(红佳酿Vintage Red(VR)) 意大利Enartis公司;2-辛醇(色谱纯)、棒曲霉素标准品美国Sigma公司;乙腈(色谱纯) 德国Merck公司;福林酚(Folin Ciocalteu,FC)试剂 上海源叶生物科技有限公司;磷钼钨酸显色剂 北京华科盛精细化工产品贸易有限公司;氯化钾、醋酸、醋酸钠、无水碳酸钠、盐酸、氢氧化钠、无水葡萄糖、一水合没食子酸等试剂均为国产分析纯;菲林试剂、次甲基蓝指示液等按照GB/T 603—2002《化学试剂:试验方法中所用制剂及制品的制备》配制。
1.2 仪器与设备
Genesis 10s紫外-可见分光光度计、265079气相色谱-质谱(gas chromatography-mass spectrometry)联用仪、TG-WAX色谱柱、DIONEX Ultimate 3000高效液相色谱仪 美国Thermo Scientific公司;CP214电子天平 上海奥豪斯仪器有限公司;固相微萃取(solid phase microextraction,SPME)装置、50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/ polydimethyl-siloxane,DVB/CAR/PDMS)萃取头美国Surpelco公司;18100摩尔超纯水机 重庆摩尔水处理设备有限公司;HH-S型恒温水浴锅 金坛市恒丰仪器制造有限公司;160350D型酒精测定仪 法国Dujardin Salleron公司。
1.3 方法
1.3.1 发酵工艺

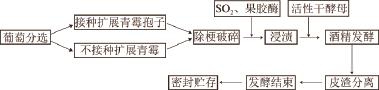
手工分选成熟度一致并无病害的‘蛇龙珠’葡萄,混匀后均分为2 组(每组设3 个重复),次氯酸钠溶液浸泡晾干,取一组进行接种实验:将25 ℃培养了7 d的扩展青霉菌株M18以无菌水制成10 6CFU/mL的孢子悬浮液,接种后,置于25 ℃,在相对湿度为85%~90%条件下培养7~10 d,待葡萄表面扩展青霉菌丝量达到60%~80%后进行除梗破碎,并添加50 mg/L SO 2及20 mg/L果胶酶进行短时的浸渍。24 h之后,加入商品酿酒干酵母(200 mg/L)启动发酵,每日定时摇瓶3 次,当发酵至糖含量低于4.0 g/L后,及时将酒液和酒脚沉淀进行分离,室温保存待用。
1.3.2 葡萄酒中棒曲霉素的检测
参照SN/T 2008—2007《进出口果汁中棒曲霉毒素的检测方法:高效液相色谱法》 [11]进行检测(y=0.010 8 x-0.029,R 2=0.999 8)。
1.3.3 葡萄酒理化指标测定
酒精体积分数、残糖、总酸含量测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》 [12];单宁含量测定参照NY/T 1600—2008《水果、蔬菜及其制品中单宁含量的测定:分光光度法》 [13](y=0.118 8x-0.000 7,R 2=0.999 1)。
色度、色调测定参照李素岳 [14]的方法并作适当修改。准确吸取1 mL供试酒样于10 mL容量瓶中,蒸馏水定容至刻度,取稀释后的溶液用1 cm光程玻璃比色皿,以蒸馏水为空白,分别于波长420、520 nm和620 nm处测定吸光度(A),样品的色度和色调值按公式(1)、(2)计算:

总酚含量测定参照李静等 [15]的方法,略有修改。将1 mL酒样用蒸馏水定容至100 mL,然后吸取1 mL样品溶液分别加入5 mL水、1 mL福林酚显色剂及3 mL质量分数7.5%碳酸钠溶液进行显色。静置2 h后,于765 nm波长处测定样品的吸光度,再根据标准曲线方程计算出样品中总多酚含量(y=0.102 4 x-0.005 8,R 2=0.999 3)。
总花色苷含量参照翦祎等 [16]的方法,略有修改。吸取0.5 mL葡萄酒,用pH 1.0的缓冲液定容至10 mL。室温平衡100 min,以蒸馏水为空白,分别于波长521 nm和700 nm处测定吸光度。用同样的方法测定样品在pH 4.5缓冲溶液中的吸光度。按公式(3)计算:

式中:M w为摩尔质量493.2 g/mol(锦葵色素-3-葡萄糖苷);DF为稀释倍数;1为光程/cm;ε为摩尔消光系数,28 000 L/(mol/cm)。
1.3.4 葡萄酒挥发性成分分析
1.3.4.1 香气成分的富集
将5 mL发酵结束后的葡萄酒注入20 mL萃取瓶,加入1.5 g NaCl和50 μL质量浓度为8.3 mg/L的2-辛醇溶液作为内标,密封,置于45 ℃磁力搅拌30 min后40 ℃水浴顶空萃取30 min,GC-MS进样解吸10 min。
1.3.4.2 GC-MS条件
参照马腾臻等 [17]方法并略作修改:TG-WAX色谱柱(60 m×0.25 mm,0.5 μm);升温程序:40 ℃保持5 min,以5 ℃/min升至230 ℃,保持10 min;载气(He)流速1 mL/min;不分流进样;进样口温度250 ℃;电子电离源;电子能量70 eV;传输线温度230 ℃;离子源温度250 ℃;质量扫描范围m/z 50~450。
1.3.4.3 香气成分的定性与定量
由GC-MS分析所得的样品质谱图经计算机在NIST、Wiley数据库检索比对及资料参考,进行定性分析。各成分的含量采用内标法进行半定量分析,按公式(5)计算,并利用公式(6)计算气味活性值(odor activity value,OAV):

1.4 数据处理
每个实验组设3 个平行,数据采用Microsoft Office Excel 2007进行处理,IBM SPSS 19.0对数据进行单因素方差分析,并利用Duncan's进行多重比较,对数据进行差异显著性分析(P<0.05)。
2.1 葡萄酒中棒曲霉素含量的检测

图1 棒曲霉素标准品高效液相色谱图
Fig.1 HPLC profile of patulin standard
以‘蛇龙珠’葡萄为原料,以不接种扩展青霉为对照,检测供试酒样中棒曲霉素含量。如图1所示,接种扩展青霉后棒曲霉素含量低于检出限(10 μg/L)。这与Scott [18]和Ough [19]等研究的结果相似。Moss等 [20]对果汁发酵过程中棒曲霉素的变化进行研究,实验发现酿酒酵母(Saccharomyces cerevisiae)对棒曲霉素有降解作用,其可被酿酒酵母(S. cerevisiae)降解产生2 种低毒性的代谢物((E)-ascladiol,(Z)-ascladiol)。而相关研究 [21]还发现,酿酒过程中酵母或其他物质的吸附作用,也会使棒曲霉素含量逐渐减少,使得在酒中检测不到。Gonzalo等 [22]在‘赤霞珠’葡萄汁中检测到棒曲霉素,但在随后发酵过程中,其含量就减少了85%左右,并最终降低到不能检测的水平。
2.2 葡萄酒理化指标分析
表1 葡萄酒的理化指标
Table1 Physicochemical characteristics of wines

注:*.与对照的差异达到显著水平(P<0.05)。表2同。
组别残糖含量/(g/L)总酸含量/(g/L)酒精体积总花色苷含量/(mg/L)对照2.90±0.235.23±0.0912.10±0.150.68±0.000.84±0.001.21±0.021.45±0.02214.00±1.00处理2.90±0.055.06±0.15 11.50±0.15*0.83±0.03*0.79±0.00*1.37±0.02*1.63±0.02*285.00±2.00*分数/%色度色调单宁含量/(g/L)总酚含量/(g/L)
由表1可知,扩展青霉污染后,葡萄酒中总酸含量与对照相比略有下降,这与Meunier等 [23]研究炭疽病菌侵染‘赤霞珠’葡萄后的总酸含量变化结果一致,分析可能是因为菌株侵染葡萄后酒中苹果酸-乳酸的转化及酒石酸盐的沉淀造成的。处理样品的酒精体积分数较对照降低了5%,这可能是因为扩展青霉侵染使得葡萄果实含糖量下降,或是因为扩展青霉消耗了葡萄中的部分氮源,导致发酵有减弱的结果。处理酒样的色度值显著的升高(P<0.05),且色调值下降了6%,表明处理后的葡萄酒颜色较深,同时处理的总花色苷含量上升了33%,这与前述的色度-色调变化相对应。分析这可能是由于真菌侵染对果皮中花色苷的合成产生了影响 [24]。此外,处理样品的单宁含量和总酚含量与对照相比也分别上升了13%和12%,这可能是因为侵染使得果皮细胞组织受到破坏,从而有利于其在发酵过程中浸提效率的提高,而单宁和总酚含量的增加不仅可以使酒的颜色和口感得以维持和提升,而且也为后期酒的陈酿潜能提供了物质保障。
2.3 葡萄酒中的主要香气成分
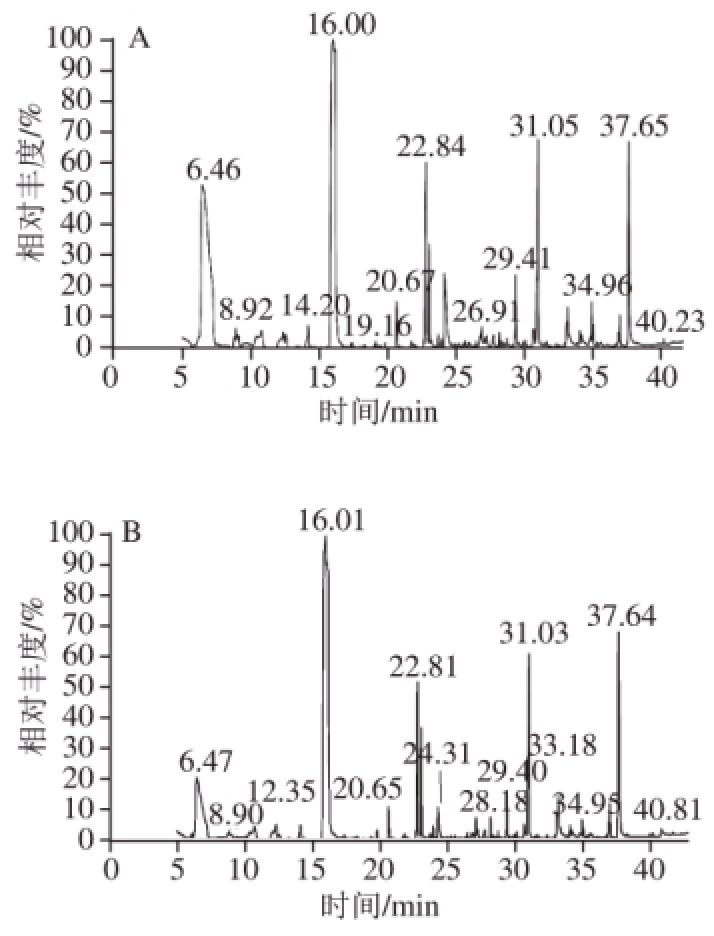
图2 对照(A)及处理(B)后的葡萄酒香气成分GC-MS总离子流图
Fig.2 GC-MS total ion current chromatograms of volatile compounds in control (A) and treatment (B)
表2 对照和处理的葡萄酒样品挥发性成分的GC-MSS分析
Table2 GC-MS analysis of volatile components of control and treatment
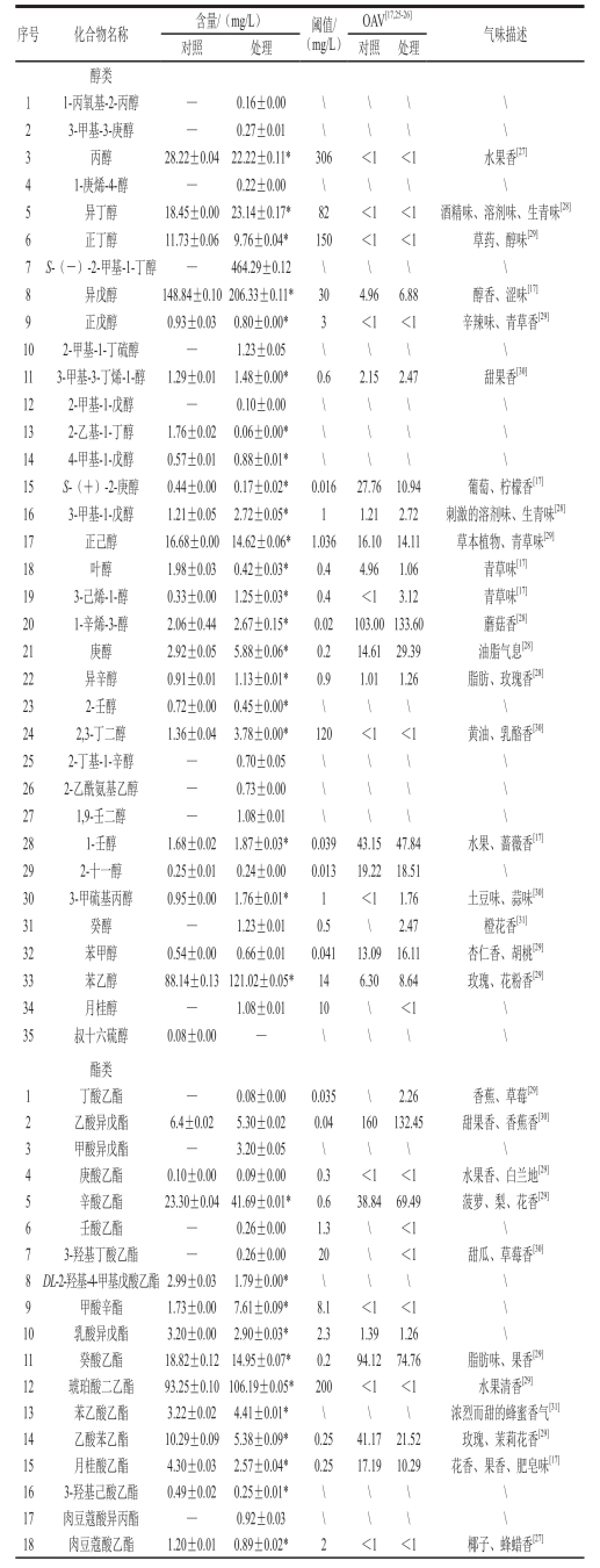
序号化合物名称含量/(mg/L)阈值/(mg/L)OAV[17,25-26]气味描述对照处理对照处理醇类11-丙氧基-2-丙醇—0.16±0.00 \\\\ 23-甲基-3-庚醇—0.27±0.01 \\\\ 3丙醇28.22±0.04 22.22±0.11* 306 <1<1水果香 [27]41-庚烯-4-醇—0.22±0.00 \\\\ 5异丁醇18.45±0.00 23.14±0.17* 82 <1<1酒精味、溶剂味、生青味 [28]6正丁醇11.73±0.06 9.76±0.04*150 <1<1草药、醇味 [29]7S-(-)-2-甲基-1-丁醇—464.29±0.12 \\\\ 8异戊醇148.84±0.10 206.33±0.11* 30 4.96 6.88 醇香、涩味 [17]9正戊醇0.93±0.03 0.80±0.00* 3 <1 <1 辛辣味、青草香 [29]102-甲基-1-丁硫醇—1.23±0.05 \\\\ 113-甲基-3-丁烯-1-醇1.29±0.01 1.48±0.00* 0.6 2.15 2.47 甜果香 [30]122-甲基-1-戊醇—0.10±0.00 \\\\ 132-乙基-1-丁醇1.76±0.02 0.06±0.00*\\\\ 144-甲基-1-戊醇0.57±0.01 0.88±0.01* \\\\ 15S-(+)-2-庚醇0.44±0.00 0.17±0.02* 0.016 27.76 10.94 葡萄、柠檬香 [17]163-甲基-1-戊醇1.21±0.05 2.72±0.05* 1 1.21 2.72 刺激的溶剂味、生青味 [28]17正己醇16.68±0.00 14.62±0.06* 1.036 16.10 14.11 草本植物、青草味 [29]18叶醇1.98±0.03 0.42±0.03* 0.4 4.96 1.06 青草味 [17]193-己烯-1-醇0.33±0.00 1.25±0.03* 0.4 <13.12 青草味 [17]201-辛烯-3-醇2.06±0.44 2.67±0.15* 0.02 103.00 133.60 蘑菇香 [28]21庚醇2.92±0.05 5.88±0.06* 0.2 14.61 29.39 油脂气息 [28]22异辛醇0.91±0.01 1.13±0.01* 0.9 1.01 1.26 脂肪、玫瑰香 [28]232-壬醇0.72±0.00 0.45±0.00* \\\\ 242,3-丁二醇1.36±0.04 3.78±0.00* 120 <1<1黄油、乳酪香 [30]252-丁基-1-辛醇—0.70±0.05 \\\\ 262-乙酰氨基乙醇—0.73±0.00 \\\\ 271,9-壬二醇—1.08±0.01 \\\\ 281-壬醇1.68±0.02 1.87±0.03*0.039 43.15 47.84 水果、蔷薇香 [17]292-十一醇0.25±0.01 0.24±0.00 0.013 19.22 18.51 \ 303-甲硫基丙醇0.95±0.00 1.76±0.01* 1 <11.76 土豆味、蒜味 [30]31癸醇—1.23±0.01 0.5 \2.47 橙花香 [31]32苯甲醇0.54±0.00 0.66±0.01 0.041 13.09 16.11 杏仁香、胡桃 [29]33苯乙醇88.14±0.13 121.02±0.05* 14 6.30 8.64 玫瑰、花粉香 [29]34月桂醇—1.08±0.01 10 \<1\ 35叔十六硫醇0.08±0.00 —\\\\酯类1丁酸乙酯—0.08±0.00 0.035 \2.26 香蕉、草莓 [29]2乙酸异戊酯6.4±0.025.30±0.02 0.04 160132.45 甜果香、香蕉香 [30]3甲酸异戊酯—3.20±0.05 \\\\ 4庚酸乙酯0.10±0.00 0.09±0.00 0.3<1<1水果香、白兰地 [29]5辛酸乙酯23.30±0.04 41.69±0.01* 0.6 38.84 69.49 菠萝、梨、花香 [29]6壬酸乙酯—0.26±0.00 1.3 \<1\ 73-羟基丁酸乙酯—0.26±0.00 20 \<1甜瓜、草莓香 [30]8DL-2-羟基-4-甲基戊酸乙酯 2.99±0.03 1.79±0.00* \\\\ 9甲酸辛酯1.73±0.00 7.61±0.09* 8.1 <1<1\ 10乳酸异戊酯3.20±0.00 2.90±0.03* 2.3 1.39 1.26 \ 11癸酸乙酯18.82±0.12 14.95±0.07* 0.2 94.12 74.76 脂肪味、果香 [29]12琥珀酸二乙酯93.25±0.10 106.19±0.05* 200 <1<1水果清香 [29]13苯乙酸乙酯3.22±0.02 4.41±0.01* \\\浓烈而甜的蜂蜜香气 [31]14乙酸苯乙酯10.29±0.09 5.38±0.09* 0.25 41.17 21.52 玫瑰、茉莉花香 [29]15月桂酸乙酯4.30±0.03 2.57±0.04* 0.25 17.19 10.29 花香、果香、肥皂味 [17]163-羟基己酸乙酯0.49±0.02 0.25±0.01* \\\\ 17肉豆蔻酸异丙酯—0.92±0.03 \\\\ 18肉豆蔻酸乙酯1.20±0.010.89±0.02* 2 <1<1椰子、蜂蜡香 [27]
续表2
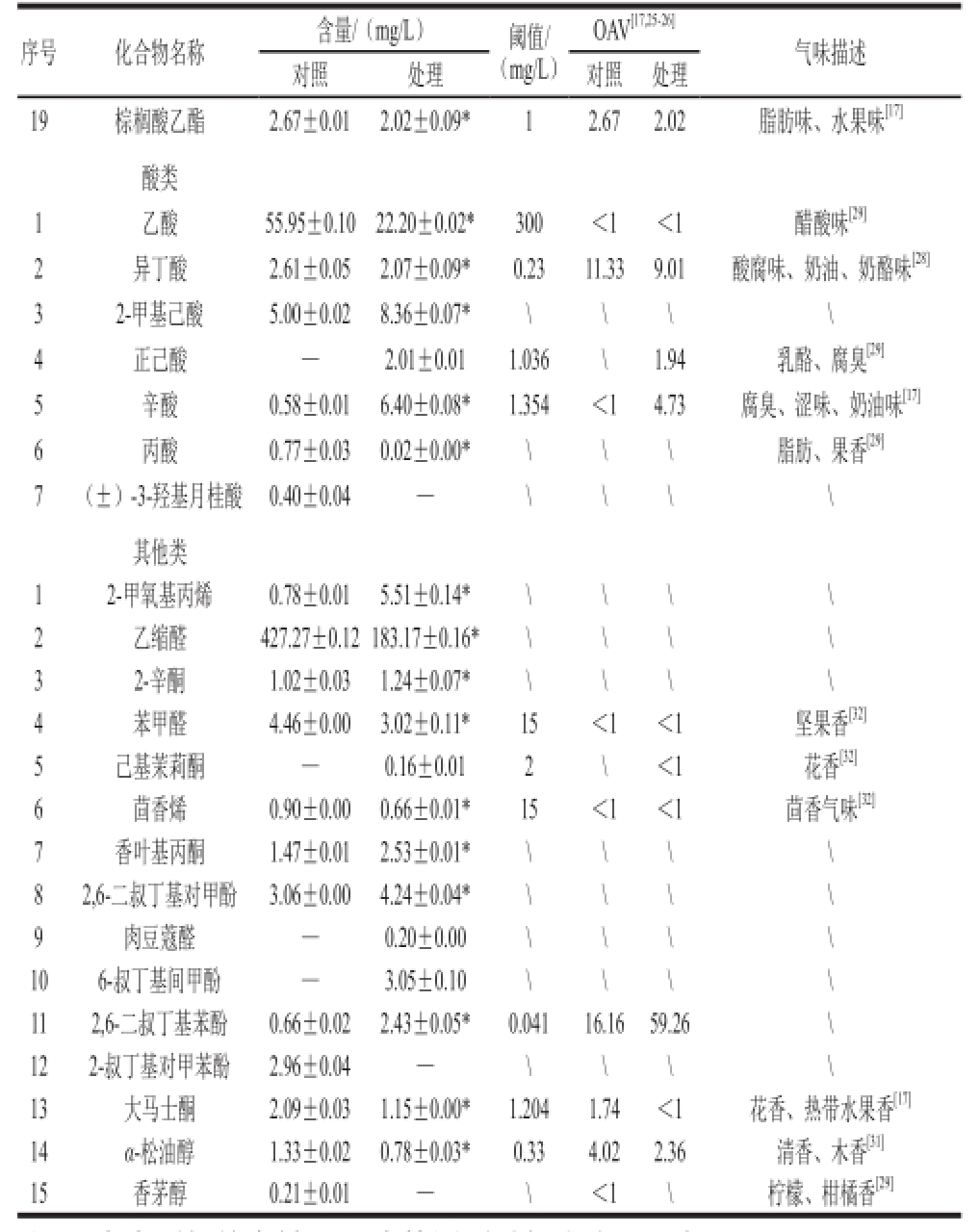
注:\.未查到相关资料;—.未检测到香气成分,下表同。
序号化合物名称含量/(mg/L)阈值/(mg/L)OAV[17,25-26]气味描述对照处理对照处理19棕榈酸乙酯2.67±0.01 2.02±0.09* 1 2.67 2.02 脂肪味、水果味 [17]酸类1乙酸55.95±0.10 22.20±0.02* 300 <1<1醋酸味 [29]2异丁酸2.61±0.05 2.07±0.09* 0.23 11.33 9.01 酸腐味、奶油、奶酪味 [28]32-甲基己酸5.00±0.02 8.36±0.07* \\\\ 4正己酸—2.01±0.01 1.036 \1.94 乳酪、腐臭 [29]5辛酸0.58±0.01 6.40±0.08* 1.354 <1 4.73 腐臭、涩味、奶油味 [17]6丙酸0.77±0.03 0.02±0.00* \\\脂肪、果香 [29]7(±)-3-羟基月桂酸0.40±0.04 —\\\\其他类12-甲氧基丙烯0.78±0.015.51±0.14* \\\\ 2乙缩醛427.27±0.12 183.17±0.16* \\\\ 32-辛酮1.02±0.03 1.24±0.07* \\\\ 4苯甲醛4.46±0.003.02±0.11* 15 <1<1坚果香 [32]5己基茉莉酮—0.16±0.01 2 \<1花香 [32]6茴香烯0.90±0.00 0.66±0.01* 15 <1<1茴香气味 [32]7香叶基丙酮1.47±0.012.53±0.01* \\\\ 82,6-二叔丁基对甲酚3.06±0.00 4.24±0.04* \\\\ 9肉豆蔻醛—0.20±0.00 \\\\ 106-叔丁基间甲酚—3.05±0.10 \\\\ 112,6-二叔丁基苯酚0.66±0.02 2.43±0.05* 0.041 16.16 59.26 \ 122-叔丁基对甲苯酚2.96±0.04 —\\\\ 13大马士酮2.09±0.03 1.15±0.00* 1.204 1.74 <1花香、热带水果香 [17]14α-松油醇1.33±0.02 0.78±0.03* 0.33 4.02 2.36 清香、木香 [31]15香茅醇0.21±0.01 —\<1\柠檬、柑橘香 [29]
葡萄酒的香气来自葡萄果实本身、酵母发酵及陈酿过程 [33],挥发性成分以醇类、酯类、脂肪酸类为主,此外还有少量的萜烯类、醛酮类和酚类等 [34]。这些挥发性香气成分是衡量葡萄酒风味品质的主要指标。
由图2、表2可知,在对照中鉴定出挥发性物质56 种,处理组中72 种,1-丙氧基-2-丙醇、3-甲基-3-庚醇、1-庚烯-4-醇、S-(-)-2-甲基-1-丁醇、2-甲基-1-丁硫醇、2-甲基-1-戊醇、2-丁基-1-辛醇、2-乙酰氨基乙醇、1,9-壬二醇、癸醇、月桂醇、丁酸乙酯、甲酸异戊酯、壬酸乙酯、3-羟基丁酸乙酯、肉豆蔻酸异丙酯、正己酸、己基茉莉酮、肉豆蔻醛、6-叔丁基间甲酚仅在处理组中检出。而叔十六硫醇、(±)-3-羟基月桂酸、香茅醇、2-叔丁基对甲苯酚仅在对照酒样中被检测到。所有检出的物质包括醇类35 种、酯类19 种、酸类7 种、萜烯类6 种、醛酮类4 种、酚类4 种、烯烃类1 种,且由方差分析可知,对照与处理组中大多数香气物质含量差异显著,说明扩展青霉侵染后对葡萄酒的香气产生了影响。而香气物质对葡萄酒整体香气的贡献取决于OAV,OAV越大,对香气的贡献也就越大 [35]。扩展青霉处理后,OAV大于1的化合物有29 种,其中,OAV较高的为1-辛烯-3醇、辛酸乙酯、癸酸乙酯、乙酸异戊酯,对照中OAV大于1化合物有24 种,较高的为1-辛烯-3醇、1-壬醇、辛酸乙酯、癸酸乙酯、乙酸异戊酯和乙酸苯乙酯。
2.3.1 醇类化合物
醇类物质是酒中主要的香气成分,由糖代谢、氨基酸脱羧和脱氢产生 [36]。其中正戊醇是果酒发酵中酵母的代谢产物之一 [35],具有浓郁的花香果香,在处理组中,其含量明显低于对照(14%,P<0.05)。Morales-valle等 [1]研究发现在灰葡萄孢、青霉和曲霉等侵染的葡萄酒中可检测出土臭味素、2-庚醇、1-辛烯-3-酮、茴香酮、茴香醇和1-辛烯-3-醇等不良风味物质,对照本实验,检测到了1-辛烯-3-醇化合物(蘑菇味),其在处理中的含量为2.67 mg/L,较对照增加了30%(P<0.05),考虑这将使酒体不良风味加重。3-己烯-1-醇具有青草味,常会给葡萄酒的香气带来负面的影响 [28],其在处理酒中的含量较高(约高出对照3 倍),这会增加酒体不成熟的感觉。S-(+)-2-庚醇具有葡萄和柠檬香,相比对照,处理样品的含量下降了60%(P<0.05)之多。苯乙醇是由苯丙氨酸代谢产生,当质量浓度低于阈值时,使酒体具有果香味,但质量浓度高于阈值却会产生腐臭味 [37],比较实验数据,发现处理的样品苯乙醇含量较对照产生了显著的增加(含量上升了37%,P<0.05)。而异戊醇(苦杏仁味)和庚醇(油脂气息)在处理中的含量也分别增加了0.4 倍和1 倍之多。研究 [32]认为,实验检测到的苯甲醇可能来源于莽草酸生物合成途径的支链化合物,其具有杏仁气味,对比实验结果发现,处理酒样中的苯甲醇比对照样品高出22%。此外,实验检测到的2,3-丁二醇(黄油、乳酪味)和3-甲硫基丙醇(烤土豆味和蒜味),其含量在处理后分别增加了108%和85%,且3-甲硫基丙醇在处理中的OAV大于1.0,由于这些物质属于异味物质,因此这将会给葡萄酒的香气带来负面的影响。
2.3.2 酯类化合物
通常认为酯类的合成可能来源于酵母菌的代谢 [38],以及在酒中的酯化反应,这类物质的产生将对葡萄酒的果香有着重要的贡献作用 [28]。实验发现,扩展青霉处理后,酒中酯类化合物的种类和含量都发生了变化。其中甲酸异戊酯、壬酸乙酯、3-羟基丁酸乙酯、肉豆蔻酸异丙酯和丁酸乙酯是处理样品中特有的组分。同时,实验检测到的癸酸乙酯(果香)、乙酸苯乙酯、月桂酸乙酯和棕榈酸乙酯(花果香气味),以及具有椰子、蜂蜡香的肉豆蔻酸乙酯含量分别较对照下降了21%、48%、40%、24%和26%。分析这可能是因为侵染造成了果实中营养物质的消耗,从而导致酵母菌代谢的前体物质减少,并最终影响了酯类物质的合成。
2.3.3 脂肪酸类化合物
葡萄酒中的脂肪酸类物质大部分来源于酵母菌和乳酸菌的代谢,这些物质一般都具有油脂、酸腐以及奶酪的气味 [28]。本实验在供试的酒样中共检出了6 种脂肪酸类物质,其中(±)-3-羟基月桂酸为对照样品中特有的物质,而正己酸仅在处理酒样中检出,并且其OAV大于1.0,推测这将会给酒体带来一定的乳酪和腐臭气味。同时,通过扩展青霉处理后,酒中的异丁酸(奶油、奶酪味)含量出现下降(21%),但是辛酸含量却增加了近10 倍。通常认为,辛酸在低质量浓度时会有奶酪和奶油的的香味,而当质量浓度过高则会出现腐败和刺激味等异味。因此考虑,处理后较高的辛酸将会对‘蛇龙珠’葡萄酒产生一定的负面影响。
2.3.4 其他类化合物
葡萄酒中的萜烯类物质主要源于葡萄果实,由其前体物质在发酵和陈酿过程逐渐释放出来,这些物质的组成和含量更多的反映了葡萄原料自身的特点 [28]。研究 [17]认为实验检测到的α-松油醇、大马士酮和香茅醇等具有浓郁的花香果香。其在处理样品中均呈现含量减少的趋势,例如α-松油醇的含量仅为对照的56%,大马士酮的含量在处理中降低了45%,而香茅醇在处理组中还未检出,表现出明显的差别(P<0.05)。
2.4 扩展青霉处理对‘蛇龙珠’葡萄酒香气感官表现影响
表3 ‘蛇龙珠’葡萄酒香气成分OAV及特征描述
Table3 OAVs and odor description of Cabernet Gernischt red wines

注:1.化学味;2.土壤味;3.坚果味;4.花香味;5.果香味;6.焦糖味;7.植物味;8.溶剂味;9.脂肪味;10.微生物;11.刺鼻味;12.木材味。
气味描述香气系列对照处理1异丁醇0.230.28酒精味、溶剂味、生青味11、8、7 2正戊醇0.31 0.27 辛辣味、青草香11、7 33-甲基-3-丁烯-1-醇2.15 2.47 甜果香5 4(S)-(+)-2-庚醇27.76 10.94 葡萄、柠檬香5 53-甲基-1-戊醇1.21 2.72 刺激的溶剂味、生青味8、7 6正己醇16.10 14.11 草本植物、青草味7 7叶醇4.96 1.06 青草味7 83-己烯-1-醇0.843.12 青草味7 91-辛烯-3-醇103.00 133.60 蘑菇香2 10庚醇14.61 29.39 油脂气息9 11异辛醇1.01 1.26 脂肪、玫瑰香9、4 121-壬醇43.15 47.84 水果、蔷薇香5、7 133-甲硫基丙醇0.951.76 土豆味、蒜味12、1 14癸醇—2.47 橙花香4 15苯甲醇13.09 16.11 杏仁香、胡桃3 16苯乙醇6.30 8.64 玫瑰、花粉香4 17丁酸乙酯—2.26 香蕉、草莓5 18乙酸异戊酯160132.45 甜果香、香蕉香5 19庚酸乙酯0.330.30 菠萝香5 20辛酸乙酯38.8469.49 菠萝、梨、花香5、4 21癸酸乙酯94.1274.76 脂肪味、果香9、5 22琥珀酸二乙酯0.470.53 水果清香5 23乙酸苯乙酯41.1721.52 玫瑰、茉莉花香4 24月桂酸乙酯17.1910.29 花香、果香、肥皂味4、5、1 25肉豆蔻酸乙酯0.600.45 椰子、蜂蜡香5、6 26棕榈酸乙酯2.672.02 脂肪味、水果味9、5 27异丁酸11.339.01 奶油、奶酪味6、9 28正己酸—1.94 乳酪、腐臭9、10 29辛酸0.434.73 腐臭、涩味、奶油味10、6 30大马士酮1.740.96花香、热带水果香4、5 31α-松油醇4.022.36 清香、木香5、1 32苯甲醛0.300.20 坚果香3序号化合物名称OAV [17,25-26]
一般认为,OAV大于1的成分为样品的主体呈香化合物。通过对实验中检测到的所有挥发性物质进行OAV的计算,按照OAV大于0.2的标准 [32]对产生的化合物进行了归纳和总结,如表3所示。
由表3可知,供试酒样中OAV大于0.2的香气成分共检出32 种。依据香气感官特征并参照葡萄酒风味轮盘的划分 [35],将‘蛇龙珠’葡萄酒的香气成分分为化学味、土壤味、坚果味、花香、果香、焦糖味、植物味、溶剂味、脂肪味、微生物、刺鼻味和木材味12 个系列,如图3A所示,分析显示对照和处理酒样中都是果香、植物味、脂肪味、花香和土壤味对葡萄酒的整体香气贡献较大。

图3 对照(A)与处理(B)酒样中各系列香气强度对比图
Fig.3 Comparison of aroma intensity between control and treatment
果香主要来自于酯类成分,扩展青霉处理酒样的香气强度比对照酒样降低了9%,这主要是乙酸异戊酯和癸酸乙酯的含量差异所致,其次是庚酸乙酯和月桂酸乙酯。植物香来自C 6醛、醇类化合物,处理后的酒样与对照差异不大,正戊醇、正己醇、叶醇是主要贡献组分。脂肪香主要来自酸类,扩展青霉处理酒样比对照酒样降低了4%,癸酸乙酯、庚醇、正己酸、辛酸是主要贡献组分。花香主要来自芳香族化合物,扩展青霉处理后略有增加,苯乙醇、辛酸乙酯、乙酸苯乙酯是‘蛇龙珠’葡萄酒中花香的主要贡献者。1-辛烯-3醇具有浓郁的蘑菇味,依据葡萄酒风味轮盘的划分 [35],它是酒样中土壤味的主要贡献组分,处理后的酒样中增加了29.7%。
‘蛇龙珠’葡萄酒果香主要包括葡萄、柠檬、香蕉、菠萝和草莓的香味,花香以玫瑰香为主,橙花香和茉莉香次之,植物香包括青草味和蔷薇香,土壤味以蘑菇香为主,同时脂肪味和蒜味也是处理和对照酒样中的香气系列,为了更具体的确定贡献显著香气系列的主体呈味物质,计算菠萝香、玫瑰香、青草香等各种香气的OAV,如图3B所示,结果显示扩展青霉处理酒样中土壤味的香气强度较高,比对照增加了29.7%,蒜味升高了将近1 倍,玫瑰、茉莉、葡萄、柠檬、香蕉和青草香的香气强度都低于对照酒样,分别降低了35.2%、47.7%、60.6%、60.6%、15.8%和8.8%。
实验通过利用采后扩展青霉处理的‘蛇龙珠’葡萄为原料,酿成干红葡萄酒,结果显示在处理的酒样中棒曲霉素含量低于检测水平,对酒的安全性不产生影响,并且处理可使样品中的单宁、总酚和总花色苷含量显著增加,色度-色调有所改善(P<0.05),但是处理样品的总酸含量较对照略有减少(3%)。
利用顶空-SPME和GC-MS联用技术,对供试样品的挥发性香气化合物进行检测,共鉴定出76 种物质,共有组分50 种,其中1-丙氧基-2-丙醇、3-甲基-3-庚醇、1-庚烯-4-醇、S-(-)-2-甲基-1-丁醇、2-甲基-1-丁硫醇、2-甲基-1-戊醇、2-丁基-1-辛醇、2-乙酰氨基乙醇、1,9-壬二醇、癸醇、月桂醇、丁酸乙酯、甲酸异戊酯、壬酸乙酯、3-羟基丁酸乙酯、肉豆蔻酸异丙酯、正己酸、己基茉莉酮、肉豆蔻醛、6-叔丁基间甲酚仅在处理中检出,而叔十六硫醇、(±)-3-羟基月桂酸、香茅醇、2-叔丁基对甲苯酚为对照中独有。
比较各化合物含量发现,处理可明显增加醇类和脂肪酸类化合物的含量,而酯类物质和萜烯类物质有所减少。通过比较香气强度(OAV大于0.2的化合物),结果显示扩展青霉处理的酒样中香气强度依次是果香、脂肪味、土壤味、花香、植物味。其中土壤味增加了29.7%,蒜味上升了将近1 倍,玫瑰、茉莉、葡萄、柠檬、香蕉和青草香的香气强度比对照酒样分别降低了35.2%、47.7%、60.6%、60.6%、15.8%和8.8%。
参考文献:
[1] MORALES-VALLE H, SILVA L C, PATERSON R R M, et al. Effects of the origins of Botrytis cinerea on earthy aromas from grape broth media further inoculated with Penicillium expansum[J]. Food Microbiology, 2011, 28(5): 1048-1053. DOI:10.1016/ j.fm.2011.02.005.
[2] SAMSON R A, FRISVAD J C. Penicillium subgenus penicillium:new taxonomic schemes, mycotoxins and other extrolites[M]. 49th ed. Utrecht: Centraalbureau voor Schimmelcultures, 2004: 260.
[3] PATERSON R R M, LIMA N. Further mycotoxin effects from climate change[J]. Food Research International, 2011, 44(9): 2555-2566.
[4] DONOSO A, LATORRE B A. Characterization of blue mold caused by Penicillium spp. in cold stored table grapes[J]. Ciencia E Investigación Agraria, 2006, 33(2): 119-130.
[5] STEEL C C, BLACKMAN J W, SCHMIDTKE M. Grapevine bunch rots: impacts on wine composition, quatilty and potential procedures for the removal of wine faults[J]. Journal of Agriculture Food Chemistry, 2013, 61(22): 5189-5206. DOI:10.1021/jf400641r.
[6] 王守一, 贠建民, 韩建平, 等. 甘肃河西走廊产区酿酒葡萄附生微生物区系分析[J]. 甘肃农业大学学报, 2015, 2(50): 77-83. DOI:10.3969/j.issn.1003-4315.2015.02.013.
[7] MOAKE M M, PADILLA-ZAKOUR O I, WOROBO R W. Comprehensive review of patulin control methods in foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2005, 4(1):8-21. DOI:10.1111/j.1541-4337.2005.tb00068.x.
[8] 张春芝, 江志国. 微生物对葡萄酒香气的影响综述[J]. 中国酿造, 2013, 32(9): 29-31. DOI:10.3969/j.issn.0254-5071.2013.09.008.
[9] STE´PHANE L G, SOPHIE C, DOMINIQUE B, et al. Origin of (-)-geosmin on grapes: on the complementary action of two fungi, Botrytis cinerea and Penicillium expansum[J]. Antonie van Leeuwenhoek, 2005, 88(2): 131-139.
[10] Official Journal of the European Communities. Commission Regulation (EC) No.1881/2006 of (December 2006) setting maximum levels of certain contaminants in foodstuffs[S].
[11] 陕西出入境检验检疫局. SN/T 2008—2007 进出口果汁中棒曲霉毒素的检测方法: 高效液相色谱法[S]. 北京: 中国标准出版社, 2007.
[12] 中国食品工业研究院, 烟台张裕葡萄酒股份有限公司, 中法合营王朝葡萄酿酒有限公司, 等. GB/T 15038—2006 葡萄酒、果酒通用分析方法[S]. 北京: 中国标准出版社, 2006.
[13] 农业部果品及苗木质量监督检验中心(兴城), 中国农业科学院果树研究所. NY/T 1600—2008 水果、蔬菜及其制品中单宁含量的测定: 分光光度法[S]. 北京: 中国农业出版社, 2008.
[14] 李素岳. 蛇龙珠果实成熟过程中的品质变化及浸渍工艺对其葡萄酒品质的影响[D]. 兰州: 甘肃农业大学, 2013.
[15] 李静, 聂继云, 王孝娣, 等. Folin-Ciocalteus法测定葡萄和葡萄酒中的总多酚[J]. 中国南方果树, 2007, 36(6): 86-87. DOI:10.3969/ j.issn.1007-1431.2007.06.041.
[16] 翦祎, 韩舜愈, 张波, 等. 单一pH法、pH示差法和差减法快速定量干红葡萄酒总花色苷的比较[J]. 食品工业科技, 2012, 33(23): 323-423.
[17] 马腾臻, 李颍, 张莉, 等. 油橄榄酒的酿造及香气成分分析[J]. 食品科学, 2010, 31(24): 484-487. DOI:10.7506/spkx1002-6630 -201418032.
[18] SCOTT P M, FULEKI T, HARWIG J. Patulin content of juice and wine produced from moldy grapes[J]. Journal of Agricultural and Food Chemistry, 1977, 25(2): 434-437. DOI:10.1021/jf60210a024.
[19] OUGH C S, CORISON C A. Measurement of patulin in grapes and wines[J]. Journal of Food Science, 2006, 45(3): 476-478.
[20] MOSS M O, LONG M T. Fate of patulin in the presence of the yeast Saccharomyces cerevisiae[J]. Food Additives and Contaminants, 2002, 19(4): 387-399.
[21] 陈士恩. 展青霉素[J]. 甘肃畜牧兽医, 1990, 32(2): 31-32.
[22] GONZALO A D, LINA Y, BERNARDO A L. Low occurrence of patulin-producing strains of Penicillium in grapes and patulin degradation during winemaking in Chile[J]. American Journal of Enology and Viticulture, 2011, 62(4): 542-546.
[23] MEUNIER M, STEEL C C. Effect of Colletotrichum acutatum ripe rot on the composition and sensory attributes of Cabernet Sauvignon grapes and wine[J]. Australian Journal of Grape and Wine Research, 2009, 15(3): 223-227. DOI:10.1111/j.1755-0238.2009.00048.x.
[24] STUMMER B E, LEIGH F I, MARKIDES A J, et al. The effect of powdery mildew infection of grape berries on juice and wine composition and on sensory properties of Chardonnay wines[J]. Australian Journal of Grape and Wine Research, 2008, 9(1): 28-39.
[25] 陶永胜, 彭传涛. 中国霞多丽干白葡萄酒香气特征与成分关联分析[J]. 农业机械学报, 2012, 43(3): 131-139. DOI:10.6041/ j.issn.1000-1298.2012.03.025.
[26] 杨婷, 祝霞, 韩舜愈, 等. 不同酿酒酵母对甜瓜酒香气品质的影响分析[J]. 食品科学, 2015, 36(14): 145-150. DOI:10.7506/spkx1002-6630-201514028.
[27] 王玉峰. 葡萄酒香气影响因素的研究[D]. 济南: 山东轻工业学院, 2010.
[28] 蔡建, 朱保庆, 段长青, 等. 蛇龙珠与卡曼娜葡萄酒主要呈香物质鉴定[J]. 中国酿造, 2014, 33(5): 90-96.
[29] 何英霞, 蒋玉梅, 李霁昕, 等. 不同酶和酵母对干红葡萄酒香气影响的差异分析[J]. 农业工程学报, 2016, 32(增刊1): 325-332. DOI:10.1 1975/j.issm.1002-6819.2016.z1.045.
[30] 李静, 徐银, 操庆国. 棒曲霉素检测方法研究进展[J]. 中国科技信息, 2011, 73(24): 122-123. DOI:10.3969/j.issn.1001-8972.2011.24.073.
[31] 张志龙. 冷浸渍处理对黑比诺干红葡萄酒挥发性风味物质的影响[D].兰州: 甘肃农业大学, 2014.
[32] 姜文广, 李记明, 徐岩, 等. 4 种酿酒红葡萄果实的挥发性香气成分分析[J]. 食品科学, 2011, 32(6): 225-229.
[33] STYGER G, PRIOR B, FLORIAN F, et al. Wine fl avor and aroma[J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38(9):1145-1159. DOI:10.1007/s10295-011-1018-4.
[34] 张亮亮, 张文, 马会勤, 等. 接种灰葡萄孢对葡萄酒发酵及挥发性物质的影响[J]. 食品科学, 2008, 29(6): 259-263.
[35] CAPONE S, TUFARIELLO M, SICILIANO P. Analytical characterisation of Negroamaro red wines by “Aroma Wheels”[J]. Food Chemistry, 2013, 141(3): 2906-2915. DOI:10.1016/ j.foodchem.2013.05.105.
[36] 何兰兰, 张妮, 于海燕. 基于气相色谱-质谱联用对樱桃酒香气分析[J].食品工业科技, 2013, 34(21): 141-148.
[37] 宋柬, 李德美, 邓小明. 京白梨酒发酵与香气分析[J]. 农业机械学报, 2012, 43(6): 132-138. DOI:10.6041/j.issn.1000-1298.2012.06.025.
[38] 李艳, 康俊杰, 成晓玲, 等. 3 种酿酒酵母酿造赤霞珠干红葡萄酒的香气成分分析[J]. 食品科学, 2010, 31(22): 378-382.
Effect of Penicillium expansum Infection of Grapes on Patulin Content and Flavor Quality of Cabernet Gernischt Wine
CHEN Xia, LI Min, ZHANG Bo, ZHANG Jianhua, ZHAO Wanzhen, LI Wei, HAN Shunyu*
(Key Laboratory of Viticulture and Oenology, Gansu Province, College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Abstract:In this experiment, we aimed to study the effect of Penicillium expansum infection of Cabernet Gernischt grapes on the patulin content, physicochemical indexes and volatile composition of the corresponding wine. The results showed that patulin content of the wine made from grapes with postharvest infection by Penicillium expansum was lower than the detection limit (10 μg/L) of the HPLC method as described in the standard SN/T 2008—2007, suggesting that patulin does not accumulate to exceed the maximum allowable limit, while the physicochemical indexes and aroma compounds of wine were affected by this treatment as indicated by a significant increase in chroma as well as the contents of tannin, total phenols and total anthocyanins (P < 0.05) and a decrease in alcohol level. The volatile composition analysis showed that the types and contents of volatiles in treated and control samples were different; the contents of 1-octen-3-ol, 3-methylthiopropanol and octanoic acid were higher in the treated sample than in the control one whereas phenethyl acetate, damascenone and α-terpilenol were lower (P < 0.05). Taking into account the odor thresholds and organoleptic properties of volatile compounds, P. expansum infection of grapes would affect wine flavor and raise the risk of wine quality deterioration.
Key words:Penicillium expansum; Cabernet Gernischt wine; patulin; physicochemical quality; volatile compounds
DOI:10.7506/spkx1002-6630-201620021
中图分类号:TS262.7
文献标志码:A
文章编号:1002-6630(2016)20-0126-05
引文格式:
陈霞, 李敏, 张波, 等. 扩展青霉对‘蛇龙珠'葡萄酒棒曲霉素及风味品质的影响[J]. 食品科学, 2016, 37(20): 126-133.
DOI:10.7506/spkx1002-6630-201620021. http://www.spkx.net.cn
CHEN Xia, LI Min, ZHANG Bo, et al. Effect of Penicillium expansum infection of grapes on patulin content and flavor quality of Cabernet Gernischt wine[J]. Food Science, 2016, 37(20): 126-133. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201620021. http://www.spkx.net.cn
收稿日期:2016-01-31
基金项目:国家自然科学基金地区科学基金项目(31160310);甘肃省农业生物技术专项(GNSW-2013-16)
作者简介:陈霞(1990—),女,硕士研究生,研究方向为酿酒微生物及葡萄酒安全。E-mail:841279724@qq.com
*通信作者:韩舜愈(1963—),男,教授,博士,研究方向为果蔬加工及葡萄酒风味化学。E-mail:gsndhsy@163.com