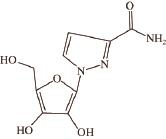
图1 利巴韦林结构式
Fig.1 Structure of ribavirin
齐 凯 1,2,汤晓艳 1,2, *,陶 瑞 2,杨小体 1,2,张小庆 2,沈习习 1,2
(1.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095;2.中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全重点实验室,北京 100081)
摘 要:为研究禁用抗病毒药物利巴韦林在鸡组织中的残留规律,对京红蛋鸡以30 mg/kg体质量剂量连续口服灌喂,在不同的时间点采集鸡肉和鸡肝样品,以超高效液相色谱-串联质谱法检测利巴韦林含量。对鸡肉、鸡肝中利巴韦林检测的方法学考察表明,鸡肉中利巴韦林检测方法线性相关系数R 2>0.99,检出限为1.20 μg/kg,质量浓度范围为5.0~200 μg/L;鸡肝中利巴韦林检测方法线性相关系数R 2>0.98,检出限为1.54 μg/kg,质量浓度范围为10.0~500 μg/L;高、中、低3 种添加水平下回收率为83.5%~120.6%,精密度(相对标准偏差)为0.7%~9.1%,满足残留分析方法要求。利巴韦林口服灌喂蛋鸡后被迅速代谢吸收,在鸡肝中代谢消除较快,残留时间短,最长检出时间为24 h,即超过24 h不再有检出,鸡肉中利巴韦林消除速率相对较慢,残留时间较长,最长检出时间为60 h,在两种组织中均不发生蓄积现象。
关键词:鸡肉;鸡肝;利巴韦林;超高效液相色谱-串联质谱法;残留规律
利巴韦林原名三氮唑核苷,相对分子质量244.21,分子式C 8H 12N 4O 5,化学名1-β-D-呋喃核糖基-1H-1,2,4,-三氮唑-3-羧酰胺,是一种人用的抗病毒类药物,分子结构式见图1 [1]。2005年10月农业部第560号公告 [2]正式废止了金刚烷胺、利巴韦林及其盐、酯单复方制剂的兽药用途。但由于其显著的抗病毒疗效,实际养殖中仍被一些养殖户非法用于预防和治疗禽类呼吸道疾病,同时兽药专项监测也发现,部分中西复方兽药中存在利巴韦林检出问题。前期研究表明,利巴韦林药物经各种给药途径进入动物体后,可转移至肉、蛋、乳及内脏等动物性食品中,从而对人类的健康造成危害 [3]。随着集约化蛋禽养殖业和食品加工业的发展,淘汰蛋鸡作为肉食原料大量被加工成各类产品 [4]。淘汰蛋鸡中药物残留也对禽类食品造成安全风险,因此有必要对淘汰蛋鸡及其产品中常见禁用抗病毒药物利巴韦林进行残留监测,以确保食品安全。目前对于动物组织中利巴韦林检测方法研究较少,主要为液相色谱法和液相色谱-串联质谱法,已有方法进样时间长,前处理繁杂,同时不同动物种属间利巴韦林的残留特性也存在较大的差异,而家禽组织中利巴韦林残留特性尚未有相关研究 [5-12]。本研究首先采用改良的QuEChERS前处理方法和超高效液相色谱-串联质谱法,建立了鸡肉、鸡肝组织中利巴韦林残留检测方法,在此基础上,对蛋鸡组织鸡肉和鸡肝中利巴韦林的残留规律进行了监测,研究结果为禽类养殖中利巴韦林违法使用监管提供了方法依据,也为禽产品质量安全风险评估提供了基础数据支持。

图1 利巴韦林结构式
Fig.1 Structure of ribavirin
1.1 材料与试剂
京红蛋鸡96 只,240 日龄,购自北京平谷某养殖场,单笼饲养于标准化养殖中心。
利巴韦林标准品(纯度99.9%,CAS:36791-04-5)德国Dr. Ehrenstorfer公司;
13C
5-利巴韦林标准品(纯度99%,分子式
 C
5H
12N
4O
5,相对分子质量249.17)加拿大TRC公司;利巴韦林注射液(规格0.1 g/mL)杭州民生药业有限公司;乙腈、甲酸均为色谱纯;实验用水为Milli-Q超纯水。
C
5H
12N
4O
5,相对分子质量249.17)加拿大TRC公司;利巴韦林注射液(规格0.1 g/mL)杭州民生药业有限公司;乙腈、甲酸均为色谱纯;实验用水为Milli-Q超纯水。
1.2 仪器与设备
ACQUITY超高效液相色谱 美国Waters公司;QTRAP ®6500型线性离子阱质谱仪 美国AB Sciex公司;TTL-DCⅡ型氮气浓缩仪 北京同泰联科技发展有限公司;Milli-Q超纯水器 美国Millipore公司。
1.3 方法
1.3.1 色谱条件
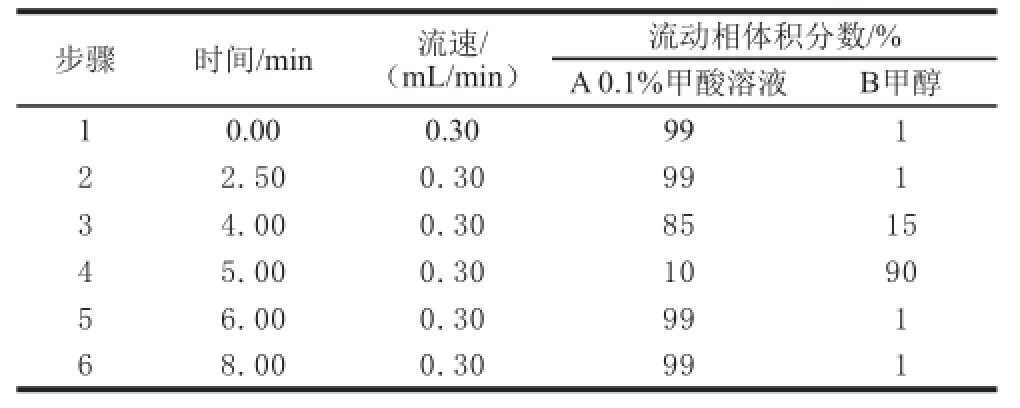
色谱柱:Agilent ZORBAX SB-Aq反相色谱柱(100 mm×3.0 mm,1.8 μm);柱温:40 ℃;流动相:A相为0.1%(体积分数)甲酸溶液,B相为甲醇;柱平衡时间:1 min;流速:0.3 mL/min;进样体积:5 μL;内标法定量。流动相梯度方案见表1。
表1 流动相梯度方案
Table1 Gradient program of mobile phase
步骤时间/min流速/(mL/min)流动相体积分数/% A 0.1%甲酸溶液B甲醇10.000.30991 22.500.30991 34.000.308515 45.000.301090 56.000.30991 68.000.30991
1.3.2 质谱条件
离子源:电喷雾离子源(electrospray ionization,ESI);检测方式:多重反应监测;扫描方式:正离子扫描;碰撞气压力:2 psi;气帘气压力:25 psi;雾化气压力:30 psi;干燥气压力:276 psi;电喷雾电压:5 500 V;离子化温度:550 ℃。
1.3.3 给药与采样
蛋鸡随机分成12 组,每组8 只,分别编号,称量后分笼饲养。利巴韦林原药用无菌生理盐水配制成30 mg/mL的溶液,蛋鸡给药前禁食12 h,自由饮水,给药时按编号取受试鸡,根据蛋鸡体质量,按30 mg/kg的标准进行口服灌喂,连续给药5 d。空白组以等量的生理盐水灌喂。停药0(空白样)、2、6、12、24、36、48、60、72、120、240、480 h,剖杀取肝脏,肌肉(胸肉)组织,保鲜袋分装,-20 ℃冰箱保存备用。
1.3.4 样品前处理
取(1±0.05) g鸡肉(鸡肝)样品于50 mL离心管中,加入100 μL 0.2 mg/L质量浓度的 13C 5-利巴韦林内标工作液,涡旋均匀,加入1 mL超纯水,超声涡旋混匀,再加入9 mL乙腈,超声振荡提取,5 000 r/min离心10 min。转移上清液,加入石墨化碳黑(graphite carbon black,GCB)40 mg和C 1860 mg,涡旋后,5 000 r/min离心5 min。移取上清液,40 ℃条件下氮气吹干,加入1 mL超纯水复溶,10 000 r/min离心5 min,过0.22 μm滤膜,上机。
1.4 数据处理
采用内标法,并结合AB SCIEX质谱工作站配置的Analyst 1.6.2分析软件,对测定的结果进行定量分析,测定不同时间点鸡肝和鸡肉中利巴韦林含量,作药物残留质量浓度-时间曲线图。
2.1 质谱条件优化
取标样标准工作液,采用针泵进样,正离子扫描,以药物母离子响应最优条件来确定仪器部分质谱参数(碰撞气压力、气帘气压力、雾化气压力、干燥气压力、电喷雾电压、离子化温度),进而对药物子离子以及去簇电压及碰撞电压进行优化。各药物优化后的最优质谱参数见表2。
表2 利巴韦林及13C5-利巴韦林质谱参数
Table2 Optimum parameters and selected fragmentations for ribavirin and
 -ribavirin
-ribavirin

注:*.定量离子对。
时间/ms碰撞电压/V去簇电压/V利巴韦林3.06245*113*501520 96504020 13C 5-利巴目标物保留时间/min母离子(m/z)子离子(m/z)驻留韦林3.03250113*501520 96504020
2.2 特异性考察
研究发现鸡肉、鸡肝样品中均含有一种与利巴韦林相似的物质,该物质与利巴韦林具有相同的质量分子数且电离打碎后有相同的离子片段,干扰利巴韦林的定性和定量分析,从而影响利巴韦林的检出和结果准确性。Danso等 [13]经过研究发现这种物质为内源性的尿苷类似物(相对分子质量244.2),该物质在质谱ESI +源中被打碎,产生的碎片离子质荷比与利巴韦林相同。为了消除尿苷类似物的影响,本研究在前处理无法将该物质除去的条件下,通过优化液相流动相成分、比例和梯度,使利巴韦林与尿苷及其碎片达到了有效分离,使其互不干扰,结果如图2所示。
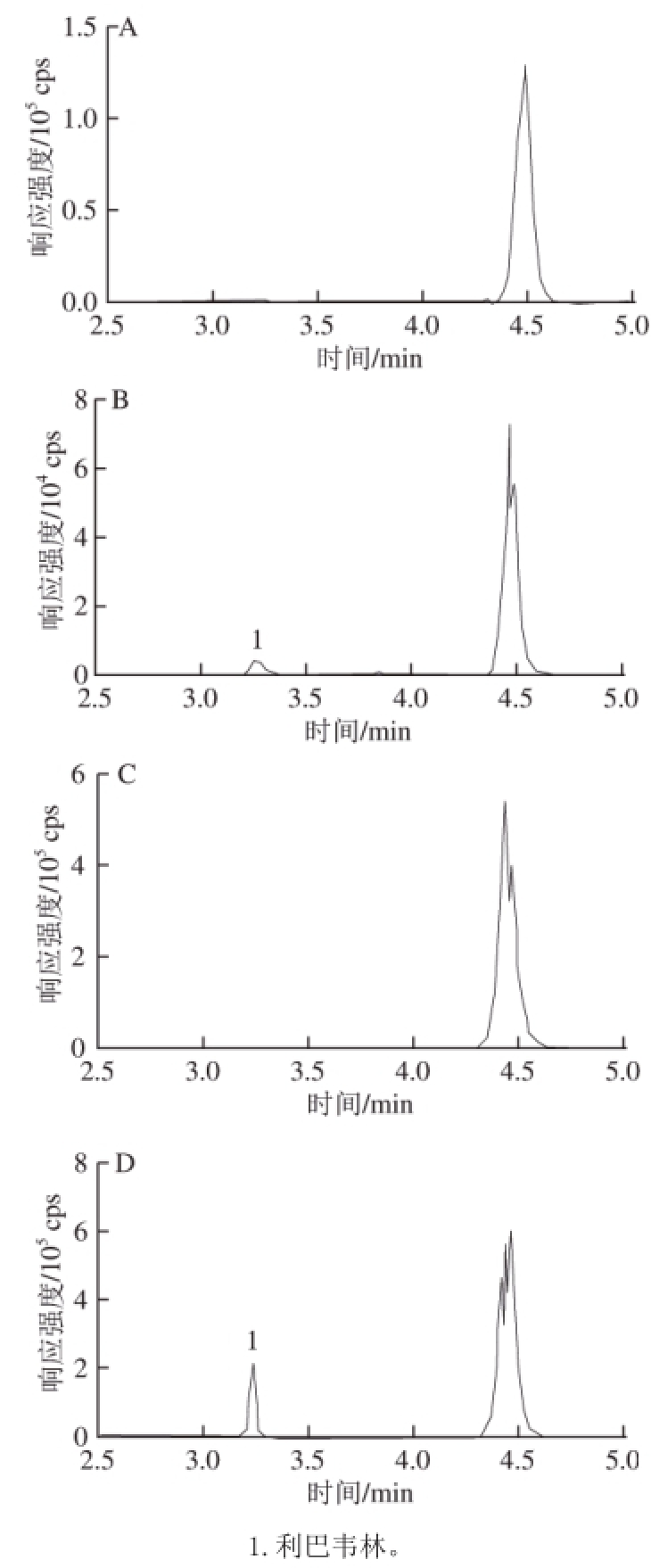
图2 鸡肉空白基质(A)、鸡肉基质标准溶液(B)、空白鸡肝(C)和鸡肝基质标准溶液(D)二级质谱总离子流色谱图
Fig.2 MS/MS total ion current chromatograms of blank muscle (A), ribavirin in matrix standard solution of blank muscle (B), blank liver (C)and ribavirin in matrix standard solution of blank liver (D)
2.3 方法线性范围、回收率和精密度
为了消除基质效应对测定结果的影响,本方法采用基质标准曲线对利巴韦林进行分析,以定量离子对和内标 13C 5-利巴韦林的峰面积比为纵坐标(Y),以基质标准工作液质量浓度作为横坐标(X)进行线性回归计算。以信噪比(R SN)确定方法的检出限(limit of detection,LOD),得到利巴韦林在鸡肉、鸡肝中的LOD(R SN=3)分别为1.20 μg/kg和1.54 μg/kg。同时,在空白鸡肉、鸡肝中分别以高、中、低3 个添加水平做利巴韦林添加回收实验。鸡肉中利巴韦林的回收率在104.8%~120.6%之间;鸡肝中利巴韦林的回收率在83.5%~113.7%之间;利巴韦林在鸡肉、鸡肝中的准确度和精密度满足基本要求,如表3所示。
表3 鸡肉、鸡肝中利巴韦林回收率和精密度(n=6)
Table3 Recovery and precision of ribavirin in chicken muscle and liver ( n= 6)

基质线性范围/(μg/L)线性方程相关系数R 2添加质量浓度/(μg/L)回收率/%精密度/%日内日间鸡肉5~200Y=0.121X+ 0.067 3 5120.63.12.8 0.998 010118.91.93.7 50104.80.76.6鸡肝10~500Y=0.095 6X +0.2590.983 9 10113.79.16.4 2083.53.26.9 200104.80.71.9
2.4 不同时间鸡肉、鸡肝中利巴韦林残留规律
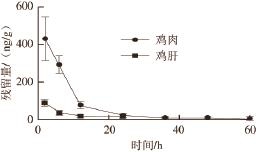
图3 口灌给药后鸡肉、鸡肝中利巴韦林残留量-时间曲线(n=6)
Fig.3 Concentration-time curve of ribavirin in chicken muscle and liver after oral administration (n = 6)
蛋鸡以30 mg/kg体质量标准连续口服灌喂5 d,以药物残留量平均值和时间的关系作药物残留消除曲线图(图3)。由图3可以看出,鸡肝脏中利巴韦林最高残留量为91.65 ng/g,鸡肉中利巴韦林最高残留量为402.97 ng/g,说明利巴韦林在鸡肉中残留量大,在鸡肝中残留量较低。从2 种组织中利巴韦林最长检出时间来看,鸡肝中利巴韦林最长检出时间为24 h,鸡肉最长检出时间为60 h,说明利巴韦林在鸡肉中残留时间长,在鸡肝中残留时间较短。从残留消除曲线斜率来看,12 h前利巴韦林在鸡肉中消除速度较快,很快从较高质量浓度降到较低质量浓度,随后以低质量浓度水平在鸡肉中缓慢消除。
3.1 检测方法优化
在质谱参数优化中,根据目标物质量分子数及分子结构特点,目标分析物通常会结合质子、铵根离子或者带正电荷的碱金属离子,在ESI +模式下成为带正电荷的加合离子,如[M+H] +、[M+NH 3] +和[M+Na] +等。本研究参考Danso等 [13]的方法,采用针泵进样,分别在正负离子模式下进行母离子Q1扫描,结果表明,利巴韦林在正离子模式下响应强度大,因此选取[M+H] +峰为准分子离子峰,确定母离子为m/z 245。通过优化碰撞能,以其分子断裂的方式,对碎片离子进行优化选择,得到主要子离子对为m/z 113和m/z 96。
由于利巴韦林的强极性,在普通C 18反相色谱柱上保留性差,本实验采用对极性化合物具有良好保留效果的Agilent ZORBAX SB-Aq色谱柱(3.0 mm×100 mm,1.8 μm),同时采用高比例的水相进行洗脱,使目标物与基质中的尿苷类似物达到有效分离。
利巴韦林属于强极性的化合物,易溶于水和一些有机溶剂 [14]。目前对于动物组织中利巴韦林的提取,主要是有机溶剂和水相结合的方式,有机溶剂使蛋白、核苷等大分子物质变性,从而去除干扰。目前已有研究采用提取溶剂包括0.1%甲酸溶液-乙腈溶液(1∶9,V/V)、0.1%甲酸溶液-20 mmol/L乙酸铵甲醇溶液(1∶9,V/V)、乙腈-水(9∶1,V/V)、甲酸-水(9∶1,V/V)等 [15]。本实验对以上提取溶剂进行了比较优化,发现乙腈-水(9∶1,V/V)作为提取溶剂具有良好的提取效果。
关于利巴韦林的净化方式,目前主要采用固相萃取技术,如MCX萃取柱、NH 2萃取柱、PBA萃取柱和HLB萃取柱等 [16-17]。本研究利用QuEChERS快速样品前处理方法原理,采用C 18和GCB两种主要的固相萃取材料进行样品净化,取得了良好提取效果,回收率明显高于固相萃取柱,且操作简单、净化时间短。
3.2 鸡肉、鸡肝中利巴韦林残留特性
目前利巴韦林在机体内的研究主要在药物代谢动力学方面,研究对象集中在大鼠、猕猴、仔猪和人等哺乳类动物,对于禽类组织中的研究甚少 [18-23]。Catlin等 [24]研究发现,人体单剂量口服利巴韦林后吸收迅速,血药浓度在1~1.5 h即达到峰值。刘雪梅 [25]对利巴韦林在仔猪体内的代谢研究发现,利巴韦林在仔猪体内吸收好,分布广泛,但代谢消除速率缓慢,容易在仔猪组织中产生蓄积,引起中毒症状。这说明不同动物种属之间,利巴韦林的代谢、吸收、分布和残留特性存在较大差异。Glue等 [26]研究发现利巴韦林消除主要途径是代谢转化,经肾脏排泄消除的原型仅占5%~15%。刘敬先等 [1]研究也提出利巴韦林原药在机体内主要是以粪便形式排出,但原型约占17%。本课题组前期对蛋鸡中利巴韦林药物代谢动力学研究发现,利巴韦林在蛋鸡血浆中代谢消除速率很快,半衰期仅1.59 h,主要是原型药物发生了代谢转化,生成了代谢产物 [27]。
鸡肉、鸡肝两种组织中鸡肉的利巴韦林残留量大,而肝脏中残留量低。蛋鸡经30 mg/kg体质量连续口服灌喂利巴韦林后,肝脏中利巴韦林原药最高残留量为91.65 ng/g,鸡肉中最高残留量为402.97 ng/g,这可能是肝脏作为药物代谢器官,导致利巴韦林在肝脏中发生了代谢转化。本实验结果发现,利巴韦林在蛋鸡体内代谢吸收速度快,在组织中消除速度也快,鸡肝与血液具有相似的代谢残留特点,即原药残留量低,代谢转化速度快。利巴韦林在组织中最长检出时间点鸡肝为24 h,鸡肉为60 h。结合本课题组郑锌等 [27]对利巴韦林在蛋鸡体内药物代谢动力学研究可以看出,蛋鸡口服给药后药物迅速向血液中转移,血浆中的最大残留量达到2 796 ng/mL,本研究同时也发现药物也向肝脏、鸡肉组织中转移,并且在鸡肉中消除速率缓慢。说明禽类养殖中违禁使用利巴韦林会对禽肉产品带来一定的安全风险隐患。
本研究建立了鸡肉、鸡肝中利巴韦林超高效液相色谱-串联质谱检测方法,方法线性关系良好(R 2>0.98),回收率为83.5%~120.6%,精密度(相对标准偏差)为0.7%~9.1%。鸡肉、鸡肝的LOD分别为1.20、1.54 μg/kg,样品分析时间短、操作简单,可作为禽类养殖中禁用抗病毒药物利巴韦林残留监管的手段。同时对可食用组织鸡肉、鸡肝中利巴韦林残留特性进行了研究,发现利巴韦林在鸡肉组织中残留量比鸡肝中残留量大,残留时间比鸡肝中残留时间长,禽类养殖中违禁使用利巴韦林会对禽产品质量安全造成一定的风险隐患。
参考文献:
[1] 刘敬先, 杜柏林, 王丽娜. 浅谈利巴韦林[J]. 黑龙江医药科学, 2013, 36(5): 24-25.
[2] 农业部. 中华人民共和国农业部公告第560号[J]. 中华人民共和国农业部公报, 2005, 10(11): 40.
[3] 孙雷, 李丹, 毕言锋, 等. 抗病毒药物的毒性及残留检测方法研究进展[J]. 中国兽药杂志, 2013(10): 57-61.
[4] 李莹, 周剑忠, 黄开红, 等. 超声波-微波设备联合嫩化淘汰蛋鸡鸡胸肉[J]. 食品科学, 2013, 34(2): 83-87.
[5] D'AVOLIO A, DENICOLÒ A, SIMIELE M, et al. Development and validation of a useful HPLC-UV method for quantification of total and phosphorylated-ribavirin in blood and erythrocytes of HCV+ patients[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66: 376-380. DOI:10.1016/j.jpba.2012.03.030.
[6] YEH L T, NGUYEN M, LIN C C. A sensitive and specific method for the determination of total ribavirin in human red blood cells by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatographic Science, 2003, 41: 255-260. DOI:10.1093/ chromsci/41.5.255.
[7] ENDRES C J, MOSS A M, KE B, et al. The role of the equilibrative nucleoside transporter 1 (ENT1) in transport and metabolism of ribavirin by human and wild-type or Ent1 (-/-) mouse erythrocytes[J]. Journal of Pharmacology and Experimental Therapeutics, 2009, 329(1): 387-398. DOI:10.1124/jpet.108.145854.
[8] YEH L T, NGUYEN M, DADGOSTARI S, et al. LC-MS/MS method for simultaneous determination of viramidine and ribavirin levels in monkey red blood cells[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 43(3): 1057-1064. DOI:10.1016/j.jpba.2006.09.001.
[9] 郝利华, 毕言锋, 郭桂芳, 等. HPLC-PDA法测定黄芪多糖注射液中非法添加利巴韦林的试验[J]. 中国兽医杂志, 2013(2): 76-79. DOI:10.3969/j.issn.0529-6005.2013.02.029.
[10] AUSTIN R K, TREFTS P E, HINTZ M, et al. Sensitive radioimmunoassay for the broad-spectrum antiviral agent ribavirin[J]. Antimicrobial Agents and Chemotherapy, 1983, 24(5): 696-701. DOI:10.1128/AAC.24.5.696.
[11] 吴飞, 丁黎. LC-MS法应用于利巴韦林颗粒剂的人体生物等效性研究[J]. 医学信息(中旬刊), 2011(8): 3532-3533. DOI:10.3969/ j.issn.1006-1959.2011.08.011.
[12] 王维霞. LC-MS/MS对鸡肉中利巴韦林残留的分析[J]. 山东畜牧兽医, 2013(7): 8-9. DOI:10.3969/j.issn.1007-1733.2013.07.005.
[13] DANSO D, LANGMAN L J, SNOZEK C L. LC-MS/MS quantitation of ribavirin in serum and identification of endogenous isobaric interferences[J]. Clinica Chimica Acta, 2011, 412(23/24): 2332-2335. DOI:10.1016/j.cca.2011.07.016.
[14] 祝伟霞, 杨冀州, 袁萍, 等. 超高效亲水色谱-串联质谱法快速检测鸡肉及其制品中的利巴韦林及其代谢物的总残留量[J]. 色谱, 2013(10): 934-938. DOI:10.3724/SP.J.1123.2013.01048.
[15] LI W K, LUO S Y, LI S Y, et al. Simultaneous determination of ribavirin and ribavirin base in monkey plasma by high performance liquid chromatography with tandem mass spectrometry[J]. Journal of Chromatography B, 2007, 846(1/2): 57-68. DOI:10.1016/ j.jchromb.2006.08.014.
[16] LIN C C, YEH L T, LAU J Y. Specific,sensitive and accurate liquid chromatographic-tandem mass spectrometric method for the measurement of ribavirin in rat and monkey plasma[J]. Journal of Chromatography B, 2002, 779(2): 241-248. DOI:10.1016/S1570-0232(02)00379-3.
[17] BERENDSEN B J, WEGH R S, ESSERS M L, et al. Quantitative trace analysis of a broad range of antiviral drugs in poultry muscle using column-swith liquid chromatography coupled to tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2012, 402(4):1611-1623. DOI:10.1007/s00216-011-5581-3.
[18] ALLEGRA S, CUSATO J, NICOLÒ A D, et al. Role of pharmacogenetic in ribavirin outcome prediction and pharmacokinetics in an Italian cohort of HCV-1 and 4 patients[J]. Biomedicine and Pharmacotherapy, 2015, 69: 47-55. DOI:10.1016/j.biopha.2014.10.030.
[19] DAHARI H, MARKATOU M, ZEREMSKI M, et al. Early ribavirin pharmacokinetics, HCV RNA and alanine aminotransferase kinetics in HIV/HCV co-infected patients during treatment with pegylated interferon and ribavirin[J]. Journal of Hepatology, 2007, 47(1): 23-30. DOI:10.1016/j.jhep.2007.01.027.
[20] SUZUKI Y, HOMMA M, ABEI M, et al. Effects of dipyridamole coadministration on the pharmacokinetics of ribavirin in healthy volunteers[J]. Drug Metabolism and Pharmacokinetics, 2013, 28(5):406-410. DOI:10.2133/dmpk.DMPK-12-RG-137.
[21] SOTIRIOS G Z, JAMES W N, ASTA J, et al. Comparison of ribavirin and oseltamivir in reducing mortality and lung injury in mice infected with mouse adapted A/California/04/2009 (H1N1)[J]. Life Sciences, 2012, 90: 440-445. DOI:10.1016/j.lfs.2011.12.014.
[22] HELEN L L, DORIAN H C, SAMUEL B. Arenavirus infection in the guinea pig model: antiviral therapy with recombinant interferon-α, the immunomodulator CL246,738 and ribavirin[J]. Antiviral Research, 1989, 12: 279-292. DOI:10.1016/0166-3542(89)90055-7.
[23] FRANK J M, SHERMAN E H, MICHAEL A U, et al. Prophylactic ribavirin treatment of dengue type 1 infection in rhesus monkeys[J]. Antiviral Research, 1990, 13(3): 139-149. DOI:10.1016/0166-3542(90)90029-7.
[24] CATLIN D M, SMITH R A, SAMUELS A I. 14C-Ribavirin:distribution and pharmacokinetic studies in rats, baboons and man[J]. Academic Press, 1980: 83-98.
[25] 刘雪梅. 利巴韦林在仔猪体内的药物代谢动力学与毒理学研究[D].泰安: 泰山医学院, 2010: 11-20. DOI:10.7666/d.y1806170.
[26] GLUE P, SCHENKER S. The single dose pharmacokinetics of ribavirin in subjects with chronic liver disease[J]. Clinical Pharmacology, 2000, 49: 417-421. DOI:10.1046/j.1365-2125.2000.00186.x.
[27] 郑锌, 汤晓艳, 曹兴元, 等. 超高效液相色谱-串联质谱法检测蛋鸡体内抗病毒药物利巴韦林[J]. 食品科学, 2016, 37(4): 197-201. DOI:10.7506/spkx1002-6630-201604035.
Determination of Residues of the Antiviral Drug Ribavirin in Chicken Muscle and Liver by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
QI Kai
1,2, TANG Xiaoyan
1,2,*, TAO Rui
2, YANG Xiaoti
1,2, ZHANG Xiaoqing
2, SHEN Xixi
1,2
(1. National Centry of Meat Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Key Laboratory of Agrifood Safety and Quality, Ministry of Agriculture, Institute of Quality Standards and Testing Technology for Agro-products, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Abstract:This study aimed to investigate the distribution prolfiles of residues of the antiviral drug ribavirin in chicken tissues, whose use has been banned. Ribavirin at the dose of 30 mg/kg was continuously administered to Jinghong laying hens. The animals were executed and chicken muscle and liver samples were collected at different time intervals for the detection of ribavirin content by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The calibration curve for ribavirin in chicken muscle was linear in the concentration range of 5.0-200 μg/L with a correlation coefficients (R 2) of above 0.99, and the limit of detection (LOD) was 1.20 μg/kg. The calibration curve for ribavirin in chicken liver was linear in the concentration range of 10.0-500 μg/L with a correlation coefficients (R 2) of above 0.98, and the the limit of detection (LOD) was 1.54 μg/kg. At three spiked concentration levels, the recoveries of ribavirin ranged from 83.5% to 120.6%, and the precision expressed as relative standard deviation (RSD) ranged from 0.7%-9.1%, which met the basic quantitative requirements. The results showed that ribavirin in chicken liver was rapidly eliminated and the final detection time was 24 h, while the elimination rate for muscle was relatively slow, and the final detection time was 60 h after oral administration. Finally, there was no accumulation of ribavirin residue in both tissues.
Key words:chicken muscle; liver; ribavirin; ultra performance liquid chromatography-tandem mass spectrometry;residue distribution pattern
DOI:10.7506/spkx1002-6630-201620024
中图分类号:TS251.7
文献标志码:A
文章编号:1002-6630(2016)20-0146-05
引文格式:
齐凯, 汤晓艳, 陶瑞, 等. 超高效液相色谱-串联质谱法检测鸡肉和鸡肝中抗病毒药物利巴韦林残留[J]. 食品科学, 2016, 37(20): 146-150. DOI:10.7506/spkx1002-6630-201620024. http://www.spkx.net.cn
QI Kai, TANG Xiaoyan, TAO Rui, et al. Determination of residues of the antiviral drug ribavirin in chicken muscle and liver by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2016, 37(20): 146-150. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620024. http://www.spkx.net.cn
收稿日期:2016-05-26
基金项目:中国农业科学院科技创新工程项目
作者简介:齐凯(1988—),男,硕士研究生,研究方向为畜产品质量安全。E-mail:410584866@qq.com
*通信作者:汤晓艳(1976—),女,研究员,博士,研究方向为畜产品质量安全。E-mail:txycaas@126.com