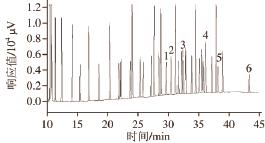
图1 37种脂肪酸甲酯标准品气相色谱图
Fig.1 Profiles of 37 fatty acid methyl ester standards
1.反亚油酸甲酯C 18∶2n-6t;2.亚油酸甲酯C 18∶2n-6c;3.亚麻酸甲酯C 18∶3;4.花生四烯酸甲酯C 20∶4;5.二十碳五烯酸甲酯C 20∶5;6.二十二碳六烯酸甲酯C 22∶6。下同。
刘晓玉 1,徐 静 2,晚观生 1,刘慧颖 2,曹际娟 1,2, *
(1.大连工业大学,辽宁 大连 116034;2.辽宁出入境检验检疫局,辽宁 大连 116001)
摘 要:目的:探讨牡蛎样品中游离脂肪酸含量随贮存温度和时间的变化,以期对小鼠法检测脂溶性贝类毒素假阳性结果的来源进行探索和分析。方法:采用三氟化硼甲酯化法对脂肪酸进行衍生化,使用固定液100%二氰丙基聚硅氧烷的毛细管色谱柱对牡蛎样品中游离脂肪酸进行检测。结果:-10 ℃和-20 ℃贮存样品中游离脂肪酸总含量随时间延长先增加后减少,之后再缓慢增加,4 ℃贮存样品中游离脂肪酸总含量随贮存时间的延长一直缓慢增加;贮存时间相同,-20 ℃贮存样品游离脂肪酸含量明显高于-10 ℃。在3 种贮存温度条件下,高毒游离脂肪酸C 20∶5n-3和低毒游离脂肪酸C 22∶6n-3含量均随时间延长而增长。5 个月后-20 ℃贮存样品中C 20∶5n-3含量为136.79 μg/g,达到小鼠最小致死量(6 mg)45%;若取2.5 倍称样量进行实验,可导致小鼠法假阳性结果。结论:牡蛎样品中高毒游离脂肪酸是小鼠法检测脂溶性贝类毒素假阳性结果的重要来源,且高毒游离脂肪酸含量随贮存温度和时间变化呈增长趋势。
关键词:小鼠法;脂溶性贝类毒;假阳性;游离脂肪酸
随着贝类毒素分析技术不断发展,许多国家和组织相继提出了用液相色谱-质谱联用分析技术替代小鼠生物法的建议,但是许多检验检疫机构仍然在使用SCT 3023—2004《贝类中麻痹性小鼠法贝类毒素的测定》、SN/T 1573—2013《出口贝类中神经性贝类毒素检测方法》、SNT 2131.2—2010《贝类腹泻性贝类毒素检验方法》等相关标准的中小鼠生物法来进行贝类毒素的监测分析。鉴于小鼠法直观监测贝类毒素毒性大小的不可代替性,故该方法仍然作为贝类毒素的常规监控分析技术被广泛使用。根据相似相溶原理,小鼠法检测脂溶性贝类毒素时,游离脂肪酸常被提取溶剂提取到待测液中,之后经腹腔注射进入小鼠体内。早在1982日本学者Takagi等 [1]使用游离脂肪酸标准品对小鼠进行腹腔注射,发现游离脂肪酸对小鼠具有很大的毒害作用。之后Takagi等 [2]进一步对不饱和游离脂肪酸的毒害作用进行研究,发现其中的多烯游离脂肪酸可能是小鼠生物法检测腹泻性贝毒假阳性结果的主要来源。
针对此问题,很多学者进行探索研究 [3-8]。唐倩囡等 [6]发现贮藏温度和时间等因素会引起贝类肠腺产生某种生化物质,这种生化物质经高效液相色谱-串联质谱法确认并非脂溶性贝毒,但是这种生化物质进行小鼠实验却导致小白鼠死亡出现假阳性结果,从而影响小鼠法检测贝毒的结果。沈志刚 [7]采用1%硫酸-甲醇甲酯化进行脂肪酸衍生化和带有聚乙二醇涂层的毛细管色谱柱对阴性牡蛎样品中游离脂肪酸进行研究,并对其随贮存时间和贮存温度含量变化进行监测分析,发现当-10 ℃冷冻保存4 个月时C 20∶5n-3含量为389.0 mg/kg,相当于1 mL中小鼠腹腔注射液含有7.78 mg C 20∶5n-3,可造成小鼠死亡。
当前脂肪酸的检测,前处理的衍生化法 [9-13]主要有碱法甲酯化、硫酸甲醇甲酯化、三氟化硼甲酯化。碱法甲酯化只适合于脂肪;硫酸-甲醇甲酯化既适于游离脂肪酸,又适合于结合态脂肪酸(脂肪) [9],但是容易造成长链脂肪酸(碳链长度大于20 个碳原子)的损失 [14]。三氟化硼法能利用快速皂化使脂肪酸盐直接转化成脂肪酸甲酯,减少酸化提取手续,并可防止常规法皂化时所引起的异构化 [15]。本实验每次对所用的牡蛎样品中贝类毒素含量先进行液相色谱-串联质谱法的检测确证,确定整个实验过程中贝类毒素的检测结果均为阴性。之后采用采用气相色谱法对小鼠法检测脂溶性贝类毒素假阳性结果来源进行探索研究,对牡蛎样品中游离脂肪酸的含量在不同贮存温度条件下随贮存时间的变化进行监测。
1.1 材料与试剂
牡蛎购于大连市场,收获季节为7月份。
甲醇、二氯甲烷、氢氧化钠、丙酮、正己烷均为色谱纯;氯化钾和氯化钠均为国产分析纯;37 种脂肪酸甲酯混合标准品 美国Supelco公司;三氟化硼-10%甲醇溶液、丁羟甲苯和Amberlyst-A26阴离子交换树脂 美国Sigma公司。
1.2 仪器与设备
GC-2010 Plus气相色谱仪 日本岛津公司;Z 323K台式高速离心机 德国Hermle公司;HY-4调速多用振荡器 国华电器有限公司;R-210旋转蒸发仪瑞士Büchi公司;T25 basic高度分散机 德国IKA公司;HH-2数显恒温水浴锅 金坛市富华仪器有限公司。
1.3 方法
1.3.1 样品的前处理
将在大连市场上购买的新鲜牡蛎,去除外壳,立刻放入-10 ℃和-20 ℃的冰箱进行贮藏。检测时,到样品处理室用绞碎机打碎,待称样使用。在室温条件下使冷冻样品融化呈半冷冻状态,此时的贝肉仍呈冷冻状态,除去牡蛎外部附着的冰片,用吸水纸轻轻抹去水分后,称量10 g牡蛎肉作为检样。
1.3.2 样品总脂肪的制备 [16-17]
取牡蛎碎肉样品10 g,于100 mL离心管(带孔的盖子)中,加入二氯甲烷-甲醇溶液(2∶1,V/V)50 mL和丁羟甲苯10 μL,然后用高度分散机均质匀浆 1 min、4 000 r/min条件下离心5 min;取出离心管后,取下层溶液(二氯甲烷大约30 mL)于50 mL具塞试管中,加入5 mL的0.88% KCl溶液后轻轻振荡混匀,混匀过程中不断开盖放气。过夜分层后取下层液体到250 mL圆底烧瓶中进行减压浓缩真空干燥,所得黏稠状油状物即为粗脂肪。
1.3.3 游离脂肪酸的的制备
1.3.3.1 Amberlyst-26(A-26)阴离子交换树脂的活化 [18-21]
称取5 g A-26树脂,加入50 mL浓度为0.5 mol/L的NaOH溶液,用调速多用振荡器以60 r/min振摇30 min,倒掉NaOH溶液,用高纯水洗树脂3 次,每次皆用10 mL高纯水并振摇20 min,用30 mL甲醇洗3 次,每次皆用10 mL甲醇且振摇20 min,重复上述甲醇洗树脂一次,将A-26树脂保存于甲醇中。因A-26阴离子交换树脂具有强烈的鱼腥味,故称量应快速进行。
1.3.3.2 游离脂肪酸的提取
经过减压浓缩得到总脂肪后,在圆底烧瓶中加入15 mL丙酮-甲醇溶液(2∶1,V/V)和250 mg A-26阴离子交换树脂,置于调速多用振荡器中以水平60 r/min常温振荡2 h后去除溶液,用丙酮-甲醇溶液洗5 次(共用20 mL),最后在旋转蒸发仪在常温条件下小转速树脂吹干后待甲酯化。
1.3.4 三氟化硼甲酯化 [22-23]
在圆底烧瓶中加入5 mL 0.5 mol/L的氢氧化钠-甲醇溶液混匀后连接回流装置。在100 ℃水浴中加热回流6~8 min,然后加3 mL三氟化硼-10%甲醇溶液反应5 min,取出冷凝装置将烧瓶冷却至室温后加入2 mL正己烷,将液体转入15 mL离心管中,后用3 mL饱和氯化钠溶液清洗平底烧瓶3 次,合并饱和氯化钠溶液于15 mL离心管,充分振摇后以2 000 r/min离心5 min。吸取上层溶液(正己烷层)约l mL于样品瓶中作为测试液,供气相色谱仪测定。
三氟化硼-10%甲醇溶液是强腐蚀性剧毒试剂,甲酯化反应必须在通风安全橱中进行;甲酯化后的试样应尽快进行气相色谱分析。如需保存,应用惰性气体保护,密封并冷藏于-4 ℃冰箱中。
1.3.5 气相色谱检测条件 [22,24]
气相毛细管色谱柱内壁涂有固定液100%二氰丙基聚硅氧烷,型号CNW CD-2560(100 m×0.25 mm,0.2 μm);检测器:氢火焰离子化检测器;检测器温度:280 ℃;进样口温度:260 ℃;气化室温度:250 ℃;柱温箱温度:初始温度140 ℃,保持5 min,以4 ℃/min升温至240 ℃,保持15 min;载气:N 2;载气流速:1.0 mL/min;分流比:100∶1;进样量:1 μL。
2.1 牡蛎中脂肪酸的检测结果
分别对新鲜牡蛎、4 ℃贮存、-10 ℃贮存及-20 ℃贮存条件下,牡蛎中游离脂肪酸的变化进行了考察。图1为37 种游离脂肪酸甲酯标准品图谱;图2为牡蛎样品中脂肪酸图谱。

图1 37种脂肪酸甲酯标准品气相色谱图
Fig.1 Profiles of 37 fatty acid methyl ester standards
1.反亚油酸甲酯C 18∶2n-6t;2.亚油酸甲酯C 18∶2n-6c;3.亚麻酸甲酯C 18∶3;4.花生四烯酸甲酯C 20∶4;5.二十碳五烯酸甲酯C 20∶5;6.二十二碳六烯酸甲酯C 22∶6。下同。
从图1可以看出,牡蛎中含量较高的游离脂肪酸约有20 种。Takagi [1]以游离脂肪酸标准品对小鼠腹腔注射的进行毒性研究,结果表明C 20∶4n-6、C 18∶3n-3、C 20∶5n-3鼠单位(MU)剂量为6~12 mg,表现出高毒性;而C 18∶2n-6t、C 18∶2n-6c、C 22∶6n-3鼠单位剂量为12~25 mg,表现出低毒性,C 18∶1n-9鼠单位剂量为25~50 mg几乎无毒。本实验针对游离脂肪酸总含量,以及高毒和低毒的游离脂肪酸含量随贮存温度和时间的变化进行了监测分析。

图2 牡蛎样品脂肪酸甲酯气相色谱图
Fig.2 Profiles of fatty acid methyl esters from oyster samples
2.2 牡蛎中游离脂肪酸总含量随贮藏条件的变化
对实验结果进行分析,牡蛎贮存过程中游离脂肪酸总含量变化情况为在相同贮存时间中,-10、-20 ℃牡蛎中脂肪酸总含量都是随贮存温度的升高先升高后降低,之后缓慢升高,主要原因是C 18∶2n-6t先升高,后剧烈下降,接近于零。新鲜牡蛎中脂肪酸总含量为270.78 μg/g,贮存5 个月后-20 ℃的牡蛎中游离脂肪酸总含量为333.35 μg/g,明显高于-10 ℃贮存的总含量199.48 μg/g。(图3)。对贮存4 个月后的牡蛎样品进行了加速实验,取出冷冻样品,在贮存(4 ℃)条件下考察其脂肪酸含量1周内的变化,发现其含量随时间的延长而升高(图4);超过1 周后4 ℃贮存的牡蛎样品发生了腐烂变质现象。
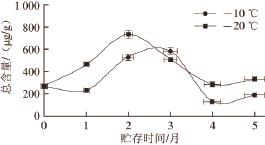
图3 不同温度贮存牡蛎肉中脂肪酸总含量变化
Fig.3 Changes in the content of total toxic fatty acids in oysters at different storage temperatures
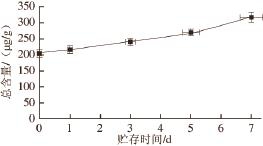
图4 4℃贮存7 d条件下牡蛎中脂肪酸总含量变化
Fig.4 Changes in the content of total toxic fatty acids in oysters with storage time
2.3 牡蛎中低毒和高毒游离脂肪酸含量随贮藏条件的变化
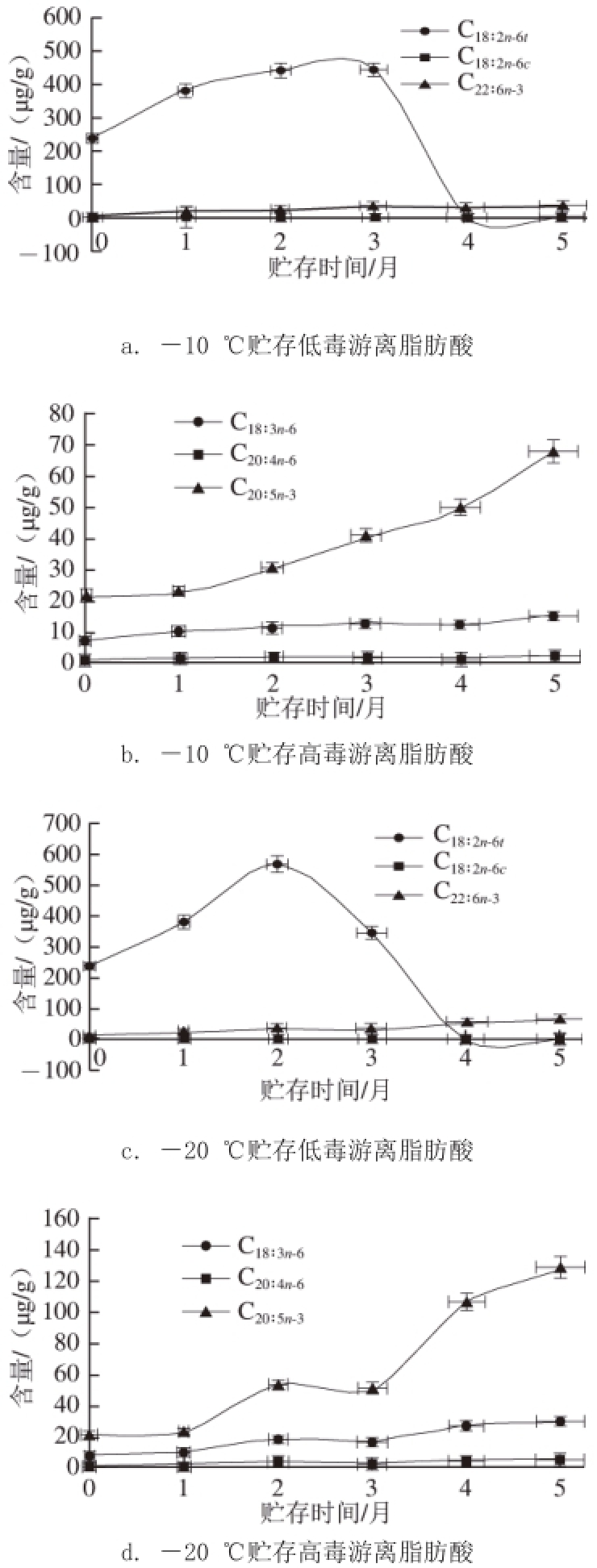
图5 不同贮存温度牡蛎中有毒脂肪酸含量变化
Fig.5 Changes in contents of toxic fatty acids in oysters at different storage temperatures
由图5可以看出,-10 ℃和-20 ℃贮藏时,低毒游离脂肪酸C 18∶2n-6t含量都是随时间延长先升高后剧烈下降接近于零,C 18∶2n-6c几乎不变,C 22∶6n-3含量随贮存时间变化则缓慢增长(图5a和c)。高毒游离脂肪酸C 20∶5n-3含量剧烈增长,C 18∶3n-3缓慢增长,C 20∶4n-6变化趋势不明显。从贮存第2个月起,-20 ℃贮存的牡蛎中每一种有毒游离脂肪酸含量均明显高于-10 ℃贮存的牡蛎含量。
在加速实验(4 ℃贮存)条件下,牡蛎中低毒游离脂肪酸C 22∶6n-3含量第5天之前缓慢增加,之后剧烈增长(图6);而C 18∶2n-6t和C 18∶2n-6c变化趋势不明显;牡蛎中高毒游离脂肪酸C 20∶5n-3含量变化趋势同C 22∶6n-3,但是C 20∶5n-3含量明显高于C 22∶6n-3,C 18∶3n-3缓慢增长,C 20∶4n-6变化趋势不明显。
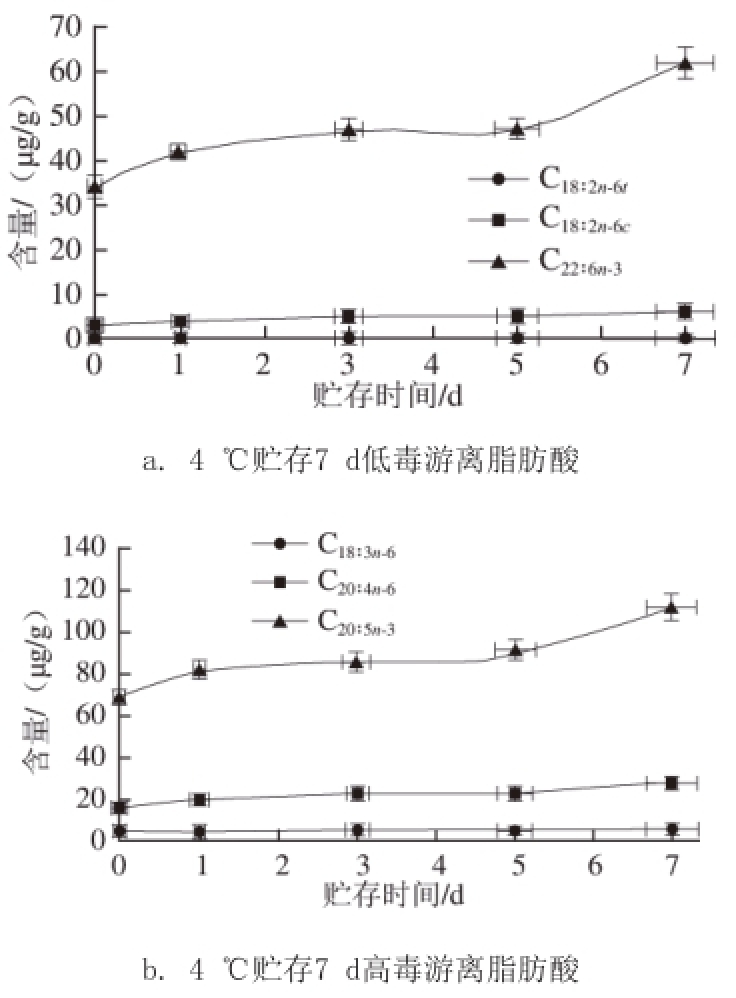
图6 4 ℃贮存牡蛎中有毒脂肪酸含量变化
Fig.6 Changes in contents of toxic fatty acids in oyster stored at 4 ℃
2.4 小鼠法检测牡蛎中脂溶性贝毒假阳性结果来源分析
表1 牡蛎中高毒游离脂肪酸含量与小鼠法致死量的关系
Table1 Relationship between the contents of highly toxic free fatty acids in oysters and their lethal dose for mouse
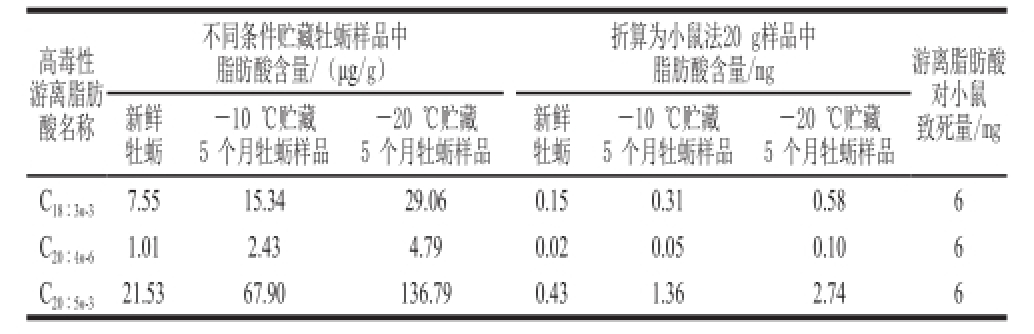
高毒性游离脂肪酸名称不同条件贮藏牡蛎样品中脂肪酸含量/(μg/g)-20 ℃贮藏5 个月牡蛎样品C 18∶3n-37.5515.3429.060.150.310.586 C 20∶4n-61.012.434.790.020.050.106 C 20∶5n-321.5367.90136.790.431.362.746新鲜牡蛎-10 ℃贮藏5 个月牡蛎样品-20 ℃贮藏5 个月牡蛎样品新鲜牡蛎-10 ℃贮藏5 个月牡蛎样品折算为小鼠法20 g样品中脂肪酸含量/mg游离脂肪酸对小鼠致死量/mg
根据现行国标 [25],采用有机试剂提取脂溶性贝毒,将1 mL注射液(内含有20 g贝肉样品提取液),腹腔注射导致小鼠死亡的含量,定义为一个鼠单位(MU)。但有机试剂不但可提取出脂溶性贝毒,也会将其中的高毒游离脂肪酸提取出来,特别是3 种高毒游离脂肪酸,是造成假阳性结果的主要原因。根据文献[1]的研究结果,脂肪酸对小鼠致死量C 20∶4n-6、C 18∶3n-3、C 20∶5n-3鼠单位剂量为6~12 mg,表现出高毒性。表1列出了本实验3种高毒性游离脂肪酸的致死量,与历经贮存后牡蛎中的脂肪酸含量对比。可见各高毒脂肪酸含量均随着贮存时间延长而升高,特别是C 20∶5n-3,在-20 ℃贮存5 个月后,其含量已经达到最小致死量(6 mg)的45%。此含量虽然尚不足以致小鼠死,但如果将检测称样量加大,则也会引起假阳性结果。结合脂肪酸随贮存时间而增长的趋势,可以预测在后续贮存过程中,各高毒脂肪酸将有可能增长到小鼠致死的剂量。
根据文献[7]研究结果,C 20∶5n-3在-10 ℃贮存4 个月后,含量即可达到389 μg/g,可导致小鼠死亡,与本实验所获得结果不同。游离离脂肪酸的产生,可作为水产品腐败的监测指标之一,但目前尚无公认的水解机理,普遍认为是由三酰甘油经化学水解或者酶促水解产生 [26]。但不同的动物品种,水解的过程机理和水解的最终结果都会有所不同,武华等 [27]对冻藏温度对鳙鱼片脂质特性变化的影响进行研究,考察了-10、-20 ℃和-30 ℃贮存条件下,鳙鱼片中游离脂肪酸总含量的变化,其结果是前2 个温度条件下,脂肪水解量在前4 周快速升高,而后渐趋平缓;-30 ℃条件则是一直缓慢升高,这与本实验研究牡蛎的结果,以及张宁等 [8]研究的牡蛎结果也不同。因此本实验认为,游离脂肪酸的水解过程,会受到物种的影响而不同,也会受到同一物种而不同产地乃至不同收获季节的影响。
牡蛎在冷冻贮存过程,体内的三酰甘油经化学水解或者酶促水解产生游离脂肪酸,经检测发现有毒脂肪酸含量占测得20 种脂肪酸总含量的66%~71%,特别是其中3种高毒性脂肪酸,C 18∶3n-3、C 20∶4n-6和C 20∶5n-3,其含量均随着贮藏时间的延长而缓慢增加。在-20 ℃贮存5 个月后,C 20∶5n-3的含量即可接近小鼠的半数致死量,可认为高毒游离脂肪酸是造成小鼠法检测脂溶性贝毒假阳性结果的重要原因之一。
参考文献:
[1] TAKAGI T, HAYASHI K, LTIABASHI Y. Toxic effect of free polyenoic acids: a fat soluble marine toxin[J]. Bulletin Faculty Fisheries Hokkaido University, 1982, 33(4): 255-262.
[2] TAKAGI T, HAYASHI K, LTIABASHI Y. Toxic effect of free unsaturated fatty acids in the mouse assay of diarrhetic shellfish toxin by intnperitoneal injection[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1984, 50(8): 1413-1418. DOI:10.2331/ suisan.50.1413.
[3] JAMES F L, RAJINDER K C, RATNAYAKE W M N, et al. An incident of elevated levels of unsaturated free fatty acids in mussels from nova scotia and their toxic effect in mice after intraperitoneal injection[J]. Natueal Toxins, 1994, 2(5): 318-321. DOI:10.1002/ nt.2620020511.
[4] COMBES R D. The mouse bioassay for diarrhetic shellfi sh poisoning:a gross misuse of laboratory animals and of scientifi c methodology[J]. Alternatives to Laboratory Animals, 2003, 31(6): 595-610.
[5] TURRELL E A, STOBO L A. Comparison of the mouse bioassay with liquid chromatography-mass pectrometry for the detection of lipophilic toxins in shellfi sh from Scottish waters[J]. Toxicon, 2007, 50(1): 442-447. DOI:10.1016/j.toxicon.2007.04.002.
[6] 唐倩囡. 贝类低温储存后对腹泻性贝毒检疫的影响[J].湖北农业科学, 2009, 48(7): 1722-1723. DOI:10.3969/ j.issn.0439-8114.2009.07.060.
[7] 沈志刚. 牡蛎产品腹泻性贝毒检测假阳性结果的产生原因及其控制措施[D]. 北京: 中国农业科学院, 2009.
[8] 张宁, 林洪, 隋涛, 等. 冷冻牡蛎贮存过程中脂溶性有毒物质的变化研究[J]. 青岛海洋大学学报(自然科学版), 2010, 40(1): 31-34. DOI:10.3969/j.issn.1672-5174.2010.01.018.
[9] 寇秀颖, 于国萍. 脂肪和脂肪酸甲酯化方法的研究[J]. 食品研究与开发, 2005, 26(2): 46-47. DOI:10.3969/j.issn.1005-6521.2005.02.016.
[10] 刘帅, 王爱武, 李美艳, 等. 脂肪酸甲酯化方法的研究进展[J]. 中国药房, 2014, 25(37): 3535-3537. DOI:10.6039/ j.issn.1001-0408.2014.37.27.
[11] 黄峥, 盛灵慧, 马康, 等. 5 种脂肪酸甲酯化方法的酯化效率研究[J].中国油脂, 2013, 38(9): 86-88.
[12] 伍新龄, 王凤玲, 关文强. 植物油脂肪酸甲酯化方法比较与含量测定[J]. 食品研究与开发, 2015, 36(7): 84-87. DOI:10.3969/ j.issn.1005-6521.2015.07.022.
[13] 曹洁, 陈卫栋, 薛斌. 植物油脂中脂肪酸甲酯合成方法及应用[J]. 粮食与油脂, 2014, 27(3): 26-28. DOI:10.3969/ j.issn.1008-9578.2014.03.008.
[14] 杨国龙, 毕艳兰, 马宇翔, 等. 甲酯化方法对油脂脂肪酸组成分析的影响[C]//中国粮油学会油脂分会第十六届学术年会会议论文, 2007: 78-81.
[15] 应珊红, 李歆, 郝希成. 动植物油脂脂肪酸甲酯制备方法验证试验[J]. 粮油食品科技, 1999, 7(2): 2-7. DOI:10.3969/ j.issn.1007-7561.1999.02.003.
[16] 付娜, 王锡昌, 汤辰婧, 等. 气相色谱法分析中华绒螯蟹4 个部位中总脂肪酸和游离脂肪酸含量与组成[J]. 食品工业科技, 2014, 35(13):305-311. DOI:10.13386/j.issn1002-0306.2014.13.058.
[17] 汤辰婧, 松前成辉, 付娜, 等. 不同阶段中华绒螯蟹脂含量及脂肪酸组成分析[J]. 食品科学, 2013, 34(22): 174-178. DOI:10.7506/ spkx1002-6630-201322035.
[18] ERIC C N, GRAEME D F. A method for the quanti-tative determination of individual free fatty acids in milkby ion exchange resin adsorption and gas-liquid chromatograph[J]. Journal of Dairy Research, 1983, 50(3): 321-329. DOI:10.1017/s0022029900023153.
[19] 日本食品工业学会. 食品分析方法[M]. 成都: 四川科学技术出版社, 1986.
[20] 周顺伍. 生物化学实验技术[M]. 北京: 中国农业大学, 1998.
[21] 傅樱花, 马长伟. 阴离子交换树脂及气相色谱法测定腊肉中的游离脂肪酸[J]. 食品科技, 2003, 28(3): 82-84. DOI:10.3969/ j.issn.1005-9989.2003.03.031.
[22] 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T 17376—2008 动植物油脂: 脂肪酸甲酯制备[S]. 北京: 中国标准出版社, 2008.
[23] 佘珠花. 气相色谱法中油脂脂肪酸衍生化方法及其选择[J]. 粮食加工, 2004, 29(6): 64-66. DOI:10.3969/j.issn.1007-6395.2004.06.018.
[24] 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T 17377—2008 动植物油脂: 脂肪酸甲酯的气相色谱分析[S]. 北京:中国标准出版社, 2008.
[25] 卫生部. GB/T 5009.212—2008 贝类中腹泻性贝类毒素的测定[S].北京: 中国标准出版社, 2008.
[26] de ABREU P D A, LOSADA P P, MAROTO J, et al. Lipid damage during fozen storage of Atlantic halibut (Hippoglossus hippoglossus)in active packaging fi lm containing antioxidants[J]. Food Chemistry, 2011, 126(1): 315-320. DOI:10.1016/j.foodchem.2010.10.048.
[27] 武华, 洪惠, 罗永康, 等. 鳙鱼片脂质特性变化的影响进行研究[J].中国农业大学学报, 2014, 19(6): 173-178. DOI:10.11841/ j.issn.1007-4333.2014.06.24.
Inquiry and Analysis of Sources of False Positive Results for the Detection of Fat Soluble Shellfish Toxins by the Mouse Bioassay
LIU Xiaoyu
1, XU Jing
2, WAN Guansheng
1, LIU Huiying
2, CAO Jijuan
1,2,*
(1. Dalian Polytechnic University, Dalian 116034, China;2. Liaoning Entry-Exit Inspection and Quarantine Bureau, Dalian 116001, China)
Abstract:Objective: To examine the changes in free fatty acid contents in oyster with storage temperature and storage time for the purpose of exploring and analyzing the sources of false positive results in mouse bioassay for fat soluble shellfi sh toxins. Methods: Methyl esterifi cation of free fatty acids was carried out with boron trifl uoride in methanol. The products were analyzed by gas capillary chromatography with a column coated with a 100% cyanopropyl polysiloxane stationary phase. Results: The total content of free fatty acids stored at -10 ℃ and -20 ℃ increased at first, then decreased, and slowly increased again with prolonging time. When the sample was stored at 4 ℃, there was a slowly increasing trend. The content of free fatty acids stored at -20 ℃ was signifi cantly higher than at -10 ℃ at the same storage time. At all the three storage temperatures, the contents of the highly toxic free fatty acid C 20:5n-3and the low toxic fatty acid C 22:6n-3kept increasing throughout the storage period. Five months later, C 20∶5n-3in oyster stored at -20 ℃ was 136.79 μg/g, which was 45% of the lethal dose for mice. If 2.5-fold weight of the oyster sample was used, the mice would die, leading to false positive results in mouse bioassay for fat soluble shellfi sh toxins. Conclusion: The high toxic free fatty acid in oyster samples was important source of false positive results in mouse bioassay for fat soluble shellfi sh toxin, and the content of high toxic free fatty acid in oyster samples presented an increasing trend at three temperatures as time goes by.
Key words:mice method; fat soluble shellfish poison; false positive; free fatty acid
DOI:10.7506/spkx1002-6630-201620026
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2016)20-0157-05
引文格式:
刘晓玉, 徐静, 晚观生, 等. 小鼠法检测脂溶性贝类毒素假阳性来源分析[J]. 食品科学, 2016, 37(20): 157-161.
DOI:10.7506/spkx1002-6630-201620026. http://www.spkx.net.cn
LIU Xiaoyu, XU Jing, WAN Guansheng, et al. Inquiry and analysis of sources of false positive results for the detection of fat soluble shellfish toxins by the mouse bioassay[J]. Food Science, 2016, 37(20): 157-161. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201620026. http://www.spkx.net.cn
收稿日期:2016-02-04
基金项目:国家公益性行业(质检)科研专项(201310141)
作者简介:刘晓玉(1990—),女,硕士研究生,研究方向为食品质量安全检测。E-mail:liuxiaoyua@sina.com
*通信作者:曹际娟(1968—),女,研究员,博士,研究方向为食品安全检测。E-mail:cjj0909@163.com