表1 高氯酸根及其内标质谱参数
Table1 MS/MS conditions for the analysis of perchlorate and its internal standard
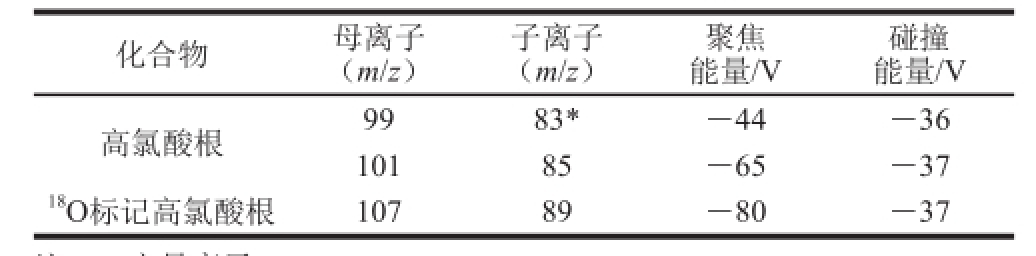
注:*.定量离子。
碰撞能量/V高氯酸根9983*-44-36 10185-65-37 18O标记高氯酸根10789-80-37化合物母离子(m/z)子离子(m/z)聚焦能量/V
邵琳智 1,2,吴映璇 1,2,欧阳少伦 1,2,林 峰 1,2
(1.广东出入境检验检疫局检验检疫技术中心,广东 广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室,广东 广州 510623)
摘 要:建立测定鸡肉和鸡肝中高氯酸盐的离子交换高效液相色谱-串联质谱法。试样加 18O标记高氯酸根离子后采用1%乙酸溶液-乙腈提取,固相萃取柱净化后,经IC-Pak TMAnion HR (4.6 mm×75 mm ,6 μm)色谱柱分离,以乙腈-100 mmol/L乙酸铵溶液为流动相,采用电喷雾离子源串联质谱,在负离子扫描方式下以多反应监测模式检测,内标法定量。结果表明:高氯酸盐在0.2~10 μg/L质量浓度范围内线性关系良好,定量限为3.0 μg/kg。在3 个加标水平下的平均回收率为91.8%~96.0%,相对标准偏差为1.8%~6.5%。该方法操作简便、灵敏度高、抗干扰能力强、回收率和重复性良好,适用于鸡肉和鸡肝中高氯酸盐的测定。
关键词:高氯酸盐;同位素稀释技术;固相萃取;高效液相色谱-串联质谱;鸡肉和鸡肝
高氯酸盐是指含有高氯酸根的盐类,作为一种常被军工航天、工业制造采用的氧化剂,由于其水溶性强,流动性强,具有高度的扩散性和持久性,从而导致对水源、土壤等环境的长期污染。2015年中国输欧茶叶大范围出现新型污染物“高氯酸盐”唤起了公众对高氯酸盐及其来源问题的关注。当环境中的高氯酸盐经过生态系统进入食物链,逐级富集,则会对农产品和食品安全构成威胁。如牛吃到富含高氯酸盐的草后,会在牛奶和牛肉中测到高氯酸盐。事实上,地下水、饮用水、肉制品、谷物、果蔬、饮料等食品中均普遍存在高氯酸盐污染,这是一个世界范围内的污染问题 [1]。高氯酸盐是一种持久性的有毒物质,由于人体的甲状腺会吸收高氯酸盐,减少对碘的吸收,进而扰乱新陈代谢,危害人的健康,尤其对婴儿的新陈代谢、中枢神经等影响较大,可能引发智力缺陷 [2]。欧洲食品安全局评估了长期和短期内暴露于高氯酸盐的风险,结果表明长期摄入高氯酸盐,对人体的危害应当引起关注。
目前,国内外已有关于饮用水、水源、土壤、奶类、蔬菜以及营养补充剂等中高氯酸盐含量的相关报道 [3-12],尚鲜有在动物组织中的相关研究及报道。因此,建立快速准确测定动物组织中的高氯酸盐含量的检测方法已迫在眉睫,以保障食品安全,尤其是孕妇和婴幼儿等敏感群体的健康。高氯酸盐的测定方法主要有离子色谱法 [4,8-11]、表面增强拉曼散射法 [12-13]、离子色谱-质谱联用技术 [14-24]和高效液相色谱-串联质谱法 [5-6,25-26]等。其中离子色谱法缺乏选择性,易出现假阳性,表面增强拉曼散射法的重现性较差、定量分析困难,离子色谱-质谱法能够满足检测需求,但由于设备的专用性强,市场占有率较低,而高效液相色谱-质谱法具有良好的灵敏度和选择性,且该设备普及率高,利于方法的推广和应用。本实验在前人研究基础上采用离子交换高效液相色谱-三重四极杆串联质谱结合 18O标记高氯酸根稀释、固相萃取等技术,建立了动物组织中高氯酸盐的检测方法。该方法操作简便、灵敏度高、抗干扰能力强、定性定量准确,能够为动物组织中高氯酸盐污染状况的监测工作提供技术支持。
1.1 材料与试剂
鸡肉和鸡肝 广州市购。
高氯酸钾标准溶液(1 000 mg/L) 美国Inorganic Ventures公司; 18O标记高氯酸钠标准溶液(100 mg/L)美国Cambridge Isotope Laboratories公司;乙腈(色谱纯) 美国Tedia公司;乙酸(色谱纯) 德国Merck公司;乙酸铵(优级纯) 印度Fluka公司;C 18固相萃取柱(200 mg/3 mL) 美国Waters公司。
1.2 仪器与设备
UFLC LC-20A超高效液相色谱仪 日本岛津公司;API 4000 QTRAP三重四极杆串联质谱仪 美国AB Sciex公司;涡旋振荡器、T25型均质器 德国IKA公司;3-16K型高速离心机 德国Sigma公司;超纯水机 美国Millipore公司。
1.3 方法
1.3.1 标准溶液配制
标准储备液的配制:分别准确吸取适量高氯酸钾标准溶液和 18O标记高氯酸钠标准溶液置于两个100 mL容量瓶中,用水定容至刻度配制成10 mg/L(折算为高氯酸根的质量浓度)的高氯酸根标准储备液及 18O标记高氯酸根内标储备液,4 ℃冰箱保存。
标准工作液的配制:分别准确吸取一定量的高氯酸根标准储备液和 18O标记高氯酸根内标储备液,用水逐级稀释配制成100 μg/L的高氯酸根标准工作液及 18O标记高氯酸根内标工作液。
标准曲线的配制:吸取20 μL内标工作液,及一定量的标准工作液,用水配制成0、0.2、0.5、1.0、2.0、5.0、10 μg/L系列标准溶液。
1.3.2 样品处理与净化
称取试样5 g (精确至0.01 g)至50 mL经过预处理的塑料离心管(用30%硝酸溶液浸泡8 h,洗净烘干)中,加100 μL 18O标记高氯酸根内标工作液(100 μg/L),加10 mL 1%乙酸溶液,匀质提取30 s,另取一离心管,加20 mL乙腈洗涤均质器刀头,合并提取液,水平振荡器振荡30 min,10 000 r/min离心10 min,分离上清液于具塞离心管,用1%乙酸溶液定容至30 mL刻度,摇匀,待净化。先吸取1 mL上清液过固相萃取柱,C 18固相萃取柱先用3 mL乙腈、3 mL 1%乙酸溶液活化,弃去流出液,再吸取1.5 mL上清液过固相萃取柱,收集流出液,涡旋振荡30 s,转移至1.5 mL塑料离心管,10 000 r/min离心10 min,取上清液供液相色谱-串联质谱仪测定。
1.3.3 超高效液相色谱条件
色谱柱:IC-Pak TMAnion HR(4.6 mm×75 mm,6 μm);流动相:乙腈-100 mmol/L乙酸铵溶液(60∶40,V/V);流速:0.70 mL/min;柱温:40 ℃;进样量:10 μL。
1.3.4 质谱条件
离子源:电喷雾电离(electrospray ionization,ESI);扫描方式:负离子扫描;监测方式:多反应监测(multiple reaction monitoring,MRM);气帘气压力:207 kPa;雾化气压力:414 kPa;辅助加热气压力:483 kPa;碰撞气压力:High;喷雾电压:-1 000 V;离子源温度:550 ℃;高氯酸盐及其内标的相关质谱参数见表1。监测离子对、碰撞能量、去簇电压、采集时间和保留时间。
表1 高氯酸根及其内标质谱参数
Table1 MS/MS conditions for the analysis of perchlorate and its internal standard

注:*.定量离子。
碰撞能量/V高氯酸根9983*-44-36 10185-65-37 18O标记高氯酸根10789-80-37化合物母离子(m/z)子离子(m/z)聚焦能量/V
2.1 提取溶剂的选择
高氯酸盐具有高溶解低吸附性,大多数易溶于水。有文献 [5,7,13]采用水作为提取溶剂,也有文献 [6,11,12]采用1%乙酸溶液。本实验考察了这2 种不同提取溶剂,发现1%乙酸溶液提取效果优于纯水。由于动物组织基质复杂,含有大量的蛋白质和脂肪等物质,脂肪不溶于水-乙腈体系,蛋白质可用乙腈沉淀去除。本实验还考察了乙腈与1%乙酸溶液体积比分别为1∶1、2∶1、3∶1和4∶1时对待测样品中高氯酸盐提取效果。结果表明,1%乙酸溶液与乙腈体积比为1∶2时,高氯酸盐的提取效率高、杂质干扰较小、蛋白沉淀效果较好,提取液澄清透明。
2.2 色谱柱的选择
高氯酸盐是一种含有强阴离子高氯酸根离子([ClO 4] -)的盐类,常规高效液相色谱柱不适用于分析高氯酸根离子,需选择特殊的阴离子交换色谱柱。本实验考察了菲罗门MAX-RP(4.6 mm×250 mm,4 μm,80 Å)柱 [5]和Waters IC-Pak TMAnion HR(4.6 mm×75 mm,6 μm)柱的分离情况。结果表明,高氯酸根离子在IC-Pak TMAnion HR 柱上获得了理想的分离效果,峰形尖锐对称。而采用MAX-RP柱色谱峰宽,峰形较差,所需分析时间较长。因此,本实验选择ICPak TMAnion HR柱。
2.3 流动相的选择
由于进质谱检测的流动相只能选择具有可挥发性的盐类,本实验考察了碳酸氢铵和乙酸铵这两种缓冲盐,研究发现,采用乙腈-碳酸氢铵溶液体系,标准溶液和基质样品溶液的保留时间不稳定,经常会有飘移,不适合高氯酸盐的分析。而乙腈-乙酸铵溶液体系的保留时间很稳定。本实验比较了不同离子强度的乙酸铵溶液对高氯酸盐的色谱峰形和离子化程度的影响。乙酸铵溶液为50 mmol/L时,峰形较差,有拖尾现象;乙酸铵溶液为100 mmol/L时,峰形尖锐对称,灵敏度较高;乙酸铵溶液为200 mmol/L时,虽然峰形较好,但灵敏度有所下降。因此,选择乙酸铵溶液100 mmol/L为最佳浓度。另外,本实验还考察了等度洗脱条件下有机相与水相不同体积比对高氯酸盐分析的影响。当乙酸铵溶液-乙腈体积比为5∶5时,保留时间为6.1 min,峰形较宽;当体积比为4∶6时,保留时间为4.6 min,峰形尖锐对称,灵敏度高;随着乙腈体积的增加,峰形变差,基线噪音变高。综合考虑分离度、保留时间和色谱峰形等因素,本实验最终选择乙腈-100 mmol/L乙酸铵溶液(6∶4,V/V)为流动相,分离结果见图1。

图1 高氯酸根标准溶液的MRM色谱图
Fig.1 Chromatograms of perchlorate standard solution in MRM mode
2.4 质谱条件的优化
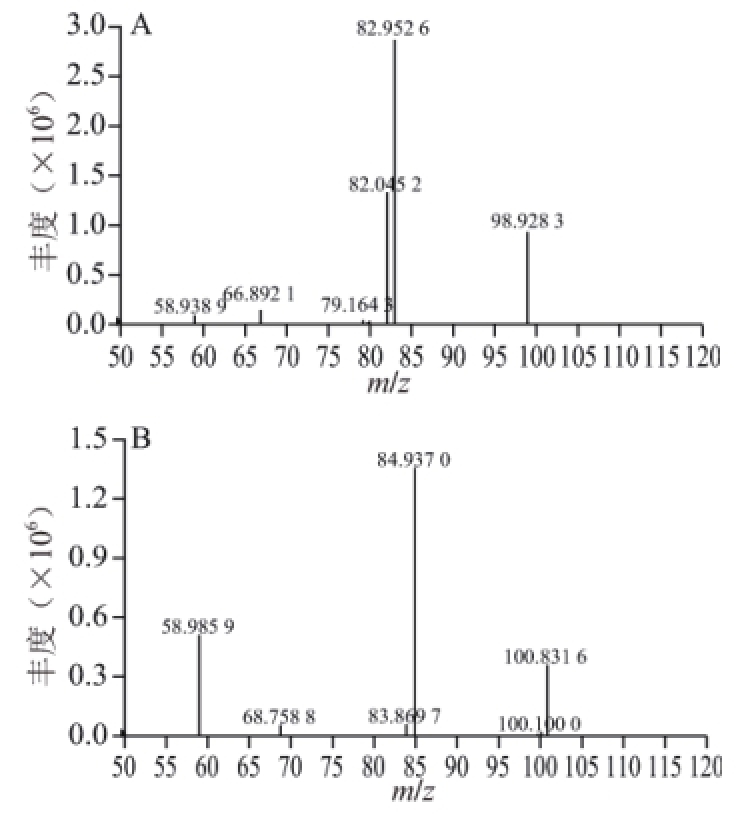
图2 高氯酸根m/z 99(A)和m/z 101(B)的二级离子碎片扫描质谱图
Fig.2 Mass spectra of perchlorate in product ion scan
用蠕动泵以10 μL/min的流速分别连续注射0.5 mg/L的高氯酸根和 18O标记高氯酸根标准溶液入ESI离子源中,在负离子检测模式下对高氯酸根离子进行一级质谱分析,由于氯离子在自然界中存在同位素 35Cl和 37Cl,所以得到高氯酸根的两个准分子离子峰(m/z 99、101)和 18O标记高氯酸根的两个准分子离子峰(m/z 107、109)。分别对准分子离子峰进行二级质谱分析,得到碎片离子信息,高氯酸根的特征碎片离子分别为m/z 83和m/z 85, 18O标记高氯酸根的特征碎片离子分别为m/z 89和m/z 91,最终选择响应高、基线噪音低的离子对m/z 99>83,m/z 107>89为定量离子对。高氯酸根的二级质谱图见图2。
2.5 线性范围和定量限
在1.3.3节和1.3.4节条件下,取一系列不同质量浓度的高氯酸根标准溶液,以高氯酸根响应峰面积与内标响应峰面积之比(y)对高氯酸根的质量浓度(x)进行线性回归,结果表明,当高氯酸根的质量浓度在0~10 μg/L范围内,线性关系良好,其回归方程为y=0.454x+ 0.011 1,相关系数r=0.999 9。
由于高氯酸盐污染物普遍存在,无法找到真正的空白样品,本实验选择的动物组织样品中检出的高氯酸根含量较低,当添加量为3.0 μg/kg时,信噪比大于10,且未添加的样品中检出的峰高小于添加样品中的1/3,符合残留检测对空白样品的要求,表明其定量限可达到3.0 μg/kg,空白样品及定量限色谱图见图3。当样品中的高氯酸根质量浓度超过此线性范围时,可适当加大样品的稀释倍数。

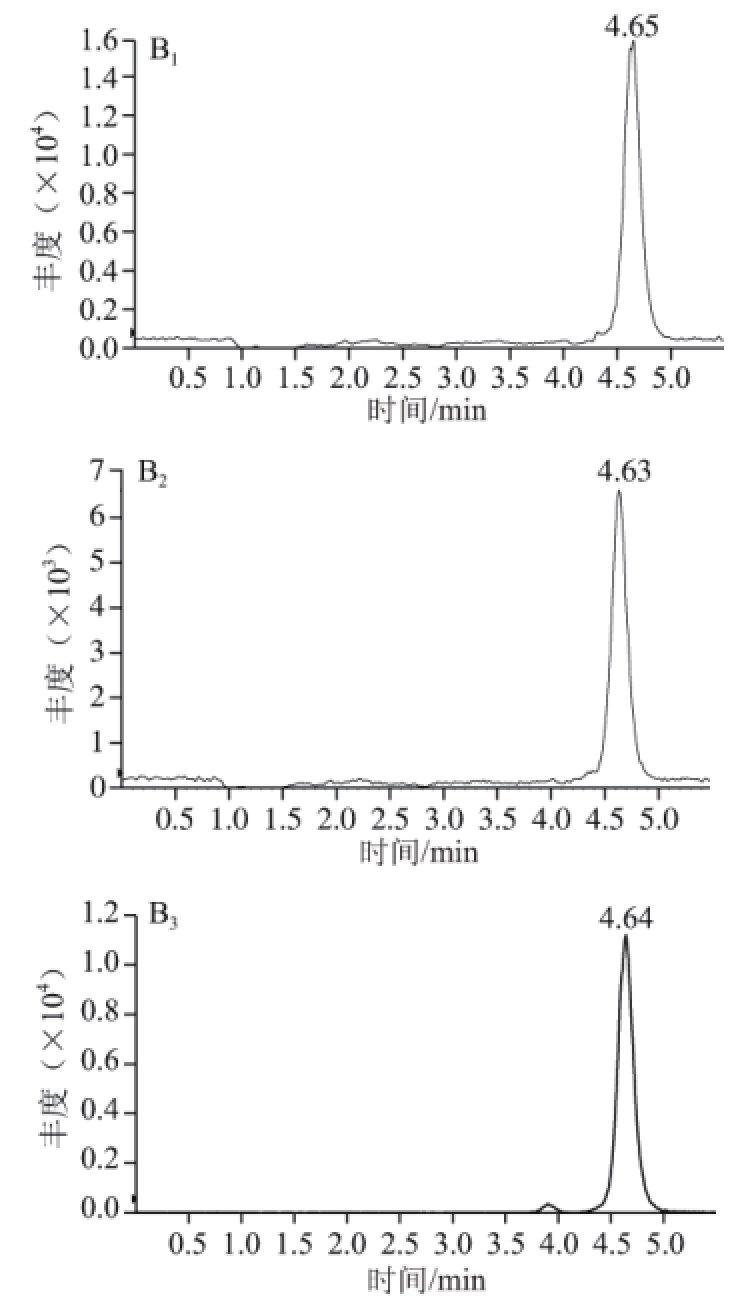
图3 鸡肝空白样品(A)和加标样品(B)中高氯酸根及内标的MRM色谱图RM
Fig.3 MRM chromatograms of perchlorate and its internal standards in blank chicken liver (A) and spiked chicken liver (B)
下标:1. m/z 99>83;2. m/z 101>85;3. m/z 107>89。
2.6 方法的回收率和精密度实验结果
选用含有较低含量高氯酸根的鸡肉和鸡肝样品分别进行添加回收率和精密度实验,添加量为3.0、6.0、30 μg/kg,按1.3.2节方法进行提取和净化,每个添加水平重复测定6 次,计算添加回收率需扣除空白样品的本底值。回收率和精密度结果见表1。3 个添加水平的平均回收率在91.8%~96.0%之间,相对标准偏差为1.8%~6.5%。表明本方法回收率稳定,可满足实际样品的检测要求。
表1 鸡肉和鸡肝中高氯酸根的加标回收率与精密度(n=6)
Table1 Recoveries and relative standard deviations (RSDs) for perchlorate in chicken meat and liver samples (n = 6)
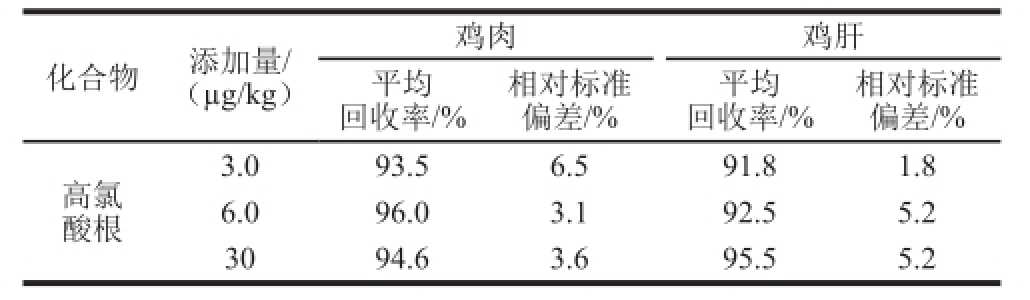
化合物添加量/(μg/kg)鸡肉鸡肝平均回收率/%相对标准偏差/%平均回收率/%相对标准偏差/%高氯酸根3.093.56.591.81.8 6.096.03.192.55.2 3094.63.695.55.2
2.7 实际样品的测定结果
按照本研究所建立的方法对目前市场销售的10 份鸡肉和10 份鸡肝样品进行了测定,一份鸡肉检出量为3.5 μg/kg,一份鸡肝检出量为4.7 μg/kg,其余均低于定量限。
本研究建立了离子交换高效液相色谱-串联质谱测定鸡肉和鸡肝中的高氯酸盐的方法。检测过程引入 18O标记高氯酸根作为内标物,对于分析全过程中导致目标物损失给予完全校正,提高了方法的精密度。该方法操作简便、灵敏度高、抗干扰能力强、测定结果准确可靠,适用于鸡肉和鸡肝中高氯酸盐的测定。
参考文献:
[1] 陈桂葵, 孟凡静, 骆世明, 等. 高氯酸盐环境行为与生态毒理研究进展[J]. 生态环境, 2008, 17(6): 2503-2510. DOI:10.16258/ j.cnki.1674-5906.2008.06.050.
[2] 吴春笃, 李顺, 许小红, 等. 高氯酸盐的环境毒理学效应及其机制的研究进展[J]. 环境与健康杂志, 2013, 30(1): 85-89.
[3] KRYNITSKY A J, NIEMANN R A, NORTRUP D A. Determination of perchlorate anion in foods by ion chromatography-tandem mass spectrometry[J]. Analytical Chemistry, 2004, 76(18): 5518-5522. DOI:10.1021/ac049281+.
[4] KRYNITSKY A J, NIEMANN R A, WILLIAMS A D, et al. Streamlined sample preparation procedure for determination of perchlorate anion in foods by ion chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2006, 567(1): 94-99. DOI:10.1016/j.aca.2006.01.005.
[5] 黄晓兰, 罗辉泰, 吴惠勤, 等. 奶粉中高氯酸盐的液相色谱-串联质谱测定[J]. 分析测试学报, 2009, 28(8): 896-899. DOI:10.3969/ j.issn.1004-4957.2009.08.004.
[6] 刘艳英, 吴敏, 林立毅, 等. 高效液相色谱串联质谱法测定牛奶中的高氯酸盐[J]. 分析测试学报, 2011, 30(7): 821-824.
[7] 史亚利. 离子色谱与API2000(IC/MS/MS)联用分析食品和饮料中的高氯酸盐[J]. 环境化学, 2006, 25(1): 117-120.
[8] 张萍, 史亚利, 蔡亚岐, 等. 改进的离子色谱法测定环境水样中的高氯酸盐[J]. 高等学校化学学报, 2007, 27(7): 1246-1250.
[9] 张萍, 史亚利, 蔡亚岐, 等. 大体积进样离子色谱法测定环境水样中高氯酸根[J]. 分析化学, 2006, 34(11): 1575-1578.
[10] 颜金良, 王立. 离子色谱法测定饮用水中高氯酸盐含量研究[J]. 中国卫生检验杂志, 2011, 21(6): 1347-1348.
[11] 蔡亚岐, 史亚利, 张萍, 等. 高氯酸盐的环境污染问题[J]. 化学进展, 2006, 18(11): 1554-1564.
[12] GU B H, RUAN C M, WANG W. Perchlorate detection at nanomolar concentrations by surface-enhanced Raman scattering[J]. Applied Spectroscopy, 2009, 63(1): 98-102. DOI:10.1366/000370209787169894.
[13] FURDUI V I, TOMASSINI F. Trends and sources of perchlorate in Arctic snow[J]. Environmental Science and Technology, 2010, 44(2):588-592. DOI:10.1021/es902243b.
[14] ARIBIH E, LE BLANC Y J C, ANTONSEN S, et al. Analysis of perchlorate in foods and beverages by ion chromatography coupled with tandem mass spectrometry (IC-ESI MS/MS)[J]. Analytica Chimica Acta, 2006, 567(1): 39-47. DOI:10.1016/j.aca.2006.03.012.
[15] KANG N, JACKSONW A, DASGUPTA P K, et al. Perchlorate production by ozone oxidation of chloride in aqueous and dry systems[J]. Science of the Total Environment, 2008, 405: 301-309. DOI:10.1016/j.scitotenv.2008.07.010.
[16] KANG N, ANDERSON T A, JACKSON W A. Photochemical formation of perch lorate from aqueous oxychlorine an ions[J]. Analytica Chimica Acta, 2006, 567(1): 48-56. DOI:10.1016/ j.aca.2006.01.085.
[17] KIRK A B, MARTINELANGO P K, TIAN K, et al. Perchlorate and iodide in dairy and breast milk[J]. Environmental Science and Technology, 2005, 39(7): 2011-2017. DOI:10.1021/es0508222.
[18] 张萍, 史亚利, 蔡亚岐, 等. 离子色谱-质谱联用测定牛奶中的高氯酸盐、溴酸盐和碘离子[J]. 分析测试学报, 2007, 26(5): 690-693.
[19] 钱蜀, 谢永洪, 杨坪, 等. 离子色谱-串联质谱测定地表水中高氯酸盐[J].中国环境监测, 2014, 30(3): 125-131.
[20] 丛鑫, 苏葳艺, 赵晓云, 等. 离子色谱法同时测定牛乳及牛乳制品中硫氰酸盐和高氯酸盐[J]. 沈阳药科大学学报, 2013, 30(8): 601-604.
[21] 史亚利, 刘肖, 张萍, 等. 离子色谱-质谱联用技术测定饮用水及环境水样中的痕量高氯酸盐[J]. 分析试验室, 2007, 26(4): 34-37. DOI:10.13595/j.cnki.issn1000-0720.2007.0097.
[22] 高峰, 刘岩, 孔维恒, 等. 离子色谱-质谱测定碳酸饮料中的亚氯酸盐、氯酸盐和高氯酸盐[J]. 食品科学, 2013, 34(22): 261-264. DOI:10.7506/spkx1002-6630-201322052.
[23] 张萍, 史亚利, 王亚韡, 等. 离子色谱-质谱联用技术测定污泥样品中的痕量高氯酸盐[J]. 分析化学, 2007, 35(1): 131-134.
[24] 宁啸骏, 朱伟, 杜茹芸, 等. 离子色谱-串联质谱法测定婴幼儿配方奶粉中的高氯酸盐[J]. 理化检验: 化学分册, 2016, 52(1): 19-23.
[25] 吴映璇, 林峰, 姚仰勋, 等. 固相萃取/ 18O标记高氯酸根稀释高效液相色谱-串联质谱法测定水果中的高氯酸盐[J]. 分析测试学报, 2016, 35(3): 355-358.
[26] 吴映璇. SN/T 4089—2015 进出口食品中高氯酸盐的测定[S]. 北京:中国标准出版社, 2015.
Determination of Perchlorate in Chicken Meat and Liver by Ion Exchange High Performance Liquid Chromatography-Tandem Mass Spectrometry
SHAO Linzhi
1,2, WU Yingxuan
1,2, OUYANG Shaolun
1,2, LIN Feng
1,2
(1. Inspection and Quarantine Technology Center, Guangdong Entry-Exit Inspection and Quarantine Bureau, Guangzhou 510623, China; 2. Key Laboratory of Animals and Plants and Food Import and Export of Technical Measures in Guangdong Province, Guangzhou 510623, China)
Abstract:A method was developed for the determination of perchlorate in chicken meat and liver by ion- exchange high performance liquid chromatography-tandem mass spectrometry (IC-HPLC-MS/MS). After adding isotopically labeled internal standards to it, the sample was extracted with 1% acetic acid-acetonitrile, and then purified by solid-phase extraction column. The target compound was separated on an IC-Pak TMAnion HR column (4.6 mm × 75 mm, 6 μm) using a mobile phase consisting of acetonitrile and 100 mmol/L aqueous ammonium acetate, and detected by tandem mass spectrometry in negative electrospray ionization and multiple reaction monitoring (MRM) mode. The quantification of perchlorate was performed by the internal standard method. The calibration curves showed good linearity in the concentration range of 0.2-10 µg/L with a limit of quantification (LOQ) of 3.0 μg/kg. The recoveries in chicken meat and liver at three spiked levels were in the range of 91.8%-96.0% with relative standard deviations (RSDs) between 1.8% and 6.5%. With the advantages of convenience, high sensitivity, strong anti-interference capability and good recovery and repeatability, the method was suitable for the analysis of perchlorate in chicken meat and liver.
Key words:perchlorate; isotope dilution technique; solid-phase extraction; high performance liquid chromatography-tandem mass spectrometry; chicken meat and liver
DOI:10.7506/spkx1002-6630-201620028
中图分类号:TS201.6;TS251.7
文献标志码:A
文章编号:1002-6630(2016)20-0167-05
引文格式:
邵琳智, 吴映璇, 欧阳少伦, 等. 离子交换高效液相色谱-串联质谱法测定鸡肉和鸡肝中的高氯酸盐[J]. 食品科学, 2016, 37(20): 167-171. DOI:10.7506/spkx1002-6630-201620028. http://www.spkx.net.cn
SHAO Linzhi, WU Yingxuan, OUYANG Shaolun, et al. Determination of perchlorate in chicken meat and liver by ion exchange high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2016, 37(20): 167-171. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620028. http://www.spkx.net.cn
收稿日期:2016-03-05
基金项目:国家认证认可监督管理委员会检验检疫行业标准计划项目(2009B535);广东检验检疫局科技计划项目(2015GDK10)
作者简介:邵琳智(1979—),女,高级工程师,硕士,研究方向为食品安全检测。E-mail:slz9741430@sina.com