表1 正交试验因素与水平
Table1 Factors and levels used for orthogonal array design
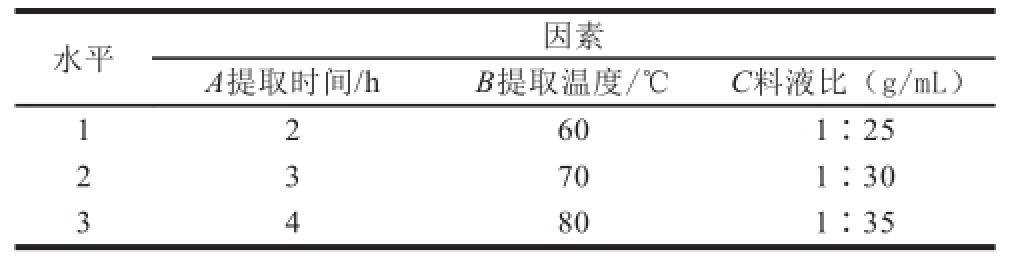
水平因素A提取时间/hB提取温度/℃C料液比(g/mL)1 2 601∶25 2 3 701∶30 3 4 801∶35
王金华 1,2,杜 超 1,2,梁 晨 1,2,马立志 1,2,曾 加 1
(1.贵阳学院食品与制药工程学院,贵州 贵阳 550005;2.贵州省果品加工工程技术研究中心,贵州 贵阳 550005)
摘 要:研究贵长猕猴桃果肉多糖、果皮多糖的提取工艺及体外抗氧化能力。采用正交试验优化贵长猕猴桃果肉、果皮多糖提取工艺参数,蒽酮-硫酸法测定多糖含量;用邻苯三酚自氧化及Fenton反应法测定贵长猕猴桃多糖抗氧化活性。结果表明:果肉多糖最优提取工艺参数为提取温度80 ℃、提取时间2 h、料液比1∶35(g/mL),重复提取3 次,多糖提取率可达1.74%;果皮多糖最优提取工艺参数为提取温度70 ℃、提取时间2 h、料液比1∶25(g/mL),重复提取3 次,多糖提取率可达1.16%。贵长猕猴桃果肉粗多糖、果皮粗多糖对O 2 -·和·OH均具有很好的清除作用,果肉多糖清除O 2 -·和·OH的IC 50分别是12.4、41.3 μg/mL,果皮多糖清除2 种自由基的IC 50分别是84.1、50.8 μg/mL。
关键词:贵长猕猴桃;果肉;果皮;多糖;提取工艺;抗氧化能力
贵长猕猴桃呈长圆柱形,果皮金黄,硬毛,属“美味”猕猴桃类型,是贵州省果树研究所从贵州野生猕猴桃中精选培育出的品种。1990年开始在黔北地区引进,现已成为贵州猕猴桃栽培大县修文县的主栽品种,并于2011年9月成为国家地理标志保护产品 [1]。该品种果肉翠绿色,富含VC、胡萝卜素以及铁、锌等微量元素,清香爽口,酸甜适度,深受消费者喜爱。多糖又称多聚糖,由单糖聚合成聚合度大于10的极性大分子,与生命的多种生理功能密切相关 [2]。多糖具有多种临床作用,如免疫调节、抗氧化、降血糖血脂等作用,并对防治肿瘤、糖尿病、冠心病等有一定作用,具有清除自由基的作用,能提高抗氧化酶活性和抑制脂质过氧化的活性,起到保护生物膜和延缓衰老的作用 [3-6]。现针对贵长猕猴桃开展的研究主要集中在种植技术、保鲜、深加工产品研发 [7-9]等方面。鲜见针对贵长猕猴桃多糖的研究。有研究表明,从中华猕猴桃根 [10]、软枣猕猴桃茎 [11]中提取的多糖具有显著的生物活性。软枣猕猴桃粗多糖也具有较强的抗氧化活性 [12]。本实验拟对贵长猕猴桃果肉及果皮中多糖的提取工艺及体外抗氧化活性进行初步实验。从而为贵长猕猴桃的深入研究与开发提供参考,促进当地经济的进一步发展。
1.1 材料
贵长猕猴桃采自贵州省贵阳市修文益众农场;蒽酮试剂、三羟甲基氨基甲烷、盐酸、邻苯三酚、硫酸亚铁、水杨酸、乙醇、过氧化氢;其余化学试剂均为分析纯。
1.2 仪器与设备
AUW-120D电子天平、UV-2550型紫外-可见分光光度计 日本岛津公司;AL104型精密分析天平 梅特勒-托利多仪器(上海)有限公司;RE52CS-1旋转蒸发器上海亚荣生化仪器厂;DS-1高速组织捣碎机 上海标本模型厂;TGL-16A台式高速冷冻离心机 长沙平凡仪器仪表有限公司 。
1.3 方法
1.3.1 样品处理
猕猴桃清洗后,经果肉与果皮分离,分别磨浆、干燥至质量恒质量,打粉备用。
1.3.2 贵长猕猴桃多糖提取工艺流程 [13]
猕猴桃粉→浸提法提取多糖(粗多糖)→乙醇沉淀→除蛋白→冷冻干燥→体外抗氧化功效研究
1.3.3 贵长猕猴桃多糖提取单因素试验
在其他条件相同的条件下,以粗多糖提取率为指标,分别研究提取温度(60、70、80、90 ℃)、提取时间(1、2、3、4、5 h)、料液比(1∶20、1∶25、1∶30、1∶35(g/mL))3 个单因素对猕猴桃多糖提取效果的影响。
1.3.4 贵长猕猴桃多糖提取正交试验 [14-15]
在单因素试验基础上,以粗多糖提取率为考察指标,用正交试验L 9(3 3)优选猕猴桃多糖提取工艺,设置因素水平如表1所示。
表1 正交试验因素与水平
Table1 Factors and levels used for orthogonal array design

水平因素A提取时间/hB提取温度/℃C料液比(g/mL)1 2 601∶25 2 3 701∶30 3 4 801∶35
1.3.5 多糖含量测定
参照《中国药典》,采用蒽酮-硫酸法测定 。
1.3.5.1 标准曲线的绘制
精密称取105 ℃干燥至恒质量的葡萄糖10 mg,用蒸馏水定容至100 mL,即为葡萄糖标准溶液。分别精密吸取葡萄糖标准溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,置10 mL具塞试管中,加水至2.0 mL,精密加入硫酸蒽酮溶液(精密称取蒽酮0.1 g,加80%的硫酸溶液100 mL使溶解,摇匀)6 mL,摇匀,置水浴中加热15 min,取出,放入冰浴中冷却15 min,以相应的试剂为空白,依据紫外-可见分光光度法(附录VA),在625 nm波长处测定吸光度,以吸光度为纵坐标,质量浓度为横坐标,绘制标准曲线。
1.3.5.2 样品粗多糖含量测定
将样品溶液糖质量浓度调整到测定范围,精确吸取2 mL置于干燥洁净试管中,在每支试管中立即加入蒽酮试剂6 mL,振荡混匀,各管加完后一起置于沸水浴中加热15 min。取出,迅速浸于冰水浴中冷却15 min,每个质量浓度做2~3 个重复。在625 nm波长处迅速测定各管吸光度。根据葡萄糖含量的标准曲线,由样品溶液吸光度计算各样品溶液中糖的质量浓度,按式(1)并计算多糖含量。
式中:c为测得的样品溶液的葡萄糖质量浓度/(mg/mL);V为供试液体积/mL;m为供试品的质量/mg。
1.3.5.3 多糖提取率计算
式中:m为醇沉后得到的粗多糖质量/g;m 1为称取的猕猴桃样品的质量/g。
1.3.6 贵长猕猴桃多糖体外抗氧化实验 [16-22]
在最优提取工艺条件下对贵长猕猴桃的果肉、果皮中多糖分别进行提取得粗多糖,冷冻干燥后用于抗氧化能力实验。
1.3.6.1 清除O 2 -·能力
自氧化速率测定:4.5 mL 50 nmol/L、pH 8.2 Tris-HCl缓冲液与4.2 mL蒸馏水混匀后在25 ℃水浴中保温20 min,加入在25 ℃预热过的3 mmol/L邻苯三酚溶液0.3 mL(以10 mmol/L HCl溶液配制),混匀,在325 nm波长处每隔0.5 min比色一次,以上述Tris-HCl缓冲液为空白,计算邻苯三酚的自氧化率V 0。
以不同质量浓度的贵长猕猴桃多糖溶液代替蒸馏水,按上述方法操作,计算邻苯三酚的自氧化率V 1。按公式(3)计算O 2 -·清除率:
1.3.6.2 清除·OH能力
在反应体系中加入8 mmol/L FeSO 4溶液2 mL、8 mmol/L水杨酸-乙醇溶液2 mL,不同质量浓度多糖溶液1 mL,最后加1 mL体积分数0.03% H 2O 2启动反应,在37 ℃反应30 min。在510 nm波长处测定吸光度A i,以相同质量浓度的多糖溶液不加0.03% H 2O 2为本底吸光度A j。并以蒸馏水为参比液测定吸光度A 0。清除率计算见公式(4):
2.1 标准曲线的绘制
以葡萄糖为标准,所得标准曲线回归曲线方程为y= 0.010 9x+0.009 7,相关系数R 2=0.999 1,可信度较高。
2.2 单因素试验结果
2.2.1 提取时间对贵长猕猴桃多糖提取率的影响
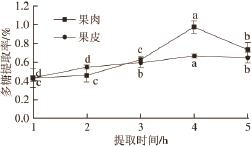
图1 提取时间对多糖提取率的影响
Fig.1 Effect of extraction time on polysaccharide yield
不同小写字母表示同来源多糖提取率之间差异显著(P<0.05)。下同。
在80 ℃和料液比1∶20情况下,考察提取时间对贵长猕猴桃多糖提取效果的影响,如图1所示,随着提取时间的延长,多糖提取率逐渐增大。4 h时果肉多糖提取率达到0.975%,果皮多糖提取率达到0.672%,提取率均为最高,且与其他时间提取率差异显著。此后果皮和果肉中多糖的提取率均下降。可能原因是在长时间受热情况下多糖分解的所致。故选用提取时间为4 h进行后续实验。
2.2.2 提取温度对贵长猕猴桃多糖提取率的影响
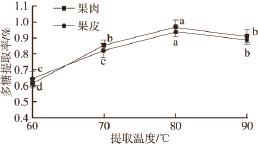
图2 提取温度对多糖提取率的影响
Fig.2 Effect of extraction temperature on polysaccharide yield
在料液比1∶20和提取时间4 h情况下,考察提取温度对贵长猕猴桃多糖提取效果的影响,如图2所示。果肉多糖和果皮多糖提取率变化趋势一致,开始时,多糖的提取率随着水浴温度的升高呈不断增加的趋势,当温度达80 ℃时,提取率达最高,且与其他处理温度差异显著。当温度超过80 ℃后多糖提取率呈下降趋势,可能是温度过高导致多糖降解所致。故采用80 ℃为宜。
2.2.3 料液比对贵长猕猴桃多糖提取率的影响
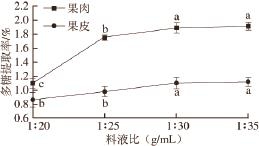
图3 料液比对粗多糖提取率的影响
Fig.3 Effect of solid-to-solvent ratio on polysaccharide yield
在80 ℃和提取时间4 h情况下,考察料液比对贵长猕猴桃多糖提取效果的影响,随着溶剂用量的降低,多糖提取率逐渐升高,溶剂用量过高或过低都不能对多糖进行充分提取,结果如图3所示。果肉多糖和果皮多糖提取率变化趋势基本一致,当料液比为1∶30时,果皮多糖和果肉多糖提取率分别达1.88%和1.12%,其与1∶20、1∶25处理结果差异显著,与1∶35处理差异不显著。即当料液比1∶30时多糖提取率最大,此后即使继续增大溶剂用量,多糖提取率增加不明显,考虑到后续的醇沉等工艺,从节约成本角度考虑,选择1∶30比例进行后续实验研究。
2.3 正交试验结果
2.3.1 贵长猕猴桃果肉中多糖提取正交试验结果
贵长猕猴桃果肉多糖提取正交试验结果见表2、3,由直观分析及方差分析结果可以看出:R B>R C>R A,即提取温度对贵长猕猴桃果肉多糖提取率影响最大,其次是料液比和提取时间。方差分析结果显示A、B、C三因素对试验结果影响均不显著,所以由直观分析得出最优提取条件为B 3C 3A 1,即提取温度80 ℃、提取时间2 h、料液比1∶35。
表2 贵长猕猴桃果肉多糖提取L
9(33
3)正交试验结果
Table2 Orthogonal array design L
9(33
3) with experimental results of
polysaccharide yield from kiwifruit pulpp
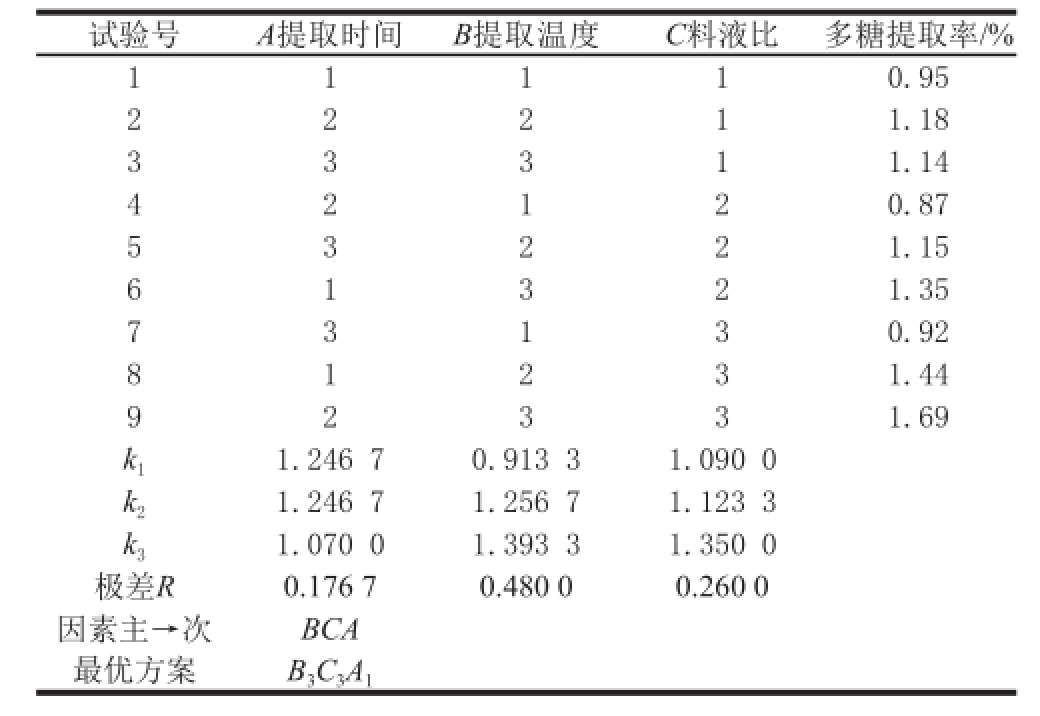
试验号A提取时间B提取温度C料液比多糖提取率/% 1 1 1 1 0.95 2 1.18 3 3 3 1 1.14 2 2 1 4 0.87 5 3 2 2 1.15 2 1 2 6 1.35 7 3 1 3 0.92 1 3 2 8 1.44 9 2 3 3 1.69 1 2 3 k 11.246 70.913 31.090 0 k 21.246 71.256 71.123 3 k 31.070 01.393 31.350 0极差R0.176 70.480 00.260 0因素主→次BCA最优方案B 3C 3A 1
表3 贵长猕猴桃果肉多糖提取正交试验方差分析
Table3 Analysis of variance of orthogonal array experimental results for polysaccharide yield from kiwifruit pulp
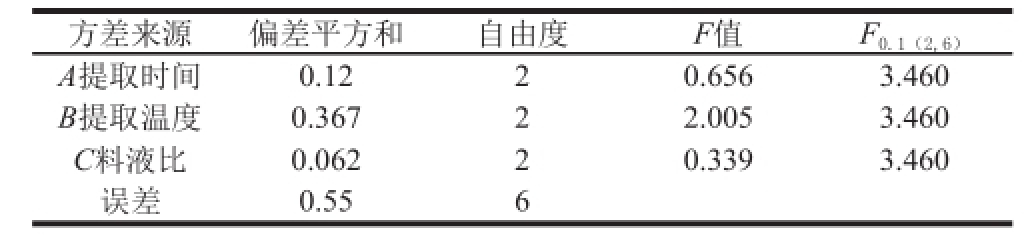
方差来源偏差平方和自由度F值F 0.1(2,6)A提取时间0.1220.6563.460 B提取温度0.36722.0053.460 C料液比0.06220.3393.460误差0.556
2.3.2 贵长猕猴桃果肉中多糖提取验证实验结果
在提取温度8 0 ℃、提取时间2 h、料液比1∶35(g/mL)条件下,进行3 次平行实验,贵长猕猴桃果肉多糖提取率分别为1.72%、1.76%和1.73%,平均提取率为1.74%。因此确定B 3C 3A 1为最佳提取方案。在最优条件下重复提取3 次,多糖提取率可达1.74%。
2.3.3 贵长猕猴桃果皮中多糖提取正交试验结果
表4 贵长猕猴桃果皮多糖提取L9(3
3)正交试验结果
Table4 Orthogonal array design L9 (3
3) with experimental results of polysaccharide yield from kiwifruit pericarpp
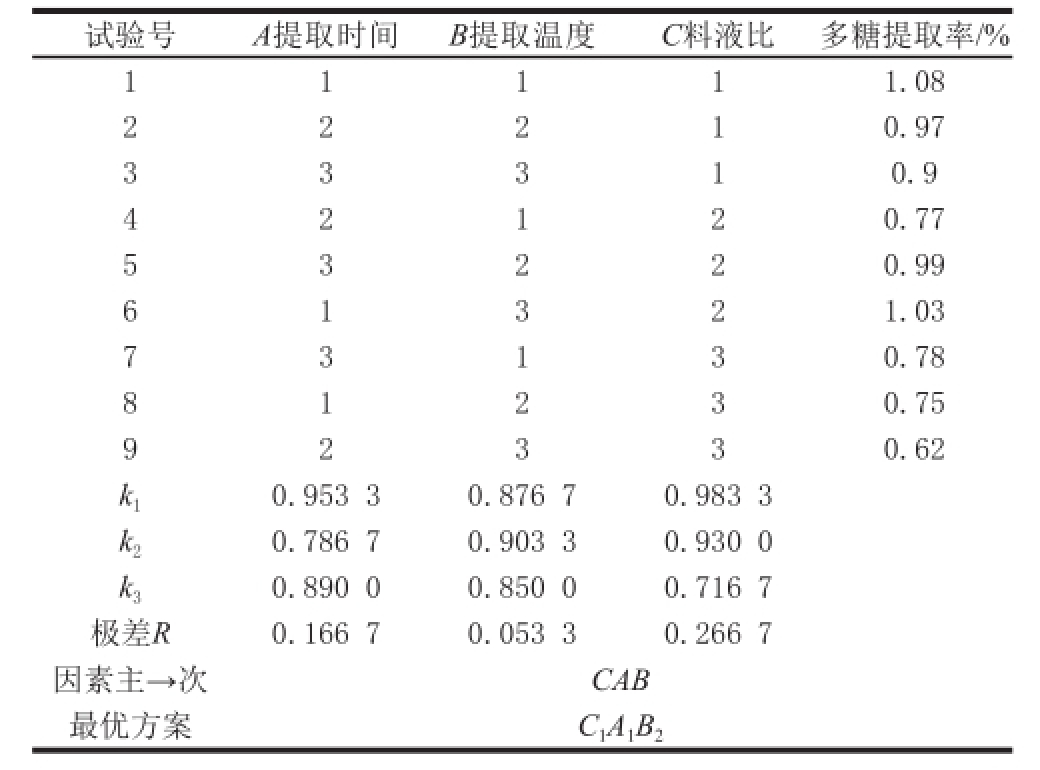
试验号A提取时间B提取温度C料液比多糖提取率/% 1 1 1 1 1.08 2 0.97 3 3 3 1 0.9 2 2 1 4 0.77 5 3 2 2 0.99 2 1 2 6 1.03 7 3 1 3 0.78 1 3 2 8 0.75 9 2 3 3 0.62 1 2 3 k 10.953 3 0.876 7 0.983 3 k 20.786 7 0.903 3 0.930 0 k 30.890 0 0.850 0 0.716 7极差R0.166 7 0.053 3 0.266 7因素主→次CAB最优方案C 1A 1B 2
表5 贵长猕猴桃果皮多糖提取正交试验方差分析
Table5 Analysis of variance of orthogonal array experimental results for polysaccharide yield from kiwifruit pericarp

方差来源偏差平方和自由度F值F 0.1(2,6)A提取时间0.11922.1643.460 B提取温度0.00420.0733.460 C料液比0.04220.7643.460误差0.176
贵长猕猴桃果皮多糖提取正交试验结果见表4、5。由直观分析与方差分析结果可以看出:R C>R A>R B,即料液比对贵长猕猴桃果皮多糖提取率影响最大,其次是提取时间和提取温度。方差分析A、B、C三因素对实验结果的影响均不显著,所以由直观分析得出最优提取条件为C 1A 1B 2,即提取温度70 ℃、提取时间2 h、料液比1∶25。
2.3.4 贵长猕猴桃果皮中多糖提取验证实验结果
在提取温度7 0 ℃、提取时间2 h、料液比1∶25(g/mL)条件下,进行3 次平行实验,贵长猕猴桃果皮多糖提取率分别为1.14%、1.14%和1.18%,平均提取率为1.16%。因此确定C 1A 1B 2为最佳提取方案。在最优条件下重复提取3 次,多糖提取率可达1.16%。
2.4 贵长猕猴桃粗多糖抗氧化性能
2.4.1 清除
 ·能力
·能力
邻苯三酚在碱性条件下自氧化生成带色的中间产物
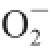 ·,
·,
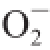 ·能促进邻苯三酚自氧化,因此通过测定某物质对邻苯三酚自氧化抑制作用,即可表征其对
·能促进邻苯三酚自氧化,因此通过测定某物质对邻苯三酚自氧化抑制作用,即可表征其对
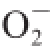 ·的清除作用。贵长猕猴桃果肉、果皮粗多糖清除
·的清除作用。贵长猕猴桃果肉、果皮粗多糖清除
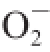 ·能力如图4所示。
·能力如图4所示。
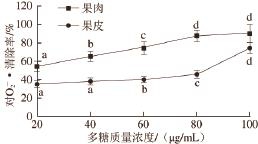
图4 贵长猕猴桃粗多糖对
 ·的清除能力
·的清除能力
Fig.4 Scavenging effects of kiwifruit polysaccharides against superoxide anion radical
由图4可见,贵长猕猴桃果肉粗多糖、果皮粗多糖在所选质量浓度范围内对
 ·具有较好的清除作用,且果肉粗多糖的清除效果优于果皮多糖。用回归分析贵长猕猴桃果肉粗多糖和果皮粗多糖清除
·具有较好的清除作用,且果肉粗多糖的清除效果优于果皮多糖。用回归分析贵长猕猴桃果肉粗多糖和果皮粗多糖清除
 ·的IC
50分别是12.4 μg/mL和84.1 μg/mL。据文献[12]报道,软枣猕猴桃粗多糖对
·的IC
50分别是12.4 μg/mL和84.1 μg/mL。据文献[12]报道,软枣猕猴桃粗多糖对
 ·的清除率低于50%,淫羊藿多糖清除
·的清除率低于50%,淫羊藿多糖清除
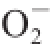 ·的IC
50是2.5 μg/mL
[23],由数据分析可见,贵长猕猴桃粗多糖清除
·的IC
50是2.5 μg/mL
[23],由数据分析可见,贵长猕猴桃粗多糖清除
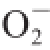 ·的能力优于软枣猕猴桃粗多糖,低于药用植物淫羊藿多糖。
·的能力优于软枣猕猴桃粗多糖,低于药用植物淫羊藿多糖。
2.4.2 清除·OH能力
采用Fenton反应检测贵长猕猴桃多糖清除·OH能力。利用H 2O 2与Fe 2+混合产生·OH,在体系内加入水杨酸捕捉·OH并产生有色物质,该物质在波长510 nm处有最大吸收。贵长猕猴桃果肉、果皮多糖清除·OH能力如图5所示。
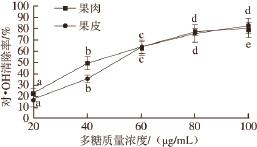
图5 贵长猕猴桃多糖对·OH的清除作用
Fig.5 Scavenging effects of kiwifruit polysaccharides against hydroxyl radical
由图5可知,在所选质量浓度范围内,贵长猕猴桃果肉多糖和果皮多糖对·OH的清除率均随着其质量浓度的增加而增大。在低质量浓度情况下果肉多糖清除·OH能力大于果皮多糖,但当质量浓度增加至60 μg/mL后果皮多糖清除·OH能力接近于果肉多糖并逐渐优于果肉多糖。回归分析分别计算出贵长猕猴桃果肉多糖和果皮多糖对·OH的IC 50值分别为41.3、50.8 μg/mL。优于文献[12]报道的软枣猕猴桃粗多糖对·OH的IC 50值66.8 μg/mL。由此可见,不同品种猕猴桃的多糖抗氧化能力存在着差异,具体原因需进一步深入研究。
本实验研究了贵长猕猴桃果肉多糖、果皮多糖的提取工艺,通过正交试验得到最优提取工艺参数,果肉多糖最优提取工艺参数为提取温度80 ℃、提取时间2 h、料液比1∶35(g/mL),在最佳提取条件下,果肉多糖提取率为1.74%;果皮多糖最优提取工艺参数为即提取温度70 ℃、提取时间2 h、料液比1∶25(g/mL),在最佳提取条件下,多糖提取率为1.16%。通过对贵长猕猴桃果肉粗多糖、果皮粗多糖体外抗氧化能力研究表明,二者对O 2 -·和·OH均具有很好的清除作用,果肉粗多糖清除O 2 -·和·OH的IC 50分别是12.4、41.3 μg/mL,果皮粗多糖清除两种自由基的IC 50分别是84.1、50.8 μg/mL,明显优于文献报道的刺梨多糖 [24]、软枣猕猴桃多糖 [12]、枸杞多糖 [25]的抗氧化能力,可能因为供试的多糖样品是粗多糖,混有VC、多酚等其他强抗氧化物质,具体原因有待进一步深入研究。
尤其值得注意的是,猕猴桃果皮粗多糖表现的优异抗氧化性,随着多糖质量浓度的增大,果皮粗多糖对·OH的清除能力甚至优于果肉粗多糖。在生产过程中,果皮多作为下脚料而丢弃,其中的粗多糖提取工艺简单、可重复性强,因而具有很高的开发利用前景。
参考文献:
[1] 刘晓燕, 王瑞, 梁虎, 等. 不同温度贮藏贵长猕猴桃采后生理和品质变化[J]. 江苏农业科学, 2015, 43(6): 264-267. DOI:10.15889/ j.issn.1002-1302.2015.06.086.
[2] 王涛, 赵谋. 多糖的研究进展[J]. 现代食品科技, 2007, 23(1): 103-106. DOI:10.3969/j.issn.1673-9078.2007.01.034.
[3] PAULINE M R, TIME E, PETER C, et al. Glycosytation and immune system[J]. Science, 2001, 291: 2370-2375. DOI:10.1126/ science.291.5512.2370.
[4] 朱晓霞, 罗学刚. 多糖提取与纯化技术应用进展[J]. 食品研究与开发, 2007, 28(3): 186-188. DOI:10.3969/j.issn.1005-6521.2007.03.056.
[5] KIHO T, MORIMOTO H, KOBAYASHI T, et al. Effect of a polysaccharide (TAP) from the fruiting bodies of Tremella auranitia on glucose metabolism in mouse liver[J]. Biotechnology Biochemistry, 2000, 64(2): 417-419. DOI:10.1271/bbb.64.417.
[6] 孟良玉, 邱松山, 兰桃芳, 等. 枸杞多糖的超声提取工艺优化及其抗氧化能力研究[J]. 安徽农业科学, 2009, 37(25): 12168-12170. DOI:10.3969/j.issn.0517-6611.2009.25.136.
[7] 杜超, 马立志, 刘彦修, 等. 不同厚度聚乙烯保鲜袋对贵长猕猴桃的贮藏效果[J]. 贵州农业科学, 2014, 42(11): 211-213. DOI:10.3969/ j.issn.1001-3601.2014.11.052.
[8] 王明力, 王文平, 周文美, 等. “贵长”猕猴桃低糖低甜度果脯护色及脱涩工艺的研究[J]. 食品工业科技, 2003, 24(1): 62-63. DOI:10.3969/j.issn.1002-0306.2003.01.027.
[9] 金方伦, 黎明, 韩成敏, 等. 贵长猕猴桃在黔北地区的生物学活性及丰产优质栽培技术[J]. 贵州农业科学, 2009, 37(10): 175-177. DOI:10.3969/j.issn.1001-3601.2009.10.058.
[10] 卢丹, 俞立超, 姚善泾. 中华猕猴桃果多糖的分离纯化与抗肿瘤试验研究[J]. 食品科学, 2005, 26(2): 213-218. DOI:10.3321/ j.issn:1002-6630.2005.02.048.
[11] 刘延吉, 刘金凤, 田晓艳, 等. 软枣猕猴桃多糖降血糖降血脂活性研究[J]. 食品与生物技术学报, 2012, 31(1): 86-90. DOI:10.3969/ j.issn.1673-1689.2012.01.013.
[12] 宣丽, 刘长江. 不同提取方法对软枣猕猴桃多糖单糖组成及抗氧化活性的影响[J]. 天然产物研究与开发, 2013, 25(9): 1260-1266. DOI:10.3969/j.issn.1001-6880.2013.09.022.
[13] 黄晓君, 聂少平, 王玉婷, 等. 铁皮石斛多糖提取工艺优化及其成分分析[J]. 食品科学, 2013, 34(22): 21-26. DOI:10.7506/spkx1002-6630-201322005.
[14] 张强, 牟雪姣, 周正义, 等. 洋葱多糖的提取及其抗氧化活性研究[J].食品与发酵工业, 2007, 33(1): 138-144. DOI:10.3321/j.issn:0253-990X.2007.01.036.
[15] 张紫叶, 杜萌萌, 张炜煜. 正交试验法优化长春胶囊的提取工艺[J]. 人参研究, 2015(4): 16-20. DOI:10.3969/ j.issn.1671-1521.2015.04.005.
[16] 李瑜, 许时婴. 蒜粉体外抗氧化活性研究[J]. 食品研究与开发, 2006, 27(1): 25-28. DOI:10.3969/j.issn.1005-6521.2006.01.009.
[17] RAMSY R. Superoxide- dependent formation of hydroxylation aromatic ompounds[J]. Analytical Biochmistry, 1981, 118: 328-335. DOI:10.1016/0003-2697(81)90590-X.
[18] YANG Yan, LIU Wanshun, HAN Baoqin, et al. Antioxidative properties of a newly synthesized -glucosamine-thiazolidine- 4(R)-carboxylic acid (GlcNH 2Cys) inmice[J]. Nutrition Research, 2006, 26:369-377. DOI:10.1016/j.nutres.2006.06.014.
[19] NICHOLA S, QUINTON J C. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry,1989, 28(4): 1057-1060. DOI:10.1016/0031-9422(89)80182-7.
[20] YEN G C, CHEN H Y. Antioxidant activity of various tea extracts in relation to their antimutagenicity[J]. Journal of Agricultural and Food Chemistry, 1995, 43: 27-32. DOI:10.1021/jf00049a007.
[21] CHEN H Y, YEN G C. Antioxidant activity and free radical scavenging capacity of extracts from guava (Psidium guajava L.) leaves[J]. Food Chemistry, 2007, 101: 686-694. DOI:10.1016/j.foodchem.2006.02.047.
[22] 周冉, 李淑芬, 张大成. 鹿茸提取物体外抗氧化活性分析[J]. 食品科学, 2009, 30(9): 33-38. DOI:10.3321/j.issn:1002-6630.2009.09.006.
[23] 付亮, 袁璟亚, 丁春邦, 等. 淫羊藿药渣中多糖的提取及其体外抗氧化活性评价[J]. 食品工业科技, 2016, 37(1): 116-120. DOI:10.13386/ j.issn1002-0306.2016.01.014.
[24] 简崇东. 刺梨药理作用的研究进展[J]. 中国医药指南, 2011, 29(9):38-42. DOI:10.3969/j.issn.1671-8194.2011.29.021.
[25] 高春燕, 田呈瑞. 枸杞多糖体外抗氧化特性研究[J]. 三峡大学学报(自然科学版), 2005, 27(5): 28-29. DOI:10.3969/j.issn.1672-948X.2005.05.020.
Extraction and Antioxidant Activity of Polysaccharides from Guichang Kiwifruit
WANG Jinhua
1,2, DU Chao
1,2, LIANG Chen
1,2, MA Lizhi
1,2, ZENG Jia
1
(1. College of Food and Pharmaceutical Engineering, Guiyang University, Guiyang 550005, China;2. Guizhou Engineering Research Center For Fruit Processing, Guiyang 550005, China)
Abstract:The extraction and antioxidant activity of polysaccharides from Guichang kiwifruit pulp or pericarp were investigated in this work. The optimization of the extraction parameters was investigated by using orthogonal array design. Polysaccharide content was determined by the anthranone-sulfuric acid method. The antioxidant activities of Guichang kiwifruit polysaccharides were tested by pyrogallol autoxidation and Fenton's oxidation reaction. The results showed that the optimum extraction conditions for kiwifruit pulp polysaccharides were found to be 2 h extraction at 80 ℃ with a solid-to-solvent ratio of 1:35 (g/mL) performed three times, and those for kiwifruit pericarp polysaccharides were determined as follows: three extraction cycles at 70 ℃ each for 2 h at a solid-to-solvent ratio of 1:25 (g/mL) . Under the optimized conditions, the yield of polysaccharide extracted from kiwifruit pulp and pericarp reached 1.74% and 1.16%, respectively. The polysaccharides from kiwifruit pulp and pericarp both had strong scavenging effects on superoxide anion and hydroxyl radicals with half inhibitory concentration (IC 50) of 12.4 and 41.3 μg/mL for pulp polysaccharides and 84.1 and 50.8 μg/mL for pericarp polysaccharides, respectively.
Key words:Guichang kiwifruit; pulp; pericarp; polysaccharide; extraction process; antioxidant activity
DOI:10.7506/spkx1002-6630-201620004
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2016)20-0019-05
引文格式:
王金华, 杜超, 梁晨, 等. 贵长猕猴桃多糖提取工艺及体外抗氧化功能[J]. 食品科学, 2016, 37(20): 19-23. DOI:10.7506/ spkx1002-6630-201620004. http://www.spkx.net.cn
WANG Jinhua, DU Chao, LIANG Chen, et al. Extraction and antioxidant activity of polysaccharides from Guichang kiwifruit[J]. Food Science, 2016, 37(20): 19-23. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620004. http://www.spkx.net.cn
收稿日期:2016-01-21
基金项目:贵州省科学技术基金项目(黔科合LH字[2014]7174号);贵州省教育厅自然科学研究项目(黔教合KY字[2013]199号;黔教合KY字[2014]309号);贵州省普通高等学校创新人才团队建设项目(黔教合人才团队字[2014]44号);食品科学与工程重点学科项目(黔学位合字ZDXK[2014]13号);贵州省果品加工、贮藏与安全控制协同创新中心项目(黔教合协同中心字[201306])
作者简介:王金华(1980—),女,高级实验师,硕士,研究方向为果蔬深加工。E-mail:292723451@qq.com