裴 斐,陶虹伶,蔡丽娟,魏琛琛,袁一鸣,杨文建,胡秋辉 *
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
摘 要:为研究辣木叶多酚超声辅助提取工艺,明确辣木叶多酚体外抗氧化活性,选取超声功率、超声时间、超声温度和料液比为考察指标,研究不同工艺参数对辣木叶多酚提取量的影响,并采用响应面法优化辣木叶多酚提取工艺。此外,研究辣木叶多酚还原力及其对DPPH自由基、超氧阴离子自由基清除能力。结果表明,超声辅助提取辣木叶多酚最优工艺为:超声时间19.5 min、料液比1∶30(g/mL)、超声温度20.2 ℃、超声功率250 W。在此条件下,辣木叶多酚提取量为(25.14±0.46) mg/g。辣木叶多酚具有较强的体外抗氧化活性,其还原力、DPPH自由基和超氧阴离子自由基清除能力分别达到同等质量浓度VC的81.25%、94.15%和75.05%。该研究为辣木叶多酚等生物活性成分高效制备与抗氧化剂的深度开发提供理论依据。
关键词:辣木叶;多酚;超声辅助提取;响应面;抗氧化
辣木(Moringa oleifera Lam.)又称鼓槌树,为辣木科辣木属多年生植物,原产于印度西北部喜马拉雅山南麓,目前广泛分布在印度、中国、日本等三十多个热带及亚热带的国家和地区 [1]。辣木营养丰富,含有多种蛋白质、维生素和矿物质,其中辣木氨基酸种类较大豆更为全面 [2],且VC、VA、钙、钾、铁等含量尤为突出 [3-4]。除此之外,辣木还具有抗氧化、降血压、降血脂、抑菌、减肥等功效 [5]。随着人们对于辣木营养与药用价值认识的不断深入,以及对于自身健康和饮食质量日益关注,越来越多的学者开始关注辣木营养与功能成分的综合开发和利用。
辣木叶多酚是辣木中重要的生物活性成分,据研究报道,辣木叶水提物或醇提物含有槲皮素、山奈酚、绿原酸等多酚类物质,具有显著的抑菌性、抗炎症以及免疫调节等活性 [6-7]。目前对辣木叶多酚的研究主要集中在提取工艺和功能活性验证方面,经典的提取方法主要是有机溶剂提取法、索氏提取法,但存在着产品安全性低、耗时长、提取率低等缺点。近年来,超声波技术因其理想的提取效果备受研究者关注,其优势在于用超声波提取多酚可利用其空化效应、机械振动作用、热效应等造成植物细胞壁的破碎,加快溶剂渗透速率,使有效成分迅速溶解到溶剂里,从而提高了活性成分的浸出率,还能避免一些热敏性成分由于温度过高而造成的破坏现象 [8]。目前,针对植物多酚的超声辅助提取技术已有较多报道,如房玉林等 [9]研究了石榴皮多酚超声辅助提取技术,优化并确定了最优提取工艺为料液比1∶20(g/mL)、超声功率100 W、提取时间20 min。朱德文等 [10]研究了超声辅助提取茶鲜叶中茶多酚提取工艺,证明了与传统水浴浸提相比,提取得率显著提高。Wang Wenjie等 [11]研究了超声辅助水果多酚提取工艺,研究证明超声通过在溶剂系统中分离聚合花色苷显著提升了水果中单体花青素的提取率。
响应面法是一种应用广泛的试验优化方法,它可以有效快速地确定多因子系统的最佳条件,已应用于多种优化实践中 [12-14]。Alessandro等 [12]研究了超声提取野樱莓多酚工艺,证明了超声辅助提取工艺是获得高抗氧化活性野樱莓多酚的良好提取手段。然而,关于辣木叶多酚的超声提取工艺及抗氧化活性评价研究较少。研究辣木叶功效成分高效制备提取技术,获得提取率高、生物活性高的辣木叶多酚具有重要的研究意义。
本实验以辣木叶超声辅助提取过程参数超声功率、超声时间、超声温度和料液比为考察因素,研究不同提取工艺参数对辣木叶多酚提取量的影响,通过响应面法优化辣木叶多酚超声辅助提取工艺。此外,研究了辣木叶多酚体外抗氧化活性,为辣木叶多酚等生物活性成分高效制备与抗氧化剂的深度开发提供理论依据。
1.1 材料与试剂
辣木茎叶,产自云南楚雄州,叶龄45 d,由楚雄宏桂绿色食品有限公司提供,新鲜辣木叶经除杂、清洗、晾晒至半干后,置于热风烘箱在60 ℃条件下进行干燥,烘干至水分含量6%以下,经粉碎机粉碎后,过80 目筛,密封避光保存于-18 ℃冰箱备用。
没食子酸标准品 中国药品生物制品鉴定所;碳酸钠(分析纯) 天津市科密欧化学试剂有限公司;Folin-Ciocalteu试剂(分析纯) 上海摩尔生化试验有限公司;VC、铁氰化钾、三氯乙酸、磷酸氢二钠、磷酸二氢钠(均为分析纯) 国药集团化学试剂有限公司;3635型96 孔紫外微孔板 美国Corning公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、Tris、EDTA-Na 2美国Sigma公司;乙醇、盐酸(均为分析纯) 南京化学试剂股份有限公司;氯化铁(分析纯) 上海光谱试剂有限公司;邻苯三酚(分析纯)天津市科密欧化学试剂有限公司。
1.2 仪器与设备
HH-4数控恒温水浴锅 国华电器有限公司;GB204电子分析天平 Mettler Toledo上海有限公司;WF-100型高速万能粉碎机 北京市永光明医疗仪器厂;101-3A电热鼓风干燥机 上海苏进仪器设备有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;QTR-3120超声波清洗机 天津市瑞普电子仪器公司;GL21M高速冷冻离心机 长沙英泰仪器有限公司;i-mark酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 辣木叶多酚含量测定
标准曲线的绘制:采用Folin-Ciocalteus比色法 [13]测定辣木叶中多酚类物质的含量。准确称取0.050 0 g没食子酸标准品,溶解并转移到250 mL容量瓶中,用蒸馏水定容、混匀,得到没食子酸标准液。分别取不同体积(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL)的没食子酸标准溶液各100 mL,分别加入双蒸水60 mL、Folin-Ciocalteu试剂3 mL,摇匀后静置3 min后,再加入3 mL质量分数10%的碳酸钠溶液,摇匀后在20 ℃水浴条件下反应1 h。最后分别定容至100 mL容量瓶中,在760 nm波长测定吸光度,并以没食子酸质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。通过标准曲线得到方程:Y=65.892X-0.0083,R 2=0.994 4。
辣木叶多酚含量测定:准确称取辣木叶粉样品2.000 g,按一定料液比加入蒸馏水,常温浸泡30 min后,采用超声波法进行提取。浸提液经冷却后在4 000×g转速条件下离心,收集上清液,测定其体积。吸取l.0 mL样品液于100 mL容量瓶中(记录稀释因子),加入60 mL蒸馏水,3 mL的Folin-Ciocalteu试剂,摇匀,放置3 min后再加入10%的碳酸钠溶液3 mL,摇匀,并在20 ℃水浴中反应l h后,用蒸馏水定容至刻度。以空白对照作为参比液,于760 nm波长处测定吸光度,并由标准曲线方程计算多酚含量。辣木叶多酚提取量计算参照陈纯等 [14]的方法,并略有改动,如公式(1)所示:
式中:c为辣木叶多酚质量浓度/(mg/mL);n为稀释因子;V为滤液体积/mL;m为样品质量/g。
1.3.2 单因素试验
前期研究报道表明,在多酚的超声波辅助提取过程中,多酚提取得率受超声功率、超声时间、超声温度和料液比提取工艺参数的影响 [15]。因此,以多酚提取量为考察指标,分别考察超声功率(200、250、300、350、400 W)、超声时间(10、15、20、25、30 min)、超声温度(20、30、40、50、60 ℃)和料液比(l∶30、l∶35、l∶40、1∶45、1∶50(g/mL))对辣木叶多酚提取量的影响。
1.3.3 响应面试验设计
根据单因素试验结果,以超声功率、超声时间、超声温度和料液比为关键工艺参数,设计四因素三水平Box-Behnken响应面试验,以辣木叶多酚提取量为考察指标,共设计5 个中心点和29 个不同组合的试验,试验因素水平设计如表1所示。
表1 响应面试验的因素与水平
Table1 Factors and levels of response surface experiments

因素编码水平-101超声时间/minX 1101520料液比(g/mL)X 21∶301∶351∶40超声温度/℃X 3203040超声功率/WX 4250300350
1.3.4 体外抗氧化实验
根据响应面法分析确定的辣木叶多酚的最优提取工艺进行辣木叶多酚提取,提取液经D101大孔树脂进行纯化,并通过70%乙醇溶液洗脱后,将乙醇溶剂回收后并冷冻干燥,得到辣木叶多酚冻干粉。将该样品配制不同质量浓度进行抗氧化活性实验。
配制质量浓度分别为62.5、125、250、500、1 000、2 000、4 000 μg/mL的辣木叶多酚溶液,对其进行总还原能力、DPPH自由基清除率和超氧阴离子自由基清除率的测定,以VC为阳性对照。
1.3.4.1 总还原力测定
参照袁娅等 [16]的方法并略作修改,取不同质量浓度的样品液1.0 mL,加入1.0 mL的磷酸缓冲液(0.2 mol/L,pH 6.6)和1.0 mL 1%铁氰化钾溶液,混合均匀后置于50 ℃的水浴锅中水浴20 min,随后取出冷却至室温,加入1.0 mL 10%的三氯乙酸溶液,室温放置10 min,再向其中加入1.0 mL蒸馏水及0.2 mL 0.1%的三氯化铁溶液混匀后反应10 min,使用酶标仪测定其在700 nm波长条件下的吸光度。
1.3.4.2 DPPH自由基清除率测定
表1 DPPH自由基清除实验加样表
Table1 DPPH sample tablee
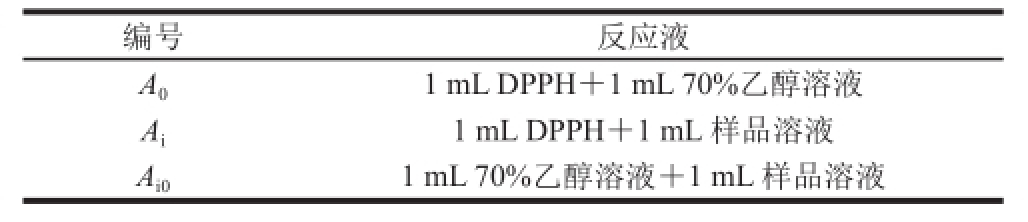
编号反应液A 01 mL DPPH+1 mL 70%乙醇溶液A i1 mL DPPH+1 mL 样品溶液A i01 mL 70%乙醇溶液+1 mL 样品溶液
参照Vattem等 [17]的方法并略作修改,配制0.2 mmol/L DPPH溶液和70%乙醇溶液备用。按表1加入试剂后置于室温条件下避光反应30 min,测定不同样品液在517 nm波长处的吸光度,并按公式(2)计算不同质量浓度样品液及VC溶液对DPPH自由基的清除率。
1.3.4.3 超氧阴离子自由基清除率测定
采用邻苯三酚自氧化法测定超氧阴离子自由基清除能力并参照盖玉红 [18]和陈晨等 [19]的方法。取不同质量浓度待测样品液1.0 mL,加入1.8 mL的Tris-HCl缓冲液(50 mmol/L,pH 8.2),在25 ℃条件下保温10 min,再加入100 μL预热好的0.01 mol/L邻苯三酚溶液,立即摇匀并在320 nm波长条件下每隔30 s测定1 次吸光度,总时间控制为4 min。用等体积蒸馏水替代样品液,10 mmol/L的HCl代替邻苯三酚溶液测定空白值。邻苯三酚自氧化速率记为A 0,可通过吸光度的斜率表示;加入辣木叶多酚样品后的邻苯三酚氧化速率记为A 1,通过公式(3)可计算出超氧阴离子自由基清除率。
1.4 数据分析
数据通过SPSS 18软件进行分析,ANOVA程序用于方差分析,当P<0.05时表示差异显著。最小显著差异法用于数据多重比较分析。数据以3 次独立样品测定结果的
 表示。
表示。
2.1 单因素试验结果
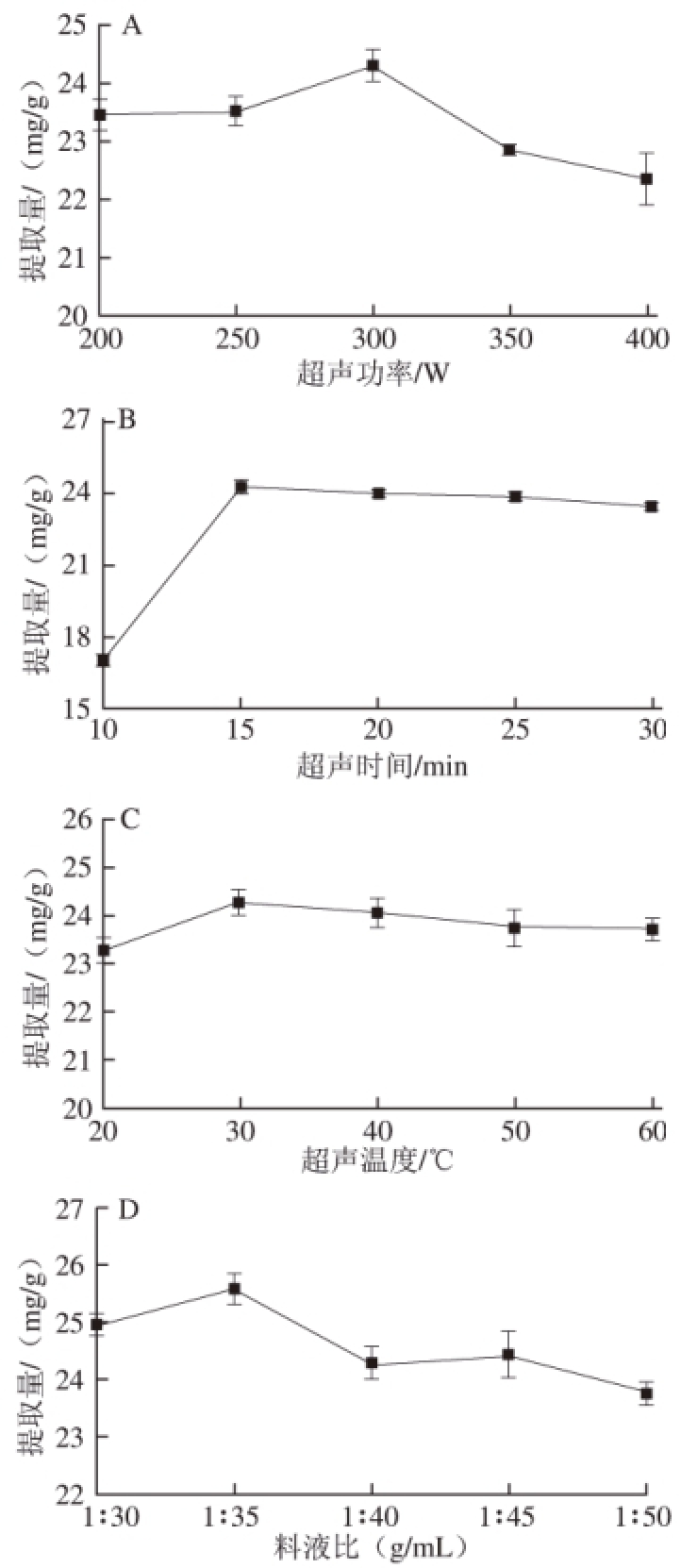
图1 超声功率(A)、超声时间(B)、超声温度(C)和料液比(D)对辣木叶多酚提取量的影响
Fig.1 Effect of ultrasonic power (A), extraction time (B), extraction temperature (C), and solid to liquid ratio (D) on extraction rate of polyphenols from Moringa oleifera Lam. leaves
由图1A可知,随着超声功率的增加,辣木叶多酚提取量呈现先上升再下降的趋势,并在超声功率300 W时达到最大。这可能是由于超声波引起的“空化效应”随着超声功率的增加而增加,导致酚类物质渗透速率加快 [20]。然而,当微波功率超过300 W后,过高的“空化效应”产生的高压环境会破坏辣木叶多酚的结构,同时杂质溶出增加,导致辣木叶多酚提取量的下降。
由图1B可知,超声时间在10~15 min,多酚提取量显著上升,在15 min以后辣木叶多酚得率趋于平稳。这可能是由于超声提取初期,细胞破碎程度迅速增加,使得浸提液中多酚含量不断增加。当超声15 min后,辣木叶多酚已基本溶出,因此含量并未发生显著变化 [8]。
由图1C可知,当超声温度上升至30 ℃时,辣木叶多酚提取量显著上升,但随着温度的进一步提升,提取量略有降低但变化并不显著。这是由于温度在一定范围内升高时,多酚物质的溶解度会增加,同时分子之间的粘滞度会有所下降,从而使更多的酚类物质溶出。但温度过高,会破坏酚类物质结构的完整性 [21]。
由图1D可知,料液比为1∶30~1∶35时,随着溶剂用量的增加,多酚提取量显著上升,这是由于质量浓度梯度增加有利于多酚提取物的溶出,但当料液比在1∶35后,辣木叶多酚却呈现了下降的趋势。这可能是由于辣木叶在提取过程中溶出了多糖等其他的物质,影响了辣木叶多酚的提取分离,导致多酚提取量的减少。
2.2 Box-Behnken试验设计及结果
根据单因素试验结果,本研究通过响应面法中的Box-Behnken试验设计对辣木叶多酚提取工艺进行优化。以辣木叶多酚提取量为响应值,进行四因素三水平Box-Behnken响应面优化试验。在29 个试验组合条件下,试验设计方案及结果如表2所示。
表2 Box-Behnken试验设计及其响应值
Table2 Box-Behnken design matrix and the response value
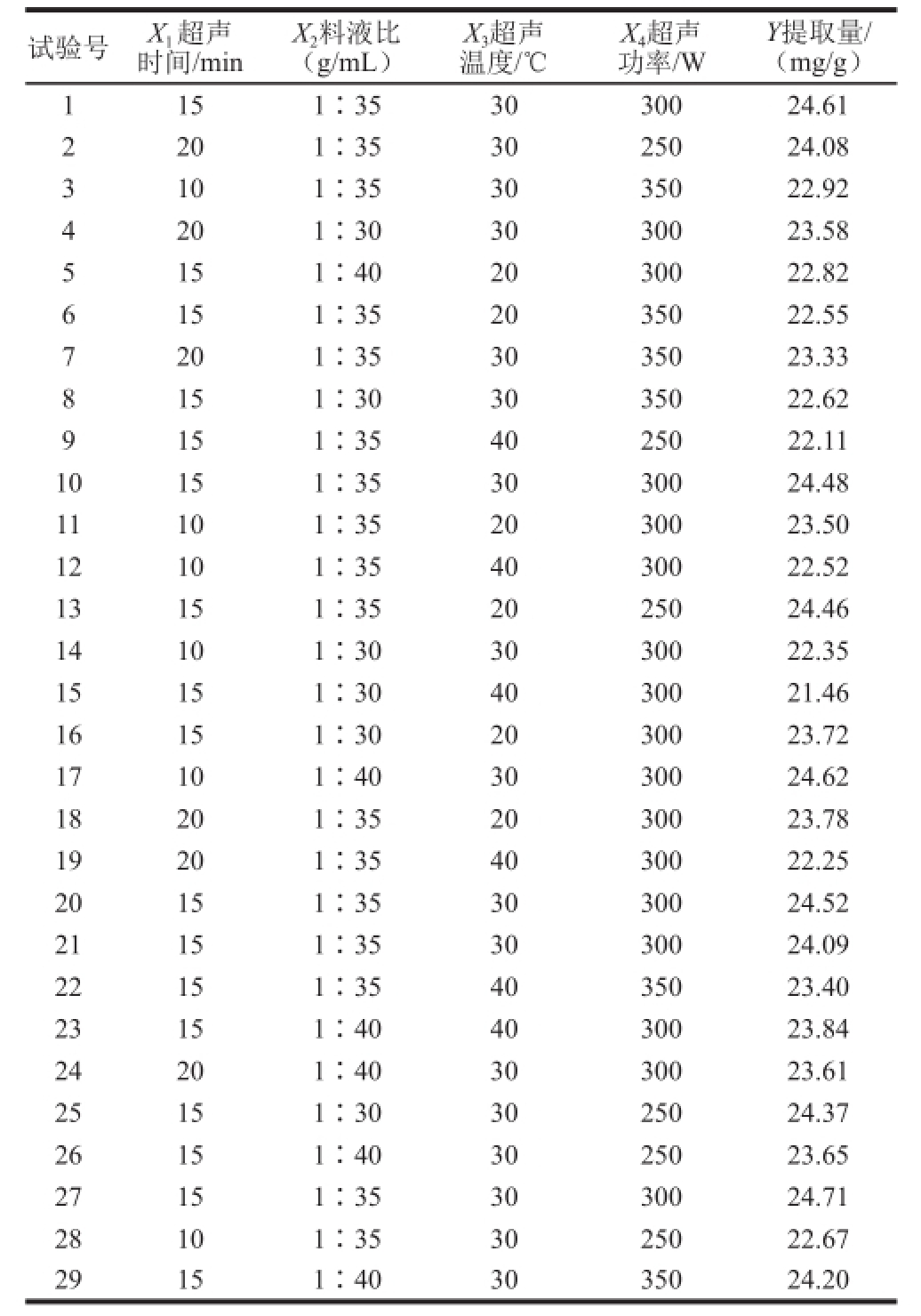
试验号X 1超声时间/min Y提取量/(mg/g)1151∶353030024.61 2201∶353025024.08 3101∶353035022.92 4201∶303030023.58 5151∶402030022.82 6151∶352035022.55 7201∶353035023.33 8151∶303035022.62 9151∶354025022.11 10151∶353030024.48 11101∶352030023.50 12101∶354030022.52 13151∶352025024.46 14101∶303030022.35 15151∶304030021.46 16151∶302030023.72 17101∶403030024.62 18201∶352030023.78 19201∶354030022.25 20151∶353030024.52 21151∶353030024.09 22151∶354035023.40 23151∶404030023.84 24201∶403030023.61 25151∶303025024.37 26151∶403025023.65 27151∶353030024.71 2 8101∶353025022.67 29151∶403035024.20 X 2料液比(g/mL)X 3超声温度/℃X 4超声功率/W
2.3 模型的建立及显著性分析
基于参数评估,运用Design-Expert V8.05b软件可得出响应值与被检变量之间的逻辑关系。对这些试验数据进行二次多元回归拟合,获得响应值与变量之间方程:
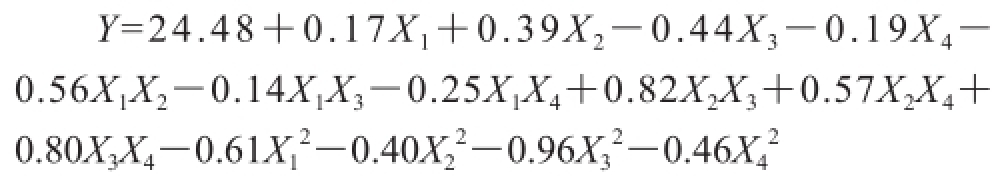
为检验建立模型的有效性,利用分析软件进一步对其进行分析,其中辣木叶多酚提取量系数显著性结果见表3,多元回归模型的方差分析结果见表4。
表3 辣木叶多酚得率拟合多元二次方程模型的方差分析
Table3 Analysis of variance for the fitted quadratic polynomial model of extraction rateo of polyphenols from Moringa oleifera Lam. leaves

注:*. P<0.05,差异显著;**. P<0.01,差异极显著。表4同。
来源系数评估标准误差方差和均方差P值显著性X 1超声时间 0.3510.353.070.101 7 X 2料液比1.8011.2715.930.001 3** X 3超声温度 2.3112.3120.370.000 5** X 4超声功率0.4510.453.940.067 2 X 1X 21.2511.2511.050.005 0** X 1X 30.07510.0750.660.430 6 X 1X 40.2510.252.230.157 4 X 2X 32.7012.7023.890.000 2** X 2X 41.3111.3111.540.004 3** X 3X 42.5512.5522.530.000 3** X 12.39 12.3921.120.000 4** X2 2 1.0511.059.260.008 8** X3 2 1.3811.3812.240.003 5** 5.9415.9452.48<0.000 1** X4 22
表4 多元回归模型方差分析表
Table4 Analysis of variance (ANOVA) for the quadratic polynomial model
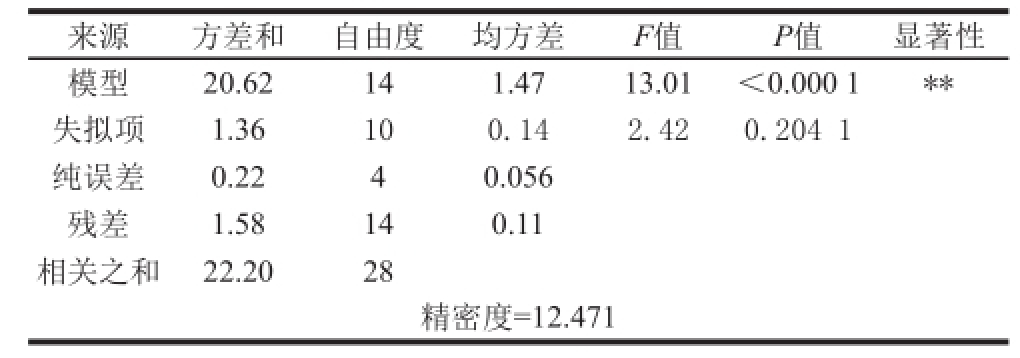
来源方差和自由度均方差F值P值显著性模型20.62141.4713.01<0.000 1**失拟项1.36100.142.420.204 1纯误差0.2240.056残差1.58140.11相关之和22.2028精密度=12.471
由表3可知,方程的一次项中X
2、X
3对辣木叶多酚提取量的影响极显著;交互项X
1X
2、X
2X
3、X
2X
4和X
3X
4对辣木叶多酚提取量的影响极显著。由此可知,各具体试验因素对响应值的影响并非是简单的线性关系。各因素之间均存在显著的交互作用。由表4可知,回归模型项极为显著,响应值的决定系数R
2达到0.928 6,说明模型的拟合度良好,表明通过该模型能够很好地对辣木叶多酚提取量做出预测。调整决定系数
 达到0.857 3,说明辣木叶多酚提取量模型分别能够在85.73%的程度上解释试验结果,仅有14.27%不能用该模型表示。模型失拟项不显著(P>0.05),进一步说明此模型的拟合度良好。离散系数表示试验的精确度
[22],本试验模型离散系数为1.43%,说明模型方程能够较好地反映真实值。综上所述,回归模型拟合程度良好,试验误差小,能够准确的分析和预测辣木叶多酚提取量。
达到0.857 3,说明辣木叶多酚提取量模型分别能够在85.73%的程度上解释试验结果,仅有14.27%不能用该模型表示。模型失拟项不显著(P>0.05),进一步说明此模型的拟合度良好。离散系数表示试验的精确度
[22],本试验模型离散系数为1.43%,说明模型方程能够较好地反映真实值。综上所述,回归模型拟合程度良好,试验误差小,能够准确的分析和预测辣木叶多酚提取量。
2.4 响应面分析
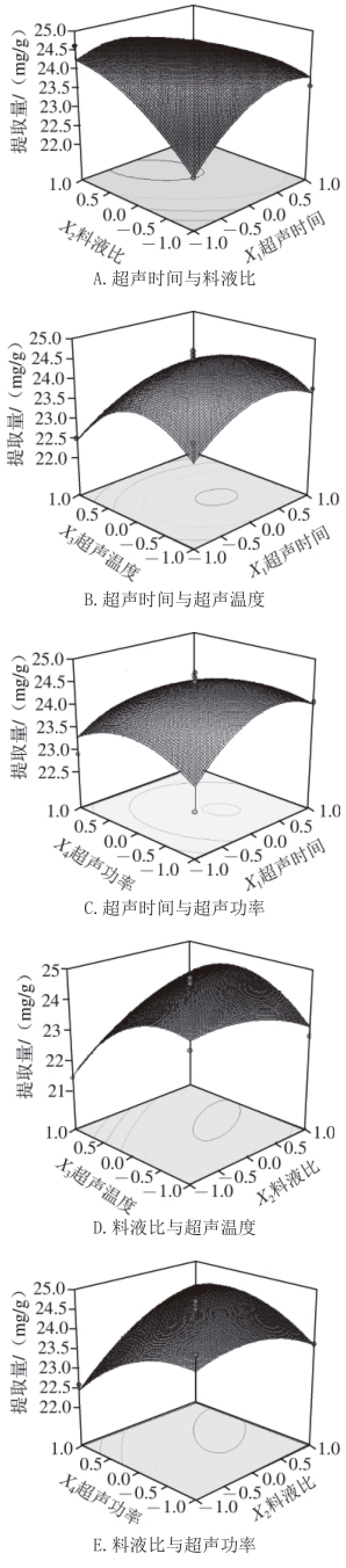
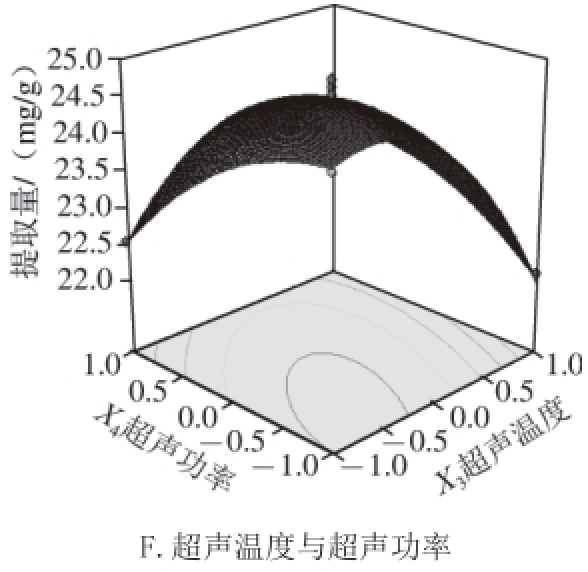
图2 各因素交互作用对辣木叶多酚提取量影响的响应面图
Fig.2 Response surface plots showing the effects of extraction condition on the extraction rateof polyphenols from Moringa oleifera Lam. leaves
响应面图是回归方程的形象描述,能够直观反映各个因素与响应值之间的关系以及两因素间交互作用的类型,然后进一步优化成生产条件 [23]。运用Design-Expert软件所获得的三维响应面图,由图2A可知,当料液比为1∶30(g/mL)时,随着超声时间的延长辣木叶多酚提取量不断上升而后逐渐趋于平稳,当料液比变化到1∶40(g/mL)时,辣木叶多酚提取量呈现先上升再下降的趋势,这与料液比单因素分析中结果一致,即在较高的溶剂用量条件下,辣木叶提取量出现下滑现象;由图2B、C可知,当超声时间一定时,辣木叶多酚提取量随超声温度的升高,呈现先上升后下降的趋势。而当超声温度或超声功率一定时,辣木叶多酚提取量呈现先上升后趋于平稳的趋势;图2D、E与图2A类似,当料液比为1∶30时,随着超声温度的升高或超声功率的增加辣木叶多酚提取量不断上升而后逐渐趋于平稳,当料液比变化到1∶40(g/mL)时,辣木叶多酚提取量随温度的升高或超声功率的增加呈现先上升再下降的趋势;由图2F可知,当一个因素值确定后,辣木叶多酚提取量随另一个因素值的增加而呈现先上升后下降的趋势。
2.5 提取参数优化及模型验证
运用Design-Expert软件求出被检变量的最优值。即最优提取工艺为超声时间19.5 min、料液比1∶30(g/mL)、超声温度20.2 ℃、超声功率250 W,此时辣木叶多酚提取量为25.60 mg/g。在此条件下,通过超声辅助提取法提取辣木叶多酚,3 次平行实验得出辣木叶多酚实际提取量为(25.14±0.46)mg/g,与理论值非常接近。因此,该多元二次回归方程能够准确对超声辅助提取辣木叶多酚提取量预测。在与超声辅助提取最优条件相同的温度(20.2 ℃)、料液比(1∶30)和时间(19.5 min)条件下,对辣木叶多酚采用传统水浴浸提法进行提取,3 次平行实验得出辣木叶多酚提取量仅为(12.33±0.84)mg/g。因此,与传统提取方法相比,通过本实验优化的超声辅助提取工艺对辣木叶多酚进行提取,其提取量能够提高1 倍以上。
2.6 体外抗氧化活性测定结果
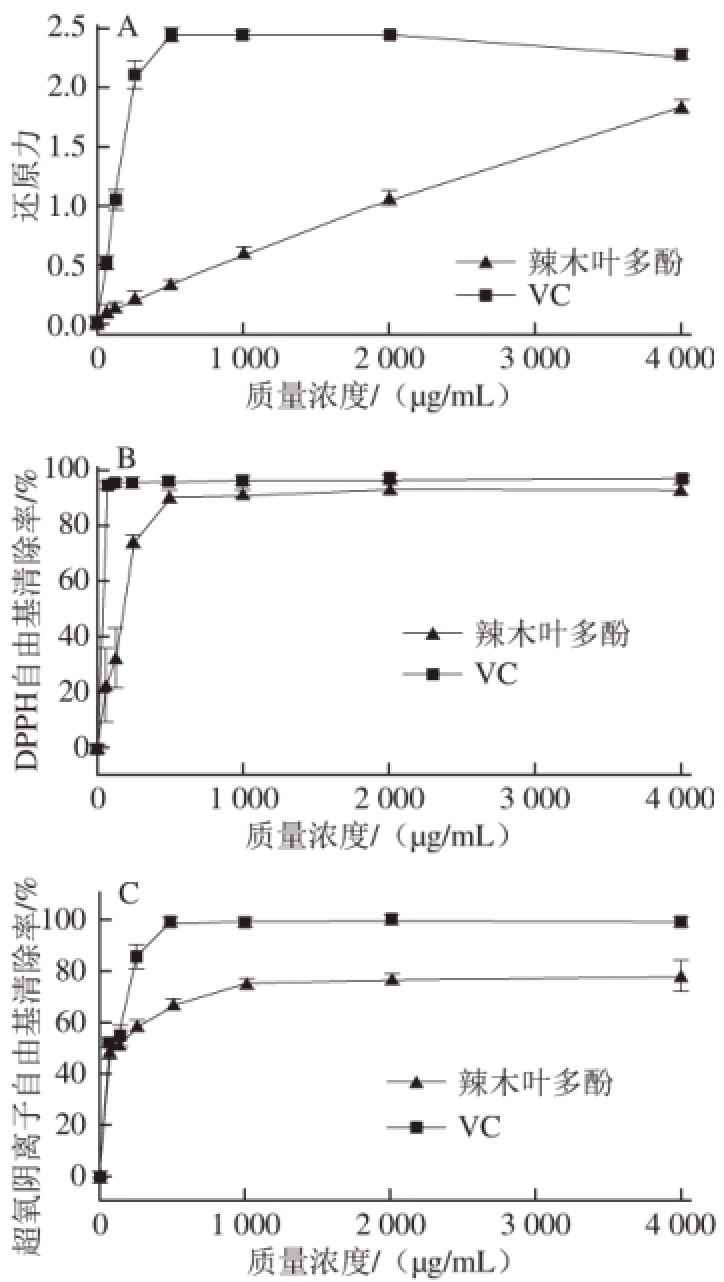
图3 辣木叶多酚的还原力(A)、DPPH自由基清除率(B)和超氧阴离子自由基清除率(C)测定结果
Fig.3 The reducing power (A), the DPPH radical scavenging activities (B)and the
 · scavenging effect (C) of polyphenols from Moringa oleifera Lam. leaves
· scavenging effect (C) of polyphenols from Moringa oleifera Lam. leaves
由图3 A可知,在辣木叶多酚质量质量浓度62.5~4 000 μg/mL的范围内,辣木叶多酚的还原力随着多酚质量质量浓度增加而增加,当多酚质量质量浓度处于最高点(4 000 μg/mL时),还原力(1.82±0.05)达到了同等质量浓度VC还原力(2.24±0.02)的81.25%,证明了辣木叶多酚具有良好的还原力。
由图3B可知,不同质量浓度的辣木叶多酚具有一定的DPPH自由基清除能力,半数清除质量浓度(EC 50)为159.75 μg/mL。其中当质量浓度在62.5~500 μg/mL范围内,DPPH自由基清除能力迅速上升,在辣木叶多酚质量质量浓度达到500 μg/mL时,DPPH自由基清除率高达(89.78±2.59)%,达到同等质量浓度VC的DPPH自由基清除率((95.36±0.72)%)的94.15%。当辣木叶多酚质量质量浓度高于500 μg/mL时,DPPH自由基清除率趋于平稳。
超氧阴离子自由基是反应性氧中间物的一种,其与羟基结合后的产物会对细胞DNA造成一定程度的损坏。因此,清除超氧阴离子自由基在抗氧化过程中起着重要的作用。由图3C可知,辣木叶多酚的超氧阴离子自由基EC 50值为79.05 μg/mL。随着辣木叶多酚质量质量浓度的升高,超氧阴离子自由基清除率升高,并在质量浓度达到1 000 μg/mL后趋于平稳,在此质量浓度条件下,辣木叶多酚的超氧阴离子自由基清除率高达(74.92±2.68)%,是同质量浓度VC超氧阴离子自由基清除率((99.83±0.01)%)的75.05%。
通过辣木叶多酚的体外抗氧化实验,证明了辣木叶多酚具有较强还原力、DPPH自由基清除能力和超氧阴离子自由基清除能力,是一种潜在的抗氧化剂。
在单因素试验的基础上,通过Box-Behnken响应面试验设计,优化得到了辣木叶多酚超声辅助提取最优工艺参数为超声时间19.5 min、料液比1∶30(g/mL)、超声温度20.2 ℃、超声功率250 W。在此条件下验证实验,辣木叶多酚提取量达到(25.14±0.46)mg/g,证明应用响应面法优化超声辅助提取辣木叶多酚是准确可行的。此外,通过体外抗氧化实验充分证明了辣木叶多酚具有较强的抗氧化活性,其还原力、DPPH自由基清除能力和超氧阴离子自由基清除能力分别达到同等质量浓度VC的81.25%、94.15%和 75.05%。该研究为辣木叶多酚进一步工业化生产以及辣木活性成分抗氧化剂的深度开发提供理论依据。
参考文献:
[1] 刘凤霞, 王苗苗, 赵有为, 等. 辣木中功能性成分提取及产品开发的研究进展[J]. 食品科学, 2015, 36(19): 282-286. DOI:10.7506/ spkx1002-6630-201519051.
[2] 段琼芬, 李迅, 陈思多, 等. 辣木营养价值的开发利用[J]. 安徽农业科学, 2008, 36(29): 12670-12672. DOI:10.3969/ j.issn.0517-6611.2008.29.058.
[3] 初雅洁, 符史关, 龚加顺. 云南不同产地辣木叶成分的分析比较[J].食品科学, 2016, 37(2): 160-164. DOI:10.7506/spkx1002-6630-201602028.
[4] MCBURNEY R P H, GRIFFIN C, PAUL A A, et al. The nutritional composition of African wild food plants: from compilation to utilization[J]. Journal of Food Composition and Analysis, 2004, 17(3/4): 277-289. DOI:10.1016/j.jfca.2004.03.008.
[5] 岳秀洁, 李超, 扶雄. 超声提取辣木叶黄酮优化及其抗氧化活性[J]. 食品工业科技, 2016, 37(1): 226-231. DOI:10.13386/ j.issn1002-0306.2016.01.037.
[6] SINGH R S G, NEGI P S, RADHA C. Phenolic composition, antioxidant and antimicrobial activities of free and bound phenolic extracts of Moringa oleifera seed fl our[J]. Journal of Functional Foods, 2013, 5(4): 1883-1891. DOI:10.1016/j.jff.2013.09.009.
[7] BAEK J, AHN J, JEGAL Y, et al. Antiproliferation and induction of apoptosis by Moringa oleifera leaf extract on human cancer cells[J]. Food and Chemical Toxicology, 2011, 49(6): 1270-1275. DOI:10.1016/ j.fct.2011.03.006.
[8] YANG W, YONG F, JIN L, et al. Optimization of ultrasonic extraction of Flammulina velutipes polysaccharides and evaluation of its acetylcholinesterase inhibitory activity[J]. Food Research International, 2011, 44(5): 1269-1275. DOI:10.1016/j.foodres.2010.11.027.
[9] 房玉林, 齐迪, 郭志君, 等. 超声波辅助法提取石榴皮中总多酚工艺[J].食品科学, 2012, 33(6): 115-118.
[10] 朱德文, 岳鹏翔, 袁弟顺, 等. 超声波辅助浸提茶鲜叶中茶多酚的工艺研究[J]. 中国农机化学报, 2011(1): 112-115. DOI:10.3969/ j.issn.1006-7205.2011.01.029.
[11] WANG W J, JUNG J Y, TOMASINO E, et al. Optimization of solvent and ultrasound-assisted extraction for different anthocyanin rich fruit and their effects on anthocyanin compositions[J]. LWT-Food Science and Technology, 2016, 72: 229-238. DOI:10.1016/j.lwt.2016.04.041.
[12] ALESSANDRO L G, KRIAA K, NIKOV I, et al. Ultrasound assisted extraction of polyphenols from black chokeberry[J]. Separation and Purification Technology, 2012, 93: 42-47. DOI:10.1016/ j.seppur.2012.03.024.
[13] 陈东明. 超声提取玫瑰花渣中多酚、多糖的工艺研究[D]. 郑州: 郑州大学, 2014.
[14] 陈纯, 王延圣, 罗自生, 等. 响应面法优化超声波提取甘蔗皮多酚的工艺条件[J]. 中国食品学报, 2013, 13(7): 95-100. DOI:10.16429/ j.1009-7848.2013.07.011.
[15] BELWAL T, DHYANI P, BHATT I D, et al. Optimization extraction conditions for improving phenolic content and antioxidant activity in Berberis asiatica fruits using response surface methodology(RSM)[J]. Food Chemistry, 2016, 207: 115-124. DOI:10.1016/ j.foodchem.2016.03.081.
[16] 袁娅, 许佳妮, 张剑飞, 等. 不同培养基对平菇营养成分、多酚含量及其抗氧化活性的影响[J]. 食品科学, 2014, 35(13): 137-142. DOI:10.7506/spkx1002-6630-201413026.
[17] VATTEM D A, LIN Y T, LABBE R G, et al. Antimicrobial activity against select food-borne pathogens by phenolic antioxidants enriched in cranberry pomace by solid-state bioprocessing using the food grade fungus Rhizopus oligosporus[J]. Process Biochemistry, 2004, 39(12):1939-1946. DOI:10.1016/j.procbio.2003.09.032.
[18] 盖玉红. 灵芝多糖抗氧化活性研究[D]. 长春: 吉林农业大学, 2007.
[19] 陈晨, 胡文忠, 田沛源, 等. 超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J]. 食品科学, 2014, 35(2): 12-17. DOI:10.7506/ spkx1002-6630-201402003.
[20] 林士惠, 易运红, 龙梓, 等. 超声波辅助提取香蕉叶多糖工艺的优化[J]. 南方农业学报, 2014, 45(2): 295-298. DOI:10.3969/ j:issn.2095-1191.2014.2.295.
[21] HAMMI K M, JDEY A, ABDELLY C, et al. Optimization of ultrasound-assisted extraction of antioxidant compounds from Tunisian Zizyphus lotus fruits using response surface methodology[J]. Food Chemistry, 2015, 184: 80-89. DOI:10.1016/j.foodchem.2015.03.047.
[22] 陈书勤, 黄健泉, 黄康宁, 等. 响应曲面法在优化果糖和葡萄糖色谱分离中的应用[J]. 轻工科技, 2011(10): 20-21. DOI:10.3969/ j.issn.1003-2673.2011.10.010.
[23] KADAM S U, TIWARI B K, SMYTH T J, et al. Optimization of ultrasound assisted extraction of bioactive components from brown seaweed Ascophyllum nodosum using response surface methodology[J]. Ultrasonics Sonochemistry, 2015, 23: 308-316. DOI:10.1016/j.ultsonch.2014.10.007.
Optimization of Polyphenols from Moringa oleifera Lam. Leaves by Ultrasound-assisted Extraction Using Response Surface Methodology and Their Antioxidant Activities
PEI Fei, TAO Hongling, CAI Lijuan, WEI Chenchen, YUAN Yiming, YANG Wenjian, HU Qiuhui*
(Collaborative Innovation Center for Modern Grain Circulation and Safety, Key Laboratory of Grains and Oils Quality Control and Processing, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
Abstract:In order to obtain the best ultrasound-assistedextracting conditions for polyphenols from Moringa oleifera Lam. leaves, and clarified their antioxidant activities. Response surface methodology was used to explore the effects of ultrasonic power, extraction time, extraction temperature, and solid to liquid ratio on extraction rate. Moreover, the reducing power, the DPPH radical scavenging activities and the
 · scavenging effect of polyphenols from Moringa oleifera Lam. leaves were also investigated. The results showed that the best extraction condition were as follows: the extraction time of 19.5 min, the solid to liquid ratio of 1:30 (g/mL), the extraction temperature of 20.2 ℃, and the ultrasonic power of 250 W. Under the optimal extractions, the extraction rate of phycoerythrin was (25.14 ± 0.46) mg/g. In addition, the polyphenols from Moringa oleifera Lam. leaves. have strong anti-oxidative, and the reducing power, the DPPH radical scavenging activities and the
· scavenging effect of polyphenols from Moringa oleifera Lam. leaves were also investigated. The results showed that the best extraction condition were as follows: the extraction time of 19.5 min, the solid to liquid ratio of 1:30 (g/mL), the extraction temperature of 20.2 ℃, and the ultrasonic power of 250 W. Under the optimal extractions, the extraction rate of phycoerythrin was (25.14 ± 0.46) mg/g. In addition, the polyphenols from Moringa oleifera Lam. leaves. have strong anti-oxidative, and the reducing power, the DPPH radical scavenging activities and the
 · scavenging effect were 81.25%, 94.15% and 75.05% of L-ascorbic acid, respectively. This research could provide the theoretical basis for higher preparation and antioxidants development of Moringa oleifera Lam. leaves.
· scavenging effect were 81.25%, 94.15% and 75.05% of L-ascorbic acid, respectively. This research could provide the theoretical basis for higher preparation and antioxidants development of Moringa oleifera Lam. leaves.
Key words:Moringa oleifera Lam.; polyphenols; ultrasound-assisted extraction; response surface methodology; antioxidant activities
DOI:10.7506/spkx1002-6630-201620005
中图分类号:TS210.4
文献标志码:A
文章编号:1002-6630(2016)18-0024-07
引文格式:
裴斐, 陶虹伶, 蔡丽娟, 等. 响应面试验优化辣木叶多酚超声辅助提取工艺及其抗氧化活性[J]. 食品科学, 2016, 37(20):24-30. DOI:10.7506/spkx1002-6630-201620005. http://www.spkx.net.cn
PEI Fei, TAO Hongling, CAI Lijuan, et al. Optimization of polyphenols from Moringa oleifera Lam. leaves by ultrasoundassisted extraction using response surface methodology and their antioxidant activities[J]. Food Science, 2016, 37(20):24-30. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620005. http://www.spkx.net.cn
收稿日期:2016-05-15
基金项目:江苏高校优势学科建设工程资助项目(PAPD)
作者简介:裴斐(1987—),男,讲师,博士,研究方向为农产品加工及储藏工程。E-mail:feipei87@163.com
*通信作者:胡秋辉(1962—),男,教授,博士,研究方向为食品营养与化学。E-mail:qiuhuihu@njue.edu.cn