张 昕 1,高 天 1,宋 蕾 1,张 林 1,江 芸 2,李蛟龙 1,高 峰 1, *,周光宏 1
(1.南京农业大学动物科技学院,江苏省动物源食品生产与安全保障重点实验室,江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095;2.南京师范大学金陵女子学院,江苏 南京 210097)
摘 要:研究不同相对湿度(relative humidity,RH)条件下低温(4 ℃)解冻对鸡胸肉品质特性的影响,以RH为65%~81%的冷藏库解冻(4 ℃)为对照组,以4 种不同RH解冻为实验组(4 ℃;RH 80%、85%、90%、95%),分析不同RH条件下低温解冻对鸡胸肉解冻时间、汁液流失率、pH值、色泽、质构、蛋白溶解度、细菌总数、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量及水分分布的影响。结果表明,随着解冻环境RH的提高,解冻时间不断延长,RH 90%和RH 95%低温解冻组鸡胸肉解冻汁液流失率、T 23峰面积比显著低于对照组(P<0.05),L*值、a*值、硬度、咀嚼性、总蛋白溶解度、肌浆蛋白溶解度、T 22峰面积比显著高于对照组(P<0.05),RH 95%组细菌总数和TVB-N含量显著高于RH 90%组(P<0.05)。综合分析,RH 90%低温解冻可有效缓解解冻过程中肌肉蛋白质变性,降低解冻后汁液流失并有一定改善肉色的作用,解冻后鸡胸肉品质最佳。
关键词:相对湿度;低温解冻;鸡胸肉;肉品质
随着肉品工业的不断发展和人们生活水平的日益提高,消费者对肉品质的要求越来越高,不仅要求种类多样化,而且更多地开始关注肉质营养价值和食用安全性。冷冻是贮藏原料肉最便捷、有效的方式之一,但在加工或食用前都需要解冻。解冻是使冻结肉中的冰晶融化成水并被肉吸收而恢复到冻结前新鲜状态的工艺过程,可视为冻结的逆过程 [1]。冻结及冻藏过程中,冰晶的形成和增长破坏肉的超微结构同时增大敏感蛋白结构周围的溶质质量浓度 [2],因此在解冻时常出现汁液流失、色泽变化、质地改变、风味损失、脂质氧化、肌球蛋白变性以及由于变性和聚集的肌原纤维蛋白交联形成二硫键而影响肌肉蛋白质水合能力等问题,这些变化使肉品质量下降 [3]。另外,解冻过程中,原料肉上微生物的繁殖和酶促或非酶促等不良反应的发生,也严重影响肉品质 [4]。
解冻过程中肉品质下降不可避免,但适宜的解冻方式可大大降低该损失。目前最常用的解冻方式有空气解冻和水解冻,但由于传统解冻方式耗时较长、物料解冻不均匀、内外温差大,易引起品质下降,近些年推出了一些新型的食品解冻技术,如低频解冻、超声波解冻、微波解冻等 [5-7]。尽管新型解冻技术能有效的提高解冻速率,但各解冻方式仍具有一定的局限性。因此,筛选合适的解冻方法及优化解冻工艺对改善解冻后肉品质显得尤为重要。
由于低温条件下解冻能有效阻止微生物繁殖以及减少肉品质量损失,冷藏库解冻已被广泛的使用在肉类工业中。Xia Xiufang等 [8]研究指出所有的解冻方式均可引起猪肉脂质和蛋白质氧化,并通过比较5 种不同解冻方式解冻猪背最长肌,得出冷藏库解冻对肉品质不利影响最小的结论。在此基础上,Li Yin等 [9]进一步改进解冻工艺,提出了低温高湿变温解冻方式,冻肉在2 ℃→6 ℃→2 ℃低变温,湿度保持在(97±3)%进行解冻,该解冻方式可有效降低汁液流失、改善色泽和质构、缓解蛋白氧化,但该工艺对设备要求较高,目前还处于实验阶段。徐世明等 [10]通过响应面分析法优化冷冻牛肉解冻工艺获得最佳条件为解冻时间16.5 h、解冻温度(17±1)℃、解冻湿度92%。张进忠等 [11]对不同RH环境下香蕉苗进行梯度低温处理,研究指出低温处理时高相对湿度(relative humidity,RH)抗失水能力强于中RH,并能减缓细胞膜渗漏率和丙二醛的增加。由以上研究可见,低温高湿条件下解冻或贮藏有利于改善产品品质。但前期研究中,不同学者 [9-13]对环境RH控制不尽相同,而解冻室空气RH不仅是助长微生物繁殖的重要因素,也是影响肉干耗的重要原因。空气RH越大,微生物活动能力越强,但RH增大有利于降低肉样水分蒸发,减少干耗 [14]。究竟鸡胸肉解冻时最适宜环境RH为多少,目前国内外领域还鲜有提及,有待进一步研究。因此,本实验致力于解冻RH参数筛选,探究其对鸡胸肉食用品质、蛋白变性程度及水分分布等的影响,以期改善解冻后鸡胸肉品质,从而为企业选择合适的解冻方式,制定科学的生产规程提供理论指导和技术支持。
1.1 材料与试剂
新鲜鸡胸肉(约225 g) 苏食公司。
轻质氧化镁 上海统亚化工科技发展有限公司;其他试剂均为分析纯 南京寿德实验器材有限公司。
1.2 仪器与设备
108防水型食品温度计 德国Testo公司;HPX-160BSH-Ⅲ型恒温恒湿培养箱 上海新苗医疗器械制造有限公司;BC/BD-220SC型海尔电冰柜 青岛海尔特种电冰柜有限公司;HI 9125便携式防水型pH测定仪 意大利Hanna公司;TA.XT Plus型物性测试仪英国Stable Micro Systems公司;CR-400型色差仪 日本柯尼卡美能达控股公司;TY-80B型脱色摇床 南京普阳科学仪器研究所;BS224S型电子天平、2-16KL型高速冷冻离心机 德国Sartorius公司;MicroMR微型核磁共振成像分析仪 上海纽迈电子有限公司。
1.3 方法
1.3.1 冻结处理
将新鲜鸡胸肉(约225 g)去除表面脂肪、筋膜及可分离结缔组织,沿垂直肌纤维方向将鸡胸肉切成质量相近、形状相似((75±5)g,6 cm×7 cm×1.5 cm)的肉块,随机分为5 组,每组3 份肉样,经聚乙烯自封袋包装后-20 ℃冻结并冻藏7 d。
1.3.2 解冻处理
冻藏结束后,以传统冷藏库解冻方式(4 ℃,RH 65%~81%)为对照,其余4组肉样分别放在温度恒定4 ℃,RH为80%、85%、90%、95%条件下的恒温恒湿培养箱中进行解冻,直至肉块中心温度达到2 ℃左右为解冻终点。解冻结束后进行相关指标的测定。实验重复3 次。
1.3.3 指标测定
1.3.3.1 解冻时间的测定
将温度传感器探头插入样品中心部位,测定肉样中心温度随解冻时间的变化情况,时刻观察鸡胸肉的中心温度,以肉块中心温度(2±0.5)℃为解冻终点,记录解冻时间。
1.3.3.2 解冻汁液流失率的测定
解冻前将样品从自封袋中取出称质量(M 1),解冻完全后,用滤纸擦干样品表面汁液,再次称质量(M 2),解冻汁液流失率计算如式(1)所示:
1.3.3.3 蒸煮汁液流失率的测定
参考余小领等 [15]的方法。将解冻好的肉沿肌纤维方向切50 g左右,称质量(M 3),放入透明蒸煮袋中,放置在80 ℃水浴15 min,取出后流水冷却至室温,用滤纸擦拭肉块表面直到没有明显汁液存在,称质量(M 4),蒸煮汁液流失率计算如式(2)所示:
1.3.3.4 pH值的测定
参考余小领等 [15]的方法。采用经过校准后的pH计进行测定,将0.5 g肉样剪碎,加入4.5 mL超纯水(提前煮沸冷却)摇匀后,将电极直接插入其中,待稳定后读数。每个样品重复测定3 次,取平均值。
1.3.3.5 肉色的测定
在解冻完全的每块肉上取3 个点,用色差仪测定L*、a*、b*值。其中L*值表示亮度,a*值表示红度,b*值表示黄度。
1.3.3.6 质构的测定
将冷却至室温的熟肉样品用取样器取出垂直肌纤维方向高20 mm、直径20 mm的圆柱体。质构仪测试参数如下:测试前探头下降速率2.0 mm/s,测试速率1.0 mm/s,测试后探头回程速率5.0 mm/s,下压样品形变量50%,时间间隔5 s;触发力5.0 g,触发类型自动,探头类型为P/50。
1.3.3.7 蛋白溶解度的测定
参考Joo等 [16]的方法测定肌浆蛋白、肌原纤维蛋白和总蛋白的溶解度。具体步骤如下:
总蛋白溶解度:0.25 g肉样加5 mL冰预冷的0.1 mol/L磷酸钾缓冲液(pH 7.2,其中碘化钾浓度为1.1 mol/L)中,冰浴匀浆3 次(6 500 r/min,20 s),4 ℃条件下摇动抽提过夜。1 500×g、4 ℃离心20 min,上清液用考马斯亮蓝测定蛋白质量浓度。溶解度表示为mg/g。
肌浆蛋白溶解度:0.25 g肉样加5 mL冰预冷的0.025 mol/L磷酸钾缓冲溶液(pH 7.2),冰浴匀浆3 次(6 500 r/min,20 s),4 ℃条件下摇动抽提过夜。1 500×g、4 ℃离心20 min,上清液用考马斯亮蓝测定蛋白质量浓度。溶解度表示为mg/g。
肌原纤维蛋白溶解度为总蛋白溶解度与肌浆蛋白溶解度之差。
1.3.3.8 细菌总数的测定
细菌总数检测参照GB/T 4789.2—2010《食品微生物学检验:菌落总数》 [17]测定。
1.3.3.9 挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量的测定
参照邓辉萍等 [18]的方法。准确称取2 g绞碎的肉样,置于20 mL蒸馏水中浸渍30 min,并不时振摇,取滤液置于冰箱备用。吸取上述滤液10 mL于消化管中,加入10 mL 1%氧化镁悬浮液,立即将消化管放入凯式定氮仪蒸馏口处,旋紧,关好安全门,仪器进行自动蒸馏、滴定和计算。TVB-N含量表示为mg/100 g。
1.3.3.10 核磁共振弛豫时间(T 2)及T 2峰面积比的测定
参考Gao Tian等 [19]的方法。准确称取剔除筋腱和脂肪的解冻胸肌2 g,放入直径为15 mm的核磁管中,进行核磁测定。T 2测定在纽曼台式脉冲核磁共振分析仪PQ001上进行,采用CPMG序列进行测量。主要参数设定如下:测试时温度32 ℃;共振频率22 MHz,模拟增益20;每个样品重复采样16 次,τ值(90 °脉冲和180 °脉冲之间的时间)150 μs;重复间隔时间3 000 ms。
1.4 数据处理与统计分析
运用SPSS 20.0软件对实验所得数据进行单因素方差分析、Duncan's多重检验比较,显著性水平设置为0.05,实验结果绘图采用Origin 8.5软件,数据结果表示为±s。
2.1 低温解冻RH对鸡胸肉保水性的影响
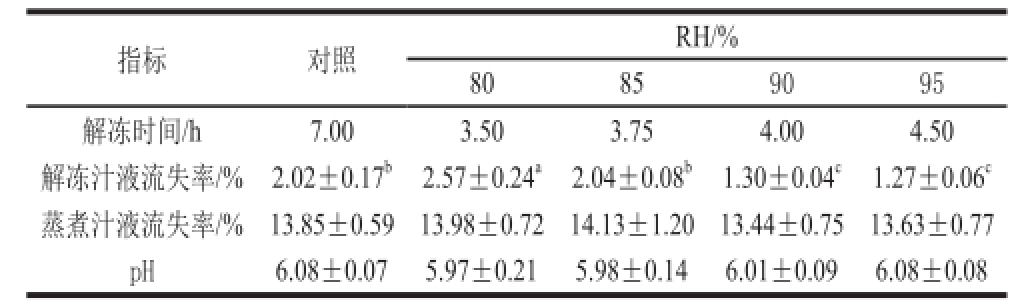
表1 低温解冻RH对鸡胸肉解冻时间、汁液流失和pH值的影响
Table1 Effect of low temperature thawing methods on the thawing time, drip loss and pH of chicken breast
注:同行不同字母表示差异显著(P<0.05);n=9。下同。
指标对照RH/% 80859095解冻时间/h7.003.503.754.004.50解冻汁液流失率/%2.02±0.17 b2.57±0.24 a2.04±0.08 b1.30±0.04 c1.27±0.06 c蒸煮汁液流失率/%13.85±0.5913.98±0.7214.13±1.2013.44±0.7513.63±0.77 pH6.08±0.075.97±0.215.98±0.146.01±0.096.08±0.08
由表1可以看出,随着环境RH的增加,解冻时间不断延长,不同RH环境下低温解冻鸡胸肉所需时间依次为:RH 80%<RH 85%<RH 90%<RH 95%。不同RH环境下低温解冻对鸡胸肉汁液流失有显著影响,随着RH的提高,鸡胸肉解冻汁液流失率逐渐降低,RH达到90%时,其解冻汁液流失率显著低于前两组和对照组(P<0.05),RH继续增大,其解冻汁液流失率变化不显著(P>0.05)。不同RH环境下低温解冻对鸡胸肉蒸煮汁液流失率无显著影响(P>0.05),Huff-Lonergan等 [20]指出,由于一些风味成分如某些氨基酸或核苷酸随解冻汁液一起流失,解冻后肉样的可接受程度会有所降低。本实验中,RH 90%和RH 95%时解冻汁液流失率显著低于其他组,但解冻时间延长,原因可能是高RH环境下解冻,保护肉样蛋白水合面,有利地降低了其表面水分蒸发,减少干耗 [21],但同时也在一定程度上影响了解冻速率。而肉样在冻结过程中,冰晶对肌肉组织造成了损伤,会导致解冻肉蒸煮汁液流失率的不同变化。
pH值对保水性的影响本质是蛋白质分子的静电荷效应。静电荷既是蛋白质分子吸引水分的强有力中心,同时增加了蛋白质分子间的静电斥力,使其结构松散,留下容水空间 [22]。Leygonie等 [2]指出,冷冻解冻过程可能会引起肌肉矿物质及小分子蛋白质混合物随解冻汁液一起流失,进而改变肉中的离子平衡,从而使pH值有轻微下降。由表1可知,各RH条件下解冻,肉pH值变化不大,均保持在5.9~6.1之间,未达显著水平(P>0.05)。结果表明,高湿条件下低温解冻对解冻后肉样pH值影响不大。
2.2 低温解冻RH对冻结鸡胸肉色泽(L*、a*、b*)的影响
表2 低温解冻RH对冻结鸡胸肉色泽(L
**、a
**、b
*)的影响
Table2 Effect of low temperature thawing methods on the color(L
*, a
*and b
*) of chicken breast

指标对照RH/% 80859095 L*49.15±1.57 b51.74±1.85 a53.34±2.28 a53.42±1.90 a53.53±2.07 aa*2.20±0.20 b2.31±0.21 ab2.38±0.21 ab2.42±0.14 a2.44±0.14 ab*6.31±0.436.31±0.426.32±0.356.34±0.426.62±0.46
由表2可知,与对照4 ℃冷藏库解冻相比,低温高湿各组L*值均显著升高(P<0.05);RH 90%、RH 95%组的a*值显著高于对照组(P<0.05)。各处理间b*值差异均不显著(P>0.05)。在一定范围内,L*值越大说明肉样光泽度越好;a*值越大说明肉颜色越好,肉越新鲜;b*值越高说明肉越不新鲜 [23]。解冻会降低鸡胸肉色泽的新鲜度,但低温高湿组较对照组色泽好,这表明高湿环境下解冻相对冷藏库解冻能减缓解冻过程中的色泽劣变,原因可能是由于高湿解冻环境下,降低了肉样表面水分蒸发,保护解冻肉样蛋白水合面,抑制解冻过程中肉的氧化 [21];但随RH越来越大,微生物的活动能力也逐渐加强,从而对解冻肉样的新鲜度有所影响。邸静等 [13]采用8 种解冻方式解冻牛肉,研究发现低温高湿(4 ℃,RH 80%)解冻方式可显著提高亮度值,与本实验结果相一致。
2.3 低温解冻RH对鸡胸肉质构特性的影响
解冻后鸡胸肉质构变化分析包括硬度、黏附性、弹性、凝聚性、胶黏性、咀嚼性、回复力等质构特性 [24]。由表3可以看出,与对照相比,随RH的增加,解冻后鸡胸肉硬度、胶黏性、咀嚼性逐渐增大,RH 90%时,硬度、咀嚼性达差异显著(P<0.05)。而解冻环境RH的不同,对弹性、回复力并没有显著影响(P>0.05)。常海军等 [25]指出,冻结肉经解冻后其硬度降低,且不同解冻方式之间存在显著或极显著变化。关文强等 [12]研究指出在高RH冰箱(温度4~6 ℃,RH 85%~96%)内贮藏青菜和西芹,可降低蔬菜失水及保持硬度作用明显。张春晖等 [21]指出,咀嚼性是一项综合评价参数,反映了鸡胸肉从咀嚼状态到吞咽状态所需能量,一定范围内,其值越大说明肉样口感方面对应的“咬感”就越好。表3结果显示,实验组RH 90%与RH 95%解冻后鸡胸肉硬度、咀嚼性显著高于对照组,这表明RH达到90%情况下低温解冻,能有效改善解冻鸡胸肉的质构特性。
表3 低温解冻RH对鸡胸肉质构特性的影响
Table3 Texture profile analysis (TPA) characteristics of chicken breast with low temperature thawing methods
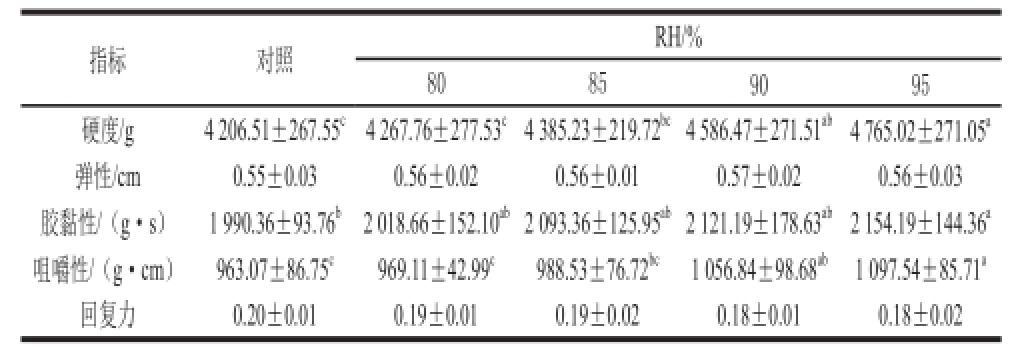
指标对照RH/% 80859095硬度/g4 206.51±267.55 c4 267.76±277.53 c4 385.23±219.72 bc4 586.47±271.51 ab4 765.02±271.05 a弹性/cm0.55±0.030.56±0.020.56±0.010.57±0.020.56±0.03胶黏性/(g·s)1 990.36±93.76 b2 018.66±152.10 ab2 093.36±125.95 ab2 121.19±178.63 ab2 154.19±144.36 a咀嚼性/(g·cm)963.07±86.75 c969.11±42.99 c988. 53±76.72 bc1 056.84±98.68 ab1 097.54±85.71 a回复力0.20±0.010.19±0.010.19±0.020.18±0.010.18±0.02
2.4 低温解冻RH对鸡胸肉蛋白溶解度的影响
表4 低温解冻RH对鸡胸肉蛋白溶解度的影响
Table4 Effect of low temperature thawing methods on the solubility of chicken breast proteins
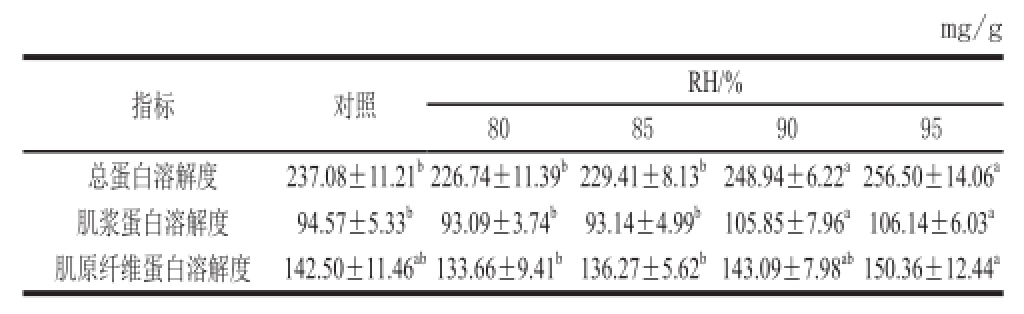
mg/g指标对照RH/% 80859095总蛋白溶解度237.08±11.21 b226.74±11.39 b229.41±8.13 b248.94±6.22 a256.50±14.06 a肌浆蛋白溶解度94.57±5.33 b93.09±3.74 b93.14±4.99 b105.85±7.96 a106.14±6.03 a肌原纤维蛋白溶解度142.50±11.46 ab133.66±9.41 b136.27±5.62 b143.09±7.98 ab150.36±12.44 a
评价蛋白质变性程度最常用指标之一就是蛋白质溶解度。由表4可知,3 种蛋白溶解度RH达90%时,达到显著水平(P<0.05)。与对照组相比,RH 90%和RH 95%时,总蛋白溶解度和肌浆蛋白溶解度均显著提高(P<0.05);但3 组间肌原纤维蛋白溶解度差异并不显著(P>0.05)。维持肌肉组织结构完整性的蛋白分子作用力主要是氢键、极性键相互作用、静电作用、疏水作用,还包括二硫键。鸡胸肉冻结-解冻过程促进了肌纤维的收缩,提高了蛋白质去折叠及变性程度,表现在蛋白质可提取性降低、盐溶性蛋白质溶解性变差 [1]。另外,有研究 [16]结果显示,肌浆蛋白溶解度、肌原纤维蛋白溶解度和总蛋白溶解度与汁液流失率的相关系数分别达到-0.72、-0.52和-0.64,结合4 种不同状态肉样PSE肉(肉色苍白,肉质松软,有渗出物)、RSE肉(肉色粉红,肉质松软,有渗出物)、RFN肉(肉色粉红,质地粗硬,无渗出物)和DFD肉(色泽深暗,质地粗硬,肌肉干燥)及其3 类蛋白质溶解性的差异,认为肌浆蛋白溶解度对肉的保水性有较大影响,这与本实验实验结果相一致。
2.5 低温解冻RH对鸡胸肉新鲜度的影响
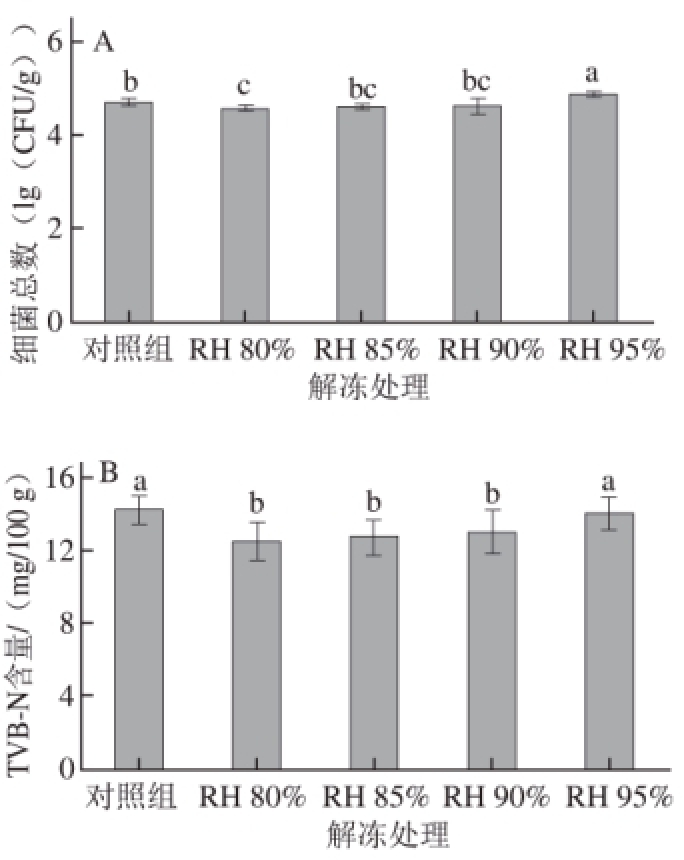
图1 低温解冻RH对鸡胸肉细菌总数(A)和TVB-N含量(B)的影响
Fig.1 Effect of low temperature thawing methods on the TBC (A) and TVB-N (B) of frozen chicken breast
小写字母不同表示差异显著(P<0.05);n=9。
如图1A所示,不同RH环境下低温解冻对鸡胸肉细菌总数有显著影响。随着RH的提高,解冻后鸡胸肉细菌总数显著升高,RH 95%时,细菌总数显著高于其他3 组和对照组(P<0.05)。在解冻的过程中,随着肉样温度的升高和环境RH的增大,微生物活动能力加强;肉自身的生化反应继续进行,使得解冻后肉的成分和感官特性发生变化,继而产生大量对人体有害的物质 [26]。
由图1B可知,RH 80%、RH 85%、RH 90%组TVB-N含量均显著低于对照组(P<0.05);RH 95%组TVB-N含量显著高于其他3 个实验组(P<0.05)。TVB-N含量是指动物性食品由于酶和细菌的作用,在贮藏过程中,使蛋白质分解而产生氨、伯胺、仲胺及叔胺等碱性含氮物质 [27]。黎园园 [26]指出,腐败菌的生长繁殖是导致TVB-N产生的主要因素。TVB-N含量越高,其腐败程度越严重,肌肉组织发粘,散发出不愉快的异味。
2.6 低温解冻RH对鸡胸肉水分分布及组成的影响
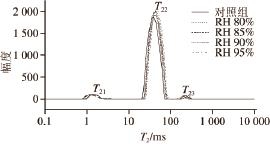
图2 低温解冻RH对鸡胸肉T
2的影响
Fig.2 Effect of low temperature thawing methods on the T
2relaxation time of chicken breast
表5 低温解冻RH对冻结鸡胸肉T
2峰面积比的影响
Table 5 Effect of low temperature thawing methods on the T
2peak area ratio of chicken breast

%峰面积比对 照RH/% 80859095 T 213.88±0.153.96±0.224.07±0.213.86±0.363.84±0.15 T 2294.66±0.16 b94.60±0.23 b94.57±0.25 b95.34±0.36 a95.42±0.17 aT 231.46±0.05 a1.43±0.12 ab1.35±0.13 b0.80±0.06 c0.74±0.03 c
通过低场核磁共振T 2值测定,可分析低温解冻RH对鸡胸肉中水分分布及组成的影响。从图2可以看出,解冻后的鸡胸肉T 2曲线上共出现3 个峰,第一个峰出现在1~5 ms,为T 21,约占总峰面积的3%~5%,在24~100 ms内出现一个较大的峰T 22,约占总面积的94%~96%,在100~350 ms处还有一个小峰T 23,约占总面积的0.5%~1.5%。
由表5可知,低温解冻RH对冻结鸡胸肉T 21峰面积比无显著影响(P>0.05)。RH 90%和RH 95%两种解冻方式T 22峰面积比显著高于其他3 组(P<0.05),T 23峰面积比显著低于其他3 组(P<0.05),但RH 90%与RH 95%两种解冻方式T 22、T 23峰面积比无显著差异(P>0.05)。
肌肉中的水分以3 种状态存在:结合水、不易流动水和自由水。以不易流动水为主,占总水分80%以上,存在于纤丝、肌原纤维及膜之间。通常肌肉系水力的变化主要由不易流动水决定,而这部分水的可保持性主要取决于肌原纤维蛋白的网状结构及其所带静电荷的多少 [14]。解冻可导致肌肉中部分不易流动水“态变”为自由水,自由水是解冻过程中汁液流失的直接来源 [28]。利用低场核磁共振技术,通过T 2横向驰豫(图2)可检测不同RH解冻下鸡胸肉中水分分布及组成的变化,驰豫时间越长,水与底物结合的越疏松,其中T 21表征结合水,与肌肉结合最为紧密,T 22表征不易流动水,T 23表征的是自由水 [29]。由表5可知,RH 90%与RH 95%两种解冻方式自由水含量显著低于其他3种解冻方式(P<0.05),这表明与其他3 种解冻方式相比,RH 90%与RH 95%两种解冻方式能降低解冻过程中肌肉水分态变,从而降低汁液流失率。其原因可能是随着解冻时间的延长,蛋白质氧化导致水与蛋白质分子之间的结合作用力减弱,从而使肌肉中与蛋白质结合程度较低的一部分不易流动水转变成自由水,而RH 90%与RH 95%两种解冻方式的高湿环境在解冻肉样表面形成一层水化膜,阻止肉样与氧气的接触,降低了解冻过程中的蛋白质氧化程度,改善鸡胸肉保水性,从而减少汁液流失 [28]。另外,有研究 [30-31]发现,T 22峰面积与肉的保水性呈正相关,与本实验结果相似。
本实验中,与4 ℃冷藏库解冻相比,低温高湿解冻工艺可显著提高冻结鸡胸肉的L*值、a*值(P<0.05),有效改善解冻后鸡胸肉的色泽。针对不同高湿条件下低温解冻,RH 90%、RH 95%明显优于 其他两组,但RH 95%低温解冻后细菌总数和TVB-N含量显著升高(P<0.05),且环境所需RH越大,供水供能需求越大,能耗越高。综上所述,RH 90%低温解冻可有效缓解解冻中肌肉蛋白变性,降低解冻后汁液流失并有一定改善肉色的效果,解冻后鸡胸肉品质最佳。
参考文献:
[1] 施雪, 夏继华, 卢进峰, 等. 冻结、解冻过程对肌肉品质的影响[J].食品工业, 2012, 33(7): 21-24.
[2] LEYGONIE C, BRITZ T J, HOFFMAN L C. Meat quality comparison between fresh and frozen/thawed ostrich M. iliofibularis[J]. Meat Science, 2012, 91(3): 364-368. DOI:10.1016/j.meatsci.2012.02.020.
[3] SRIKET P, BENJAKUL S, VISESSANGUAN W, et al. Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei)muscle[J]. Food Chemistry, 2007, 104(1): 113-121. DOI:10.1016/ j.foodchem.2006.11.004.
[4] 尤瑜敏. 冻结食品的解冻技术[J]. 食品科学, 2001, 22(8): 87-90. DOI:10.3321/j.issn:1002-6630.2001.08.026.
[5] DAI Y, MIAO J, Y UAN S, et al. Colour and sarcoplasmic protein evaluation of pork followin g water bath and ohmic cooking[J]. Meat Science, 2013, 93(4): 898-905. DOI:10.1016/j.meatsci.2012.11.044.
[6] MILES C A, MORLEY M J, RENDELL M. High power ultr asonic thawing of frozen foods[J]. Journal of Food Engineeri ng, 1999, 39(2):151-159. DOI:10.1016/S0260-8774(98)00155-1.
[7] 崔瑾, 农绍庄, 谷小慧, 等. 冻藏黄花鱼微波解冻条件的研究[J].食品科技, 2012, 37(3): 69-72.
[8] XIA X F, KONG B H, LIU J, et al. Influence of different thawing meth ods on physicochemical ch anges and protein oxidation of porcine longissimus muscle[J]. LWT-Food Science and Technology, 2012, 46(1): 280-286. DOI:10.1016/j.lwt.2011.09.018.
[9] LI Y, JIA W, ZHANG C H, et al. Fluctuated low temperature combined with high-humidity thawing to reduce physicochemical quality deterioration of beef[J]. Fo od and Bioprocess Technology, 2014, 7(12):3370-3380. DOI:10.1007/s1194 7-014-1337-3.
[10] 徐世明, 赵瑞连, 郭光平, 等. 响 应面分析法优化冷冻肉解冻工艺[J]. 农产品加工(创新版), 2012(7): 54-57. DOI:10.3969/ j.issn.1671-9646.2012.07.034.
[11] 张进忠, 韦华芳, 林贵美, 等. 不同RH环境下香蕉苗对低温胁迫响应[J]. 农学学报, 2011(11): 7-12. DOI:10.3969/ j.issn.1007-7774.20 11.09.00 2.
[12] 关文强, 陶晓彦, 张娜, 等. 高湿度冰箱对青菜和西芹的保鲜效果[J].农业工程学报, 2009(4): 265-269.
[13] 邸静, 靳烨. 不同解冻方法对牛肉品质的 影响[J]. 食品工业, 2015, 36(1): 174-177.
[14] 周光宏 , 徐庆莲. 肉品学[M]. 北京: 中国农业出版社, 1999.
[15] 余小领, 李学斌, 赵良, 等. 常规冷冻冻藏对猪肉保水性和组织结构的影响[J]. 农业工程学报, 2008, 24(12): 264-268. DOI:10.3321/j.iss n:1002-6819.2008.12.054.
[16] JOO S T, KAUFFMAN R G, KIM B, et al. The relationship of sarcoplasmic and myofi brillar protein solubility to colour and waterholding capacity in porcine longissimus muscle[J]. Meat Science, 1999, 52(3): 291-297. DOI:10.1016/S0309-1740(99)00005-4.
[17] 卫生部. GB 4789.2—2010 食品微生物学检验: 菌落总数测定[S]. 北京: 中国标准出版社, 2010.
[18] 邓辉萍, 林凯, 张红宇, 等. 肉类中的挥发性盐基氮的自动定氮仪快速测定法[J]. 职业与健康, 2005, 21(6): 838-839. DOI:10.3969/ j.issn.1004-1257.2005.06.024.
[19] GAO T, LI J L, ZHANG L, et al. Effect of different tumbling marinade treatments on the water status and protein properties of prepared pork chops[J]. Journal of the Science of Food and Agriculture, 2015, 95(12): 2494-2500. DOI:10.1002/jsfa.6980.
[20] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of waterholding capacity of meat: the role of postmortem biochemical and structural changes[J]. Meat Science, 2005, 71(1): 194-204. DOI:10.1016/j.meatsci.2005.04.022.
[21] 张春晖, 李侠, 李银, 等. 低温高湿变温解冻提高羊肉的品质[J]. 农业工程学报, 2013, 29(6): 267-273. DOI:10.3864/ j.issn.0578-1752.2009.03.029.
[22] 周光宏, 罗欣, 徐幸莲, 等. 肉品加工学[M]. 北京: 中国农业出版社, 2009.
[23] 夏秀芳, 孔保华, 郭园园, 等. 反复冷冻-解冻对猪肉品质特性和微观结构的影响[J]. 中国农业科学, 2009, 42(3): 982-98 8. DOI:10.3864/ j.issn.0578-1752.2009.03.029.
[24] ICIER F, IZZETOGLU G T, BOZKURT H, et al. Effects of ohmic thawing on histological and textural properties of beef cuts[J]. Journal of Food Engineering, 2010, 99(3): 360-365. DOI:10.1016/ j.jfoodeng.2010.03.018.
[25] 常海军, 唐翠, 唐春红. 不同解冻方式对猪肉品质特性的影响[J]. 食品科学, 2014, 35(10): 1-5. DOI:10.7506/spkx1002-6630-201410001.[26] 黎园园. 解冻猪肉腐败机理及解冻措施优化研究[D]. 上海: 上海理工大学, 2010.
[27] 朱民望. 冷冻储藏和反复解冻对鸡肉品质的影响研究[D]. 乌鲁木齐: 新疆农业大学, 2012.
[28] 李银. 蛋白氧化对肌肉保水性的影响机制研究[D]. 北京: 中国农业科学院, 2014.
[29] BERTRAM H C, PURSLOW P P, ANDERSEN H J. Relationship between meat structure, water mobility, and distribution: a low-fi eld nuclear magnetic resonance study[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 824-829. DO I:10.1021/jf010738f.
[30] STRAADT I K, RASMUSSEN M, ANDERSEN H J, et al. Aginginduced changes in microstructure and water distribution in fresh and cooked pork in relation to water-holding capacity and cooking loss-A combined confocal laser scanning microscopy (CLSM) and low-fi eld nuclear magnetic resonance relaxation study[J]. Meat Science, 2007, 75(4): 687-695. DOI:10.1016/j.meatsci.2006.09.019.
[31] BERTRAM H C, ANDERSEN H J, KARLSSON A H. Comparative study of low-fi eld NMR relaxation measurements and two traditional methods in the determination of water holding capacity of pork[J]. Meat Science, 2001, 57(2): 125-132. DOI:10.1016/S0309-1740(00)00080-2.
Effects of Low Temperature Thawing under Different Humidity Conditions on the Quality Characteristics of Chicken Breast
ZHANG Xin
1, GAO Tian
1, SONG Lei
1, ZHANG Lin
1, JIANG Yun
2, LI Jiaolong
1, GAO Feng
1,*, ZHOU Guanghong
1
(1. Key Laboratory of Animal Origin Food Production and Safety Guarantee of Jiangsu Province, Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control, College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Ginling College, Nanjing Normal University, Nanjing 210097, China)
Abstract:The effects of low temperature (4 ℃) thawing under different relative humidity (RH) conditions on the quality characteristics of chicken breast were investigated. Low temperature refrigerator thawing (4 ℃; RH 65%-81%) was taken as the control group, and four different humidity (4 ℃; RH 80%, RH 85%, RH 90% and RH 95%) thawing methods were set as the experimental groups. The differences in thawing time, drip loss, pH, color, texture, protein solubility, total bacterial count(TBC), and total volatile basic nitrogen (TVB-N) and water distribution were analyzed among fi ve thawing samples. The results showed that with increasing RH thawing time, thawing drip loss and T 23peak area ratio in the RH 90% and RH 95% groups were signifi cantly lower than those of the control group (P < 0.05), whereas L* value, a* value, hardness, chewiness, total protein solubility, sarcoplasmic protein solubility, and T 22peak area ratio in both experimental groups were signifi cantly higher (P < 0.05). Moreover, signifi cantly higher TBC and TVB-N content were observed for the RH 95% group (P < 0.05). In conclusion, the best quality of chicken breast could be obtained through RH 90% low temperature thawing method, which could effectively decrease muscle protein denaturation, reduce thawing drip loss and improve the color in thawing process.
Key words:relative humidity (RH); low temperature thawing; chicken breast; meat quality
DOI:10.7506/spkx1002-6630-201620041
中图分类号:TS251.5
文献标志码:A
文章编号:1002-6630(2016)20-0241-06
引文格式:
张昕, 高天, 宋蕾, 等. 低温解冻相对湿度对鸡胸肉品质的影响[J]. 食品科学, 2016, 37(20): 241-246. DOI:10.7506/ spkx1002-6630-201620041. http://www.spkx.net.cn
ZHANG Xin, GAO Tian, SONG Lei, et al. Effects of low temperature thawing under different humidity conditions on the quality characteristics of chicken breast[J]. Food Science, 2016, 37(20): 241-246. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201620041. http://www.spkx.net.cn
收稿日期:2016-03-27
基金项目:“十二五”国家科技支撑计划项目(2012BAD28B03)
作者简介:张昕(1992—),女,硕士研究生,研究方向为肉品质量安全控制。E-mail:xinxinzhang1919@163.com
*通信作者:高峰(1970—),男,教授,博士,研究方向为肉品质量安全控制。E-mail:gaofeng0629@sina.com