
图1 CHP的合成途径
Fig.1 Scheme of CHP synthesis
樊红秀,刘婷婷,刘鸿铖,任华华,张艳荣 *
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:将高温高压技术应用于玉米环(组氨酸-脯氨酸)二肽(cyclo(His-Pro),CHP)的制备,以玉米蛋白水解物为原料,在水相溶液中采用高温高压法对其进行环化,合成CHP。通过单因素试验考察反应温度、底物质量浓度、反应时间和KHCO 3浓度对CHP提取量的影响,应用响应面试验设计对高温高压环化反应条件进行优化。结果表明最佳反应条件为反应温度125.9 ℃、反应压力0.25 MPa、底物质量浓度20.5 mg/mL、KHCO 3浓度0.16 mol/L、反应时间5.3 h,此条件下CHP提取量可达6.58 mg/g。采用超高效液相色谱-串联质谱法对水解物中的CHP进行进一步鉴定,结果表明制备的玉米CHP与预期结构相符。
关键词:玉米蛋白;环(组氨酸-脯氨酸)二肽;高温高压法;环化反应
环(组氨酸-脯氨酸)二肽(cyclo(His-Pro),CHP)是一种内源性环二肽,广泛分布于人和动物的组织和体液中 [1],在哺乳动物体内表现出多种生理活性,例如缓解酒精的麻醉作用 [2]、避免自由基和外伤诱发的神经元死亡 [3]、降低食欲 [4]、调节血糖代谢 [5]等。CHP是促甲状腺素释放激素的代谢产物,相关研究过程中大量的CHP从某些食物蛋白水解物中被分离出来,如酪蛋白、鱼、虾以及大豆蛋白等 [6-7],这些CHP被认为是由蛋白质通过热处理或酶解作用释放出的组氨酸-脯氨酸(His-Pro)或脯氨酸-组氨酸(Pro-His)二肽发生非酶促环化而形成的 [8]。食物蛋白源CHP因其安全性高、来源广泛、成本低廉以及较强的生理活性而受到研究者们的关注,已成为生物活性肽领域的研究热点。
玉米是三大粮食作物之一,我国玉米年产量正常年产量为2.12亿 t左右,约占世界总产量的四分之一 [9]。玉米蛋白粉是玉米淀粉加工中的副产物,其蛋白含量高达50%~60%。玉米蛋白粉水溶性差,缺乏色氨酸、赖氨酸等人体必需的氨基酸,严重限制其在食品工业中的应用。目前在国内玉米蛋白粉主要作为低价饲料蛋白出售,未充分发挥玉米蛋白的粮食属性,造成人类食物资源的浪费 [10-11]。利用GenBank数据库对已收录的玉米蛋白进行氨基酸序列分析,发现玉米γ-醇溶蛋白、谷蛋白以及球蛋白的一级结构中富含His-Pro和Pro-His序列 [12],是制备高附加值CHP的良好来源。环二肽的传统合成方法主要有固相法和溶剂回流法 [13],存在产率低、反应时间长、有机溶剂消耗量大等缺点。近年来出现了利用高温高压法、微波辐射法等新技术合成环二肽的文献报道 [14-15],取得了令人满意的结果。高温高压技术具有高效、廉价、操作简单、绿色环保等特点,可大幅度提高反应速度和产率。本研究将高温高压技术应用于玉米CHP的合成中,以玉米黄粉为起始原料,经蛋白酶水解得到富含His-Pro和Pro-His二肽的玉米蛋白水解物后,在高温高压条件下直接对其进行环化,制备CHP。重点考察了高温高压环化反应条件,并采用超高效液相色谱-串联质谱仪对产物中CHP的结构进行鉴定,旨在促进CHP活性肽的开发与应用、提高玉米蛋白的附加值、促进玉米精深加工业良性发展。
1.1 材料与试剂
玉米黄粉(蛋白含量55.76%) 黄龙食品工业有限公司;碱性蛋白酶(酶活286 000 U/mL)、风味蛋白酶(酶活247 000 U/g)(均为食品级) 丹麦诺维信公司;耐高温α-淀粉酶(酶活20 000 U/g)、葡萄糖苷酶(酶活120 000 U/g)(均为食品级) 无锡杰能科生物工程有限公司;CHP标准品(纯度98%) 上海吉尔生化有限公司;乙腈(色谱纯) 美国Fisher公司;三氟乙酸(trifl uoroacetic acid,TFA,纯度98%) 美国Sigma Aldrich公司;屈臣氏蒸馏水 广州屈臣氏有限公司;KHCO 3(分析纯) 北京化工厂。
1.2 仪器与设备
LDZM-80KCS-Ⅱ立式压力蒸汽灭菌器 上海申安医疗器械厂;Acquity H-Class超高效液相色谱仪 美国Waters公司;超高效液相色谱-质谱联用仪(Accela UPLC色谱系统和LTQ XL线性离子阱质谱仪,配有电喷雾电离源和Xcalibur工作站) 美国Thermo Fisher公司;HA121-50-02超临界萃取装置 江苏南通华安超临界萃取有限公司;PHS-3BW电脑数显酸度计 上海理达仪器厂;DZKW-4电子恒温水浴锅 北京市中兴伟业仪器有限公司;Alpha 1-4 LDplus冻干机 德国Marin Christ公司;KDC-1402低速离心机 安徽中科中佳科学仪器有限公司;HYP-1004消化炉 上海纤检仪器有限公司。
1.3 方法
1.3.1 玉米γ-醇溶蛋白和谷蛋白的同时提取
称取1 kg玉米黄粉粉碎,过40 目筛,超临界CO 2萃取法脱脂脱色后用去离子水配制成质量浓度为0.1 g/mL的玉米黄粉悬浮液,调节pH 6.5,于90 ℃条件下按40 U/g底物加入耐高温α-淀粉酶,继续搅拌反应1 h,降温至55 ℃,调节pH 4.5,按280 U/g底物加入葡萄糖苷酶继续水解1 h,在沸水浴中灭酶30 min,离心(3 800 r/min,15 min)去除上清液,沉淀物用等量蒸馏水洗涤3 次,彻底去除淀粉及其水解产物,60 ℃干燥箱中烘干。将脱淀粉玉米黄粉按料液比1∶10(g/mL)加入体积分数70%的乙醇溶液,60 ℃水浴提取60 min后,离心(3 800 r/min,15 min)分离收集上清液和沉淀。如此重复2 次。上清液即为α-醇溶蛋白和β-醇溶蛋白,可用于制备醇溶蛋白膜、缓释性壁材等 [16];沉淀于60 ℃烘箱中烘干后,得到玉米γ-醇溶蛋白和谷蛋白(580 g),作为蛋白酶酶解实验的原料,经凯氏定氮法测定其蛋白含量为83.14%。
1.3.2 γ-醇溶蛋白和谷蛋白水解液的制备
采用碱性蛋白酶和风味蛋白酶分步水解玉米γ-醇溶蛋白和谷蛋白,得到富含His-Pro和Pro-His二肽的玉米蛋白水解物。将玉米γ-醇溶蛋白和谷蛋白按照料液比1∶20(g/mL)加水混合于55℃条件下预热,调节溶液pH 8.0,按12 100 U/g底物加入碱性蛋白酶,搅拌水解6.5 h,调节pH 7.5,温度保持不变,按17 000 U/g底物加入风味蛋白酶继续水解6 h,反应结束后在95 ℃条件下灭酶15 min,酶解液离心分离(3 800 r/min,15 min)收集上清液。向上清液中加入3 倍体积无水乙醇,于4 ℃条件下静置4 h,离心脱除蛋白,收集上清液,旋转蒸发除去乙醇后冷冻干燥,得到玉米蛋白水解物(232 g)。
1.3.3 高温高压法合成玉米CHP
称取10.00 g水解物冻干粉置于500 mL锥形瓶中,按一定底物质量浓度加入蒸馏水配制成多肽溶液,同时加入一定量的KHCO 3调节溶液pH值为弱碱性,用纱布封口,放入压力蒸汽灭菌器中进行高温高压处理,使样液中的Pro-His二肽发生环化反应,生成CHP(图1),达到预定时间后,溶液冷却,经旋转蒸发仪浓缩后,冷冻干燥,得到环化产物。称取2 mg产物溶于20 mL含0.05% TFA的水-乙腈(95∶5,V/V)溶液,样液过0.22 μm微孔滤膜后,采用超高效液相色谱法进行分析。

图1 CHP的合成途径
Fig.1 Scheme of CHP synthesis
1.3.4 CHP含量的测定
环化产物中CHP含量的测定采用超高效液相色谱法,色谱柱:Waters Acquity UPLC HSS T3柱(100 mm×2.1 mm,1.8 μm);保护柱:VanGuard Pre-Column HSS T3(5 mm×2.1 mm,1.8 μm);流动相A为含0.05% TFA的超纯水,流动相B为乙腈,线性洗脱梯度:0~5 min,5% B;5~6 min,5%~80% B;6~20 min,80% B。流速:0.2 mL/min;柱温:35 ℃,检测波长:220 nm,进样量1 μL。
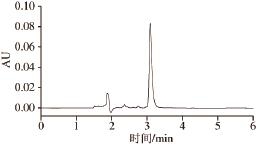
图2 CHP标准品的超高效液相色谱图
Fig.2 UPLC chromatogram of CHP standard
CHP的定量采用外标法,精密称取CHP标准品5 mg(精确至0.l mg)于5 mL容量瓶中,用流动相溶解并定容,配置成1.0 mg/mL的标准储备液,再将标准储备液稀释成系列标准工作溶液,采用上述色谱条件检测(图2),以峰面积为纵坐标、以对照品质量浓度(mg/mL)为横坐标,进行线性回归,得到方程y=4 307 590x+10 640(R 2=0.999 8)。根据标准曲线计算样品中CHP的含量,最终根据下式计算CHP提取量:
式中:X为CHP提取量/(mg/g);c为根据标准曲线计算得到的样液中CHP的含量/(mg/mL);V为样液的体积/mL;m为样品的质量/g;M 1为环化产物的质量/g;M 2为环化前玉米蛋白水解物的质量/g。
1.3.5 高温高压法合成玉米CHP工艺条件优化
1.3.5.1 单因素试验
选取反应温度(11 0~1 3 5 ℃)、反应时间(3~7 h)、底物质量浓度(13~33 mg/mL)和KHCO 3浓度(0~0.5 mol/L)4 个因素,研究不同因素对CHP提取量的影响,从而确定各因素的最佳水平。
1.3.5.2 响应面试验
根据中心组合试验设计原理,在单因素试验的基础上,以反应温度、底物质量浓度、KHCO 3浓度和反应时间为自变量,进行四因素三水平的响应面分析试验,以CHP提取量为响应值,优化高温高压法合成玉米CHP的工艺条件,试验因素及水平设计见表1。
表1 中心组合试验设计因素及水平
Table1 Factors and levels used in central composite design
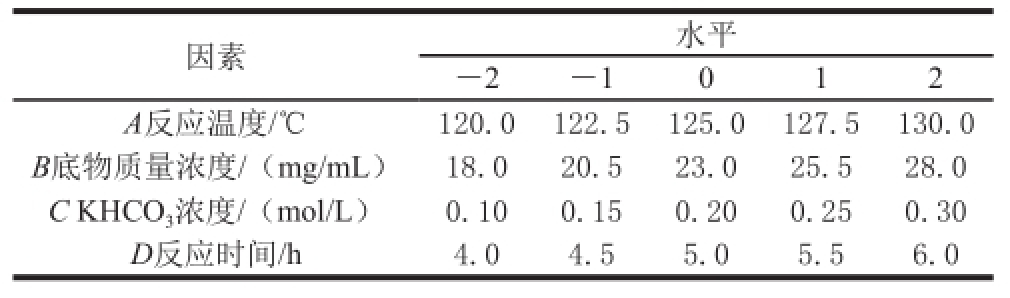
因素水平-2-1012 A反应温度/℃120.0122.5125.0127.5130.0 B底物质量浓度/(mg/mL)18.020.523.025.528.0 C KHCO 3浓度/(mol/L)0.100.150.200.250.30 D反应时间/h4.04.55.05.56.0
1.3.6 环化产物中CHP超高效液相色谱-串联质谱分析
采用Thermo LTQ XL线性离子阱质谱仪对环化产物中CHP进行鉴定,质谱条件为电喷雾离子源,正离子检测模式,喷雾电压5.00 kV,毛细管电压25.00 V,毛细管温度250 ℃,鞘气(N 2)流速50.00 mL/min,管透镜补偿电压85.00 V,一级全扫描范围m/z 100~500。采用Thermo-Fisher Accela超高效液相色谱仪与质谱仪联用,色谱柱及色谱条件同方法1.3.4节,实验数据的采集和处理采用Xcalibur软件。
2.1 单因素试验结果
2.1.1 反应温度的确定
线型二肽前体闭合成环二肽反应实质上是分子内缩合形成肽键的过程,二肽的环化反应历程是线型二肽前体通过单键的旋转使羧基中的C和氨基中的N逐渐接近,羧基上的OH先脱去,N和C继续接近至形成单键,而后氨基上的H才脱去,H移向OH与之结合成H 2O,最后H 2O远离生成的环二肽 [17]。根据文献报道 [18],高温高压有利于线性肽克服形成环状过渡态结构中的扭曲张力,增加首尾相遇机会,促进成环反应进行。在底物质量浓度23 mg/mL、KHCO 3浓度0.2 mol/L、反应时间5 h条件下,分别于110、115、120、125、130、135 ℃进行环化反应,考察反应温度对CHP提取量的影响,如图3所示。

图3 反应温度对CHP提取量的影响
Fig.3 Effect of reaction time on the yield of CHP
由图3可知,随着反应温度的升高,反应釜显示的反应压力不断增大,而CHP提取量呈现先增加后下降的趋势:当反应温度低于125 ℃时,CHP提取量随着反应温度的升高而急剧增大,在125 ℃时趋于平稳;继续提高反应温度,超过130 ℃时,反应压力继续增大,而CHP提取量开始降低,同时伴随有副产物生成,并且在产物中观察到了部分消旋。因此本实验选取125 ℃为最佳反应温度,此时反应压力为0.24 MPa。
2.1.2 底物质量浓度的确定
Marchini等 [19]指出最佳底物质量浓度是形成环状过渡态复合物引起环张力最小的那一种;若底物质量浓度过高则容易发生分子间的聚合,从而导致环二聚肽和环多聚肽等副产物的生成 [20]。在KHCO 3浓度0.2 mol/L、反应温度125 ℃、反应时间5 h条件下,分别于13、18、23、28、33 mg/mL的底物质量浓度条件下进行环化反应,考察底物质量浓度对CHP提取量的影响,如图4所示。
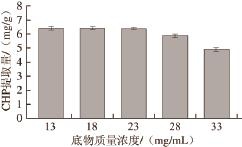
图4 底物质量浓度对CHP提取量的影响
Fig.4 Effect of substrate concentration on the yield of CHP
由图4可知,随着底物质量浓度的增加,CHP提取量逐渐降低,底物质量浓度在13~23mg/mL范围内,CHP提取量随着底物质量浓度的增加降低不显著;当底物质量浓度超过23 mg/mL时,CHP提取量降低的幅度较大,液相色谱检测到有副产物生成。因此关环反应需在稀溶液中进行,但是过低的底物质量浓度造成反应溶液体积过大,在实际生产中无形的增加了设备要求,浓缩成本也加大,因此本实验选取23 mg/mL为最佳底物质量浓度。
2.1.3 KHCO 3浓度的确定
根据文献[21],反应体系中添加碱可以提高二肽N端的亲核活性,有利于氨基进攻末端碳原子发生分子内缩合,提高环化速率,故经典的环二肽液相合成法大多是在碱性条件下进行,但是过量的碱易引起终产物环二肽的消旋,得到非对映异构体的混合物 [22]。分别添加0、0.1、0.2、0.3、0.4、0.5 mol/L不同浓度的KHCO 3溶液,于底物质量浓度23 mg/mL、反应温度125 ℃、反应时间5 h条件下进行环化反应,考察KHCO 3浓度对CHP提取量的影响,如图5所示。

图5 KHCO
3浓度对CHP提取量的影响
Fig.5 Effect of KHCO
3concentration on the yield of CHP
由图5可知,随着KHCO 3浓度的增加,CHP提取量呈现先增加后下降的趋势,当KHCO 3在低浓度范围(0~0.2 mol/L)时,随着KHCO 3浓度的增加,CHP提取量逐渐增大;当KHCO 3浓度大于0.2 mol/L时,随着KHCO 3浓度的增加,CHP提取量开始缓慢下降,并且产物的消旋化程度逐渐增加,因此本实验中KHCO 3浓度选择0.2 mol/L。
2.1.4 反应时间的确定
在底物质量浓度23 mg/mL、反应温度125 ℃、KHCO 3浓度0.2 mol/L的条件下,分别反应不同的时间3、4、5、6、7 h,考察反应时间对CHP提取量的影响,如图6所示。

图6 反应时间对CHP提取量的影响
Fig.6 Effect of reaction time on the yield of CHP
由图6可知,随着反应时间的延长,CHP提取量逐渐增大,当反应时间为5 h时,CHP提取量达到最大,继续延长反应时间,CHP提取量上升缓慢并逐渐趋于平稳,表明此时反应已经完全,从能耗及经济角度考虑,本实验选取5 h为最佳反应时间。
2.2 响应面试验结果
由于试验过程中反应釜的压力不可调,其是随着反应温度的变化而变化的,故反应压力和反应温度的影响一致,因此选择反应温度(A)、底物质量浓度(B)、KHCO 3浓度(C)和反应时间(D)进行中心组合试验,中心组合试验设计和结果如表2所示。
表2 响应面试验方案及结果
Table2 Experimental design and results for response surface methodology
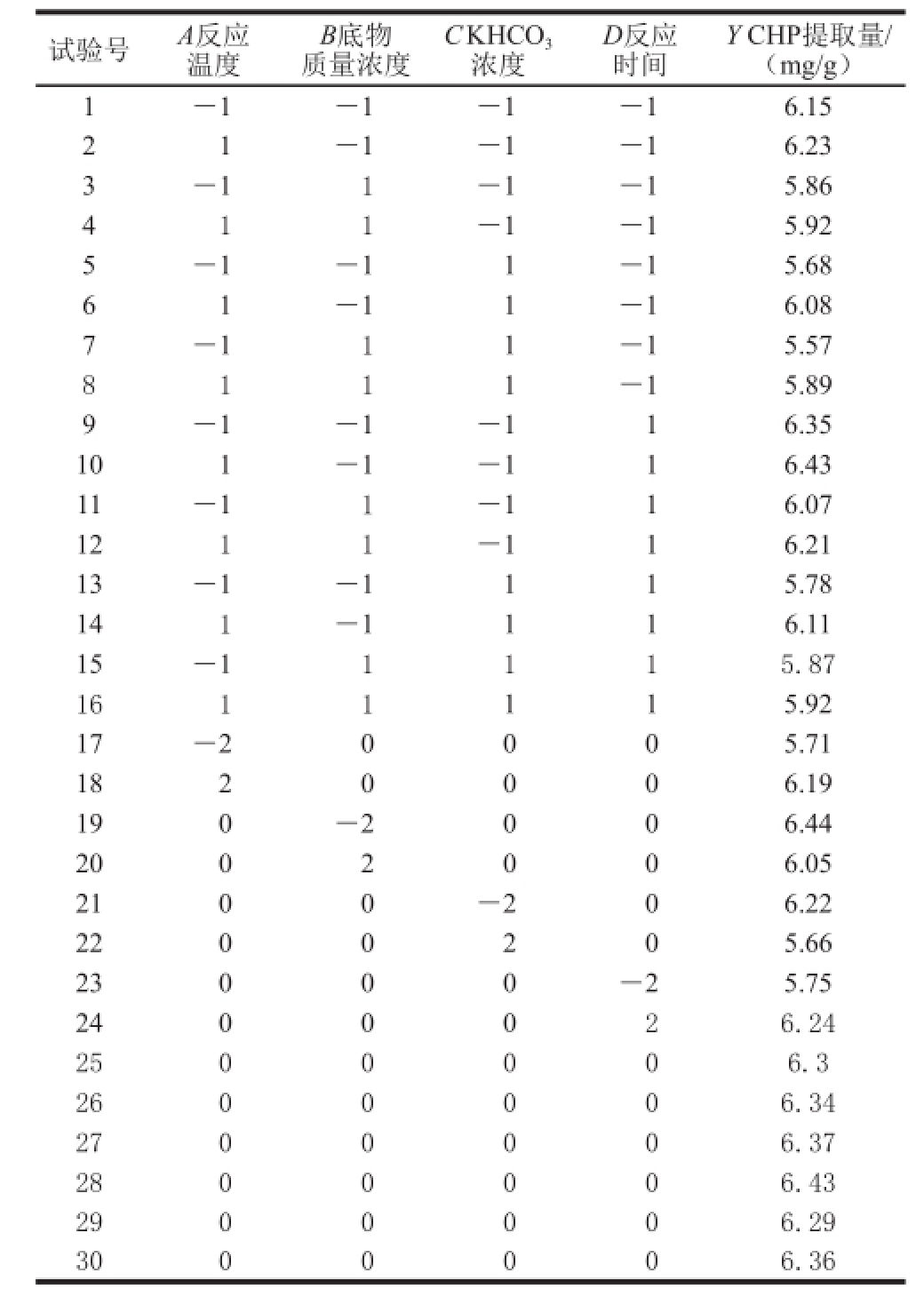
试验号A反应温度Y CHP提取量/(mg/g)1-1-1-1-16.15 21-1-1-16.23 3-11-1-15.86 4 1 1-1-15.92 5-1-11-15.68 61-11-16.08 7-111-15.57 8111-15.89 9-1-1-116.35 101-1-116.43 11-11-116.07 1211-116.21 13-1-1115.78 141-1116.11 15-11115.87 1611115.92 17-20005.71 1820006.19 190-2006.44 2002006.05 2100-206.22 2200205.66 23000-25.75 2400026.24 2500006.3 2600006.34 2700006.37 2800006.43 2900006.29 3000006.36 B底物质量浓度C KHCO 3浓度D反应时间
以CHP提取量为因变量,采用Design-Expert 8.0.6软件对表2数据进行响应面分析,得二次多项拟合回归方程为:
Y=-276.925 2+4.254 9A+0.437 8B-34.666 7C+ 5.935D-0.003 2AB+0.37AC-0.13AD+0.35BC+ 0.015BD-1.1CD-0.016 6A 2-0.004 8B 2-42.5C 2-0.37D 2
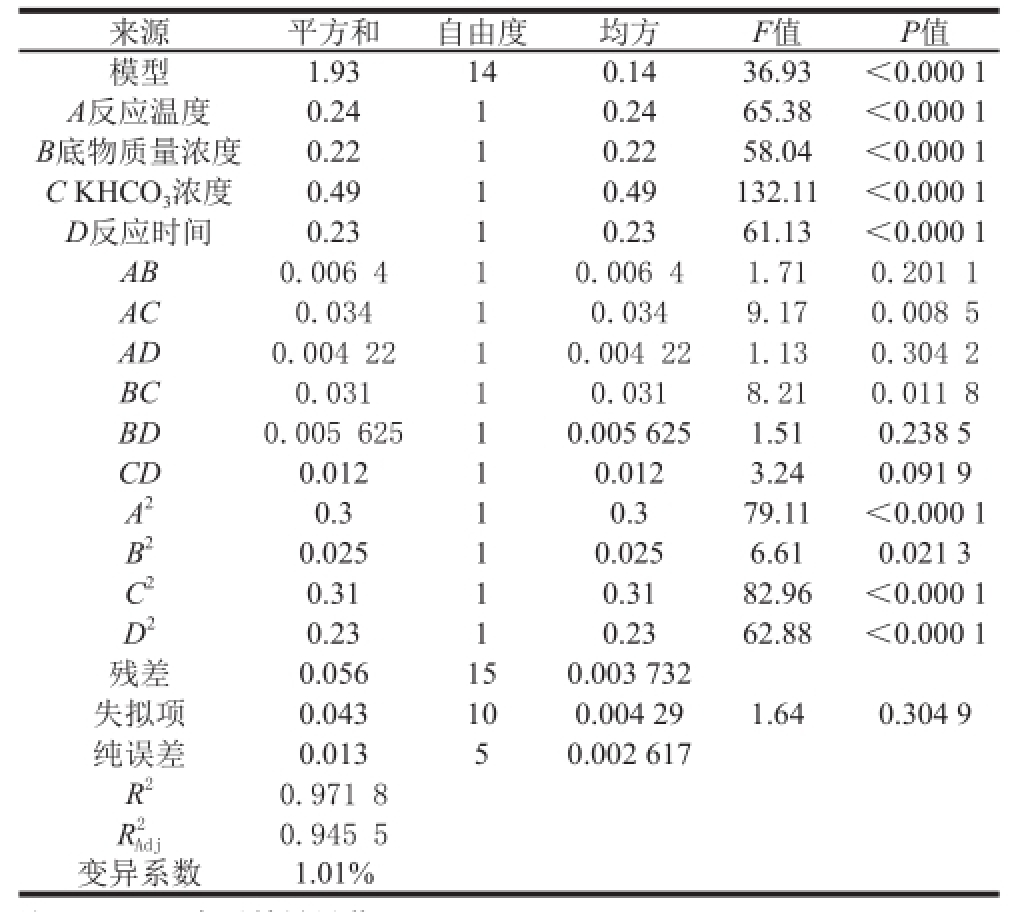
从表3可以看出,整体模型的P值小于0.05,表明该二次方程模型显著;失拟项P=0.304 9>0.05,表明其对于绝对误差不显著,方程拟合较好;变异系数越小,试验的可靠性越高
[23],变异系数较低,说明试验操作的可信度高。此外,模型的相关系数R
2=0.971 8和校正决定系数
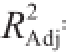 =0.945 5,说明自变量与响应值之间的多元回归关系显著,该模型与实际数据拟合良好,可以在模型设定的范围内分析和预测CHP提取量。模型中一次项A、B、C、D,二次项A
2、B
2、C
2、D
2以及交互项AC、BC对CHP提取量有显著影响,其余项的影响均不显著(P> 0.05)。方差分析结果还说明,高温高压合成过程中对CHP提取量影响程度由强到弱的因素为:KHCO
3浓度>反应温度>反应时间>底物质量浓度。
=0.945 5,说明自变量与响应值之间的多元回归关系显著,该模型与实际数据拟合良好,可以在模型设定的范围内分析和预测CHP提取量。模型中一次项A、B、C、D,二次项A
2、B
2、C
2、D
2以及交互项AC、BC对CHP提取量有显著影响,其余项的影响均不显著(P> 0.05)。方差分析结果还说明,高温高压合成过程中对CHP提取量影响程度由强到弱的因素为:KHCO
3浓度>反应温度>反应时间>底物质量浓度。
表3 回归模型的方差分析及回归系数的显著性检验
Table3 Analysis of variance (ANOVA) and significance test for quadratic response surface model
注:P<0.05表示差异显著。
来源平方和自由度均方F值P值模型1.93140.1436.93<0.000 1 A反应温度0.2410.2465.38<0.000 1 B底物质量浓度0.2210.2258.04<0.000 1 C KHCO 3浓度0.4910.49132.11<0.000 1 D反应时间0.2310.2361.13<0.000 1 AB 0.006 410.006 41.710.201 1 AC 0.03410.0349.170.008 5 AD 0.004 2210.004 221.130.304 2 BC0.03110.0318.210.011 8 BD0.005 62510.005 6251.510.238 5 CD0.01210.0123.240.091 9 A 20.310.379.11<0.000 1 B 20.02510.0256.610.021 3 C 20.3110.3182.96<0.000 1 D 20.2310.2362.88<0.000 1残差0.056150.003 732失拟项0.043100.004 291.640.304 9纯误差0.01350.002 617 R 20.971 8 R2 Adj0.945 5变异系数1.01%

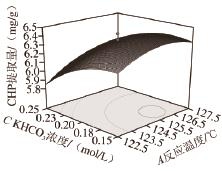
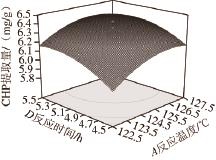

图7 各因素交互作用对CHP提取量影响的响应面
Fig.7 Response surfaces showing the interactive effects of reaction conditions on the yield of CHP
利用软件分析得到如图7所示的因变量与四因素间交互作用的响应面图。对回归方程进行模拟优化,得到高温高压法合成玉米CHP的最佳工艺条件为反应温度125.87 ℃、底物质量浓度20.5 mg/mL、KHCO 3浓度0.16 mol/L,反应时间5.26 h,在此条件下得到的CHP提取量的理论值为6.54 mg/g。
2.3 最佳反应条件的验证
考虑到实际操作可行性,将最佳反应条件修正为反应温度125.9 ℃、底物质量浓度20.5 mg/mL、KHCO 3浓度0.16 mol/L,反应时间5.3 h。取10 g水解物,按照上述最优条件进行3 次高温高压合成反应实验,实际测得的平均CHP提取量为6.58 mg/g,与模型预测值较为相近,验证了响应面设计的准确性。Lieberman等 [6]从富含蛋白的加工食品如肉罐头、鱼露以及干制虾中鉴定出CHP,其含量分别为0.84、1.27、1.41 μg/g食物;Koo等 [24]用含KHCO 3的乙醇溶液加热回流大豆蛋白水解物,反应2 周后水解物中CHP的含量为11.2 mg/g(水解物干质量),但我国大豆年产量很低,为1 200万~1 300万 t,每年需要进口大豆6 500万~7 700万 t,占国内大豆消费总量的80% [25],有研究指出到2020年国内大豆供需缺口将高达1 383万 t [26],我国大豆资源呈紧缺态势。玉米蛋白粉来源广泛,利用率很低,据统计数字显示每年全国通过废液自然排放的玉米黄粉的产量达8万 t以上 [27],利用高温高压技术将玉米蛋白粉中含量丰富的玉米蛋白转化为CHP不仅能够提高社会效益和经济效益,而且有利于减少环境污染。
2.4 环化产物中CHP的超高效液相色谱-串联质谱分析
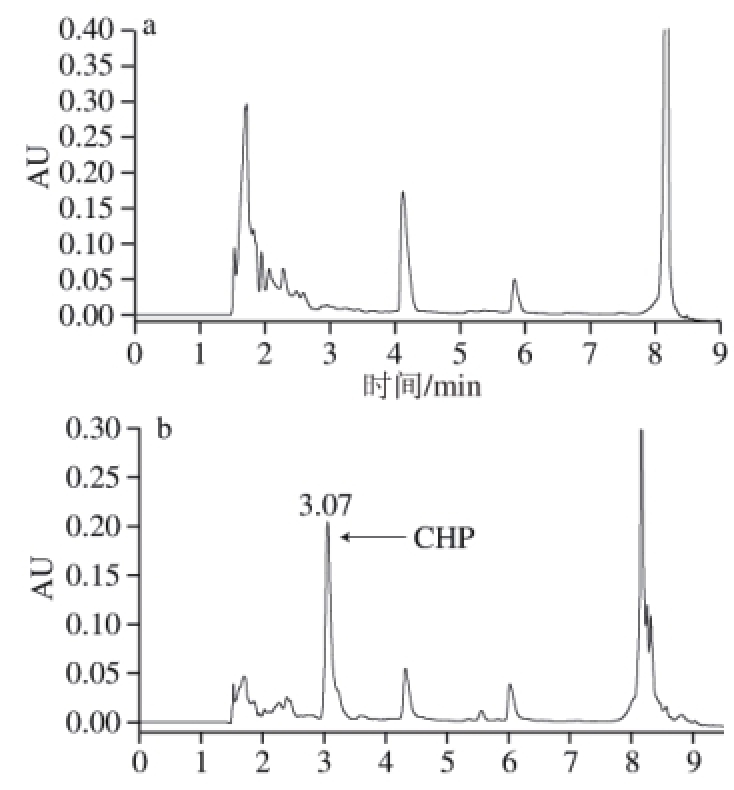
图8 高温高压环化反应前(a)和反应后(b)水解物的超高效液相色谱图
Fig.8 Comparison of UPLC chromatogram of hydrolysate before and after being subjected to cyclization reaction under high temperature and high pressure

图9 保留时间3.07 min的色谱峰的一级质谱图
Fig.9 Mass spectrum of peak at retention time of 3.07 min
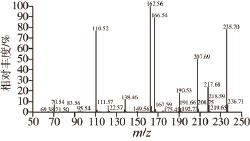
图10 10 m/z 235.7母离子的二级质谱图
Fig.10 Tandem mass (MS/MS) spectrum of precursor ion m/z 235.7
对最优工艺条件下得到的环化产物中的CHP进行进一步鉴定。图8为环化产物的超高效液相色谱图,对比标准品的保留时间,推测保留时间3.07 min的峰为CHP。通过质谱仪自动对来自超高效液相色谱的洗脱组分交替进行一级质谱和二级质谱处理,借助分析软件,可对目标组分进行结构预测。由图9可知,保留时间3.07 min的成分形成m/z 235.7的母离子[M+H] +峰,可得出该组分的分子质量为234.7 D,与标准品的分子质量一致。再选择母离子(m/z 235.7)通过惰性气体碰撞诱导离解为多个二级碎片离子,碎片离子的扫描图如图10所示,主要碎片离子峰有m/z 207、162、166、110、70,查阅相关文献,根据环二肽的质谱裂解规律可以推断出:母离子m/z 235裂解失去一个中性分子—CO形成碎片离子m/z 207.7,基峰m/z 162是碎片m/z 207进一步丢失一个肽键(—CHONH 2)形成的,强峰 m/z 166则是母离子m/z 235通过丢失一个咪唑基团(C 3N 2H 5)产生的,另一强峰m/z 110是由碎片m/z 207丢失CHNHC 4N 2H 5形成的,二级质谱中还出现了典型的m/z 70的碎片离子,这是典型的脯氨酸的特征碎片离子,故可进一步证明高温高压环化反应后的玉米蛋白水解物中含有CHP。
以水为溶剂,采用高温高压技术对玉米蛋白水解物进行环化,制备CHP。通过单因素试验和响应面分析对此工艺进行优化,得出最佳反应条件为反应温度125.9 ℃、反应压力0.25 MPa、底物质量浓度20.5 mg/mL、KHCO 3浓度0.16 mol/L、反应时间5.3 h。在此条件下,玉米蛋白水解物中的His-Pro和Pro-His线性二肽可以直接发生分子内环化,得到较高提取量的CHP(6.58 mg/g),表明从玉米蛋白粉中实际生产CHP很有前景。通过超高效液相色谱-串联质谱技术对产物中的CHP进行结构鉴定,进一步证明了环化产物中含有CHP活性肽。目前环二肽的高温高压合成都要经过两步:首先将二肽的羧基端制成活泼酯,然后于高温高压条件下成环,制备工艺繁琐。本实验利用高温高压法一步合成CHP,不仅简化了工艺流程,同时具有反应时间短、产物提取量高、环境友好等优点,适于在工业化生产中推广。我国玉米蛋白资源丰富,利用率低,玉米蛋白制备CHP用于保健食品和药品的生产,可大幅度提高玉米蛋白经济效益及社会效益。
参考文献:
[1] MINELLI A, GROTTELLI S, Annalisa MIERL A et al. Cyclo (His-Pro) exerts anti-inflammatory effects by modulating NF-ĸB and Nrf 2 signalling[J]. The International Journal of Biochemistry and Cell Biology, 2012, 44(3): 525-535. DOI:10.1016/j.biocel.2011.12.006.
[2] RA K S, SUH H J, CHOI J W J. Hypoglycemic effects of cyclo (His-Pro) in streptozotocin-induced diabetic rats[J]. Biotechnology and Bioprocess Engineering, 2012, 17: 176-184. DOI:10.1007/s12257-011-0618-1.
[3] MINELLI A, BELLEZZA I, GROTTELLI S, et al. Focus on cyclo(His-Pro): history and perspectives as antioxidant peptide[J]. Amino Acids, 2008, 35(2): 283-289. DOI:10.1007/s00726-007-0629-6.
[4] SONG M K, ROSENTHAL M J, SONG A M, et al. Body weight reduction in rats by oral treatment with zinc plus cyclo-(His-Pro)[J]. British Journal of Pharmacology, 2009, 158(2): 442-450. DOI:10.1111/ j.1476-5381.2009.00201.x.
[5] PARK Y, LEE H J, CHOI J W, et al. Anti-diabetic effect of cyclo-His-Pro (CHP)-enriched yeast hydrolysate in streptozotocin-induced diabetic mice[J]. African Journal of Biotechnology, 2013, 12(35):5473-5479. DOI:10.5897/AJB12.1556.
[6] LIEBERMAN H R, KANAREK R B, PRASAD C. Nutritional Neruscience[M]. Cleveland: CRC Press, 2005: 49-51. DOI:10.1016/ j.jchemneu.2013.02.001.
[7] CHOI S A, YUN J W, PARK H S, et al. Hypoglycemic dipeptide cyclo (His-Pro) significantly altered plasma proteome in streptozocininduced diabetic rats and genetically-diabetic (ob/ob) mice[J]. Molecular Biology Reports, 2013, 40(2): 1753-1765. DOI:10.1007/ s11033-012-2229-0.
[8] ABIRAM A, KOLANDAIVEL P. Structural analysis and the effect of cyclo (His-Pro) dipeptide on neurotoxins-a dynamics and density functional theory study[J]. Journal of Molecular Modeling, 2010, 16(2): 193-202. DOI:10.1007/s00894-009-0531-0.
[9] ZHOU Cunshan, HU Jiali, MA Haile, et al. Antioxidant peptides from corn gluten meal: orthogonal design evaluation[J]. Food Chemistry, 2015, 187(15): 270-278. DOI:10.1016/j.foodchem.2015.04.092.
[10] 张艳荣, 杨羿, 宋春春, 等. 微波协同辅助复合酶法制备高F值玉米肽条件的优化[J]. 食品科学, 2013, 34(3): 172-178.
[11] 马艳秋, 郑喜群, 刘晓兰, 等. 玉米蛋白酶解物的解酒作用[J]. 食品科学, 2015, 36(1): 191-196. DOI:10.7506/spkx1002-6630-201501036.
[12] WOO Y M, HU D W N, LARKINS B A, et al. Genomics analysis of genes expressed in maize endosperm identifies novel seed proteins and clarifi es patterns of zein gene expression[J]. The Plant Cell, 2001, 13(10): 2297-2317. DOI:10.1105/tpc.010240.
[13] 卢曦元, 徐德昌. 环二肽生物活性的研究进展[J]. 生物信息学, 2011, 9(4): 289-291. DOI:10.3969/j.issn.1672-5565.2011.04.06.
[14] 唐子龙, 潘志, 罗娟, 等. 手性催化剂环二肽类化合物的微波合成[J]. 合成化学, 2008, 16(5): 542-545. DOI:10.3969/ j.issn.1005-1511.2008.05.012.
[15] THAJUDEEN H, PARK K, MOON S, et al. An efficient green synthesis of proline-based cyclic dipeptides under water-mediated catalyst-free conditions[J]. Tetrahedron Letters, 2010, 51(9): 1303-1305. DOI:10.1016/j.tetlet.2009.12.134.
[16] 张敏, 陈野, 刘君, 等. EDC和NHS对玉米醇溶蛋白成膜性质的影响[J]. 食品科学, 2014, 35(1): 12-18. DOI:10.7506/spkx1002-6630-201401003.
[17] 朱艳艳. 环肤优势构象的理论化学研究[D]. 郑州: 郑州大学, 2006. DOI:10.7666/d.y947400.
[18] 于燕. 手性含脯氨酸环二肽的合成、抗菌抗肿瘤活性及作为不对称催化剂的研究[D]. 青岛: 青岛科技大学, 2010. DOI:10.7666/ d.y1740344.
[19] MARCHINI M, MINGOZZI M, COLOMBO R, et al.Selective O-acylation of unprotected N-benzylserine methyl ester and O,N-acyl transfer in the formation of cyclo (Asp-Ser) diketopiperazines[J]. Tetrahedron, 2010, 66(49): 9528-9531. DOI:10.1016/j.tet.2010.10.007.
[20] 刘廷凤. 环二肽催化不对称合成光学活性氰醇研究[D]. 南京: 南京工业大学, 2004. DOI:10.7666/d.y672109.
[21] YAMAZAKI Y, MORI Y, ODA A, et al. Acid catalyzed monodehydro-2,5-diketopiperazine formation from N-α-ketoacyl amino acid amides[J]. Tetrahedron, 2009, 65(18): 3688-3694. DOI:10.1016/j.tet.2009.02.058.
[22] 张艳荣, 樊红秀, 刘婷婷, 等. 环(组氨酸-脯氨酸)二肽的高温高压辅助合成工艺优化[J]. 食品科学, 2016, 37(8): 18-25. DOI:10.7506/ spkx1002-6630-201608004.
[23] 陈红, 邬欣蕾, 王大为. 响应面试验优化植物甾醇超声乳化工艺及其乳化稳定性[J]. 食品科学, 2016, 37(8): 20-25. DOI:10.7506/ spkx1002-6630-201606004.
[24] KOO K B, SUH H J, RA K S, et al. Protective effect of cyclo (His-Pro) on streptozotocin-induced cytotoxicity and apoptosis in vitro[J]. Journal of Microbiology and Biotechnology, 2011, 21(2): 2218-2227. DOI:10.4014/jmb.1012.12003.
[25] YANG Weiqiao, LI Xihong, LIU Xia, et al. Improvement of soybean quality by ground source heat pump (GSHP) cooling system[J]. Journal of Stored products Research, 2015, 64: 113-119. DOI:10.1016/ j.jspr.2015.09.002.
[26] LIU Xiaobing, JIN Jian, WANG Guanghua, et al. Soybean yield physiology and development of high-yielding practices in Northeast China[J]. Field Crops Research, 2008, 105(3): 157-171. DOI:10.1016/ j.fcr.2007.09.003.
[27] ZHUANG Hong, TANG Ning, DONG Shuting, et al. Optimisation of antioxidant peptide preparation from corn gluten meal[J]. Journal of the Science of Food and Agriculture, 2013, 93(13): 3264-3270. DOI:10.1002/jsfa.6170.
Optimization of Key Processing Parameters for Preparation of Corn Cyclo (His-Pro) by High Temperature/High Pressure Method
FAN Hongxiu, LIU Tingting, LIU Hongcheng, REN Huahua, ZHANG Yanrong
*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:In this study, we investigated the synthesis of corn cyclo (His-Pro) (CHP) in aqueous solution by a high temperature/pressure method from corn protein hydrolysate prepared in our laboratory. First of all, the one-factor-at-a-time method was used to investigate the influences of reaction temperature, substrate concentration, KHCO 3concentration and reaction time on CHP yield. Subsequently, the reaction conditions were optimized using response surface methodology. Results revealed that the optimum reaction conditions were determined as follows: reaction temperature, 125.9 ℃;reaction pressure, 0.25 MPa; substrate concentration, 20.5 mg/mL; KHCO 3concentration, 0.16 mol/L; and reaction time, 5.3 h, resulting in the maximum yield of CHP as high as 6.58 mg/g. The prepared CHP exhibited the expected structure as confirmed by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS).
Key words:corn protein; cyclo (His-Pro); high temperature/high pressure method; cyclization reaction
DOI:10.7506/spkx1002-6630-201620002
中图分类号:TS213.4
文献标志码:A
文章编号:1002-6630(2016)20-0006-07
引文格式:
樊红秀, 刘婷婷, 刘鸿铖, 等. 响应面试验优化高温高压制备玉米环(组氨酸-脯氨酸)二肽关键工艺[J]. 食品科学, 2016, 37(20): 6-12. DOI:10.7506/spkx1002-6630-201620002. http://www.spkx.net.cn
FAN Hongxiu, LIU Tingting, LIU Hongcheng, et al. Optimization of key processing parameters for preparation of corn cyclo (His-Pro) by high temperature/high pressure method[J]. Food Science, 2016, 37(20): 6-12. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620002. http://www.spkx.net.cn
收稿日期:2016-05-12
基金项目:“十二五”国家科技支撑计划项目(2013BAD16B08);国家高技术研究发展计划(863计划)项目(2011AA100805)
作者简介:樊红秀(1987—),女,博士研究生,研究方向为粮油植物蛋白工程。E-mail:xcpyfzx@163.com
*通信作者:张艳荣(1965—),女,教授,博士,研究方向为粮油植物蛋白工程及功能食品。E-mail:xcpyfzx @163.com