母乳和牛乳中乳脂肪球膜蛋白质的差异分析
景萌娜
1,2,姜铁民
2,刘 斌
2,张咚咚
2,魏京华
1,2,王 品
1,2,李菊芳
2,陈历俊
1,2,
*
(1.大连工业大学生物工程学院,辽宁 大连 116034;2.北京三元食品股份有限公司,国家母婴乳品健康工程技术研究中心,北京 100163)
摘 要:为比较乳脂肪球膜(milk fat globule membrane,MFGM)蛋白在母乳和牛乳中的差异,采用有机试剂提取法,从母乳和牛乳中提取分离出MFGM蛋白,经皮尔斯
TM去垢小柱去除十二烷基硫酸钠后,通过液相色谱-质谱联用技术检测分析,检测结果根据特异性肽段匹配数不小于1筛选后,在母乳和牛乳中分别检测到863 种和454 种蛋白,其中二者共有175 种,分别独有688 种和279 种。将母乳中差异表达的688 种蛋白质按PANTHER数据库进行蛋白质的Gene Ontology(GO)功能注释,这些蛋白主要是细胞部分、细胞器、细胞膜等组分,参与的生物途径有新陈代谢过程、生物调节、刺激性反应、免疫系统过程、再生作用等,具有催化、黏合、转运、酶调节等多种分子功能。另外,母乳中的这些差异蛋白参与氨酰tRNA生物合成、致病性大肠杆菌感染、脂肪酸代谢、丙酸代谢、甾体合成、酸降解等都是牛乳中的乳脂肪球膜蛋白不具有的功能。通过分析得出母乳和牛乳中的MFGM蛋白具有明显差异,虽然有部分组成和功能的重叠,但在丰度和代谢路径上,牛乳MFGM蛋白不能替代母乳MFGM蛋白。
关键词:乳脂肪球膜蛋白;母乳;牛乳;功能注释;代谢途径
婴幼儿处于特殊生长发育阶段,具有特殊的营养需求
[1]。1998年,Lucas
[2]提出了“营养程序化”的概念,即发育关键或敏感时期的营养状况将对机体各器官功能产生长期以至终生的影响,且程序化的敏感时期可能从胎儿期和婴儿期延伸到青少年时期。婴幼儿的营养状况越来越受到人们的关注。
众所周知,母乳是婴幼儿最理想的天然食物,母乳中丰富的营养物质为婴幼儿的生长发育提供了能量和营养需求。但是当母乳不能满足需求时,一般选择婴幼儿配方奶粉作为营养补充食品,目前大部分的配方奶粉来源于牛乳
[1],婴幼儿配方奶粉的基本原则是调节牛乳成分,使其最大程度上与母乳相似
[3]。乳中的蛋白质是主要的营养物质之一,是婴幼儿建造机体的重要物质基础,机体的每一个细胞及所有的重要活性物质都有蛋白质的参与。研究
[4]发现,牛乳和母乳具有明显的成分差异,尤其是蛋白含量的差异,乳清蛋白与酪蛋白的比例在母乳中约为70∶30,而牛乳中约为18∶82。除此之外,随着蛋白质组学技术的发展,以前一直被忽视的乳脂肪球膜(milk fat globule membrane,MFGM)蛋白的研究正成为乳蛋白研究中的一个重要部分
[5]。
MFG以一种微小的球状存在于乳中,直径大约为0.2~15 μm
[6],外面被一层很薄的膜所包围,这层膜被称为MFGM,它的横截面直径大约为10~20 nm。起着乳化剂的作用并阻止乳脂肪球的聚合和酶退化
[7]。MFGM蛋白中含有25%~60%的蛋白质,占乳中总蛋白含量的1%~2%
[8]。MFGM蛋白虽然在乳中含量甚微,但却具有重要的生物学意义,如抗癌作用、抗菌性和抗黏着性以及对脑脊髓炎的自身免疫作用
[9-10]等,都是不容被忽视的。近年来,国内外关于MFGM蛋白的研究越来越多,其中对牛乳、羊乳等动物的MFGM蛋白研究较多,对母乳的MFGM蛋白国内外已有了高度的重视,但对MFGM蛋白在母乳和牛乳中的差异分析却很少
[11-12]。本实验采用纳升液相色谱-静电场轨道阱组合式高分辨质谱对母乳和牛乳中的MFGM蛋白进行检测,并进行相关生物信息分析,为婴幼儿配方奶粉的研发提供理论指导。
1 材料与方法
1.1 材料与试剂
新鲜牛乳、成熟期(大于6 个月)的母乳 北京三元食品股份有限公司。
蔗糖、氯化钾、氯化钠、磷酸二氢钾、磷酸氢二纳、碳酸氢铵、甲醇、三氯甲烷(均为分析纯) 北京化工厂;二硫苏糖醇、尿素、碘代乙酰胺、胰蛋白酶、黄嘌呤氧化酶标品、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、磷酸盐缓冲液(phosphate buffered saline,PBS) 德国Sigma公司;甲酸、乙腈、甲醇(均为色谱纯) 美国Fisher Scientific公司;蒸馏水广州屈臣氏食品饮料有限公司。
1.2 仪器与设备
Bradford蛋白定量试剂盒 碧云天生物技术公司;UltiMate 3000纳升液相色谱仪、Q Exactive Orbitrap高分辨质谱仪、皮尔斯™去垢小柱、D-37520微量高速离心机、Nanodrop2000超微量分光光度计 美国Thermo Fisher公司;氮吹仪 美国Organomation公司;3K-15型冷冻离心机 德国Sigma公司;TRID2.5真空冷冻干燥机 美国Labconco公司;KQ-500DE超声波清洗仪 昆山市超声仪器有限公司;Milli-Advantage超纯水系统 美国Millipore公司;Oasis HLB固相萃取柱 美国Waters公司。
1.3 方法
1.3.1 MFGM蛋白的提取
参考文献:[13-16]的方法,在此基础上略有改动。分别取新鲜牛乳和母乳各8 mL,按5 g/100 mL添加蔗糖,混合均匀后,于4 ℃、4 000×g条件下离心20 min,取脂肪层,脂肪层采用PBS洗2~3 遍,得乳脂肪。向得到的乳脂肪中加入适量的超纯水,混匀后5 000×g离心20 min,取脂肪层,按体积比1∶1添加三氯甲烷和甲醇,混匀后11 000×g离心20 min,取中间蛋白层,重复2 次后氮吹,得到MFGM蛋白。
1.3.2 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析
采用不连续电泳体系,配制体积分数15%分离胶和体积分数4%的浓缩胶,各取20 μL样品加入5 μL的5 倍上样缓冲液,沸水浴10 min后,11 000×g离心10 min,上样体积为5 μL。以80 V恒压预电泳30 min左右,再以120 V恒压至电泳结束,振荡染色1 h。脱色至背景透明,进行凝胶成像分析,分析软件为Alphaimager HP。
1.3.3 MFGM蛋白液相色谱-质谱分析的前处理
将得到的MFGM蛋白加入适量的SDS裂解液(0.1 mol/L pH 8.0 Tris-HCl+4% SDS+0.1 mol/L二硫苏糖醇),100 W超声溶解30 min。取100 μL蛋白质裂解液,加100 μL水混匀。采用皮尔斯
TM去垢小柱去除SDS:将皮尔斯
TM去垢小柱置于2 mL离心管中,于4 ℃、1 500×g离心1 min,除去储存溶液;向皮尔斯™去垢小柱内加入400 μL PBS溶液,于4 ℃、1 500×g离心1 min,弃流出液,重复1 次;将稀释后的裂解液转入皮尔斯™去垢小柱内,置于室温2 min后,于4 ℃、1 500×g离心1 min,收集流出液,采用0.05 mol/L NH
4HCO
3溶液将流出液稀释至500 μL,Bradford法测定蛋白含量后,按质量比1∶50加入1 mg/mL的胰蛋白酶,37 ℃酶解过夜。酶解液经HLB萃取柱脱盐后,真空冷冻干燥。干燥后加入50 μL体积分数0.1%甲酸溶液复溶,11 000×g离心10 min,取上清液进行质谱分析
[17-18]。
1.3.4 仪器测定条件
色谱条件:色谱分析柱为C
18Acclaim Pep Map RSLC柱(15 cm×50 μm,2 μm,100 Å);富集柱为C
18Acclaim Pep Map 100柱(2 cm×75 μm,5 μm,100 Å);柱温为35 ℃;流动相:A为0.1%甲酸溶液,B为0.1%甲酸-乙腈溶液。梯度洗脱程序:体积分数4% B保持5 min,在70 min内B的体积分数从4%升到50%,保持3 min,在2 min之内B的体积分数降低到4%并保持10 min。流速为0.25 μL/min,进样量1 μL
[19-21]。
质谱条件:离子源为Nanospray Flex纳升电喷雾离子源;电喷雾电压3.2 kV;离子传输管温度320 ℃;射频透镜为50%;扫描模式为数据依赖模式;一级质谱采用Orbitrap采集,质量扫描范围为m/z 300~1 600,分辨率为70 000;对丰度最高的15 个离子峰进行二次碎片采集,碎裂模式为高能碎裂,碰撞能量为28%
[22]。
1.3.5 Q Exactive质谱数据分析
所获得样品的RAW数据文件使用Thermo Proterme Discoverer 1.4软件进行数据库比对。比对数据库检索软件使用SEQUEST HT,数据库源自Uniprot(物种为人,Homo sapiens;物种为牛,Bos taurus)。具体参数设置:酶为胰蛋白酶(full),最大漏切位点设置为2,母离子质量偏差为10 mg/mL,子离子质量偏差为0.02 D。动态修饰设置:氧化(Oxidation/M+15.995 D),脱氨基化(Deamidated/N,Q+0.984 D),固定修饰设置为脲甲基化(Carbamidomethyl/C+57.021 D)。比对结果使用Percolator计算q值进行卡值
[22]。采用R(3.2.0)进行蛋白组数据分析,使用R的“limma”包进行韦恩图绘制,使用“gplots”包进行热图的绘制。差异蛋白的Gene Ontology(GO)功能注释采用PANTHER在线分析平台(http://www.pantherdb.org/)。京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路分析采用DAVID在线分析平台(https://david. ncifcrf.gov/tools.jsp)。
2 结果与分析
2.1 SDS-PAGE结果分析
参考马莺等
[15]的方法提取,在提取过程中用PBS溶液洗数次,以除去附着于MFGM上的酪蛋白、乳清蛋白或其他蛋白,降低所提取的MFGM蛋白中杂质蛋白的含量。在提取离心过程中母乳和牛乳的沉淀量有所差异:第1次离心后,母乳有少量沉淀,而牛乳的沉淀却很多;用PBS溶液洗2 次,在这个过程中,牛乳有少量几乎看不见的沉淀,而母乳却有明显的沉淀。
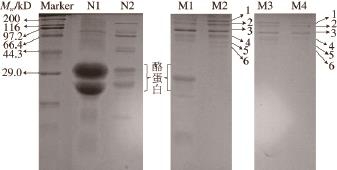
图1 MFGM蛋白离心提取过程中沉淀蛋白的SDS-PAGGEE图
Fig.1 SDS-PAGE patterns of MFGM proteins in centrifugal extraction process
N1.牛乳第1次离心的沉淀蛋白;N2.牛乳脂肪用PBS溶液洗第1次后的沉淀蛋白;M1.母乳在提取过程中第1次离心的沉淀蛋白;M2.母乳脂肪第1次用PBS溶液洗后的沉淀蛋白;M3.母乳脂肪第2次用PBS溶液洗后的沉淀蛋白;M4.母乳脂肪用超纯水洗后的沉淀蛋白。1.黏蛋白;2.黄嘌呤氧化酶;3.过碘酸稀夫Ⅲ/Ⅳ;4.嗜乳脂蛋白;5.过碘酸稀夫6;6.过碘酸稀夫7。
为了说明在提取过程中母乳和牛乳中沉淀的蛋白是否需要除去,保证除去杂蛋白,而又能保留目标蛋白,取其提取过程中前3 次离心后沉淀蛋白进行SDS-PAGE分析,由图1可以看出,N1含有大量酪蛋白,有必要去除;N2含有少量酪蛋白,必要的时候可以去除;M1含有少量酪蛋白,为了不影响后续实验需要将其去除;M2从条带上看已经几乎没有酪蛋白及其他杂蛋白的存在,所以第1次洗后的沉淀蛋白可以不去除;M3、M4从条带上看是没有酪蛋白及其他杂蛋白影响的,所以可以不去除。值得注意的是,对实验中每次PBS溶液洗后弃去的上清液电泳分析后,会有少量的MFGM蛋白,所以实验中用PBS溶液洗的次数过多后会有MFGM蛋白损失。由SDSPAGE结果除了可以看出牛乳和母乳在提取过程中的差异,还可以得出在提取过程中需要用PBS溶液洗合适的次数,排除杂蛋白的干扰外,不至于损失过多MFGM蛋白,得到纯度较高的MFGM蛋白。
2.2 皮尔斯
TM去垢小柱法样品前处理结果
在处理MFGM蛋白样品时,为了使MFGM上附着的蛋白充分解离,并促使蛋白质结构充分展开,实验中需要使用去垢剂将其裂解,本实验所使用的是SDS裂解液,但残留的SDS会降低酶解效率、干扰肽段的色谱分离并对目标物离子化过程产生强烈的离子抑制作用
[23],对质谱检测产生不利影响,必须将其除去。目前脱除SDS的方法中,使用较多的是Wisniewski等
[24]的方法,即利用超滤管辅助样品前处理(Filter aided proteome preparation,FASP)法来脱除SDS。实验过程中发现,超滤管对SDS耐受度低,并且该法存在步骤繁琐、损失过多等问题。采用皮尔斯™去垢小柱通过简单操作,可以很好的去除SDS。曹晓琳等
[17]将该新型亲和小柱用于水稻蛋白质样品的净化中,并对比了传统的FASP法、丙酮沉淀法和皮尔斯
TM去垢小柱法对SDS的去除效果,参考文献结果,以5 mL的牛乳为样品做验证实验,提取MFGM蛋白后,运用FASP法和皮尔斯
TM去垢小柱法2 种前处理方法,经NanoLC-Orbitrap质谱对提取蛋白分析,FASP法识别出的354 种蛋白质;皮尔斯
TM去垢小柱法识别出568 种蛋白质,是FASP法的1.6 倍。由此可知,皮尔斯去垢小柱法不但操作简单,而且具有更高的提取率。
本实验运用操作简单且结果较好的皮尔斯™去垢小柱法对8 mL的牛乳和母乳成熟乳进行实验,每个样品2 个技术重复。
2.3 Q Exactive Orbitrap质谱仪检测结果
将提取的母乳和牛乳蛋白样品经过皮尔斯
TM去垢小柱法前处理后,采用纳升液相色谱-串联Q Exactive Orbitrap质谱仪检测,将得到的RAW源文件进行SEQUEST HT比对。在牛乳的2 个平行样品中分别检测到了579 种和525 种蛋白质,母乳的2 个平行样品中分别检测到了1 254 种和1 215 种蛋白质,母乳中所检测到的蛋白种类约是牛乳中的2.2 倍。其中,选取稳定检测到的蛋白进行下一步的分析。
对于母乳和牛乳来说,首先选取样品中unique peptide大于1的蛋白进行进一步分析;其次,为了方便不同物种间蛋白的比较,以蛋白uniprot标准名称为索引,选择母乳样品和牛乳样品中共有的蛋白进行后续的分析。
2.3.1 母乳和牛乳质谱检测结果的对比分析
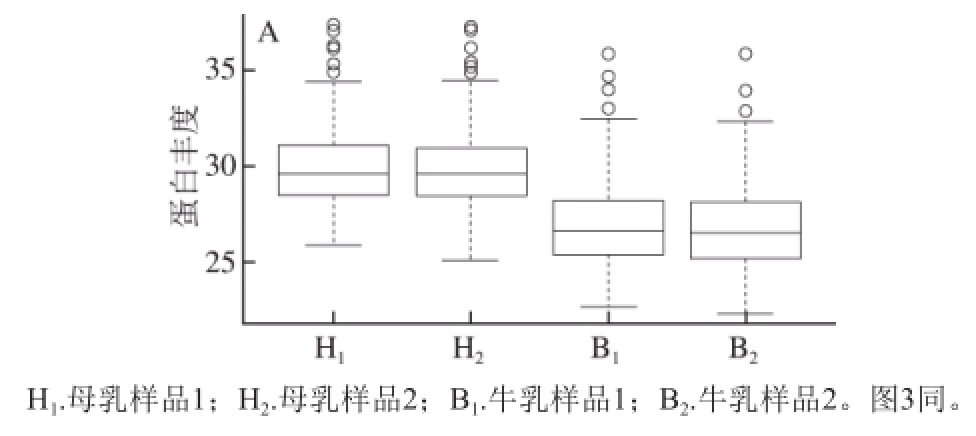
为了从整体上对母乳和牛乳蛋白样品的比对结果进行分析,对母乳和牛乳样品结果进行盒形图分析,如图2A所示。盒形图显示在母乳H
1、H
2和牛乳B
1、B
22 个平行样品中,蛋白丰度(log
2转换)的分布情况。可以看到,首先,牛乳和母乳2 个平行样品的重复性较好,说明前处理过程和仪器分析的误差小,结果较为可靠,可用于后续分析。其次,整体来说,母乳中蛋白丰度的中位数要高于牛乳蛋白丰度的中位数,可以说明母乳中的MFGM蛋白含量明显比牛乳中的高。
进一步比较母乳和牛乳中的MFGM蛋白的差异,如图2B所示(经过unique peptide不小于1筛选),母乳和牛乳中分别检测到863 种和454 种蛋白,其中二者共有175 种,分别独有688 种和279 种,母乳中差异蛋白数量约为牛乳的2 倍。
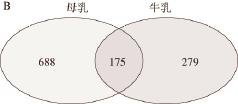
图2 2组MFGM蛋白的盒形图(A)和韦恩图(B)
Fig.2 Venn diagrams of two groups of MFGM proteins
进一步对母乳和牛乳中共有的175 种蛋白的丰度情况进行层次聚类分析和热图展示,以对这些蛋白在母乳和牛乳中的丰度进行整体性的概览,如图3所示。绝大部分蛋白在母乳中含量均高于牛乳,如Clusterin等,而其余少数蛋白则是在牛乳中的丰度高于母乳,如protein S100-A8、Musin-15等。个别蛋白在2 种乳品中没有明显差异,如Butyrophilin subfamily 1 member A1等。
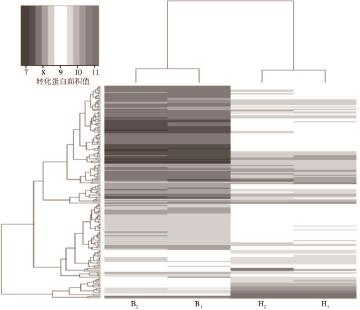
图3 2组MFGM蛋白的聚类热图
Fig.3 Clustering and heat maps of two groups of MFGM proteins
虽然母乳和牛乳中MFGM有差异,但是2 种样品中均含有丰度相对较高且有显著生理功能的几种蛋白:黄嘌呤脱氢酶/氧化酶、嗜乳脂蛋白、组织糖蛋白高碘酸稀尔6/7、脂肪酸结合蛋白、血小板糖蛋白4、黏蛋白-1和脂滴包被蛋白等
[14,25]。为此,将母乳和牛乳的这几种蛋白的面积值进行对比分析,从表1可以看出,7 种主要蛋白的面积均值均不相同,除脂肪酸结合蛋白在牛乳中较大外,其他蛋白均在母乳中较大,有的蛋白的面积值甚至大出了几倍。从这些较高丰度蛋白在一定程度上可以反映出与母乳相比,牛乳的MFGM蛋白还是有一定差距的。
表1 乳中7种MFGM蛋白
Table1 Seven milk fat globule membrane proteins in breast milk andbovine milk
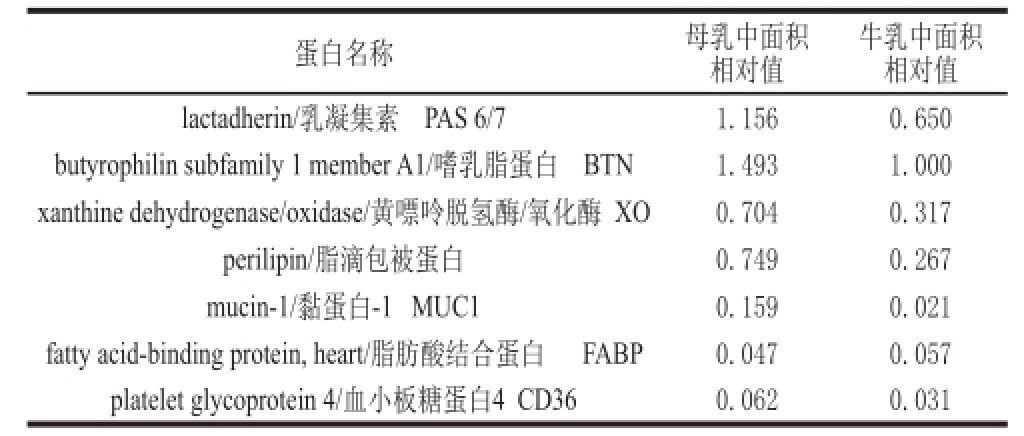
注:其中以牛乳中嗜乳脂蛋白的面积均值1.088×10
11设为标准值1。
牛乳中面积相对值lactadherin/乳凝集素 PAS 6/71.156 0.650 butyrophili n subfamily 1 member A1/嗜乳脂蛋白 BTN1.493 1.000 xanthine dehydrogenase/oxidase/黄嘌呤脱氢酶/氧化酶 XO0.704 0.317 perilipin/脂滴包被蛋白0.749 0.267 mucin-1/黏蛋白-1 MUC10.159 0.021 fatty acid-binding protein, heart/脂肪酸结合蛋白 FABP0.047 0.057 platelet glycoprotein 4/血小板糖蛋白4 CD360.062 0.031蛋白名称母乳中面积相对值
2.3.2 差异蛋白的GO注释分析
对蛋白质功能性质的研究有助于提高对乳中蛋白的认识和利用
[5]。为了进一步认识母乳和牛乳中MFGM蛋白的差异,以牛乳为本体,将母乳中差异表达的688 种MFGM蛋白按PANTHER数据库进行蛋白质的GO注释,分别对其细胞成分、生物途径以及分子功能3 个方面的信息进行归类
[21]。如图4所示,在母乳中MFGM的差异表达蛋白中,41.6%的是细胞部分、24.3%的是细胞器、16.0%的是高分子复合物、10.3%的是膜以及少量的胞外区以及细胞外基质;差异表达蛋白参与了很多生物途径,其中有32.2%的蛋白参与代谢过程,19.8%的蛋白参与细胞过程,10.7%的蛋白参与定位过程,其余蛋白分别参与了生物调节、发展历程、刺激性反应、免疫系统过程、凋亡过程、再生作用等,母乳中这些差异蛋白的分子功能主要是催化活性和黏性,分别占蛋白的38.4%和30.6%,还有结构分子活性、转运活性、受体活性、抗氧化剂活性等多个分子功能。同样,将牛乳中的MFGM蛋白依据PANTHER数据库进行蛋白质的GO注释,分析其细胞成分、生物途径和分子功能3 个方面的信息,都与母乳中的这些差异蛋白有很多重叠,但是3 个部分所占比例不同,所以,牛乳中MFGM蛋白某些功能和母乳是一样的,但是由于生物体的差异,其含量是不同的。
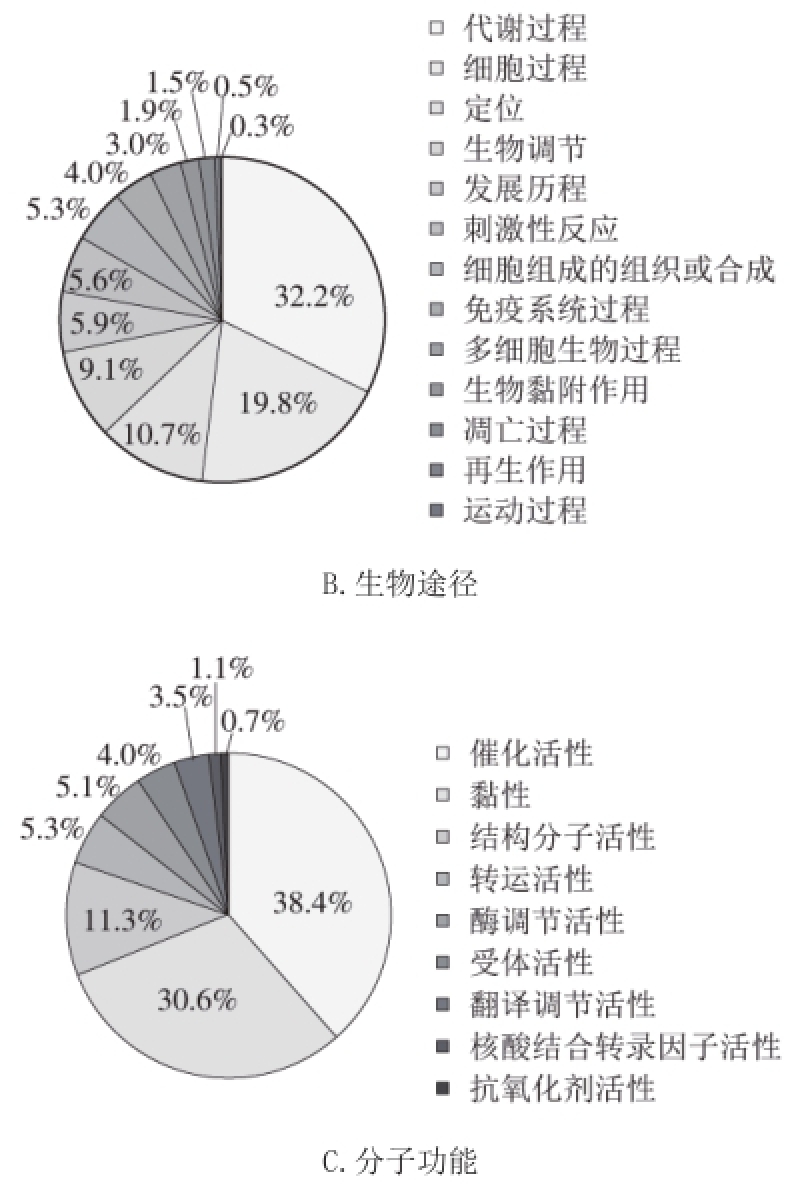
图4 母乳中MFGM差异蛋白的GO注释图
Fig.4 GO annotations of specific MFGM proteins in human milk
2.3.3 差异蛋白的KEGG代谢路径分析

图5 母乳中MFGM差异蛋白的KEGG代谢路径图
Fig.5 KEGG pathway analysis of specific MFGM proteins in human milk
为了更进一步的了解母乳和牛乳MFGM蛋白中差异蛋白的代谢路径,以牛乳为本体,采用DAVID在线分析平台对母乳中具有差异表达的688 种MFGM蛋白进行KEGG代谢路径分析,结果有461 种蛋白被识别,其中有44.7%的蛋白(即206 种)有代谢路径信息,其中每个路径中蛋白数大于2的有31.2%即144 种,共有19 个代谢路径,除去与牛乳中代谢路径重叠的核糖体、糖酵解途径、过氧化物酶体增殖物激活受体信号通路、丙酮酸代谢等路径外,其余差异蛋白参与的路径如图5所示,包括:氨酰tRNA生物合成、致病性大肠杆菌感染、脂肪酸代谢、丙酸代谢、甾体合成、酸降解等。结果表明,母乳中MFGM蛋白参与的代谢路径较牛乳中MFGM蛋白多。牛乳中MFGM蛋白在某些代谢途径上还是无法达到母乳中MFGM蛋白的功能特性。
3 结 论
本实验分别以8 mL的母乳成熟乳和牛乳为原料经有机试剂提取后,采用皮尔斯™去垢小柱法前处理,采用NanoLC-Orbitrap质谱对牛乳中的MFGM蛋白质进行检测分析,并进行相关生物信息分析。
通过SDS-PAGE分析提取母乳和牛乳的MFGM蛋白过程中的差异,结果表明母乳和牛乳的MFGM蛋白提取过程具有很大差别,所以要根据不同的乳源进行不同的提取,以便达到实验所要求的纯度而又达到较高的产率;采用皮尔斯™去垢小柱法进行样品前处理,运用简单的操作可以很好地去除SDS,避免了运用FASP法中样品的损失;通过高分辨质谱仪检测,发现母乳所检测到的MFGM蛋白种类约是牛乳种类的2.2 倍;利用盒形图、热图聚类、韦恩图,从种类和丰度上直观的对比了母乳和牛乳的差异,显示出与牛乳MFGM蛋白相比,母乳中的MFGM蛋白不但种类多而且丰度高;以牛乳为本体,对母乳中特有的MFGM差异蛋白做GO注释,与牛乳中MFGM蛋白功能相比,细胞成分、生物途径以及分子功能3 个方面的信息有很多重叠,从GO注释的结果对比来看,与母乳相比牛乳中的MFGM蛋白在功能方面可以起到一定的作用;通过KEGG代谢通路比较,母乳中具有差异表达的MFGM蛋白参与的代谢途径虽然和牛乳中只有少部分重叠,氨酰tRNA生物合成、致病性大肠杆菌感染、脂肪酸代谢、丙酸代谢、甾体合成、酸降解等这些途径是母乳中MFGM蛋白所参与的,所以牛乳MFGM蛋白还是与母乳MFGM蛋白有一定差距。
通过以上结果可以看出,MFGM蛋白在母乳和牛乳中具有明显差异,其中虽然有部分组成和功能重叠,但是在丰度和代谢路径上,牛乳MFGM蛋白并不能替代母乳MFGM蛋白。目前婴幼儿配方粉的研究主要关注在几种主要蛋白含量的差异、乳脂肪的差异、微量元素的添加和其他一些营养物质的添加
[1],而随着蛋白质组学的应用,MFGM蛋白在母乳和牛乳中的差异也得以进行深入研究,这对开发含MFGM蛋白的婴幼儿配方奶粉具有重要意义。
参考文献:
[1] 庞彩霞. 婴儿配方乳研究现状[J]. 农产品加工(学刊), 2008(11): 66-68. DOI:10.3969/j.issn.1671-9646-B.2007.11.020.
[2] LUCAS A. Programming by early nutrition: an experimental approach[J]. Journal of Nutrition, 1998, 128(Suppl 2): 401S-406S.
[3] 田建军, 张开屏, 李国君, 等. 婴幼儿配方奶粉的研究方法[J]. 中国供销商情(乳业导刊), 2005(8): 31-34.
[4] 柏丹丹. 母乳营养成分含量的测定[D]. 苏州: 苏州大学, 2013.
[5] 芦晶, 刘鹭, 张书文, 等. 蛋白质组学技术在乳品研究中的应用[J]. 生物技术进展, 2013, 3(6): 385-388. DOI:10.3969/ j.issn.2095-2341.2013.06.01.
[6] MARIE-CAROLINE M, MICHEL O, VALÉRIE B, et al. Native fat globules of different sizes selected from raw milk: thermal and structural behavior[J]. Chemistry and Physics of Lipids, 2004, 132(2):247-261. DOI:10.1016/j.chemphyslip.2004.08.007.
[7] DEWETTINCK K, ROMBAUT R, THIENPONT N, et al. Nutritional and technological aspects of milk fat globule me mbrane material[J]. International Dairy Journal, 2008, 18(5): 436-457. DOI:10.1016/ j.idairyj.2007.10.014.
[8] MATHER I H. A review and proposed nomenclature for major proteins of the milk-fat globule membrane1, 2[J]. Journal of Dairy Science, 2000, 83(2): 203-247. DOI:10.3168/jds.S0022-0302(00)74870-3.
[9] SPITSBERG V L, GOREWIT R C. Isolation, purification and characterization of fatty-acid-binding protein from milk fat globule membrane: effect of bovine growth hormone treatment[J]. Pakistan Journal of Nutrition, 2002. DOI:10.3923/pjn.2002.43.48.
[10] NEWBURG D S. Human-milk lactadherin in protection against rotavirus[J]. Lancet, 1998, 351: 1815-1816. DOI:10.1016/S0140-6736(05)78783-3.
[11] CEBO C, CAILLAT H, BOUV IER F, et al. Major proteins of the goat milk fat globule membrane[J]. Journal of Dairy Science, 2010, 93(3):868- 876. DOI:10.3168/jds.2009-2638.
[12] PISANU S, GHISAURA S, PAGNOZZI D, et al. The sheep milk fat globule membrane proteome[J]. Journal of Proteomics, 2011, 74(3):350-358. DOI:10.1016/j.jprot.2010.11.011.
[13] 何胜华, 马莺, 崔艳华, 等. 牦 牛乳脂肪球膜组成分析及蛋白热稳定性[J]. 哈尔滨工业大学学报, 2012, 44(10): 104-108.
[14] 隋顺超. 对转基因克隆牛乳脂肪球膜蛋白质及四种牛奶蛋白质组学研究[D]. 北京: 中国农业大学, 2014.
[15] 马莺, 姬晓曦, 李琳. 一种牦牛乳乳脂肪球膜蛋白的分离方法: 中国, CN 102863526 A[P]. 2013-01-09.
[16] AFFOLTER M, GRASS L, VANROBAEYS F, et al. Qualitative and quantitative profiling of the bovine milk fat globule membrane proteome[J]. Journal of Proteomics, 2010, 73(6): 1079-1088. DOI:10.1016/j.jprot.2009.11.008.
[17] 曹晓林, 巩佳第, 陈铭学, 等. 新型亲和去垢小柱净化-液相色谱- 串联质谱法分析水稻叶片蛋白质组[J]. 色谱, 2014, 32(11): 1181-1186. DOI:10.3724/SP.J.1123.2014.06035.
[18] ANTHARAVALLY B S, MALLIA K A, ROSENBLATT M M, et al. Effi cient removal of detergents from proteins and peptides in a spin column format[J]. Analytical Biochemistry, 2011, 416(1): 39-44. DOI:10.1016/j.ab.2011.05.013.
[19] 陈达炜, 高洁, 吕冰, 等. 超高效液相色谱-高分辨质谱法快速筛查土豆中的多种农药残留[J]. 分析化学, 2014, 42(4): 579-584. DOI:10.3724/SP.J.1096.2014. 30989.
[20] 安卓玲, 史忱, 赵瑞, 等. 基于超高效液相色谱-质谱的药物性肝损伤患者血清代谢组学研究[J]. 分析化学, 2015, 43(9): 1408-1414. DOI:10.11895/j.issn.0253-3820.150261.
[21] 黄宇, 冯晶, 饶力群, 等. 质谱非标记定量分析小麦抗条锈病近等基因系蛋白质变化[J]. 生物技术通报, 2014, 15(6): 88-95.
[22] ZHANG W, GU P, JIANG Z, et al. The o ne hour proteome: Q-OT-qIT mass spectrometry based rapid proteome identifi cation[J]. Scientia Sinica Vitae, 2014, 44(5): 528-536. DOI:10.1360/05201 4-16.
[23] ALESSANDRO T, GRAZIA B, DANIELA P, et al. Comparison of detergent-based sample preparation workflows for LTQ-Orbitrap analysis of the Escherichia coli proteome[J]. Proteomics, 2013, 13(17):2597-2607. DOI:10.1002/pmic.201200478.
[24] WISNIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al. Universal sample preparation method for proteome analysis[J]. Nature Methods, 2009, 6(5): 359-362. DOI:10.1038/nmeth.1322.
[25] 何胜华, 李海梅, 马莺. 乳脂肪球膜(MFGM)的组成及生理特性[J].中国乳品工业 , 2009, 37(4): 38-41.
Analysis of Differences in Milk Fat Globule Membrane Proteins between Breast Milk and Bovine Milk
JING Mengna
1,2, JIANG Tiemin
2, LIU Bin
2, ZHANG Dongdong
2, WEI Jinghua
1,2, WANG Pin
1,2, LI Jufang
2, CHEN Lijun
1,2,*
(1. School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China;2. National Maternal and Infant Health Dairy Researching Center, Beijing Sanyuan Foods Co. Ltd., Beijing 100163, China)
Abstract:In order to compare the difference in milk fat globule membrane (MFGM) proteins between breast milk and bovine milk, MFGM were extracted from milk by organic solvent extraction and lysed in SDS-containing lysis buffer for analysis by liquid chromatography and mass spectrometry (LC-MS) after the removal of SDS using Pierce
TMdetergent removal spin column. The results were filtered according to the number of unique peptide ≥ 1. A total of 863 and 454 proteins were identifi ed separately in breast milk and bovine milk, including 175 proteins in common, and 688 and 279 proteins unique for breast milk and bovine milk, respectively. Gene Ontology (GO) analysis of 688 specifi c MFGM proteins in human milk showed that they were mainly distributed in cell part, cell organelle, and cell membrane, and involved in biological pathways such as metabolic processes, biological regulation, response to stimulus, immune system process, reproduction, and so on. These proteins also participated in many molecular functions, such as catalytic activity, binding, transport activity and enzyme regulation activity. In addition, these breast milk MFGM proteins were involved in some metabolic pathways, such as aminoacyl-tRNA biosynthesis, pathogenic Escherichia coli infection, fatty acid metabolism, propanoate metabolism, steroid biosynthesis, lysine degradation, which were not shown in bovine milk. The MFGM proteins in breast milk and bovine milk had obvious differences. Although some compositions and functions were overlapped, in terms of abundance and metabolic pathways, the MFGM proteins in bovine milk could not be replaced by those in breast milk.
Key words:milk fat globule membrane proteins; breast milk; bovine milk; functional annotation; metabolic pathway
DOI:10.7506/spkx1002-6630-201620012
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2016)20-0069-06
引文格式:
景萌娜, 姜铁民, 刘斌, 等. 母乳和牛乳中乳脂肪球膜蛋白质的差异分析[J]. 食品科学, 2016, 37(20): 69-74.
DOI:10.7506/spkx1002-6630-201620012. http://www.spkx.net.cn
JING Mengna, JIANG Tiemin, LIU Bin, et al. Analysis of differences in milk fat globule membrane proteins between breast milk and bovine milk[J]. Food Science, 2016, 37(20): 69-74. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201620012. http://www.spkx.net.cn
收稿日期:2016-01-13
基金项目:北京市科技计划项目(D141100004814001)
作者简介:景萌娜(1990—),女,硕士研究生,研究方向为发酵乳制品。E-mail:479560904@qq.com
*通信作者:陈历俊(1967—),男,教授级高级工程师,博士,研究方向为乳品科学。E-mail:chenlijun@sanyuan.com.cn