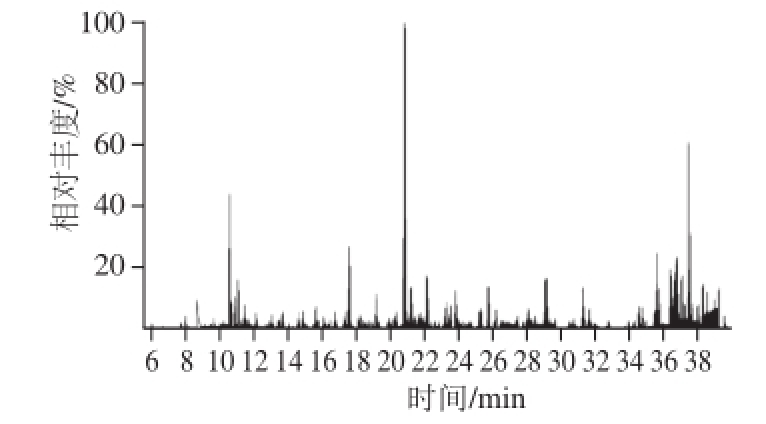
图1 51 种农药的总离子流色谱图
Fig.1 Total ion current chromatograms of 51 pesticides from spiked sorghum sample
孟祥龙,张云清,范广宇,徐文科,唐 秀,姚燕林
(连云港出入境检验检疫局,江苏 连云港 222042)
摘 要:为建立用气相色谱-三重四极杆串联质谱仪检测进出口粮谷中51 种农药残留的方法,通过考察不同加速溶剂萃取温度和萃取试剂的实验效果,建立了最优加速溶剂萃取条件,分别以高粱和大麦为研究基质,比较了3 种净化方式的净化效果,通过气相色谱-三重四极杆串联质谱仪有效解决了粮谷中多农药残留检测的问题,在系统优化的基础上建立了高粱中多种农药残留检测方法,并用大麦和燕麦其他的粮谷基质考察检测方法的适应性,同时对3 个添加水平6 个高粱、大麦、燕麦平行样品分析,该方法的回收率为62.4%~119.7%,相对标准偏差为0.5%~17.3%,检出限为0.03~2.07 µg/kg,方法相关指标均满足检测要求,适用于粮谷中农药残留高通量检测需要。
关键词:气相色谱-三重四极杆串联质谱法;加速溶剂萃取;多农药残留;粮谷
粮谷作为初级农产品,是我国十分重要的战略物资,随着国外对农药最大残留限量要求不断提高,我国农产品出口遭遇贸易壁垒特别是技术性贸易壁垒,大有愈演愈烈之势,同时国内农产品也受到国外农产品的冲
击,优势农产品出口受阻,劣势农产品遭遇进口产品冲击,这些使我国农业结构调整面临很大压力,直接影响农民收入的增加。
农药多残留分析是在复杂的样品基质中测定多种农药,而样品中有数百种自然存在的干扰物质,其浓度比农药高出很多倍 [1],农药多残留分析时进行样品前处理不仅要求尽可能完全提取其中的待测组分,而且还要求尽可能除去与目标物同时存在的杂质,避免对色谱柱和检测器等的污染。目前,农药多残留分析前处理常用的方法有固相萃取法 [2]、加速溶剂萃取法 [3]、分散固相萃取法 [4]、基质固相分散萃取法 [5]、凝胶渗透色谱技术法 [6]等,而凝胶渗透色谱技术存在溶剂用量较大,样品处理时间较长,不利于样品的批量快速处理 [7]等问题,当前样品前处理技术正向着快速、有效、减少溶剂、减少对环境的污染、微型化和自动化方向发展 [8],加速溶剂萃取技术作为一种新的萃取技术,集萃取时间短、溶剂消耗少、自动控制于一体等优点,很快成为各国的环境、食品等样品中农药残留的标准萃取方法,美国环保署固体废弃物有害物质的标准测定方法EPA SW-864 Method 3545A《加压液体萃取法》和我国粮谷多农残的检测标准 GB/T 19649—2006《粮谷中475种农药及相关化学品残留量的测定:气相色谱-质谱法》均采用加速溶剂萃取技术。
在多农药残留检测中,某些极性、结构类似的化合物会出现部分甚至完全重叠,质谱图互相交错、干扰。因此对重叠农药峰的确证成为残留分析方法建立的难点。当前的农残分析方法主要有气相色谱法 [9-10]、气相色谱-质谱法 [11]、气相色谱-串联质谱法 [12]和液相色谱-串联质谱法 [13]。气相色谱法灵敏度高,但抗干扰能力差,对样品前处理净化要求较高,气相色谱-串联质谱法在定性方面优于气相色谱,但基质碎片离子和柱流出物碎片离子会对目标分析物产生干扰,而串联质谱技术通过多反应监测(multiple reaction monitoring,MRM)可以在复杂样本体系中进行目标化合物进行快速定量,串联质谱可提高灵敏度,对一级质谱无法区分的化合物可进行进一步的确认 [14-15]。近年来,加速溶剂萃取技术的应用主要集中食品、土壤、茶叶等基质 [16-21],加速溶剂萃取技术结合气相色谱-三重四极杆串联质谱技术在粮谷多农残方面的应用在国内外尚未见报道,本研究适应当前农残前处理发展趋势,结合加速溶剂萃取法、固相萃取法、分散固相萃取3 种前处理技术对粮谷样品的前处理条件进行优化,采用气相色谱-三重四极杆串联质谱仪多反应监测技术对进出口粮谷中51 种多农药残留进行检测,该方法抗干扰能力强、灵敏度高、检出限低,完全可以满足主要贸易国家及我国对粮谷农残检测的需求。
1.1 材料与试剂
进口高粱、大麦、燕麦样品,粉碎机粉碎后过40 目筛。
51 种农残标准品:固体标准品纯度均大于90%,氟酰胺(CAS:66332-96-5)、乙嘧酚磺酸酯(CAS:41483-43-6)、戊唑醇(CAS:107534-96-3)、禾草灵(CAS:51338-27-3)、哒嗪硫磷(CAS:119-12-0)、丙环唑(CAS:60207-90-1)、胺菊酯(CAS:7696-12-0)、甲氧滴滴涕(CAS:72-43-5)、三氯杀螨砜(CAS:116-29-0)、吡菌磷(CAS:13457-18-6)、二甲戊乐灵(CAS:40487-42-1)、戊菌唑(CAS:66246-88-6)、苯胺灵(CAS:122-42-9)、土菌灵(CAS:2593-15-9)、环草特(CAS:1134-23-2)、乙丁烯氟灵(CAS:55283-68-6)、甲拌磷(CAS:298-02-2)、西玛津(CAS:122-37-9)、异恶草酮(CAS:81777-89-1)、乙烯菌核利(CAS:50471-44-8)、苯硫威(CAS:62850-32-2))购自德国Dr. Ehrenstorfer公司;液体标液质量浓度均为100 µg/mL,甲霜灵(CAS:70630-17-0)、杀螟硫磷(CAS:122-14-5)、艾氏剂(CAS:309-00-2)、马拉硫磷(CAS:121-75-5)、倍硫磷(CAS:55-38-9)、毒死蜱(CAS:2921-88-2)、对硫磷(CAS:56-38-2)、三唑酮(CAS:43121-43-3)、喹硫磷(CAS:13593-03-8)、稻丰散(CAS:2597-03-7)、腐霉利(CAS:32809-16-8)、反式氯丹(CAS:5103-74-2)、杀扑磷(CAS:950-37-8)、克线磷(CAS:22224-92-6)、丙硫磷(CAS:34643-46-4)、狄氏剂(CAS:60-57-1)、丰索磷(CAS:115-90-2)、噁霜灵(CAS:77732-09-3)、乙硫磷(CAS:563-12-2)、联苯菊酯(CAS:82657-04-3)、氯氰菊酯(CAS:52315-07-8)、五氯硝基苯(CAS:82-68-8)、地虫硫磷(CAS:944-22-9)、胺丙畏(CAS:31218-83-4)、二嗪农(CAS:333-41-5)、乙嘧硫磷(CAS:38260-54-7)、除线磷(CAS:97-17-6)、环丙津(CAS:22936-86-3)、甲基对硫磷(CAS:298-00-0)、皮蝇磷(CAS:299-84-3)购自农业部环境保护科研监测所;有机溶剂为色谱级;Carb-NH 2柱(6 mL/0.5 g) 天津天兴达公司;Florisil固相萃取柱(6 mL/1 g)、PSA固相萃取粉末、C 18固相萃取粉末美国安捷伦公司。
1.2 仪器与设备
TSQ QuantumXLS气相色谱-串联谱联用仪(配电子电离源)、ASE350加速溶剂萃取仪(22 mL萃取池) 美国戴安公司;OA-SYS氮吹仪 美国Organomation公司。
1.3 方法
1.3.1 标准储备溶液配制
准确称取固体标准品各50.0 mg,置于同一只100 mL
容量瓶中,用丙酮稀释并定容,得质量浓度为500 µg/mL的混合标准储备液Ⅰ,再进一步稀释成质量浓度为100 µg/mL的混合标准储备液Ⅱ,准确量取1 mL标准储备液Ⅱ和购买的100 µg/mL的液体标准溶液置于同一只50 mL容量瓶中,用丙酮稀释定容,再逐级稀释后得质量浓度均为1 µg/mL的51 种农药的混合标准储备液,所有的储备液均于-18 ℃冰箱中保存备用,其中配制的500 µg/mL的储备液Ⅰ保存期为6 个月,外购的含质量浓度为100 µg/mL的标准溶液有效期根据证书均为12 个月,其他混合标准溶液保存期为20 d,使用前恢复至室温。
1.3.2 样品处理
1.3.2.1 样品提取
取粮谷样品5 g样品(精确至0.01 g),加适量水润湿样品,与硅藻土混合,研磨均匀后,移入加速溶剂萃取仪的22 mL萃取池中,在10 342.5 kPa压力,100 ℃条件下,加热时间5 min,静态萃取时间3 min,静态循环3 次,用池体积的60%的乙腈冲洗萃取池,氮气吹扫100 s,萃取完毕后,收集萃取液,待后续处理。
1.3.2.2 样品净化
将1.3.2.1节萃取液(乙腈相)通过C 18固相萃取柱(C 18事先用10 mL乙腈活化),再用15 mL乙腈洗脱于平底烧瓶中,于39 ℃条件下减压浓缩,至近干后用4 mL乙腈-甲苯(3∶1,V/V)溶解,充分涡旋,待进一步净化。
第2步固相萃取净化采用Carb-NH 2柱,先在Carb-NH 2柱里加2 cm高的无水硫酸钠,用10 mL乙腈-甲苯(3∶1,V/V)溶液活化,用2 mL乙腈-甲苯(3∶1,V/V)洗涤平底烧瓶并重复3 次,上样后再用10mL乙腈-甲苯(3∶1,V/V)溶液洗脱,洗脱液在39 ℃条件下浓缩至近干,用2 mL的丙酮转移到10 mL试管中,重复3 次,氮气吹干,用1 mL的丙酮-正己烷(1∶1,V/V)溶解后,待加速溶剂萃取技术结合气相色谱-三重四极杆串联质谱技术测定。
1.3.3 仪器条件
1.3.3.1 气相色谱-质谱条件
色谱柱:HP-5MS(30 m×0.25 mm,0.25 µm);柱温条件:50 ℃保持1 min,20 ℃/min升至150 ℃,3℃/min升至230 ℃,10 ℃/min升至300 ℃,保持5 min;载气:高纯氦气,流速:1.5 mL/min;进样口温度:250 ℃;进样量:1 μL;进样模式:不分流进样;辅助传输线温度:280 ℃。
1.3.3.2 TSQ Quantum XLS质谱仪参数
离子源温度:250 ℃;发射电流:50 µA;离子源:电子电离源;分析模式:MRM;碰撞气压力:0.1596 Pa (Ar);溶剂延迟:4 min。在高粱阴性基质中添加51 种农药标准溶液(0.01 mg/kg)的总离子流图见图1。

图1 51 种农药的总离子流色谱图
Fig.1 Total ion current chromatograms of 51 pesticides from spiked sorghum sample
2.1 加速溶剂萃取仪提取溶剂的选择
加速溶剂萃取常用的提取溶剂主要有乙腈、丙酮、乙酸乙酯等,分别比较了乙腈、丙酮作为萃取溶剂时的提取效果,研究发现使用乙腈时收集瓶内的液体有部分白色浑浊,可能是从高粱中提取的部分脂肪和蛋白类物质在乙腈中形成沉淀的原因,而用丙酮和乙酸乙酯时,收集瓶内的液体澄清透明,而且提取液的颜色较深,说明用丙酮和乙酸乙酯做提取溶剂时,溶剂中共萃取物较多,引入了较多干扰,从而增大了后面的净化压力,而用乙腈通用性强,对农药溶解度较大,对油脂和色素的提取率低,基质干扰少 [22],所以,选择乙腈作为加速溶剂萃取仪的提取溶剂。
2.2 加速溶剂萃取温度的优化
在加速溶剂萃取仪中,萃取压力一般采用10 342.5 kPa,在压力固定的条件下,其他影响萃取效果的主要因素有提取溶剂、提取温度、静态循环次数3 个参数,在静态时间固定的情况下,静态循环次数越多,回收率越大,所以静态循环次数也无需优化,循环次数一般为1~3 次,这里设定静态循环次数3 次,只需再对萃取温度进行优化即可,在萃取溶剂为乙腈的条件下,分别选择萃取温度80、100、120、140 ℃四个参数,通过添加回收率数据来优化萃取温度参数。以高粱样品为研究对象,在每个方法中平行测定3 个高粱标准添加样品,标准添加量为0.01 µg/kg,结果如表1所示。
表1 不同萃取温度条件下高粱样品实验数据
Table1 Recoveries of 52 pesticides in sorghum at different extraction temperatures
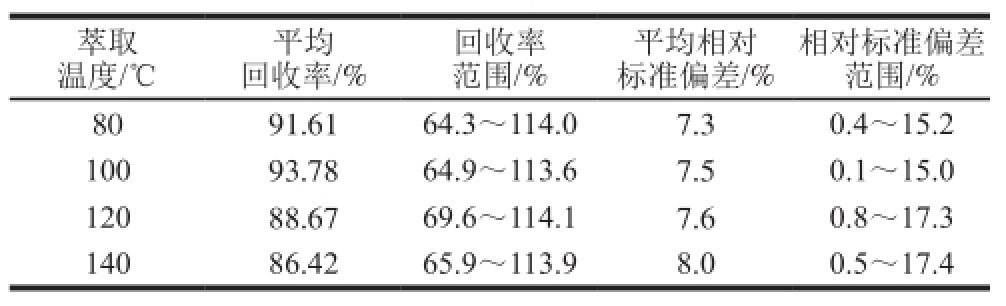
由表1可知,当萃取温度为100 ℃时,萃取效果最好,这可能是由于萃取温度逐渐升高时,有的化合物对热不稳定产生分解,从而降低回收率,而且在温度越高,溶剂中的共萃取物也会更多,也会干扰后续的实验效果。
2.3 固相萃取净化条件的优化
粮谷中的主要基质除了有机酸外,还有大量的淀粉、蛋白质和一些油脂等 [23]。Florisil柱能去除样品基质中的部分色素、脂肪等大分子化合物,Carb-NH 2柱可去除大量色素,去除脂肪能力虽不如Florisil柱,但可应用于绝大部分农药的净化 [24],这里以高粱样品为研究对象,分别对GB/T 19649—2006和NY/T 761—2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》进行改进的基础上,采用3 种净化方式:Florisil柱净化、Carb-NH 2柱净化和分散固相萃取净化处理方式,并比较净化效果。
2.3.1 净化方法1
改进的GB/T 19649—2006方法,具体步骤见1.3.2.2节样品净化部分。
2.3.2 净化方法2
改进的NY761—2008方法:第1步:乙腈相先过C 18固相萃取柱进行净化,C 18柱用10 mL乙腈活化后上样,用15 mL乙腈洗脱,于39 ℃条件下减压浓缩,至近干后用2 mL丙酮-正己烷(1∶9,V/V)溶解,充分涡旋,待进一步净化。
第2步固相萃取净化采用Florisil柱,先在Florisil柱里加2 cm高的无水硫酸钠,分别用5 mL丙酮-正己烷(1∶9,V/V)和5mL的正己烷溶液活化Florisil柱,当溶剂液面到达吸附层表面时,立即倒入上述待净化溶液,然后用10 mL的试管接收洗脱液,上样后用2 mL丙酮-正己烷(1∶9,V/V)洗脱4次,洗脱液在39 ℃条件下氮吹干,用1 mL的丙酮-正己烷(1∶1,V/V)溶解后,待气相色谱-三重四极杆串联质谱仪测定。
2.3.3 净化方法3
分散固相萃取法:将收集的萃取液经少量的无水硫酸钠过滤到平底烧瓶中,再用10 mL乙腈洗涤两次,于39 ℃条件下减压浓缩,用1.5 mL的乙腈转移4 次到试管中,氮气吹干,用2 mL丙酮定容,分别加入100 mg 的PSA粉末和C 18粉末于试管中,涡旋1 min,然后离心5 min,取上清液,过0.22 µm的滤膜,用于气相色谱-三重四极杆串联质谱仪测定。
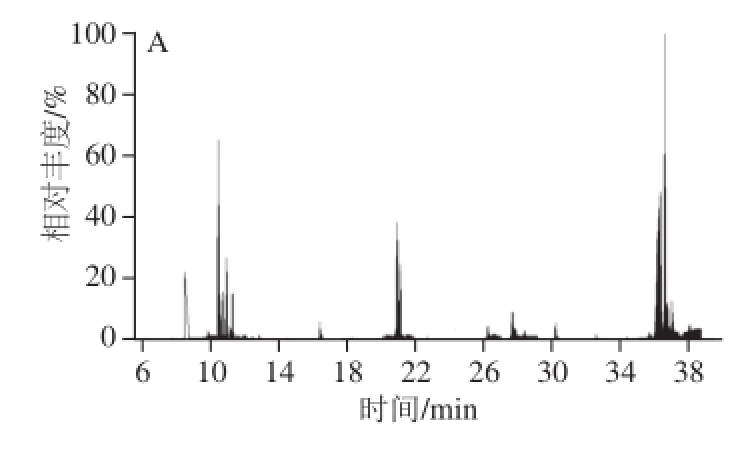

图2 阴性高粱样品经3 种方法净化后的总离子流色谱图
Fig.2 Total ion current chromatogram of blank sorghum barley and sample purified 3 methods
3 种净化方法中处理后的高粱及大麦阴性样品,用MRM模式扫描结果如图2所示,无论高粱还是大麦基质,方法1净化后杂峰较少,明显优于经方法2和方法3净化后的效果,说明经Florisil柱净化后和经分散固相萃取法净化后的基质干扰物较Carb-NH 2净化后的杂质多。
表3 MRM模式下51 种农药的保留时间、监测离子对、碰撞能量、相关系数、基质效应、检出限、定量限
Table3 Retention time, monitoring ion pairs and collision energies, correlation coefficients (R
2), LODs, LOQs and matrix effects of 51 pesticides under multiple reaction monitoring (MRM) mode

表4 多反应监测模式下51 种农药的平均回收率和相对标准偏差
Table4 Average recoveries and RSDs of 51 pesticides under multiple reaction monitoring (MRM) mode
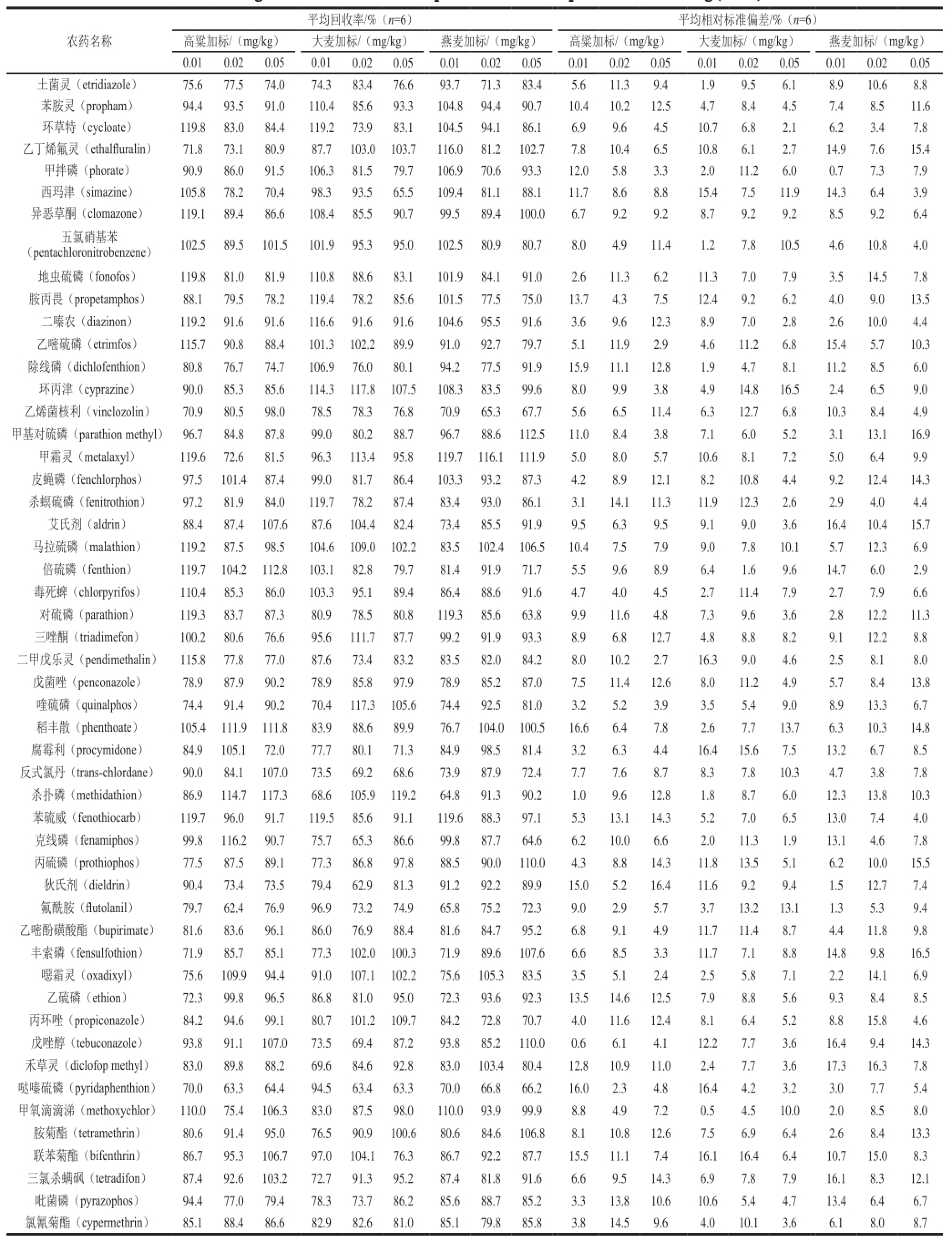
在每个方法中平行测定3 个高粱标准添加样品,标准添加量为0.01 µg/kg,处理结果见表2。经法1净化后的平均回收率最高,每种净化方式的处理后3 个标准添加样品检测数据的变异系数范围为0.283%~16.171%。
表2 高粱3 种净化方法实验数据统计
Table2 Statistics of pesticide recoveries from sorghum with 3 purification methods
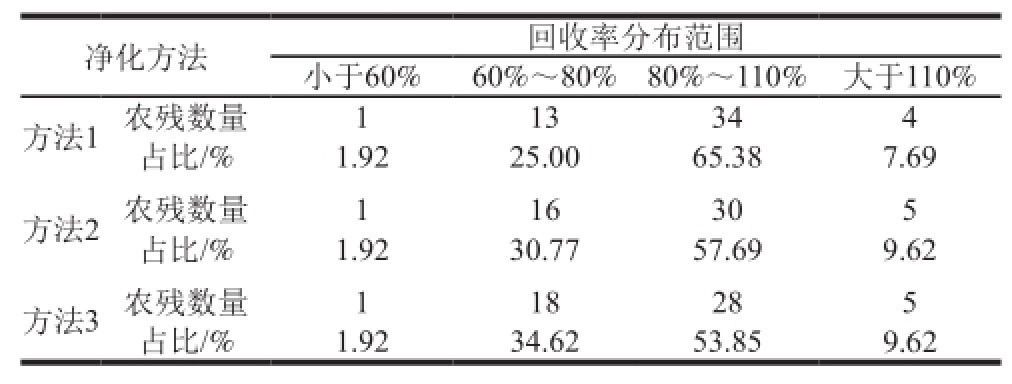
综合以上信息,方法1净化效果最好,且回收率在60%~110%之间数据最多,实验效果最理想,所以前处理方法选定方法1。
2.3.4 仪器条件的优化结果
选择适当质量浓度对51 种农药标准混合溶液进行单级质谱全扫描,通过谱图检索来确定每种农药的保留时间和代表性的母离子碎片,根据母离子碎片和保留时间间隔分组来优化碰撞能量,在设定的碰撞能量下母离子被进一步解离,选择离子强度较大的作为子离子,一般选择两组离子对,分别做定量和定性用,前面的为定量离子对,具体参数见表3。
2.3.5 基质效应考察结果
基质效应的存在会影响到定量的准确性,一般表现为基质增强或基质抑制效应,为考察样品的基质效应,阴性的高粱、大麦、燕麦样品经上述优化后的萃取、净化和检测步骤得到3 种基质溶液,分别用这3 种基质溶液和丙酮溶剂配好的10、20 µg/L的混合标准溶液和样品基质标液,上机后,用基质标样的峰面积除以溶剂标样的峰面积得到的比值r来反映基质增强或是基质抑制效应,其结果见表1,可见绝大多数农药项目在3 种基质中都表现出基质增强效应。
2.3.6 方法的线性关系、检出限
为了消除高粱样品的基质效应,用阴性的高粱样品基质溶液与农药混合标准溶液配制成质量浓度分别为5~200 µg/L的农药基质标准溶液,用农药浓度响应值为纵坐标,质量浓度为横坐标作图,得到线性范围和相关系数,结果见表3,在5~200 µg/L质量浓度范围内,各农药响应值与其质量浓度线性关系良好,相关系数均高于0.99;对空白高粱样品添加一定质量浓度的混合标准溶液,根据上述优化后的前处理和仪器条件,进行样品分析,分别以每种农药3、10 倍信噪比计算检出限和定量限,方法的检出限范围为0.03~2.07 µg/kg,定量限范围为0.12~7.23 µg/kg,此方法在检出限、定量限相关指标方面明显优于郭新东等 [25]在粮谷多农残检测方面的研究报道。
2.3.7 实际样品检测结果
分别在阴性高粱、大麦和燕麦样品中添加0.01、0.02、0.05 mg/kg的混合标准溶液,按上述优化后的前处理和仪器条件,每种基质作6 个平行实验,计算各种农药的平均回收率和相对标准偏差,以考察用高粱样品基质进行优化后的方法在其他不同基质中方法的准确度和精密度,结果见表4,3 种基质的回收率范围为62.4%~119.7%,变异系数范围为0.5%~17.3%,说明适用于高粱的检测方法也同样适用于其他粮谷基质的检测。
本实验通过以高粱为研究对象,建立了快速检测粮谷中51 种农药残留的检测方法,分别从提取过程、净化过程、仪器条件3 个方面进行系统优化的基础上,建立了应用气相色谱-三重四极杆串联质谱法检测高粱的快速检测方法,同时用大麦和燕麦其他的基质考察检测方法的适用性,方法的检出限范围为0.03~2.07 µg/kg,定量限范围为0.05~7.23 µg/kg,回收率范围为62.4%~119.7%,变异系数范围为0.5%~17.3%,结果表明,此方法适用于检测粮谷的多种农药残留的检测。
参考文献:
[1] 钱传范, 刘丰茂, 潘灿平. 农药残留分析原理与方法[M]. 北京: 化学工业出版社, 2011: 284.
[2] HUANG Z Q, ZHANG Y, WANG L B, et al. Simultaneous determination of 103 pesticide residues in tea samples by LC-MS/ MS[J]. Journal of Separation Science, 2009, 32(9): 1294-1301. DOI:10.1002/jssc.200800605.
[3] CHO S K, El ATY A M, PARK Y S, et al. A multiresidue method for the analysis of pesticide residues in polished rice (Oryza sativa L.) using accelerated solvent extraction and gas chromatography and confirmation by mass spectrometry[J]. Biomedical Chromatography, 2007, 21(6): 602-609. DOI:10.1002/bmc.792.
[4] ARIEL R F, ALEJANDRA C, LUIS D M, et al. Dispersive solidphase extraction as a simplified clean-up technique for biological sample extracts. determination of polybrominated diphenyl ethers by gas chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(18): 2490-2496. DOI:10.1016/ j.chroma.2011.02.058.
[5] 李蓉, 卢俊文, 杨芳, 等. 基质固相分散萃取-气相色谱-串联质谱法同时测定蔬菜中195 种农药残留[J]. 食品科学, 2014, 35(24): 301-307. DOI:10.7506/spkx1002-6630-201424058.
[6] WANG J H, CAI F, WANG Y L, et al. Pesticide multiresidue analysis of peanuts using automated gel permeation chromatography clean-up/gas chromatography-mass spectrometry[J]. Journal of AOAC International, 2004, 87(4): 333-339. DOI:10.1080/02652030802350672.
[7] 孟祥龙, 王海涛, 范广宇, 等. 气相色谱-负化学电离离子化-质谱法测定出口泥鳅中的硫丹及其代谢物[J]. 理化检验: 化学分册, 2015, 51(4): 458-461.
[8] 王立. 色谱分析样品处理[M]. 北京: 化学工业出版社, 2006: 2.
[9] 田丽梅, 孙志勇, 向明, 等. 固相萃取.气相色谱法检测金银花中9 种拟除虫菊酯农药残留[J]. 食品科学, 2015, 36(20): 239-241. DOI:10.7506/spkxl002-6630-201520046.
[10] 丁立平, 蔡春平, 王丹红. 双重净化/气相色谱法测定水产品中指示性多氯联苯[J]. 分析测试学报, 2014, 33(10): 1178-1183. DOI:10.3969/j.issn.1004-4957.2014.10.18.
[11] CASTILLO M, GONZÁLEZ C, MIRALLES A. et al. An evaluation method for determination of non-polar pesticide residues in animal fat samples by using dispersive solid-phase extraction clean-up and GCMS[J]. Analytical and Bioanalytical Chemistry, 2011, 400(5): 1315-1328. DOI:10.1007/s00216-011-4656-5.
[12] 李萍萍, 程景, 乐渊. 气相色谱-三重四极杆串联质谱法测定含硫蔬菜中46 种农药残留量[J]. 分析测试学报, 2015, 34(4): 421-427. DOI:10.3969/j.issn.1004-4957.2015.04.008.
[13] 李岩, 郑锋, 王明林, 等. 液相色谱-串联质谱法快速筛查测定浓缩果蔬汁中的156 种农药残留[J]. 色谱, 2009, 27(2): 127-137. DOI:10.3321/j.issn:1000-8713.2009.02.001.
[14] 沈伟健, 余可垚, 桂茜雯, 等. 分散固相萃取-气相色谱-串联质谱法测定蔬菜中107 种农药的残留量[J]. 色谱, 2009, 27(4): 391-396. DOI:10.3321/j.issn:1000-8713.2009.04.003.
[15] 谢文, 钱艳, 丁慧瑛, 等. 液相色谱-电喷雾电离三级四极杆质谱法测定茶叶中6 种烟碱类农药残留[J]. 分析化学, 2009, 37(4): 495-499. DOI:10.3321/j.issn:0253-3820.2009.04.004.
[16] 闫蕊, 邵明媛, 鞠福龙. 加速溶剂萃取-高效液相色谱串联质谱法测定土壤中农药残留[J]. 分析化学, 2013, 41(2): 315-316. DOI:10.3724/SP.J.1096.2013.20965.
[17] 郝昀. 加速溶剂萃取-高效液相色谱法检测磺胺类、氟喹诺酮类及鼠药类药物残留[D]. 保定: 河北大学, 2014: 6-17.
[18] 胡贝贞, 宋伟华, 谢丽萍, 等. 加速溶剂萃取/凝胶渗透色谱-固相萃取净化/气相色谱-质谱法测定茶叶中残留的33 种农药[J]. 色谱, 2008, 26(1): 22-28. DOI:10.3321/j.issn:1000-8713.2008.01.005.
[19] 吴刚, 鲍晓霞, 王华雄, 等. 加速溶剂萃取-凝胶渗透色谱净化-气相色谱快速分析动物源性食品中残留的多种有机磷农药[J]. 色谱, 2008, 26(5): 577-582. DOI:10.3321/j.issn:1000-8713.2008.05.010.
[20] 杨琳, 温裕云, 弓振斌. 加速溶剂萃取-液相色谱-串级质谱法测定近岸及河口沉积物中的拟除虫菊酯农药[J]. 分析化学, 2010, 38(7): 968-972. DOI:10.3724/SP.J.1096.2010.00968.
[21] 欧阳运富, 唐宏兵, 吴英, 等. 加速溶剂萃取-在线凝胶渗透色谱-气相色谱-质谱联用法快速测定蔬菜和水果中多农药残留[J].色谱, 2012, 30(7): 654-659. DOI:10.3724/SP.J.1123.2012.03039.
[22] 王敬, 艾连峰, 马育松, 等. 气相色谱/三重四极杆串联质谱法测定牛奶及奶粉中213 种农药多残留[J]. 色谱, 2015, 33(11): 1175-1178.
[23] 陈小华, 汪群杰. 固相萃取技术及应用[M]. 北京: 科学出版社, 2010: 300. DOI:10.3724/SP.J.1123.2015.07012.
[24] 吕冰, 陈达炜, 苗虹. 凝胶渗透色谱-固相萃取净化/气相色谱-串联质谱法测定动物性食品中167 种农药残留[J]. 分析测试学报, 2015, 34(6): 639-645. DOI:10.3969/j.issn.1004-4957.2015.06.002.
[25] 郭新东, 冼燕萍, 罗海英, 等. 气相色谱-三重串联四极杆质谱法测定粮谷中169 种农药的残留量[J]. 现代食品科技, 2012, 28(6): 695-702. DOI:10.3969/j.issn.1673-9078.2012.06.025.
Determination of 51 Pesticide Residues in Cereals Using Accelerated Solvent Extraction and Gas Chromatography-Triple Quadrupole-Tandem Mass Spectrometry
MENG Xianglong, ZHANG Yunqing, FAN Guangyu, XU Wenke, TANG Xiu, YAO Yanlin
(Lianyungang Entry-Exit Inspection and Quarantine Bureau, Lianyungang 222042, China)
Abstract:A method was developed for detecting 51 pesticide residues in import and export cereals by gas chromatographytriple quadrupole-tandem mass spectrometry (GC-MS/MS). The optimal conditions for accelerated solvent extraction were established by investigating the effect of extraction temperature and solvent on extraction efficiency. The purification efficiencies of three different methods were compared for pesticide residues extracted from sorghum and barley. Multipesticide residues in sorghum were detected by GC-MS/MS, and the suitability of the analytical method for determining other cereals including barley and oat was investigated. The detection of six parallel samples of sorghum, barley and oat at three spiked levels showed that the recoveries for all pesticides were between 62.4% and 119.7%, with relative standard deviations (RSDs) varying from 0.5% to 17.3%, and the limits of detection (LODs) of the method were between 0.03 μg/kg and 2.07 μg/kg. This method can meet the analytical requirements and is suiTablefor high-throughput determination of multi-pesticide residues in cereals.
Key words:gas chromatography-triple quadrupole-tandem mass spectrometry (GC-MS/MS); accelerated solvent extraction; multi-pesticide residues; cereals
DOI:10.7506/spkx1002-6630-201622033
中图分类号:O657.63
文献标志码:A
文章编号:1002-6630(2016)22-0216-08
引文格式:
孟祥龙, 张云清, 范广宇, 等. 加速溶剂萃取-气相色谱-三重四极杆串联质谱法测定粮谷中的51 种农药残留[J]. 食品科学, 2016, 37(22): 216-223. DOI:10.7506/spkx1002-6630-201622033. http://www.spkx.net.cn
MENG Xianglong, ZHANG Yunqing, FAN Guangyu, et al. Determination of 51 pesticide residues in cereals using accelerated solvent extraction and gas chromatography-triple quadrupole-tandem mass spectrometry[J]. Food Science, 2016, 37(22): 216-223. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622033. http://www.spkx.net.cn
收稿日期:2016-03-08
基金项目:连云港科技公共服务平台项目(JC1404)
作者简介:孟祥龙(1979—),男,工程师,硕士,研究方向为食品中农药残留检测。E-mail:mengxl@jsciq.gov.cn