表1 NO间歇熏蒸对木纳格葡萄贮藏第62天品质指标的影响
Table1 Effect of intermittent fumigation with NO on quality of ‘Munage’ grapes on day 62 of storage

注:同列肩标不同字母表示差异显著(P<0.05)。
张 政 1,王 倩 1,张 辉 1,魏 佳 2,丁娟丽 1,沈爱燕 1,吴 斌 2,3,*
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆农业科学院农产品贮藏加工研究所,新疆 乌鲁木齐 830091;3.新疆农产品质量安全实验室,新疆 乌鲁木齐 830091)
摘 要:以木纳格葡萄为材料,采用0、300、1 000 μL/L一氧化氮(NO)以间歇熏蒸的方式处理木纳格葡萄,每7 d熏蒸1 次,共熏蒸8 次。测定了不同用量NO熏蒸处理后其活性氧代谢相关酶的变化趋势。比较了NO处理对葡萄果皮以及果肉中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、丙二醛(MDA)含量、超氧阴离子自由基(O 2 -·)生成速率和过氧化氢(H 2O 2)含量变化的差异性,研究NO对葡萄抗氧化酶以及活性氧的影响方式。结果表明:300 μL/L NO处理能够提高木纳格葡萄果皮和果肉中SOD、POD、CAT和APX的活性,延缓MDA、O 2 -·和H 2O 2的积累,维持木纳格葡萄果实中活性氧代谢的平衡,抑制膜质过氧化的发生,延缓果实的衰老。
关键词:一氧化氮;间歇熏蒸;葡萄;活性氧
木纳格葡萄(Vitis vinifera L. cv. ‘Munage’),别名克孜木纳格,属亚欧种(Vitis Feval),是优良的晚熟鲜食葡萄品种,分布于新疆天山南部和塔里木盆地,以阿图什品质最优。在商业上,SO 2熏蒸是葡萄保鲜过程中常用的一种处理方法。但是,SO 2的残留量很难受到人为控制,SO 2残留物质(亚硝酸盐)的摄入会导致某些人出现过敏性反应,这也是促使美国食品和药物管理局将葡萄中的SO 2残留量限定为10 mg/kg的原因 [1]。SO 2作为葡萄最常用的保鲜剂,能延缓果实中抗氧化酶活性的降低,维持活性氧代谢平衡,提高果实的逆抗性,延缓果实衰老 [2-3]。目前,葡萄保鲜多采用SO 2保鲜片或保鲜纸一段式释放的方式,但这种贮藏方式不利于维持葡萄后期的贮藏品质,而间歇熏蒸可以改善商业保鲜纸药效后期集中释放的问题。
前期课题组研究发现,NO具有提高伽师瓜 [4]、番茄 [5]和小白杏 [6]等果实中抗氧化酶的活性、抑制膜脂过氧化、延缓果实成熟衰老的作用。采用NO作为葡萄保鲜剂,可以减少SO 2葡萄保鲜剂的使用量,缓解葡萄贮藏过程中使用SO 2出现的有害物质残留和漂白等问题。因此,本研究以木纳格葡萄为试材,采用NO气体间歇熏蒸的方式处理果实,研究NO用量以及气体间歇熏蒸的方式对木纳格葡萄采后活性氧代谢的调控作用,为改善木纳格葡萄的贮藏品质,延长其贮藏期提供理论依据,同时也为提高鲜食葡萄采后食用安全性提供新方法。
1.1 材料与试剂
木纳格葡萄于2015年10月17日采自新疆阿图什,采后立即运往新疆农业科学院农产品贮藏加工研究所,挑选大小均一、无机械损伤、无病虫害的葡萄果实。初始硬度为(6.77±0.15)N,可溶性固形物含量达到(20.7±0.46)%。
磷酸氢二钠、磷酸氢二钠、乙二胺四乙酸、聚乙烯吡咯烷酮、盐酸羟胺、过氧化氢(H 2O 2) 天津市福晨化学试剂厂;愈创木酚 天津市光复精细化工研究所;核黄素 上海蓝季科技发展有限公司;三氯乙酸 天津市致远化学试剂有限公司;硫代巴比妥酸 上海展云化学有限公司;氮蓝四唑 南京奥多福尼生物科技公司;甲硫氨酸 美国Sigma公司。以上试剂均为分析纯。
NO气体(气体纯度为99.99%) 广州世源气体有限公司。
1.2 仪器与设备
UV-2600紫外分光光度计 日本岛津有限公司;IKA ®A11基本型研磨机 广州仪科实验室技术有限公司;GY-4硬度计 北京市兴光测色仪器公司;PAL-1数显折射仪 日本Atago公司;Centrifge 5810 R型高速冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 样品处理
将试供材料随机分组,每筐葡萄果实质量7.00 kg,每个处理为6 筐,共计18 筐。将葡萄至于密闭环境中,分别采用前期筛选出的最适用量300 μL/L NO和处理的最高用量1 000 μL/L NO在有氧条件下熏蒸处理2 h(每隔7 d熏蒸一次,共熏蒸8 次)。处理结束后,筐外套入0.03 mm的聚乙烯(polyethylene,PE)袋并封口,置于(0±0.5)℃的条件下贮藏,以不采用NO间歇熏蒸处理为对照。定期拍照,每次取样为2.5 kg,并对相关活性酶进行测定。
1.3.2 指标测定
超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用氮蓝四唑还原法 [7];过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法 [8];过氧化氢酶(catalase,CAT)活性测定参考Aebi等 [9]的方法;抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性测定参考Imahori等 [10]的方法;丙二醛(malondialdehyde,MDA)含量的测定采用硫代巴比妥酸法 [11];超氧阴离子自由基(O 2 -·)生成速率测定采用羟胺氧化法 [12];H 2O 2含量的测定采用四氯化钛还原法 [13]。
1.4 数据分析
使用Sigma Plot 12.0软件作图,SPSS 19.5进行数据方差分析并利用Duncan法进行均值比较。P<0.05表示差异显著。
2.1 最适NO间歇熏蒸用量的筛选
表1 NO间歇熏蒸对木纳格葡萄贮藏第62天品质指标的影响
Table1 Effect of intermittent fumigation with NO on quality of ‘Munage’ grapes on day 62 of storage

注:同列肩标不同字母表示差异显著(P<0.05)。
如表1所示,前期工作中,采用不同用量的NO处理葡萄果实,在贮藏结束,即第62天时,发现300 μL/L NO间歇熏蒸处理能显著维持木纳格葡萄的硬度。与对照组和其他用量NO处理组相比,300 μL/L NO间歇熏蒸处理
有效延缓了木纳格葡萄质量损失率、腐烂率、落粒率以及果梗褐变指数的增长,延长了果实的贮藏期。
2.2 NO间歇熏蒸对木纳格葡萄SOD活性的影响

图1 NO间歇熏蒸对木纳格葡萄果皮(A)与果肉(B)中SOD活性的影响
Fig.1 Effect of intermittent fumigation with NO on SOD activity of ‘Munage’ grape peel and flesh
SOD是一种金属蛋白酶,能有效清除细胞中的O 2 -·迅速转化成H 2O 2和O 2,保护参与氧代谢的细胞免受O 2 -·的伤害 [14]。由图1A可知,木纳格葡萄果皮中SOD活性在贮藏期间呈下降的趋势。在贮藏第12天,对照果的SOD活性急速下降,但300、1 000 μL/L NO处理果的SOD活性均维持在较高的水平。整个贮藏期间,300 μL/L NO处理果的SOD活性显著高于1 000 μL/L NO处理果和对照果(P<0.05)。直至贮藏第62天,对照果和1 000 μL/L NO处理果的SOD活性分别降低了13.35%和10.17%,而300 μL/L NO处理果的SOD活性仅降低了5.61%。
如图1B所示,木纳格葡萄果肉中SOD活性呈先上升后下降的趋势。300 μL/L NO处理果的SOD活性在第22天达最大值0.50 U/g,而对照果的SOD活性在32 d才达最大值。虽然,300 μL/L NO处理使SOD活性高峰提前出现,但是300 μL/L NO处理果的SOD活性在32 d时仍显著高于对照果(P<0.05)。1 000 μL/L NO处理果的SOD活性在贮藏12 d后低于对照果。
2.3 NO间歇熏蒸对木纳格葡萄POD活性的影响
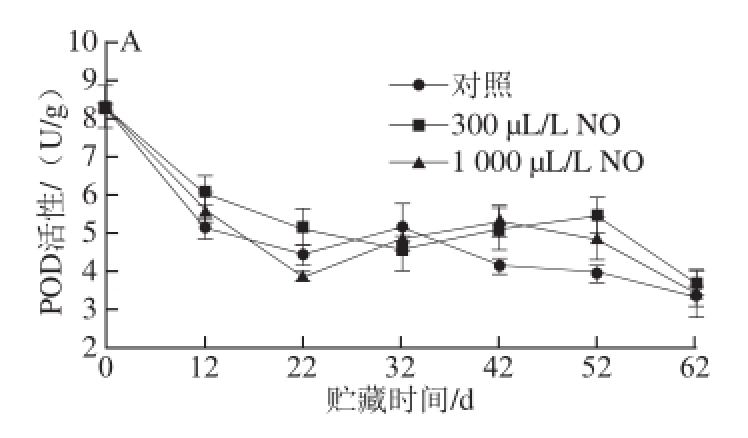
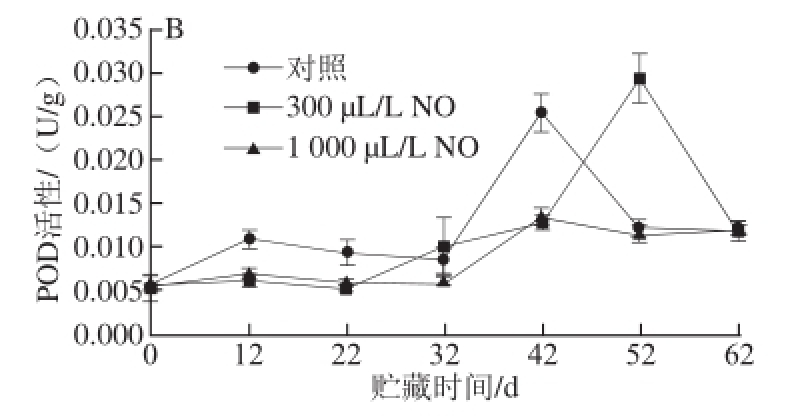
图2 NO间歇熏蒸对木纳格葡萄果皮(A)与果肉(B)中POD活性的影响
Fig.2 Effect of intermittent fumigation with NO on POD activity of ‘Munage’ grape peel and flesh
POD广泛存在于植物体内,能催化NADH氧化形成O 2 -·产生H 2O 2,也能与CAT一样参与分解H 2O 2的过程 [15]。由图2A可以看出,贮藏12 d时木纳格葡萄果皮中的POD活性迅速下降。此时,300 μL/L和1 000 μL/L NO处理果的POD活性显著大于对照果(P<0.05),且300 μL/L NO处理要优于1 000 μL/L NO处理。贮藏32 d后,300、1 000 μL/L NO处理果和对照果的POD活性没有显著差异(P>0.05)。
图2B表明,在木纳格葡萄贮藏的过程中,果肉的POD活性在贮藏前32 d一直维持在0.01 U/g以下,对照果和1 000 μL/L NO处理果的POD在42 d达到最大值后迅速降低,而300 μL/L NO处理果POD活性高峰推迟了10 d才出现。
2.4 NO间歇熏蒸对木纳格葡萄CAT活性的影响
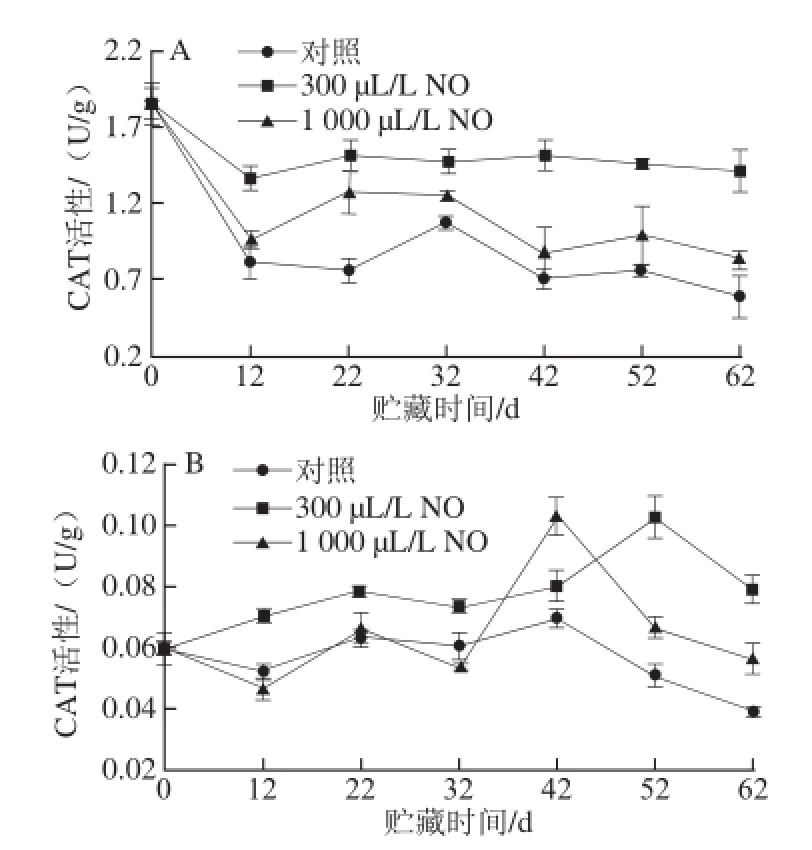
图3 NO间歇熏蒸对木纳格葡萄果皮(A)与果肉(B)中CAT活性的影响
Fig.3 Effect of intermittent fumigation with NO on CAT activity of ‘Munage’ grape peel and flesh
CAT是第一个被发现的抗氧化酶,对H 2O 2具有高度的特异性,能将H 2O 2分解为O 2和H 2O,从而降低过量的H 2O 2对植物造成的伤害 [16]。由图3A所示,随着贮藏
时间的延长,木纳格葡萄果皮的CAT活性呈下降趋势,300 μL/L和1 000 μL/L NO处理果的CAT活性变化趋势与对照果一致。1 000 μL/L NO处理果和对照果的CAT活性在贮藏的前12 d急速下降,而300 μL/L NO处理显著抑制了CAT活性的降低(P<0.05)。整个贮藏过程中,300 μL/L NO处理果的CAT活性始终显著高于1 000 μL/L NO处理果和对照果(P<0.05)。
从图3B可以看出,木纳格葡萄果肉中CAT活性变化趋势与果皮不同,呈现上升后下降的趋势。贮藏前期,对照果的CAT活性与1 000 μL/L NO处理果CAT活性无显著差异,且贮藏后期显著低于300 μL/L和1 000 μL/L NO处理(P<0.05)。虽然1 000 μL/L NO处理果CAT活性的最大值与300 μL/L NO处理CAT活性的最大值无显著差异(P>0.05),但300 μL/L NO处理显著延缓了CAT活性高峰的出现。
2.5 NO间歇熏蒸对木纳格葡萄APX活性的影响
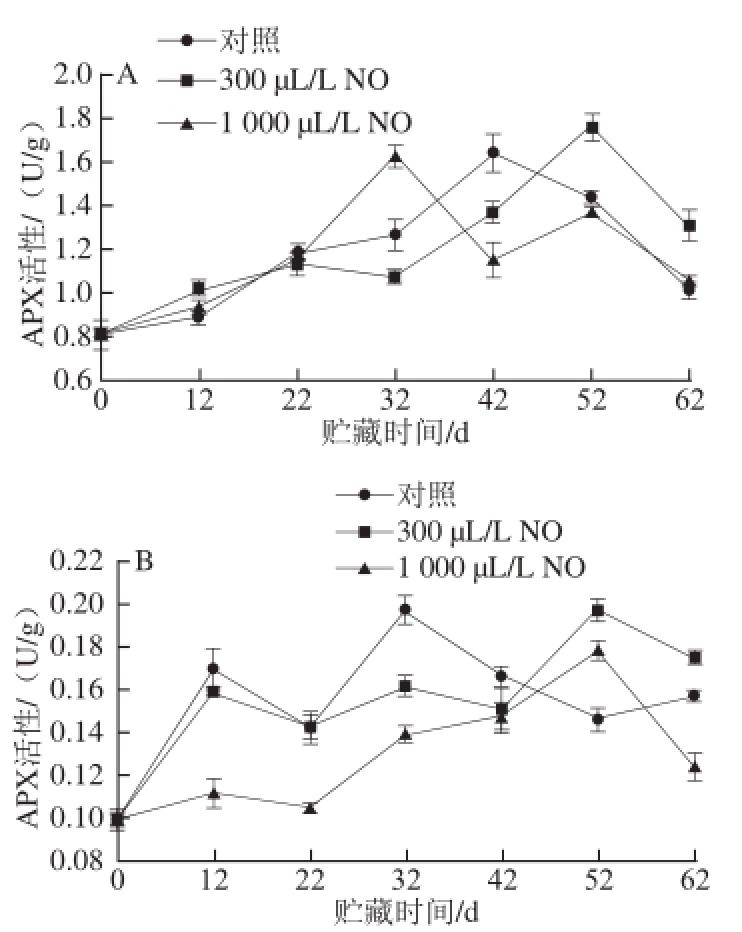
图4 NO间歇熏蒸对木纳格葡萄果皮(A)与果肉(B)中APX活性的影响
Fig.4 Effect of intermittent fumigation with NO on APX activity of ‘Munage’ grape peel and flesh
APX是ASA-GHS循环的核心组成部分,它可以清除植物体内的H 2O 2,防止植物中叶绿素的降解和细胞组织的伤害 [17]。图4A表明,木纳格葡萄采后贮藏期间,处理和对照果果皮的APX活性均成先上升后下降的趋势。贮藏前期,处理果和对照果的APX活性之间无显著差异。贮藏22 d后果皮的APX活性开始上升,此时300 μL/L NO处理显著延缓了APX活性高峰的出现(P<0.05),分别比对照和1 000 μL/L NO处理晚了10d和20d。
如图4B所示,木纳格葡萄果肉中的APX活性也成上升趋势。在贮藏前22 d,对照果和300 μL/L NO处理果的APX活性无显著差异,而1 000 μL/L NO处理果的APX活性显著低于前者。与果皮中APX变化趋势类似,300 μL/L NO处理同样使APX的活性高峰向后推移。
2.6 NO间歇熏蒸对木纳格葡萄MDA含量的影响
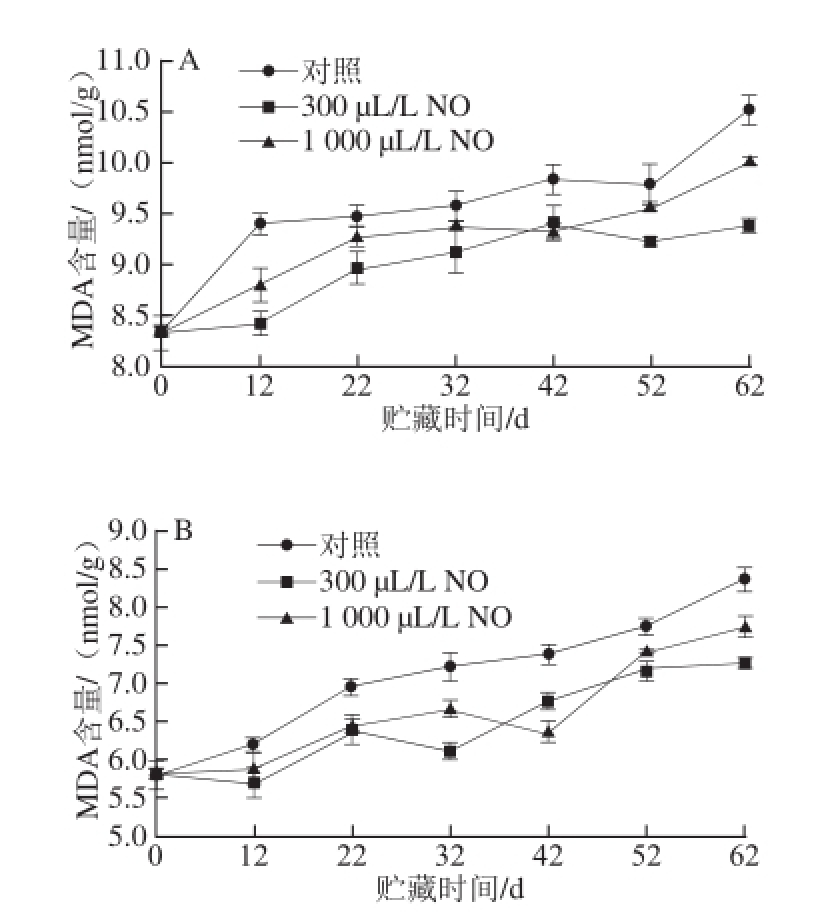
图5 NO间歇熏蒸对木纳格葡萄果皮(A)与果肉(B)中MDA含量的影响
Fig.5 Effect of intermittent fumigation with NO on MDA content of ‘Munage’ grape peel and flesh
MDA含量体现了细胞膜脂过氧化的程度,膜脂过氧化程度越高,细胞所受到的氧化损伤就越严重 [18]。图5表明,在贮藏过程中,木纳格葡萄果实的MDA含量随贮藏时间的延长和果实的衰老不断增加。NO处理显著抑制了贮藏过程中葡萄果皮与果肉MDA含量的增长,且300 μL/L NO处理显著优于1 000 μL/L NO处理(P<0.05)。NO处理与对照果果皮的MDA含量从贮藏12 d后开始迅上升,直至贮藏结束,对照果、300 μL/L和1 000 μL/L NO处理果果皮MDA含量是贮藏初期的1.26、1.13 倍和1.20倍。果肉中MDA含量的变化趋势与果皮类似,在采后贮藏期间,300 μL/L NO处理显著抑制了MDA含量的增长,减轻了果实的膜质过氧化程度(P<0.05)。
2.7 NO间歇熏蒸对木纳格葡萄O 2 -·产生速率的影响

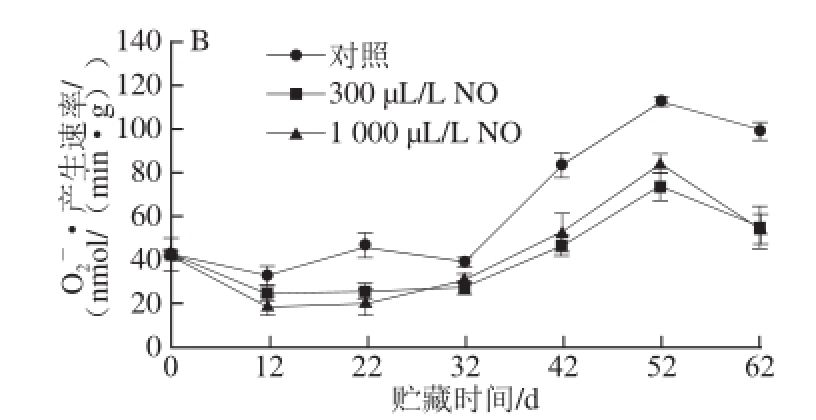
图6 NO间歇熏蒸对木纳格葡萄果皮(A)与果肉(B)中
 •产生速率的影响
•产生速率的影响
Fig.6 Effect of intermittent fumigation with NO on superoxide anion radical generation rate of ‘Munage’ grape peel and flesh
O 2 -·是一种对细胞具有氧化损伤作用的自由基,能经SOD转化成H 2O 2和O 2 [19]。由图6可知,木纳格葡萄果实中O 2 -·产生速率随着果实贮藏时间的延长而逐渐增加,果肉中O 2 -·产生速率在贮藏52 d小幅下降,且不同用量NO处理的O 2 -·产生速率均显著低于对照(P<0.05)。其中除22 d外,300 μL/L NO处理果果皮的O 2 -·产生速率显著低于1 000 μL/L NO处理(P<0.05);对于果肉而言,在贮藏第52天,300 μL/L NO处理显著低于1 000 μL/L NO处理,其他贮藏时间二者无显著差异(P>0.05)。
2.8 NO间歇熏蒸对木纳格葡萄H 2O 2含量的影响

图7 NO间歇熏蒸对木纳格葡萄果皮(A)与果肉(B)中H
2O
2含量的影响
Fig.7 Effect of intermittent fumigation with NO on H
2O
2content of ‘Munage’ grape peel and flesh
过量积累的H 2O 2可以使细胞膜中的磷脂双分子层受到氧化损伤,导致DNA结构被破坏以及细胞的死亡 [20]。从图7可以看出,伴随着木纳格葡萄果实的衰老,其果实中H 2O 2的含量逐渐累积。与对照果相比,300 μL/L 和1 000 μL/L NO处理能显著抑制果皮中H 2O 2的生成(P<0.05),但是在贮藏后期1 000μL/L NO处理与对照果之间无显著差异。果肉中的H 2O 2含量要低于果皮,仅为果皮的45.96%。在贮藏的42~52 d,300 μL/L和1 000 μL/L NO处理果果肉H 2O 2含量之间无显著差异,但在整个贮藏过程中,300 μL/L和1 000 μL/L NO处理都能减少果肉中H 2O 2的累积,且300 μL/L NO处理效果较好。
外源NO可以显著提高香蕉 [21]、竹笋 [22]和菠菜 [23]等果蔬中SOD、POD和CAT等抗氧化酶的活性。在本实验中,300 μL/L NO处理推迟了木纳格萄果皮中APX活性和果肉中POD、CAT、APX活性高峰的出现,并且木纳格葡萄果皮中的SOD、CAT和果肉中的SOD活性均高于对照组。赵强等 [24]在对无核葡萄的研究中发现,当SOD、POD和CAT保持较高的活性时,葡萄中的O 2 -·和H 2O 2的含量得到了有效的控制,有利于葡萄的长期贮藏。NO不仅能诱导抗氧化酶活性的上升,还能与O 2 -·结合形成对植物细胞无毒害作用的ONOO -,减少O 2 -·含量 [25]。本研究表明,300 μL/L NO处理延缓了木纳格葡萄果皮和果肉中O 2 -·和H 2O 2的积累,这与上述研究结果一致。
膜脂过氧化作用是活性氧产生的重要来源,O 2 -·和H 2O 2含量的增加加速了膜脂过氧化的过程 [26]。MDA含量体现了细胞膜脂过氧化的程度,膜脂过氧化程度越高,细胞所受到的氧化损伤就越严重。本研究发现,NO处理有效减少了木纳格葡萄果皮和果肉中MDA含量的累积,可能是由于NO通过提高活性氧清除酶的活性,减少O 2 -·和H 2O 2的产生,减轻了葡萄果实膜脂过氧化的程度。Shi Jingying等 [27]研究表明NO处理可以显著抑制鲜切板栗中POD和PPO的活性,将总酚的含量维持在一个较高的水平。赵金梅等 [28]指出,猕猴桃的抗氧化能力与它的VC和总酚的含量密切相关。因此,NO也有可能通过诱导葡萄果实中VC以及酚类化合物这类抗氧化物质含量的增加,从而减少MDA含量。
综上所述,300 μL/L NO间歇熏蒸处理可以提高木纳格葡萄果皮和果肉中SOD、POD、CAT和APX的活性,增强了对O 2 -·和H 2O 2的清除能力,抑制了MDA含量的增长,从而延缓了葡萄果实的衰老。NO间歇熏蒸在葡萄贮藏中的应用可以减少SO 2葡萄保鲜剂的使用,提高鲜食葡萄采后食用的安全性。通过本实验结果可考虑后期采用NO与SO 2双气体组分对葡萄进行间歇熏蒸处理,以期为葡萄贮藏保鲜提供高效安全的方法,同时为NO在果蔬采后中的应用提供新思路。
参考文献:
[1] LICHTER A, GABLER F M, SMILANICK J L. Control of spoilage in Tablegrapes[J]. Stewart Postharvest Review, 2006, 2(6): 1-10. DOI:10.2212/spr.2006.6.1.
[2] GAO K, MA H Y, LIU H D, et al. Effect of SO 2interval fumigation on color and antioxidant activity of red grape[J]. Advanced Materials Research, 2014, 971: 59-62. DOI:10.4028/www.scientific.net/ AMR.971-973.59.
[3] 刘丽青, 仪慧兰. SO 2处理激活龙眼葡萄果实采后防御应答[J].食品科学, 2015, 36(18): 209-212. DOI:10.7506/spkx1002-6630-201518039.
[4] 胡江伟, 周江, 朱璇, 等. 一氧化氮对新疆伽师瓜果实采后贮藏品质的影响[J]. 食品工业科技, 2015, 36(13): 352-356. DOI:10.13386/ j.issn1002-0306.2015.13.065.
[5] 李洁, 温昕晔, 张辉, 等. 一氧化氮对绿熟和粉红期番茄采后抗氧化相关酶的影响[J]. 食品工业科技, 2014, 35(6): 329-333. DOI:10.13386/j.issn1002-0306.2014.06.059.
[6] 温昕晔, 李洁, 张辉, 等. 一氧化氮对新疆小白杏采后抗氧化相关酶活性的影响[J]. 食品科技, 2014, 39(1): 37-41.
[7] PASQUARIELLO M S, DI PATRE D, MASTROBUONI F, et al. Influence of postharvest chitosan treatment on enzymatic browning and antioxidant enzyme activity in sweet cherry fruit[J]. Postharvest Biology and Technology, 2015, 109: 45-56. DOI:10.1016/ j.postharvbio.2015.06.007.
[8] ZAPATA P J, MARTINEZ-ESPLA A, GUILLÉN F, et al. Preharvest application of methyl jasmonate (MeJA) in two plum cultivars. 2. Improvement of fruit quality and antioxidant systems during postharvest storage[J]. Postharvest Biology and Technology, 2014, 98(3): 115-122. DOI:10.1016/j.postharvbio.2014.07.012.
[9] AEBI H. Catalase in vitro[J]. Methods Enzymes, 1984, 105: 121-126. DOI:10.1016/S0076-6879(84)05016-3.
[10] IMAHORI Y, BAI J, BALDWIN E. Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments[J]. Scientia Horticulturae, 2016, 198: 398-406. DOI:10.1016/j.scienta.2015.12.006.
[11] ZHANG Z, HUBER D J, QU H, et al. Enzymatic browning and antioxidant activities in harvested litchi fruit as influenced by apple polyphenols[J]. Food Chemistry, 2015, 171: 191-199. DOI:10.1016/ j.foodchem.2014.09.001.
[12] 曹建康, 江微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 118-120.
[13] PATTERSON B D, MACRAE E A, FERGUSON I B. Estimation of hydrogen peroxide in plant extracts using titanium (Ⅳ)[J]. Analytical Biochemistry, 1984, 139(2): 487-492. DOI:10.1016/0003-2697(84)90039-3.
[14] FRIDOVICH I. Superoxide dismutases: defence against endogenous superoxide radical[J]. Ciba Foundation Symposium, 1978, 65: 77-93. DOI:10.1002/9780470715413.
[15] ANJA L, ESTHER V D Z, PETER S. Production of reactive oxygen intermediates O 2 -, H 2O 2, and OH by maize roots and their role in wall loosening and elongation growth[J]. Plant Physiology, 2004, 136(2): 3114-3123. DOI:10.1104/pp.104.044784.
[16] MHAMDI A, QUEVAL G, CHAOUCH S, et al. Catalase function in plants: a focus on Arabidopsis mutants as stress-mimic models[J]. Journal of Experimental Botany, 2010, 61(15): 4197-4220. DOI:10.1093/jxb/erq282.
[17] ASADA K. Ascorbate peroxidase-a hydrogen peroxide-scavenging enzyme in plants[J]. Physiologia Plantarum, 1992, 85(2): 235-241. DOI:10.1111/j.1399-3054.1992.tb04728.x.
[18] MOLLER I M, JENSEN P E, HANSSON A. Oxidative modifications to cellular components in plants[J]. Annual Review of Plant Biology, 2007, 58(1): 459-481. DOI:10.1146/annurev. arplant.58.032806.103946.
[19] FELISA W, DANIEL G, OSCAR S, et al. The role and evolution of superoxide dismutases in algae[J]. Journal of Phycology, 2005, 41(3): 453-465. DOI:10.1111/j.1529-8817.2005.00086.x.
[20] KANG K A, MEI J P, KIM K C, et al. Fisetin attenuates hydrogen peroxide-induced cell damage by scavenging reactive oxygen species and activating protective functions of cellular glutathione system[J]. In Vitro Cellular and Developmental Biology Animal, 2014, 50(1): 66-74. DOI:10.1007/s11626-013-9681-6.
[21] WU B, GUO Q, LI Q, et al. Impact of postharvest nitric oxide treatment on antioxidant enzymes and related genes in banana fruit in response to chilling tolerance[J]. Postharvest Biology and Technology, 2014, 92(3): 157-163. DOI:10.1016/j.postharvbio.2014.01.017.
[22] YANG H Q, WU F H, CHENG J Y. Effects of nitric oxide treatment on active oxygen metabolism and flesh lignification in bamboo shoots[J]. Journal of Horticultural Science and Biotechnology, 2011, 86(5): 499-504. DOI:10.1080/14620316.2011.11512795.
[23] DU S T, LIU Y, ZHANG P, et al. Atmospheric application of trace amounts of nitric oxide enhances tolerance to salt stress and improves nutritional quality in spinach (Spinacia oleracea L.)[J]. Food Chemistry, 2015, 173: 905-911. DOI:10.1016/j.foodchem.2014.10.115.
[24] 赵强, 张平, 朱志强, 等. 不同品种无核葡萄采后活性氧代谢的比较研究[J]. 北方园艺, 2013(17): 20-22.
[25] ARASIMOWICZ M, FLORYSZAK-WIECZOREK J. Nitric oxide as a bioactive signalling molecule in plant stress responses[J]. Plant Science, 2007, 172(5): 876-887. DOI:10.1016/j.plantsci.2007.02.005.
[26] BHATTACHARJEE S. Reactive oxygen species and oxidative burst: roles in stress, senescence and signal transduction in plants Currnt Scienc[J]. Current Science, 2005, 89(7): 1113-1121.
[27] SHI J Y, LI J X, ZHU S H, et al. Browning inhibition on fresh-cut chestnut kernel by exogenous nitric oxide[J]. International Journal of Food Science and Technology, 2011, 46(5): 944-950. DOI:10.1111/ j.1365-2621.2010.02540.x.
[28] 赵金梅, 高贵田, 薛敏, 等. 不同品种猕猴桃果实的品质及抗氧化活性[J]. 食品科学, 2014, 35(9): 118-122. DOI:10.7506/spkx1002-6630-201409024.
Effect of Intermittent Fumigation with Nitric Oxide on Reactive Oxygen Species Metabolism of ‘Munage’ TableGrapes
ZHANG Zheng
1, WANG Qian
1, ZHANG Hui
1, WEI Jia
2, DING Juanli
1, SHEN Aiyan
1, WU Bin
2,3,*
(1. College of Food Science and Pharmacy, Xinjiang Agricultural University, Ürümqi 830052, China; 2. Institute of Agro-Products Storage and Processing, Xinjiang Academy of Agricultural Sciences, Ürümqi 830091, China; 3. Xinjiang Laboratory of Agro-Products Quality and Safety, Ürümqi 830091, China)
Abstract:The aim of this work was to investigate the impact of nitric oxide (NO) on the metabolism of reactive oxygen species (ROS). ‘Munage’ Tablegrapes were treated by intermittent fumigation once every seven days totally 8 times. The effects of NO on the activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), and ascorbate peroxidase (APX) in grape peel and flesh were analyzed. The changes in the contents of malondialdehyde (MDA) and H 2O 2, as well as superoxide anion radical formation rate were also monitored. The results showed that SOD, POD, CAT and APX activities grape peel and flesh could be improved effectively and the accumulations of MDA, superoxide anion radical and H 2O 2were delayed by 300 μL/L NO intermittent fumigation treatment. The NO treatment could maintain the balance of active oxygen metabolism, inhibit membrane lipid peroxidation and delay grape senescence. This study contributed to a comprehensive understanding of the ROS metabolism in ‘Munage’ grape treated with NO and provided useful information for maintaining fruit quality.
Key words:nitric oxide; intermittent fumigation; grape; reactive oxygen species
DOI:10.7506/spkx1002-6630-201622038
中图分类号:TS225.3
文献标志码:A
文章编号:1002-6630(2016)22-0249-06
引文格式:
张政, 王倩, 张辉, 等. 一氧化氮间歇熏蒸对木纳格葡萄活性氧代谢的影响[J]. 食品科学, 2016, 37(22): 249-254. DOI:10.7506/spkx1002-6630-201622038. http://www.spkx.net.cn
ZHANG Zheng, WANG Qian, ZHANG Hui, et al. Effect of intermittent fumigation with nitric oxide on reactive oxygen species metabolism of ‘Munage’ Tablegrapes[J]. Food Science, 2016, 37(22): 249-254. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622038. http://www.spkx.net.cn
收稿日期:2016-03-24
基金项目:国家自然科学基金地区科学基金项目(31560473)
作者简介:张政(1990—),男,硕士研究生,研究方向为农产品贮藏与加工。E-mail:57541038@qq.com
*通信作者:吴斌(1973—),男,副研究员,博士,研究方向为果蔬采后分子生物学。E-mail:xjuwubin0320@sina.com