表1 包装方式及贮藏条件
Table1 Packaging and storage conditions

岑剑伟 1,2,蒋爱民 1,*,李来好 2,杨贤庆 2,杜 冰 1,郝淑贤 2,辛少平 2
(1.华南农业大学食品学院,广东 广州 510642;2.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300)
摘 要:研究高压静电场结合冰温技术对鲜罗非鱼片的保鲜效果,比较了不同贮藏条件下,罗非鱼片的感官指标、肉质渗出率、微生物数量、质构、鲜度指标及肌肉显微结构的变化。结果表明,高压静电场冰温条件下,罗非鱼片的色泽和气味的感官评分始终比普通冰温保鲜样品更高,鱼肉中微生物活动得到有效抑制,贮藏到30 d微生物含量约为10 4CFU/g,比初始值更低,肉汁渗出率保持在5%以内,鲜度指标挥发性盐基氮值与K值维持在较低水平,鱼肉硬度减弱更加缓慢。通过透射电子显微镜观察鱼肉细胞完整性及肌肉纤维,细胞结构较完整,轮廓清晰,细胞间黏连紧密表明了肌肉蛋白质降解速率被延缓,维持了良好的感官特征,冰鲜鱼片的货架期延长至30 d。在高压静电场结合冰温气调组合条件下贮藏的鱼片产品,保持了新鲜鱼片的品质,货架期也得到有效延伸,为冰鲜罗非鱼鱼片产品在国内超市流通提供可行的技术条件。
关键词:罗非鱼片;高压静电场;冰温气调保鲜;显微观察
罗非鱼因其高蛋白、低脂肪的特点,深受消费者的喜爱,畅销欧美国家,成为了我国出口创汇的大宗水产品 [1]。目前罗非鱼产品国内销售主要以鲜活全鱼为主,以冷藏、冷冻罗非鱼鱼片的形式出口。冷冻的水产品因经过深度冻结,需要解冻才能烹调处理,解冻过程中鱼肉中发生一系列生化反应,进而影响品质,导致肉汁液损失、组织结构被破坏、蛋白生化特性改变和脂肪氧化加剧,品质发生较大的改变。但随着人民消费水平的增长和消费意识的增强,消费者日益追求健康美味的食品。加上随着生活节奏的加快,人们需要方便快捷、直接烹调的水产食品。因此,新鲜未经冻结鱼片产品具有巨大市场潜力,该产品的开发可以打破罗非鱼国内以鲜活为主的销售方式。
生产新鲜未经冻结鱼片产品的关键技术难题在于如何保藏该类产品延长货架期、保障产品价值。突破传统的保鲜方式,开发一种便利、高效、实用的保鲜方式,将冰鲜罗非鱼片产品推进超市。研究表明,高压静电场可显著影响一些生物酶的活力,作用于生物体后能引起一系列生物学效应 [2-3]。例如高压静电场可以保持过氧化氢酶的稳定性 [4-6],从而加快自由基清除,延缓细胞的衰老;一定频率和强度的高压静电场作用于微生物能抑制其生长与繁殖,甚至杀死微生物 [7-11]。因为这些特点,高压静电场被人们应用于食品保鲜上。目前,高压静电场保鲜技术应用于葡萄、草莓、藕片等果蔬产品保鲜的研究前人已有所开展 [12-17],Ko等 [18]研究评估了4 ℃贮藏条件下,高压静电场对罗非鱼肉品质的影响,发现高压静电场能够减少鱼肉的细菌总数,明显减缓鱼眼的不透明度,但将高压静电场技术与冰温气调技术结合在水产品中的应用研究鲜见报道。本实验研究高压静电场结合冰温气调保鲜方法对贮藏过程中罗非鱼鱼片品质的影响,比较不同高压静电场下的作用效果,旨在为高压静电场在鱼肉保鲜中的应用提供依据。
1.1 材料与试剂
奥尼罗非 广州华润万家超市。
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)营养琼脂、蛋白胨 广东环凯微生物有限公司;NaCl、KCl、高氯酸、NaOH、盐酸、硼酸、酚酞、甲基红、次甲基蓝、无水乙醇等均为分析纯。实验用水为蒸馏水。
1.2 仪器与设备
MAP-D400复合气调保鲜包装机 苏州森瑞公司;精密低温培养箱 日本Sanyo公司;多功能静电冷冻实验机 台湾迪弗斯科技股份有限公司;天孚牌电子计数天平 常熟市金羊生化器具厂;明鉴SPX型智能生化培养箱 宁波江南仪器厂;1100高效液相色谱(配有二极管阵列检测器) 美国安捷伦公司;Ultra Turrax T25B型均质机 德国IKA工业设备公司;JEM100CⅫ型透射电子显微镜 日本电子株式会社。
1.3 方法
1.3.1 样品处理
表1 包装方式及贮藏条件
Table1 Packaging and storage conditions

根据实验需要购买生鲜罗非鱼,取鱼片,经臭氧水减菌处理(用量5 mg/kg,处理时间10 min),装入9 层高阻隔气调包装袋,充入相应气体,热封,标记(组别Ⅰ、Ⅱ、Ⅲ、Ⅳ)。分别贮藏于相应条件下(表1)。冰温:-(0.5±0.2)℃;高压静电场:3.8 kV/cm,50 Hz。冰温样品保存于精密低温培养箱,冰温与高压静电场处理样品保存于高压静电场保鲜冰箱,调节相应的高压静电场参数和温度,贮藏后第0、3、6、9、12、15、18、21、24、27、30天取出测定指标。
1.3.2 感官评分
主要以罗非鱼经处理后的色泽及气味进行评定。评定人员由经过专门培训的8 名人员组成,具体评分标准见表2。
表2 鲜罗非鱼片感官评定标准
Table2 Criteria for sensory evaluation of tilapia fillets

1.3.3 肉汁渗出率测定
参考吕凯波 [19]的方法,贮藏前称量包装袋质量(M 0),测定指标时将包装袋剪一小口排尽袋内气体,称取样品、包装袋及残留在包装袋内渗出的肉汁的总质量(M 1)。小心剪开包装袋,缓慢将袋中的鱼片取出,称量包装袋和肉汁质量(M 2)。肉汁渗出率计算公式如下:
1.3.4 微生物数量测定
称取剪碎鱼肉10 g,加入90 mL 0.1%蛋白胨无菌生理盐水,振荡混匀,以10 倍稀释将菌液稀释,取适宜稀释度的稀释液1 mL,倾注灭菌后冷却至45 ℃ TTC培养基15~20 mL培养,各2 个平行。培养基凝结后,倒扣于(25±1)℃培养48 h后,选取平均菌落数在30~300之间的培养基平计数。
1.3.5 挥发性盐基氮(total volatile basic nitrogen,TVB-N)值测定
TVB-N值参照SC/T 3032—2007《水产品中挥发性盐基氮的测定》测定 [20]。
1.3.6 鲜度指标K值测定
K值按文献[21]方法测定。
1.3.7 质构特征值测定
取鱼体背侧靠近头部的肌肉,切成20 mm× 20 mm×10 mm的小块,采用TPA模式,圆柱型探头,探头直径6 mm。测试条件:下压速率0.5 mm/s,下压深度4 mm,触发值5 g,下压程度为样品厚度的50%,停留间隔时间5 s,压后上行速率0.5 mm/s,数据收集率200。每个样品测3 次,取平均值。
1.3.8 微观结构观察
取肌肉组织,切成1 mm×1 mm×2 mm大小长方体块状,立即固定。首先放入2.5%戊二醛中固定2 h以上,取出用磷酸缓冲液漂洗,再放入1%锇酸固定液固定1~2 h,固定完毕,用缓冲液漂洗20 min后进行脱水;采用梯度脱水法,先放入70%丙酮脱水15 min,再依次80%丙酮15 min,90%丙酮15 min,100%丙酮10 min(二次);将脱水后的组织块置于环氧树脂包埋剂中,浸透,然后置烤箱烘干,在45 ℃烘箱内放置12 h以上;超薄切片,染色,透射电子显微镜下观察微观结构。
1.4 数据统计
实验数据采用SPSS 13.0统计软件进行统计分析,用One Way ANOVA(LSD)和t检验测定差异显著性,显著性水平设置为P<0.05。
2.1 感官评分结果
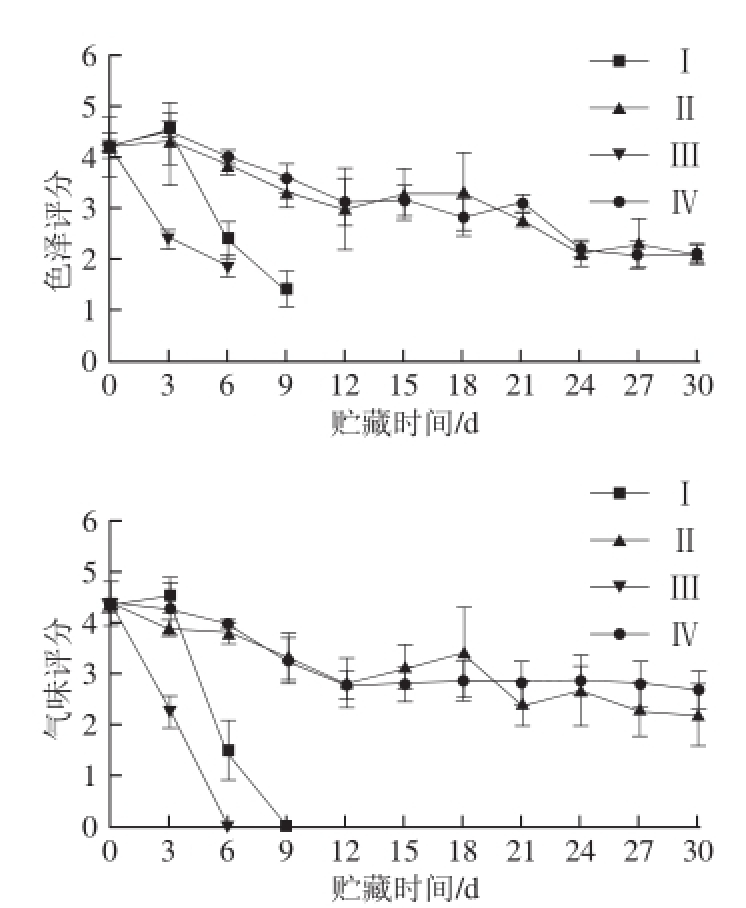
图1 贮藏过程中罗非鱼片感官评分变化
Fig.1 Changes in sensory quality of tilapia fillets under different storage conditions
如图1所示,冰温条件下色泽和气味得分均低于同时期高压静电场冰温条件下贮藏的鱼肉,冰温气调保鲜(Ⅰ组)9 d后鱼肉发臭,冰温空气保鲜(Ⅲ组)第6天发臭。高压静电场冰温条件下鱼肉前期色泽正常,但随着贮藏时间的延长罗非鱼鲜亮颜色逐渐越变淡。在鱼肉气味方面,高压静电场处理条件下,前18 d气调包装(Ⅱ组)和空气包装(Ⅳ组)差异不明显,21 d后空气包装(Ⅳ组)得分反而略高于气调包装(Ⅱ组);21 d后鱼肉切面无光泽,两个高压静电场处理组(Ⅳ组和Ⅱ组)在色泽上无明显差异,贮藏到30 d气味均仍保持良好。
2.2 肉汁渗出率变化
罗非鱼片的肉汁渗出率在高压静电场处理组与冰温条件下贮藏的效果差异明显,贮藏第6天,冰温气调保鲜(Ⅰ组)及冰温空气保鲜(Ⅲ组)肉汁渗出率约为5%,而同期高压静电场冰温气调包装(Ⅱ组)、空气包装(Ⅳ组)则约为2%。高压静电场冰温条件下,贮藏前18 d,气调包装(Ⅱ组)与空气包装(Ⅳ组)肉汁渗出
率无显著差别,但在后期气调包装的肉汁渗出率增加幅度要高于空气包装,至30 d时,Ⅱ组为4.87%,Ⅳ组为3.68%(图2)。

图2 贮藏过程中肉汁渗出率变化
Fig.2 Changes in drip loss of tilapia fillets under different storage conditions
2.3 微生物数量变化
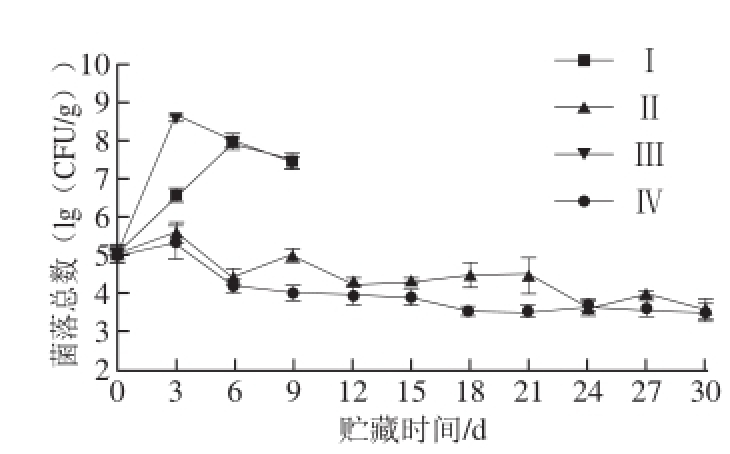
图3 贮藏过程中微生物数量变化
Fig.3 Changes in total bacterial count of tilapia fillets under different storage conditions
如图3所示,鱼片微生物数量初始值为5.1(lg (CFU/g))。贮藏过程中,冰温条件下气调包装及空气包装组的微生物总数呈快速上升趋势,冰温气调保鲜(Ⅰ组)在第6天超过10 7CFU/g [22],冰温空气包装(Ⅲ组)在第3天已超10 8CFU/g。而在高压静电场冰温条件下气调包装(Ⅱ组)、空气包装(Ⅳ组)则呈现相反趋势,除前3 d微生物含量略有增长之外,无论是气调还是空气环境下,微生物数量在3 d之后的贮藏过程中呈缓慢下降趋势,显示高压静电场对微生物生长的抑制作用,同时期微生物数量空气包装(Ⅳ组)略低于气调包装(Ⅱ组),贮藏到30 d微生物含量约为10 4CFU/g。
2.4 TVB-N值变化

图4 贮藏过程中TVB-N值变化
Fig.4 Changes in TVB-N value of tilapia fillets under different storage conditions
TVB-N在是贮藏过程罗非鱼肉蛋白质分解而产生氨以及胺类等具有挥发性碱性含氮物质,其含量越高,表明氨基酸被破坏得越大。TVB-N值随贮藏时间延长而增加,如图4所示,鱼片TVB-N初始值为16.81 mg/100 g,在冰温条件下贮藏的罗非鱼片TVB-N值快速增长,贮藏第3天,冰温气调保鲜(Ⅰ组)达到21.15 mg/100 g,冰温空气保鲜(Ⅲ组)达到37.41 mg/100 g,均超过了鲜冻水产品的卫生标准。而在高压静电场冰温条件下,气调包装(Ⅱ组)、空气包装(Ⅳ组)罗非鱼片TVB-N值增加缓慢,较长时间处于较低值,Ⅱ、Ⅳ在贮藏第30天时才稍微超过20 mg/100 g的限量值 [21],仍保持在安全食用范围内。
2.5 K值变化
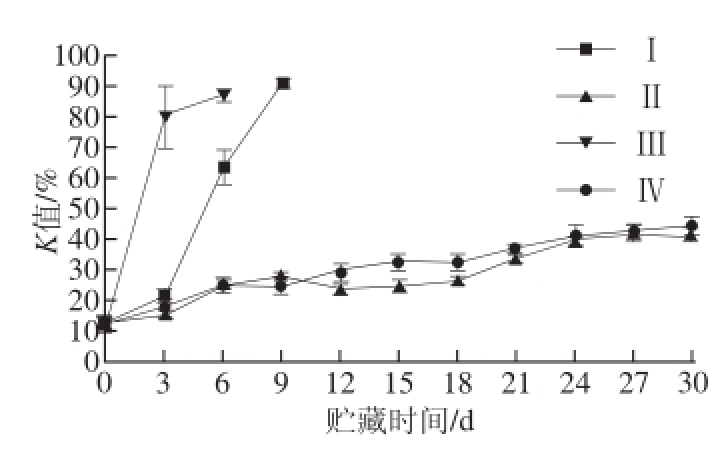
图5 贮藏过程中鲜度指标K值变化
Fig.5 Changes in K-value of tilapia fillets under different storage conditions
几组贮藏不同条件下产品的K值在贮藏过程中变化情况与TVB-N值的变化趋势基本一致。如图5所示,非高压静电场处理组的K值快速增长,气调包装(Ⅰ组)在第6天、空气包装(Ⅲ组)在第3天即超过了40%。高压静电场结合冰温条件下增加速率相对缓慢,贮藏第24天,气调包装(Ⅱ组)、空气包装(Ⅳ组)稍微超过40%,贮藏30 d后K值未超45%。在高压静电场冰温条件下贮藏两组样品之间的差异不明显。
2.6 鱼肉质构的变化

图6 贮藏过程中罗非鱼片硬度变化
Fig.6 Changes in hardness of tilapia fillets under different storage conditions
如图6所示,鱼肉硬度在贮藏过程中呈下降趋势,不同贮藏条件下降的幅度有所区别。冰温条件下气调包装(Ⅰ组)、空气包装(Ⅲ组)急剧下降,高压静电场结
合冰温条件下的气调包装(Ⅱ组)、空气包装(Ⅳ组)硬度前期下降较快,但降幅低于非高压静电场处理组,后期下降趋势趋缓。在高压静电场冰温条件下,气调包装(Ⅱ组)、空气包装(Ⅳ组)无显著性差异,气调包装所起的作用不明显。
2.7 鱼肉细胞完整性

图7 罗非鱼肌肉纤维透射电子显微镜图
Fig.7 Transmission electron micrographs showing the microstructure of tilapia muscle tissue
新鲜鱼肉(图7a)细胞结构较完整,轮廓清晰,细胞间黏连紧密,而处于腐败状态的罗非鱼(图7d)细胞间黏连不紧密,呈散开状态,细胞变形,轮廓不清晰。贮藏至第6天,冰温条件下气调包装(Ⅰ组)(图7b)细胞间隙变大连接不紧密,趋于松散;冰温空气包装(Ⅲ组)(图7d)鱼肉细胞则呈散开状态,轮廓不清晰,接近自溶崩溃。高压静电场结合冰温条件下,无论是气调包装(Ⅱ组)(图7c)还是空气包装(Ⅳ组)(图7e),细胞结构均保持完整,与新鲜鱼肉状态差异不明显;贮藏到21 d(图7f、g),结构仍然保持完整,细胞轮廓清晰,气调与空气包装差异不明显,贮藏到30 d,气调包装(Ⅱ组)罗非鱼肉细胞(图7h)间隙变大,细胞间联接变疏,表明品质有所下降,此条件下,空气包装(Ⅳ组)(图7i)状况稍好。
2.8 细胞内肌原纤维结构的变化

图8 罗非鱼肌肉肌原纤维结构透射电子显微镜图
Fig.8 Transmission electron micrographs showing the microstructure of tilapia myofibril
在透射电子显微镜下,将放大倍数调节至14 000~20 000 倍,则可观察到鱼肉组织细胞内肌原纤维。受鱼肉内源蛋白酶作用,鱼肉在贮藏过程中肌原纤维会逐渐溶解,粗丝变细,肌节变模糊。不同贮藏时间罗非鱼肉细胞肌原纤维变化如图8所示,新鲜罗非鱼肌肉肌小节间隔清晰(图8a),明带(I-band)、明带中间(Z-line),暗带(A-band)及暗带中间较明亮区域(H-zone)清晰可辨。明带及暗带中间较明亮区由细丝组成,其主要成分是肌动蛋白,暗带由粗丝和细丝叠加组成,粗丝主要成分是肌球蛋白。鱼片贮藏到第6天,明带变宽,暗带区域趋窄,说明粗丝有所降解。冰温保藏气调包装(Ⅰ组)(图8b)、空气包装(Ⅲ组)(图8d)纤维丝降解更明显,透射电子显微镜下观察难以看清纤丝;高压静电场冰温条件下气调包装(Ⅱ组)(图8c)、空气包装(Ⅳ组)(图8e)中,明、暗带界限还比较明显,透射电子显微镜下观察到的纤丝较粗,说明高压静电场一定程度上能减缓肌原纤维丝的降解速率。
高压静电场冰温条件下贮藏到21 d(图8f、g),暗带完全消失,则说明即使在高压静电场下鱼肉的内源蛋白酶的活性没有完成被抑制。
3.1 高压静电场的保鲜作用
货架期是指当食品被贮藏在推荐的条件下,能够保持理想的感官、理化和微生物特性的一段时间 [23]。综合上述各项指标,判定各贮藏条件下鲜罗非鱼片的货架期分别为:冰温气调4 d、高压静电场冰温气调24 d、冰温空气2 d、高压静电场冰温空气24 d。腐败菌的活动是引起鱼肉腐败变质的关键因素 [24],气调保鲜中使用的高体积分数CO 2能在一定程度上抑制了大部分微生物的生长,但也不能完全抑制或杀死腐败菌 [25]。在原料初始状态微生物含量较高的条件下,冰温结合气调包装技术也未能很好地阻止地鱼片快速腐败。在同等条件下,复合了高压静电场则表现出优异的保鲜效果,鱼片肉汁渗出率低、微生物数量下降、鲜度指标TVB-N值与K值维持在较低水平,货架期得到明显的延长。众多研究表明静电场不仅影响微生物活动,对多种生物酶的催化活性也有极大的影响 [5]。高压静电场通过改变酶的构象、影响酶与反应底物的接触从而影响其催化活性,使生物体在生理生化性质上产生改变。高压静电场保鲜的原理可能在于,一方面杀灭和抑制了微生物及其活动,减弱微生物对鱼片的破坏,另一方面在于影响了鱼肉细胞内各种酶的活性,在宏观上延缓了细胞的崩塌等生命进程,使细胞在一段时期内免于自溶,从而保持了细胞的完整性,降低了鱼肉的肉渗,使鱼肉组织维持了良好的状态。
3.2 高压静电场对鱼肉质构的影响
贮藏过程中鱼肉硬度值变小,反映出细胞间链接逐渐断裂,组织架构趋于松散,肌原纤维逐渐降解。本研究通过质构检测和扫描透射电子显微镜观察分析高压静电场对罗非鱼片鱼肉组织的影响,直观地展示了鱼肉组织在贮藏过程中的细节变化。透射电子显微镜观察结果显示,随着贮藏时间的延长,肌肉细胞间链接逐渐减弱,最后肌肉组织松散崩溃;肌原纤维丝也逐渐减少消失。贮藏相同时间,高压静电场条件下鱼肉硬度值高于未施加静电场处理的鱼肉,表明高压静电场条件下鱼肉蛋白质降解速率减缓。一般贮藏过程中,鱼肉细胞的蛋白质受到细胞内源蛋白酶和微生物活动产生的外源蛋白酶的共同作用下,鱼肉细胞的破坏速率加快。高压静电场一定程度上抑制了微生物的活动,减弱了外源蛋白酶的降解作用。另外,已有研究表明高压静电场对酶的催化活性有影响,高压静电场条件下蛋白降解速率减缓,可能是起作用的蛋白酶量减少和酶催化活性降低两方面原因共同促成的。研究表明,高压静电场提高、降低或灭杀酶的催化活性取决于高压静电场强度和频率,相同条件下高压静电场对不同种类酶的影响也有差异 [26-28]。本研究发现高压静电场贮藏的鱼肉硬度、细胞完整性都优于未施加高压电场组,但呈缓慢下降过程。
3.3 高压静电场结合气调包装对鱼肉品质的影响
高压静电场条件下无论是气调包装还是空气包装保鲜处理样品的微生物的生长都得到明显的抑制,但在相同的贮藏时间,空气包装样品的微生物反而略低于气调包装样品,有研究认为高压静电场可以将氧气电离生成臭氧,杀菌效果更好。高压静电场条件下气调包装微生物数量以及肉汁渗出率高于空气包装,也说明高体积分数CO 2抑菌作用并没有与之形成协同作用,CO 2的存在反而加重了鱼肉的肉质渗出 [2]。高压静电场条件下,气调包装和空气包装在感官、质构和鲜度指标值上显著性差异,综合来看,空气包装优于气调包装。因此,高压静电场结合冰温条件下保存鲜罗非鱼片,采用空气包装即可达到理想的效果。
将高压静电场结合冰温技术能够有效延长鲜罗非鱼片货架期,鱼肉中微生物数量在贮藏过程中不断下降,肉汁渗出问题得到有效改善,鲜度指标TVB-N值与K值维持在较低水平。通过透射电子显微镜观察鱼肉组织肌肉纤维,表明了肌肉蛋白质降解速率被延缓,维持了良好的感官特征。高压静电场结合冰温技术结合使用可使得冰鲜鱼片产品在超市中销售,而带有高压静电场的新型冰箱是未来家用冰箱的发展新趋势。
参考文献:
[1] 赵海军, 杨彬彬, 郝跃, 等. 我国罗非鱼出口现状及对策[J]. 食品安全质量检测学报, 2015(12): 5100-5106.
[2] 蔡兴旺, 王斌. 茄子种高压静电场生物效应试验研究[J]. 种子, 2003(1): 19-20. DOI:10.3969/j.issn.1001-4705.2003.01.008.
[3] 高伟娜, 顾小清. 高压静电场对植物生物学效应的研究进展[J]. 现代生物医学进展, 2006(7): 60-62. DOI:10.3969/ j.issn.1673-6273.2006.07.022.
[4] 牟波佳, 张光先. 高压静电场对过氧化氢酶的激活作用研究[J]. 西南师范大学学报(自然科学版), 1999(2): 196-200.
[5] 沈泽智. 微环境下高压静电场对酶作用的影响[J]. 重庆职业技术学院学报, 2008(3): 105-106. DOI:10.3969/ j.issn.1674-5787.2008.03.038.
[6] 张光先, 张济龙, 牟波佳. 高压静电场对过氧化氢酶的稳定作用及机理研究[J]. 激光生物学报, 2001(1): 44-47. DOI:10.3969/ j.issn.1007-7146.2001.01.010.
[7] 蒋耀庭, 孙英. 高压静电场用于生酱油灭菌处理的研究[J]. 高电压技术, 1999(3): 45-46. DOI:10.3969/j.issn.1003-6520.1999.03.016.
[8] 罗莹, 张佰清, 魏宝东. 高压直流静电场对大肠杆菌的杀菌效果[J]. 沈阳农业大学学报, 2006(1): 114-116. DOI:10.3969/ j.issn.1000-1700.2006.01.030.
[9] 罗莹, 张佰清, 魏宝东. 静电高压杀菌效果研究[J]. 包装与食品机械, 2005(5): 12-14. DOI:10.3969/j.issn.1005-1295.2005.05.004.
[10] 张佰清, 罗莹, 魏宝东. 高压静电场杀菌效果研究[J]. 保鲜与加工, 2005(6): 44-46. DOI:10.3969/j.issn.1009-6221.2005.06.018.
[11] 朱丽霞, 张佰清. 高压匀强静电场对大肠杆菌的致死效应[J]. 沈阳农业大学学报, 2008(1): 52-55. DOI:10.3969/ j.issn.1000-1700.2008.01.012.
[12] 胡燕, 陈忠杰. 高压静电场(HVEF)处理对莲藕品质的影响[J]. 食品科技, 2012, 37(3): 89-93.
[13] 胡燕, 陈忠杰. 高压静电场联合气调包装对莲藕保鲜效果研究[J].食品工业, 2013, 34(10): 110-112.
[14] 蒋耀庭, 常秀莲, 李磊. 高压静电场处理对鲜切青花菜保鲜的影响[J].食品科学, 2012, 33(12): 299-302.
[15] 孙贵宝. 高压静电场长期贮藏保鲜蓝莓果的试验研究[J]. 农机化研究, 2003(1): 121-123. DOI:10.3969/j.issn.1003-188X.2003.01.050.
[16] 孙贵宝, 刘铁玲, 梁鹏, 等. 高压静电场处理对青椒鲜度保持的影响[J]. 农机化研究, 2007(3): 134-135. DOI:10.3969/j.issn.1003-188X.2007.03.043.
[17] 王颉. 高压静电场处理对几种果品蔬菜采后品质的影响及机理探讨[D]. 北京: 中国农业大学, 2003.
[18] KO W, YANG S, CHANG C, et al. Effects of adjusTableparallel high voltage electrostatic field on the freshness of tilapia (Orechromis niloticus) during refrigeration[J]. LWT-Food Science and Technology, 2016, 66: 151-157. DOI:10.1016/j.lwt.2015.10.019.
[19] 吕凯波. 冰温气调保鲜对黄鳝片品质及其菌相的影响[D]. 武汉: 华中农业大学, 2007.
[20] 农业部. 水产品中挥发性盐基氮的测定: SC/T 3032—2007[S]. 北京:中国标准出版社, 2007.
[21] 邹明辉, 李来好, 郝淑贤, 等. 凡纳滨对虾虾仁在冻藏过程中品质变化研究[J]. 南方水产, 2010(4): 37-42. DOI:10.3969/ j.issn.1673-2227.2010.04.007.
[22] 国家质量监督检验检疫总局. 农产品安全质量无公害水产品安全要求: GB 18406.4—2001[S]. 北京: 中国标准出版社, 2001.
[23] DAVID K, PERSIS S. The stability and shelf-life of food[M]. England: Wood Head Publishing Limited, 2000: 6-13.
[24] DALGAARD P. Qualitative and quantitative characterization of spoilage bacteria from packed fish[J]. International Journal of Food Microbiology, 1995, 26(3): 319-333. DOI:10.1016/0168-1605(94)00137-U.
[25] 李来好, 彭城宇, 岑剑伟, 等. 冰温气调贮藏对罗非鱼片品质的影响[J]. 食品科学, 2009, 30(24): 439-443. DOI:10.3321/ j.issn:1002-6630.2009.24.101.
[26] 曹祝, 李广雨, 赫娟, 等. 高压静电场对小麦叶片保护酶系统及麦长管蚜种群动态的影响[J]. 生态学报, 2016(4): 1001-1009. DOI:10.5846/stxb201407041377.
[27] 王国栋, 傅志东, 罗在碧. 高压静电场对米曲霉的致死效应及其酶活性的影响[J]. 西北农林科技大学学报(自然科学版), 1992(3): 102-106. DOI:10.3321/j.issn:1671-9387.1992.03.019.
[28] 熊建平, 李亚丽, 黎兆东, 等. 高压静电场(HVEF)对玉豆酶活性的影响[C]//中国物理学会第十五届静电学术年会. 郑州: 中国物理学会, 2009: 286-289.
Effect of High Voltage Electrostatic Field Combined with Modified Atmosphere Packaging and Controlled Freezing-Point Storage on the Quality of Tilapia Fillet
CEN Jianwei
1,2, JIANG Aimin
1,*, LI Laihao
2, YANG Xianqing
2, DU Bing
1, HAO Shuxian
2, XIN Shaoping
2
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China; 2. South China Sea Fisheries Research Institute, Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, National R&D Center for Aquatic Product Processing, Chinese Academy of Fishery Sciences, Guangzhou 510300, China)
Abstract:This study examined the effectiveness of high voltage electrostatic field (HVEF) in combination with modified atmosphere packaging (MAP) and controlled freezing-point storage (CFPS) for the preservation of fresh tilapia fillet. Its quality changes in terms of sensory evaluation, fleshy exudation rate, microbial count, texture and muscle microstructure were compared under different storage conditions. Experimental results showed that the combined treatment resulted in higher scores for fillet color and odor than the ordinary CFOS treatment (control) and effectively inhibited the microbial activity in fillet, and the total number of bacterial colonies in the combined treatment group was reduced to about 10 4CFU/g after 30 days of storage, indicating a larger reduction than of the control group. In addition, the drip loss rate was maintained at less than 5% in the combined treatment group, total volatile basic nitrogen (TVB-N) and K value (freshness index) also remained at a low level, and hardness decreased more slowly. Cell integrity and muscle fiber were observed by electron microscope, and it was revealed that the cellular structure was intact with close intercellular adhesions, which demonstrated that muscle protein degradation was slowed down. Moreover, the combined treatment could maintain the sensory quality of tilapia fillet and extend its shelf life to 30 days. This study indicates that the combination of HEVF, MAP and CFPS can maintain the quality of tilapia fillet and effectively extend its shelf life and therefore provides a feasible technical solution for domestic supermarket circulation of ice-stored tilapia fillet.
Key words:tilapia fillet; high voltage electrostatic field; modified atmosphere packaging and controlled freezing-point storage; microscopic observation
DOI:10.7506/spkx1002-6630-201622043
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2016)22-0282-07
引文格式:
岑剑伟, 蒋爱民, 李来好, 等. 高压静电场结合冰温技术对罗非鱼片贮藏期品质的影响[J]. 食品科学, 2016, 37(22): 282-288. DOI:10.7506/spkx1002-6630-201622043. http://www.spkx.net.cn
CEN Jianwei, JIANG Aimin, LI Laihao, et al. Effect of high voltage electrostatic field combined with modified atmosphere packaging and controlled freezing-point storage on the quality of tilapia fillet[J]. Food Science, 2016, 37(22): 282-288. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201622043. http://www.spkx.net.cn
收稿日期:2016-03-31
基金项目:中国水产科学研究院基本科研业务费专项(2015B06YQ01);中国水产科学研究院南海水产研究所中央级公益性科研院所基本科研业务费专项(2014YD06);国家现代农业(罗非鱼)产业技术体系建设专项(CARS-49);“扬帆计划”引进创新创业团队专项(2015YT02H109);“十二五”国家科技支撑计划项目(2015BAD17B03)
作者简介:岑剑伟(1976—),男,副研究员,博士,研究方向为水产品加工与质量安全。E-mail:genvex@163.com
*通信作者:蒋爱民(1962—),男,教授,博士,研究方向为食品工程。E-mail:jiangaimin20000@163.com