张 凯,侯 虎,彭 喆,张朝辉,赵 雪,李八方 *
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘 要::佳制备工艺及其消化吸收稳定性,以螯合率为指标对鳕鱼骨明胶多肽与CaCl 2的螯合工艺进行了优化,并利用体外胃肠模拟消化系统考察了产物在胃肠道环境中螯合率的变化情况。通过Box-Behnken试验设计与响应面分析,优化后螯合工艺确定为酶解时间1.5 h、肽钙质量比8∶1、pH 5.5、螯合温度50 ℃、螯合时间1 h,最终螯合率可达93.47%。扫描电子显微镜结果显示,鳕鱼骨明胶多肽与Ca 2+螯合后由粗糙的纤维状结构变为光滑的球状颗粒;傅里叶变换红外光谱显示Ca 2+和鱼骨明胶肽的氨基端与羧基端相结合。体外模拟消化实验证明,钙肽螯合物在模拟胃液中结构易受破坏,螯合率从60.74%降低到3.64%;在模拟肠液中螯合率随着时间的延长,由10.74%上升至53.38%(120 min)。研究结果为水产加工副产物的高值化利用及鱼骨明胶多肽螯合钙这一新型补钙制剂的开发提供了理论支持与技术参考。
关键词:明胶多肽;钙;螯合;响应面优化;体外模拟消化
缺钙会造成佝偻病、软骨病及骨质疏松等严重疾病,对人类的身体健康造成极大的威胁 [1]。目前市面上的补钙制剂具有一定的补充Ca 2+作用,但这些钙制剂多以无机酸钙或有机酸钙为主,吸收利用率低、对肠胃的刺激性大 [2],难以达到较好的补钙效果。研究发现钙在体内需要与小肠刷状缘分泌的短肽或氨基酸螯合后再被小肠吸收 [3-4]。因此明胶多肽螯合钙以其生物效价高、吸收快、无毒、无刺激作用等优点 [5]成为了为第四代补钙制剂,得到了人们的广泛关注。
我国鳕鱼年加工量约为40万~50万 t,鱼骨占总加工量的15%左右,其中鱼骨干物质中蛋白质含量为40%~50%,且主要是胶原蛋白 [6]。但实际生产中鱼骨直接作为低值饲料甚至废弃物处理,造成了资源浪费及环境污染问题。利用鱼骨制备明胶多肽是一种有效的利用形式 [7],研究者们发现鱼骨明胶多肽具有较好的降血压 [8]、抗氧化 [9-10]、预防骨质疏松 [5]等生物活性。也研究了斑点叉尾鮰鱼骨、猪骨、羊骨、鲢鱼骨等其他来源的多肽与Ca 2+的螯合技术 [5,11-17],并初步推测Ca 2+与多肽中α-氨基酸上的羧基与氨基结合形成多元环的结构 [5]。这些研究虽然对骨明胶多肽与Ca 2+的螯合工艺进行了一定的优化,但最终螯合率分别为83.15%、79.9%、67.24%、85.24%,一直难以提升到较高水平,制约了其在食品工业中的应用;而以鳕鱼骨为原料制备鱼骨明胶钙肽螯合物的工艺研究较少,其消化吸收稳定性的研究则更是鲜有报道。
本实验以鳕鱼骨为原料,通过复合酶解法制备鳕鱼骨明胶多肽并将其与Ca 2+在一定条件下螯合,旨在开发具有较高螯合率的鳕鱼骨明胶多肽螯合钙制备工艺。利用单因素试验探究了酶解时间、螯合温度、螯合时间、螯合pH值及肽钙质量比对螯合率的影响。并通过Box-Behnken响应面试验对制备工艺进行了优化,制得了较高质量的鳕鱼骨明胶多肽螯合钙。利用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)及扫描电子显微镜(scanning electron microscope,SEM)对鳕鱼骨明胶多肽螯合钙的结构变化进行了初步的分析。最终采用体外模拟消化系统,探究了鱼骨明胶钙肽螯合物在胃肠道环境中的稳定性。实验结果为高效补钙制剂的开发、水产资源的深加工以及水产副产物的高值化利用提供了技术支持与实验依据,有利于水产加工行业的可持续发展。
1.1 材料与试剂
新鲜鳕鱼(Gadus macrocephalus)鱼排由青岛福生食品有限公司提供,-20 ℃保藏。
KBr(光谱纯) 美国Sigma公司;胃脂肪酶(30~90 U/mg)、胰蛋白酶(250 U/mg)、中性蛋白酶(200 U/mg)、胃蛋白酶(3 000 U/mg)、猪胆粉北京索莱宝科技有限公司;氢氧化钠、氯化钠、氯化钾、氯化钙、碳酸氢钠、醋酸钠、盐酸、氢氧化钠、无水乙醇(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
QDGX-15湿法超微粉碎机 无锡轻大食品装备有限公司;MLS-3750高温高压灭菌锅 日本Sanyo株式会社;HD-3A型智能水分活度测量仪 无锡市华科仪器仪表有限公司;HHS-Ni型电热恒温水浴锅北京市长安仪器厂;200SXV型FT-IR仪 美国Nicolet公司;NXG101-1电热鼓风干燥箱 南京市第一医疗器械厂;PHS-3C精密酸度计 上海市虹益仪器仪表有限公司;ME204电子天平 梅特勒-托利多仪器有限公司;Alpha 2-4 LD plus冷冻干燥器 德国Marin Christ公司;TAS-990原子吸收分光光度计 北京普析通用仪器公司;JSM-840型SEM 日本Jeol株式会社。
1.3 方法
1.3.1 鳕鱼骨明胶的制备
在55 ℃条件下,按料液比1∶1(g/mL)将解冻后的鱼排与蒸馏水混合,将pH值调至7.5,加质量分数0.5%胰蛋白酶与0.5%中性蛋白酶(以鱼排质量计)酶解1 h,得到洁净鳕鱼骨后煮沸10 min灭酶。灭酶后的鱼骨用湿法超微粉碎机粉碎至0.05 mm,121 ℃高温高压处理50 min,按料液比1∶3(g/mL)加入蒸馏水后在70 ℃条件下热力提取4 h,离心后冻干得到鳕鱼骨明胶。
1.3.2 鱼骨明胶多肽螯合钙的制备
鱼骨明胶多肽螯合钙的制备工艺流程如下:质量浓度为100 g/L的鱼骨明胶溶液→加0.5 g/L胰蛋白酶与0.5 g/L中性蛋白酶酶解(pH 7.5,50 ℃)→煮沸10 min灭酶→鱼骨明胶多肽溶液(含钙量为0%)→加入氯化钙→调节pH值→恒温水浴螯合→8 倍体积无水乙醇沉淀→抽滤、洗涤→冷冻干燥制得成品。
1.3.3 螯合率的测定与计算
采用改进的乙醇沉淀法 [13-14,17]对螯合率进行测定:螯合反应结束后取1 mL样品加入8 mL无水乙醇,静置3 h后8 000 r/min离心15 min,去除沉淀后将上清液浓缩至1~2 mL,再加入8 倍体积无水乙醇,静置3 h后8 000 r/min离心15 min,测定上清液中的游离钙含量。钙含量参照GB/T 5009.92—2003《食品中钙的测定》通过原子吸收法测定。螯合率按下式进行计算:
式中:m 1为1 mL样品反应体系中的总钙含量/mg;m 2为上清液中游离钙的含量/mg。
1.3.4 螯合工艺优化设计
1.3.4.1 单因素试验设计
单因素试验的基本条件定为:酶解时间1.5 h、螯合温度60 ℃、螯合时间1.5 h、螯合pH 6.5、肽钙质量比2.5∶1。改变其中一个条件,固定其他条件以分析各单因素对螯合率的影响。各因素水平梯度分别为:酶解时间0.5、1.0、1.5、2.0、2.5、3.0 h;螯合温度30、40、50、60、70、80、90 ℃;螯合时间0.5、1.0、1.5、2.0、2.5 h;螯合pH 4.5、5.5、6.5、7.5、8.5;肽钙质量比10∶1、5∶1、2.5∶1、1∶1、1∶2.5(当多肽与钙离子质量比为1∶2.5时,先将氯化钙加入蒸馏水中,50 ℃振荡水浴溶解后再按比例加入鱼骨明胶多肽进行螯合反应)。每个水平重复试验3 次。
1.3.4.2 响应面试验设计
在分析单因素试验结果的基础上,选取3 个对螯合率影响最显著的因素,以螯合率Y为响应值,采用Box-Behnken组合方法进行三因素三水平响应面试验设计。分别将螯合温度、肽钙质量比、pH值设为X 1、X 2、X 3,采用Design-Expert 8.1软件设计试验并对数据进行分析。
1.3.5 SEM观察
分别将1 mg鱼骨明胶多肽及鱼骨明胶多肽螯合钙放置于洁净铝箔上,在15 mA的电流条件下真空喷金后装入SEM观察室中,将加速电压设为15 kV,在SEM下分别将样品放大至800 倍与2 000 倍对其微观结构表征进行观察。
1.3.6 FT-IR分析
分别将1~2 mg鱼骨明胶多肽和鱼骨明胶多肽螯合钙样品与200~300 mg烘干至恒质量的KBr置于玛瑙研钵中,混匀并研磨成粉末状并压片,后将压片后的样品放入样品室。用Nicolet-200SXV FT-IR仪对样品在4 000~500 cm -1区间扫描,设置分辨率为2 cm -1。
1.3.7 鱼骨明胶多肽螯合钙在体外胃肠模拟体系中稳定性分析
胃肠模拟体系中使用的胃肠电解质溶液及胃肠模拟液参考Tedeschi等 [15]报道的胃肠消化模型进行配制。
1.3.7.1 胃液配制
胃电解质溶液的配制:称取3.1 g NaCl、1.1 g KCl、0.6 g NaHCO 3,用蒸馏水定容至1 L后将pH值调至2;胃液的配制:称取 37.5 mg胃脂肪酶、35.4 mg胃蛋白酶加入到150 g胃电解质中,加入1.5 mL 1 mol/L醋酸钠溶液(pH 5)后将pH值调至2。
1.3.7.2 小肠液配制
肠电解质溶液的配制:称取5.4 g NaCl与0.65 g KCl,用蒸馏水定容至1 L后将pH值调至8;胰酶溶液的配制:将14 g胰酶溶于200 g蒸馏水中,室温条件下磁力搅拌10 min,5 000 r/min离心10 min,取上清液100 g待用;胆汁的配制:将猪胆粉溶于去离子水中制得质量分数4%溶液;小肠液的配制:50 g肠电解质溶液、50 g胰酶溶液与100 g胆汁混合溶解后将pH值调至8;将样品配制成10.0 mg/mL的溶液。取2 个50 mL灭菌离心管,编号A、B,在两管中各加入4 mL样品溶液,然后向A管中加入模拟胃液4 mL,B管中加入胃电解质溶液4 mL,置于恒温振荡器(37 ℃)中,分别在0、15、30、60、90、120 min时取1 mL反应液,测定反应体系中样品的螯合率。
上述反应全部结束后,将剩余样液用0.1 mol/L NaOH溶液调节pH值至7.5。向A管中继续加入模拟肠液4 mL,B管中加入肠电解质,置于恒温振荡器(37 ℃)中,分别在0、15、30、60、90、120 min时取1 mL反应液,测定反应体系中钙的螯合率。螯合率的测定参照1.3.3节。
1.4 数据统计分析
所有数据以
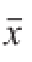 ±s表示,采用SPSS 11.0软件对数据进行方差分析(ANOVA),同时进行LSD检验。以P<0.05为有显著性差异。
±s表示,采用SPSS 11.0软件对数据进行方差分析(ANOVA),同时进行LSD检验。以P<0.05为有显著性差异。
2.1 单因素试验结果
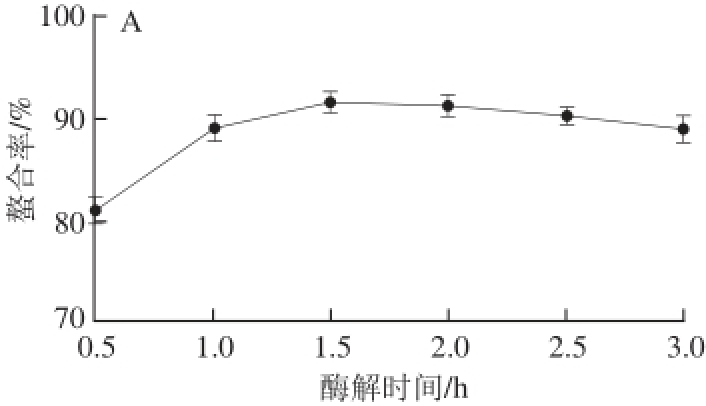
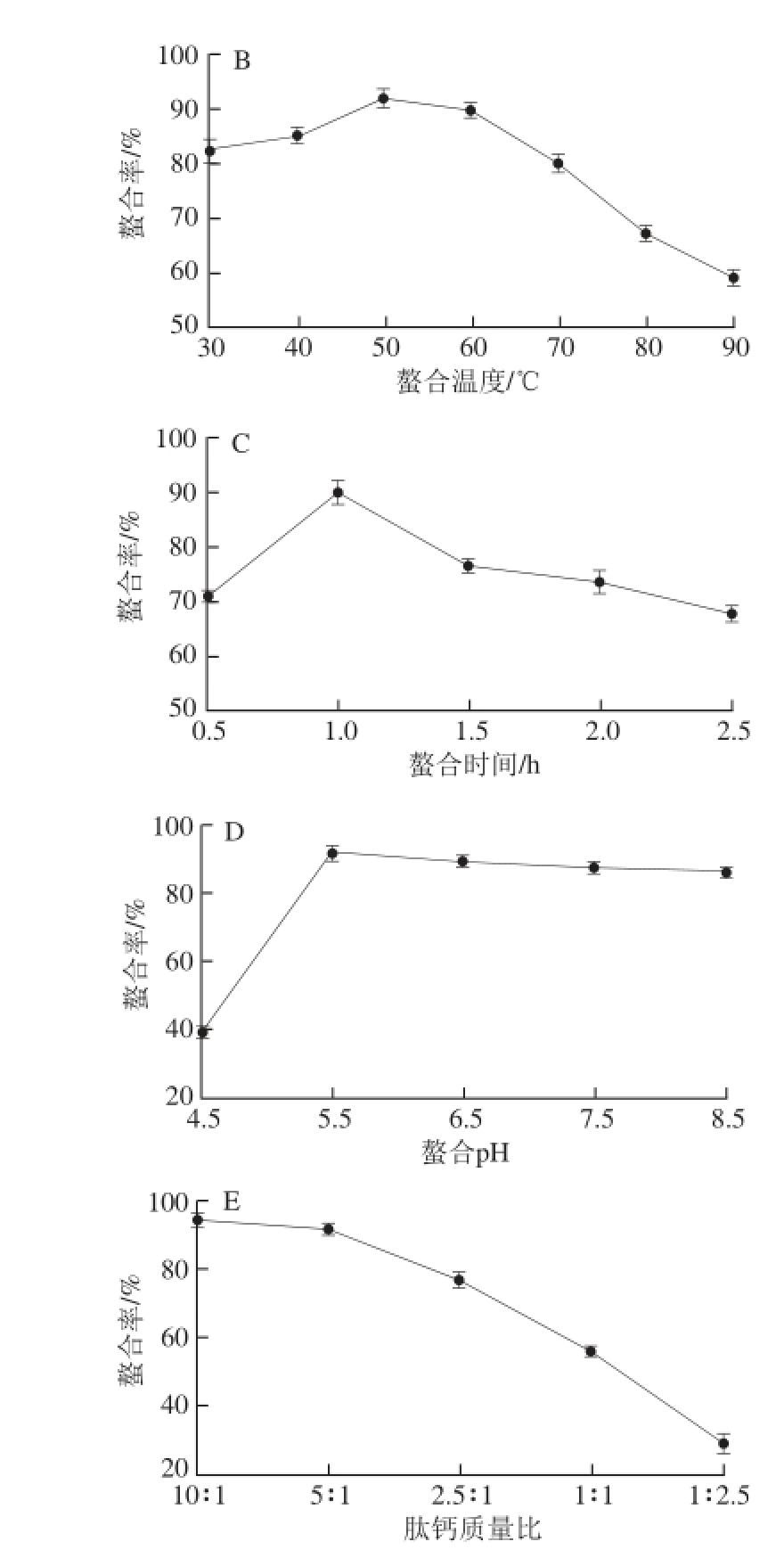
图1 酶解时间(A)、螯合温度(B)、螯合时间(C)、螯合pH值(D)及肽钙质量比(E)对螯合率的影响
Fig. 1 Effects of hydrolysis time, chelating temperature, time, pH value and mass ratio of peptide to calcium on the chelating rate
如图1所示,随着酶解时间的延长,螯合温度的升高及螯合时间的延长,螯合率均呈先上升后下降的趋势,分别在酶解时间1.5 h、螯合温度50 ℃、螯合时间1 h时螯合率达到最高。过低或过高的pH值都不利于螯合反应的进行 [16],当反应体系的pH值从4.5增加到5.5时,螯合率从38.78%增加到92.20%,而当pH值进一步升高时,螯合率并没有继续增高的现象,但在pH值分别为6.5、7.5的条件下螯合率依旧保持较高水平(大于87.5%),当pH值为8.5时,螯合率降低到86.05%。当肽钙质量比10∶1~1∶2.5时,螯合率显著下降(P<0.01),这说明当Ca 2+含量过高时多肽中的螯合位点已经饱和,导致反应体系中的钙大多以游离态的形式存在,最终造成了螯合率的下降,这与范鸿冰等 [17]的研究相一致。当肽钙质量比为10∶1与5∶1时螯合率分别为94.12%和91.94%,但是当肽钙质量比为10∶1时产物中的钙含量仅为4.6%,造成了活性多肽的浪费,因此最佳肽钙质量比选定为5∶1。
2.2 响应面试验结果
2.2.1 响应面试验设计及结果
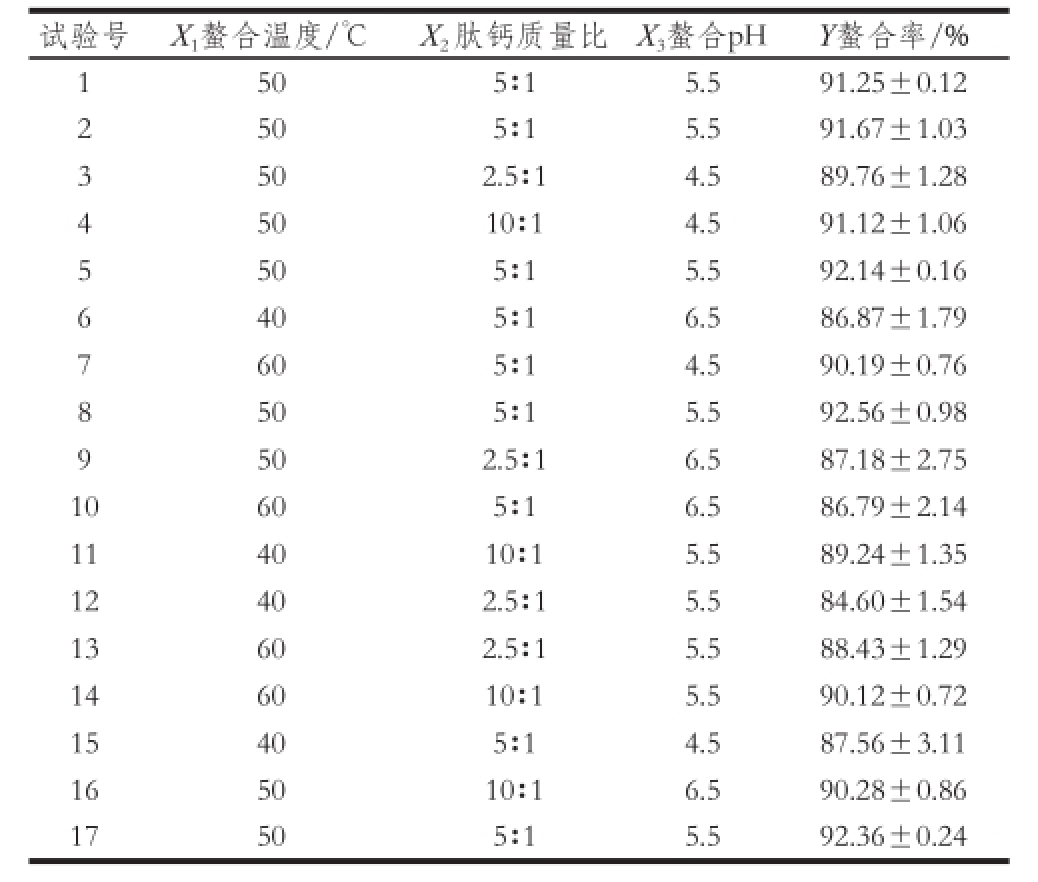
以螯合率为响应值Y,综合单因素试验结果选取螯合温度、肽钙质量比、螯合pH值3 个因素进行Box-Behnken响应面试验设计。试验设计及结果如表1所示。
表1 响应面试验设计及结果
Table 1 Experimental design and results for response surface analysis
?
表2 响应面试验方差分析
Table 2 Analysis of variance (ANOVA) of response surface regression model
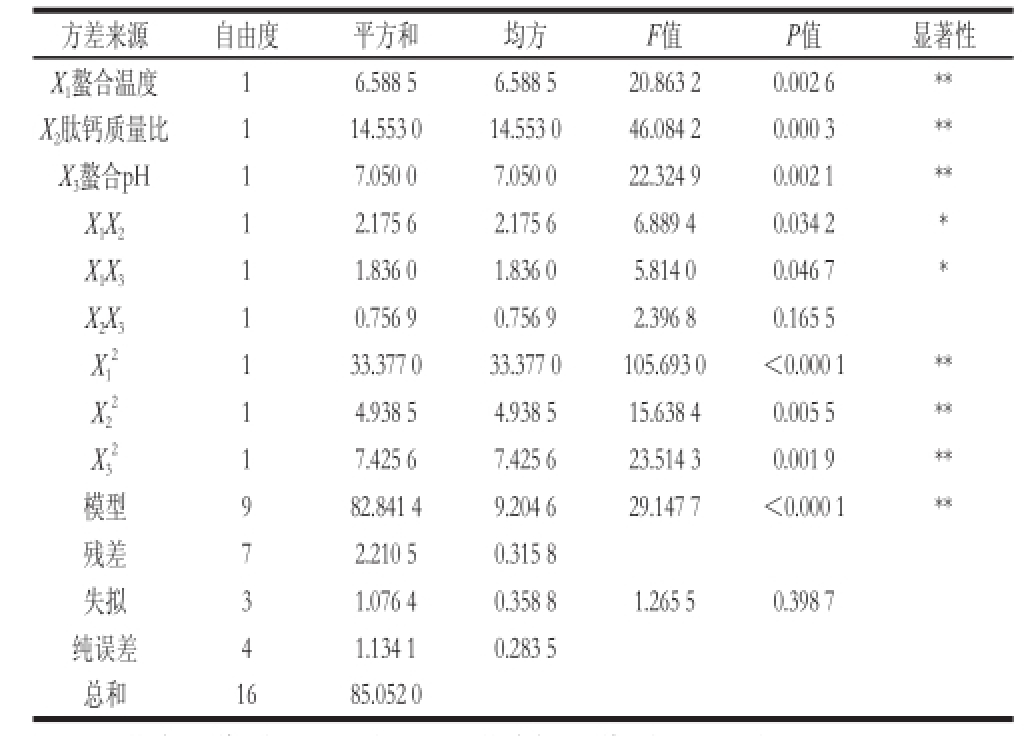
注:*.影响显著(P<0.05);**.影响极显著(P<0.01)。
?
对结果中的试验数据进行拟合回归,以螯合温度(X 1)、肽钙质量比(X 2)、螯合pH值(X 3)为自变量,螯合率为因变量(响应值Y),建立二次多元回归方程模型:
Y =92.00+0.91X 1+1.35X 2-0.94X 3-0.74X 1X 2-0.68X 1X 3+0.43X 2X 3-2.82X 1 2-1.08X 2 2-1.33X 3 2
回归方程的方差分析如表2所示。其回归方程达到了极显著水平(P<0.01),且失拟项不显著(P>0.05),表明方程相对于试验数据的拟合程度较好。总决定系数R 2= 0.974 0,表明自变量与响应值之间线性关系显著,即该模型预测值与实际试验值拟合较好,因此可利用该回归方程代替试验真实点对结果进行分析。而回归方程各项系数的显著性分析结果显示,因素X 1、X 2与X 3三者的线性效应以及平方效应对螯合率的影响均呈现极显著水平(P<0.01),因素X 1与X 2、因素X 1与X 3的耦合效应对螯合率的影响呈显著水平(P<0.05)。响应面分析图可以直观地表明2 个因素间相互作用对响应值的影响程度,螯合温度(X 1)、肽钙质量比(X 2)、螯合pH值(X 3)3 个因素之间耦合作用对螯合率的影响如图2所示。由表2和图2的结果分析可以得出,对螯合率影响最显著的是肽钙质量比和螯合温度之间的耦合作用,其次是螯合温度和螯合pH值的耦合作用,而肽钙质量比和螯合pH值之间的相互作用对螯合率没有显著影响。

图2 螯合温度、肽钙质量比、螯合pH值交互作用对螯合率的影响
Fig. 2 Effects of chelating temperature, mass ration of peptide to calcium, and pH on the chelating rate
2.2.2 工艺优化验证实验结果
利用Design-Export 8.1软件对回归方程进行预测,预测最优螯合工艺为螯合温度51.30 ℃、肽钙质量比8.19∶1、螯合pH 5.20,此时螯合率最高可达(92.55±3.08)%。选择最接近此条件的反应参数:在螯合温度50 ℃、肽钙质量比例8∶1、螯合pH 5.5的条件下螯合1 h,做3 组平行实验。结果表明在此条件下螯合率为(93.47±1.25)%,与预测值无显著性差异(P>0.05),证明此条件为鱼骨明胶钙肽螯合反应的最优条件。生产过程中未螯合的Ca 2+以游离的形式存在,不仅造成了Ca 2+的浪费,而且不利于身体的消化吸收。相关研究 [5,17-19]中得到的最高螯合率分别为65.17%、85.24%、57.22%、77.7%,与之相比本实验优化的工艺螯合率显著增加(P<0.05),实验结果说明本研究得到的鳕鱼骨明胶多肽螯合钙制备工艺在生产过程中浪费的Ca 2+更少,更适用于工业生产。
2.3 SEM分析

图3 鳕鱼骨明胶多肽及鳕鱼骨明胶多肽螯合钙SEM图谱
Fig. 3 Scanning electron micrograph of cod bone gelatin peptide and its calcium-chelated form
鱼骨明胶多肽及鱼骨明胶钙肽螯合物的表观差异极为显著,利用SEM对其微观结构进行了研究,结果如图3所示,鱼骨明胶多肽呈表面粗糙的短纤维状,且多肽分子之间形成一定的蜂窝状交联结构。鱼骨明胶多肽螯合钙变为10 μm左右的光滑球状颗粒,表明多肽与Ca 2+结合后导致了产物结构的变化。韩克光等 [13]对羊骨明胶多肽与羊骨多肽螯合钙进行了扫描SEM分析,结果表明与Ca 2+螯合之后,明胶多肽由疏松的片状结构变为了紧密的颗粒状聚集体,与本研究的结果相似。
2.4 FT-IR分析
鱼骨明胶多肽及鳕鱼骨明胶多肽螯合钙的FT-IR扫描结果如图4所示,FT-IR图结果表明:鱼骨明胶多肽在3 308.66 cm -1处出现明显的宽吸收峰,这是由于多肽酰胺结构中N—H伸缩振动引起的特征吸收峰 [20];1 646.72 cm -1处出现的特征吸收峰是由多肽中C=O的伸缩振动所引起的,属于酰胺Ⅰ带吸收峰 [21];这些光谱的特征说明了鱼骨明胶蛋白肽的多肽特征 [22]。
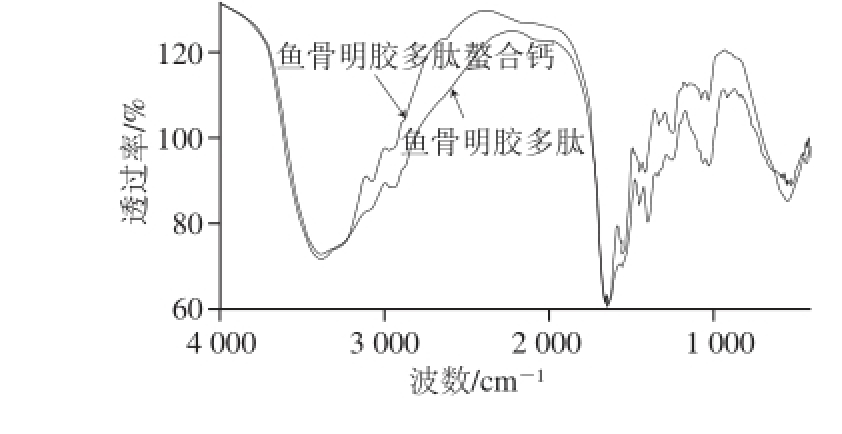
图4 鳕鱼骨明胶多肽与鳕鱼骨明胶多肽螯合钙FT-IR图
Fig. 4 Infrared spectra of cod bone gelatin peptide and its calcium-chelated form
与鱼骨明胶多肽的谱图相比,鱼骨明胶多肽螯合钙的光谱发生了明显变化。鱼骨明胶多肽谱图指纹区中1 079.17 cm -1及1 250.94 cm -1处的特征吸收峰分别是由明胶多肽中—COOH以及—NH 2的伸缩振动造成的,在鳕鱼骨明胶多肽螯合钙的谱图中这2 个峰均显著减弱,说明多肽中的—COOH以及—NH 2参与了钙肽螯合反应 [23]。鱼骨明胶多肽谱图官能区中1 398.21 cm -1处的特征吸收峰为多肽中羧基离子的对称振动吸收峰,在鳕鱼骨明胶多肽螯合钙的谱图中此峰移到了1 416.98 cm -1处,位于羧酸盐的特征吸收区域(1 410~1 450 cm -1)中;并且吸收峰的强度显著减弱,说明鱼骨明胶多肽中的羧基参与了钙肽螯合物的形成 [24]。铵盐中N—H弯曲振动的特征吸收带为1 500~1 600 cm -1,鳕鱼骨明胶多肽螯合钙的谱图在此区域中1 557.65 cm -1处出现了一个明显的强峰,说明多肽中的氨基与Ca 2+发生了较强的螯合作用,导致了钙肽螯合物的形成 [25]。以上结果说明鱼骨明胶多肽的氨基与羧基都在螯合Ca 2+的过程中起到了重要的作用,氨基与羧基与Ca 2+螯合之后导致鱼骨明胶多肽的结构发生了显著变化。
2.5 鱼骨明胶多肽螯合钙在体外模拟消化体系中的稳定性
Ca 2+主要在肠道内被人体吸收利用,当产物中的Ca 2+与多肽以螯合的形式存在时具有较好的吸收特性,Ca 2+在肠道内以游离态存在时容易与OH -形成Ca(OH) 2沉淀进而降低Ca 2+的生物利用度 [4]。目前的研究主要关注于螯合工艺的优化 [5,11,13,17],而对螯合物消化吸收稳定性的研究较少。本研究以螯合率为指标,利用体外模拟胃肠消化体系考察了其在消化吸收过程中的稳定性。样品在胃肠电解质以及胃肠模拟液(胃肠电解质加消化酶)中螯合率的变化如图5所示,实验结果表明:胃肠电解质以及胃肠模拟液中样品的螯合率随着模拟消化时间的延长而显著变化。
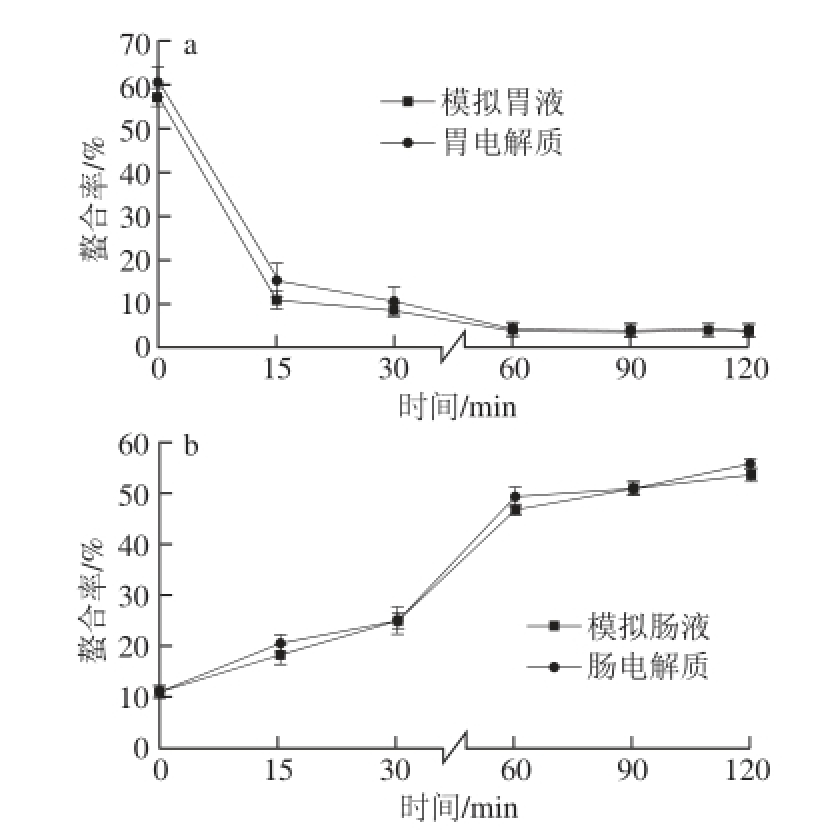
图5 模拟胃部消化(a)和肠道消化(b)对鱼骨明胶多肽螯合钙螯合率的影响
Fig. 5 Changes in calcium chelating rate of fishbone gelatin peptide during simulated gastrointestinal digestion
经工艺优化后鱼骨明胶多肽螯合钙的螯合率可达93.47%,如图5a所示,在加入模拟胃液后,样品螯合率下降到60.74%,并于15 min内迅速降至10.82%(P<0.01);当模拟胃部消化时间从15 min延长至120 min时,螯合率的下降速度逐渐变缓,最终降至3.64%,此时Ca 2+主要以游离的形式存在。这是可能是由于胃部pH值较低,H +含量极高,高浓度的H +与Ca 2+争夺了明胶多肽上绝大部分的结合位点,并破坏了鱼骨明胶多肽螯合钙的结构,导致了螯合率的迅速下降 [14]。
由图5b可知,在模拟肠道消化过程中,样品的螯合率显著回升(P<0.01)。在0~60 min内,螯合率从10.74%增加到了46.77%;随着时间的进一步延长,螯合率的增长速度变缓,最终模拟肠液中鱼骨明胶钙肽螯合物的螯合率增加到(53.38±1.10)%,肠电解质中的螯合物的螯合率上升到(55.58±0.68)%。这是由于进入肠道后pH值升高,外界环境中H +的浓度逐渐降低,Ca 2+和多肽的螯合能力增强,最终导致钙肽螯合率升高 [14]。但此时仍有近50%的Ca 2+以游离形式存在于溶液中,这可能是由于胃部过酸的电解质环境导致了鱼骨明胶多肽结构的变化,影响了其与Ca 2+结合的活性;并且模拟胃肠消化体系中的消化酶的存在也可能造成了多肽的降解,破坏了多肽中的螯合结构,减弱了明胶多肽与Ca 2+的螯合作用。两歩模拟消化结束后,产物在模拟肠液中的螯合率略低于肠电解质中螯合率的原因可能是模拟胃肠消化体系中的消化酶导致了鱼骨明胶多肽的降解,影响了其螯合能力的恢复。此现象会导致Ca 2+生物利用度的下降,为保证Ca 2+可以被人体高效吸收利用,开发在胃肠道环境内稳定性较好的新一代多肽螯合钙制剂可能会成为该领域新的研究热点。
本研究通过Box-Behnken试验设计与响应面分析确定了鳕鱼骨明胶多肽螯合钙的制备工艺为:酶解时间1.5 h、螯合温度50 ℃、肽钙质量比例8∶1、螯合pH 5.5、螯合时间1 h。在此工艺条件下螯合率可达93.47%。实验结果证明,鱼骨明胶多肽的氨基和羧基参与了螯合反应的进程,且多肽与Ca 2+结合生成鱼骨明胶多肽螯合钙后微观结构显著改变,形成了直径约为10 μm左右的紧密球形结构。体外模拟消化结果表明鱼骨明胶多肽螯合钙在胃部受到破坏,Ca 2+主要以游离形式存在;进入肠道后其螯合率逐渐恢复,但最终仍会有近50%的Ca 2+未与多肽螯合,这可能是多肽在模拟胃肠消化体系中受到电解质环境以及消化酶的破坏,从而导致了螯合率的下降。本研究为多肽螯合钙这一新型补钙制剂的开发与利用提供了技术参考与理论支持。
参考文献:
[1] 梁春辉, 菅景颖, 张志胜. 胶原多肽螯合钙壮骨作用研究[J]. 河北农业大学学报, 2010, 33(5): 94-97. DOI:10.3969/j.issn.1000-1573.2010.05.021.
[2] 蒋金来, 王令充, 吴皓, 等. 钙制剂研究进展[J]. 食品工业科技, 2012, 33(11): 379-387. DOI:10.13386/j.issn1002-0306.2012.11.019.
[3] PEREGO S, del FAVERO E, de LUCA P, et al. Calcium bioaccessibility and uptake by human intestinal like cells following in vitro digestion of casein phosphopeptide-calcium aggregates[J]. Food and Function, 2015, 6(6): 1796-1807. DOI:10.1039/c4fo00672k.
[4] 张经坤, 张泽民, 于敖. 人体钙吸收理论探讨[J]. 科学通报, 2000, 45(10): 1114-1120. DOI:10.3321/j.issn:0023-074X.2000.10.022.
[5] 孟昌伟. 斑点叉尾鮰鱼骨钙制剂的制备及其生物活性研究[D].合肥: 合肥工业大学, 2012.
[6] 王珊珊. 鳕鱼骨胶原肽与活性钙的制备及其抗骨质疏松活性研究[D].青岛: 中国海洋大学, 2013.
[7] TOPPE J, ALBREKTSEN S, HOPE B, et al. Chemical composition,mineral content and amino acid and lipid profiles in bones from various fish species[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 146(3): 395-401. DOI:10.1016/j.cbpb.2006.11.020.
[8] MORIMURA S, NAGATA H, UEMURA Y, et al. Development of an effective process for utilization of collagen from livestock and fish waste[J]. Process Biochemistry, 2002, 37(12): 1403-1412. DOI:10.1016/S0032-9592(02)00024-9.
[9] JE J Y, QIAN Z J, BYUN H G, et al. Purifi cation and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry, 2007, 42(5): 840-846. DOI:10.1016/j.procbio.2007.02.006.
[10] BOUGATEF A, NEDIAR A N, MANNI L, et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle (Sardinella aurita) by-products proteins[J]. Food Chemistry, 2010, 118(3): 559-565. DOI:10.1016/ j.foodchem.2009.05.021.
[11] 赵妍嫣, 胡林林, 姜绍通. 猪骨粉制备胶原多肽螯合钙工艺优化[J]. 农业工程学报, 2011, 27(14): 277-281. DOI:10.3969/ j.issn.1002-6819.2011.z2.053.
[12] 赵立娜, 汪少芸, 张亚娇, 等. 响应面法优化乳清蛋白肽螯合钙离子的研究[J]. 中国食品学报, 2014, 14(4): 64-71. DOI:10.16429/j.1009-7848.2015.07.023.
[13] 韩克光, 甄守艳, 范华, 等. 钙螯合羊骨胶原多肽的制备及表征分析[J]. 农业工程学报, 2015, 31(21): 301-307. DOI:10.11975/ j.issn.1002-6819.2015.21.040.
[14] 卢玉坤. 鳕鱼皮胶原蛋白肽的促钙吸收作用研究[D]. 青岛: 中国海洋大学, 2013.
[15] TEDESCHI C, CLEMENT V, ROUVET M, et al. Dissolution tests as a tool for predicting bioaccessibility of nutrients during digestion[J]. Food Hydrocolloids, 2009, 23(4): 1228-1235. DOI:10.1016/ j.foodhyd.2008.09.012.
[16] 薛爱爱. 氨基酸与二肽金属螯合物的研究[D]. 兰州: 兰州理工大学, 2008.
[17] 范鸿冰, 汪之颖, 刘鹏, 等. 鲢鱼骨胶原多肽螯合钙的制备研究[J]. 南方水产科学, 2014, 10(2): 72-79. DOI:10.3969/ j.issn.2095-0780.2014.02.011.
[18] 胡振珠, 杨贤庆, 马海霞, 等. 罗非鱼骨粉制备氨基酸螯合钙及其抗氧化性研究[J]. 食品科学, 2010, 31(20): 141-145.
[19] 彭巧云, 沈菊泉, 魏东芝, 等. 正交试验优化胶原多肽螯合钙的制备工艺[J]. 食品科学, 2013, 34(8): 94-99.
[20] BAE I, OSATOMI K, YOSHIDA A, et al. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes[J]. Food Chemistry, 2008, 108(1): 49-54. DOI:10.1016/ j.foodchem.2007.10.039.
[21] 高菲, 王维有, 鲁军, 等. 海洋鱼骨胶原肽钙螯合物的制备及红外光谱表征[J]. 中国海洋大学学报(自然科学版), 2015, 45(1): 47-54.
[22] MOORE W H, KRIMM S. Vibrational analysis of peptides, polypeptides, and proteins. Ⅱ. Β-Poly (L-alanine) and β-poly (L-alanylglycine)[J]. Biopolymers, 1976, 15(12): 2465-2483. DOI:10.1002/bip.1976.360151211.
[23] NARA M, TANOKURA M. Infrared spectroscopic study of the metalcoordination structures of calcium-binding proteins[J]. Biochemical and Biophysical Research Communications, 2008, 369(1): 225-239. DOI:10.1016/j.bbrc.2007.11.188.
[24] DOYLE B B, BENDIT E G, BLOUT E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers, 1975, 14(5): 937-957. DOI:10.1002/bip.1975.360140505.
[25] NARA M, MORII H, TANOKURA M. Coordination to divalent cations by calcium-binding proteins studied by FTIR spectroscopy[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2013, 1828(10): 2319-2327. DOI:10.1016/j.bbamem.2012.11.025.
Optimization of Preparation of Calcium-Chelated Cod Bone Gelatin Peptide and Its Stability in Simulated Gastrointestinal System
ZHANG Kai, HOU Hu, PENG Zhe, ZHANG Zhaohui, ZHAO Xue, LI Bafang*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:The preparation and digestion stability of calcium-chelated cod bone gelatin peptides were investigated in this study. The optimal parameters for chelating cod bone gelatin polypeptides with CaCl 2were obtained by using a 3-factor 3-level Box-Behnken experimental design with response surface methodology as follows: after the gelatin was hydrolyzed at 50 ℃ for 1.5 h, the hydrolysate and CaCl 2were mixed at 50 ℃ at a mass ratio of 8:1 for 1 h and adjusted to pH 5.5. Then, after reaction, the samples were collected by precipitating the calcium-chelated cod bone gelatin polypeptides with pure ethanol, and dehydrated by vacuum freeze drying. The chelating rate was 93.47%. Scanning electron microscope showed that the microstructure of cod bone gelatin polypeptides changed dramatically after chelated with Ca 2+, turning from coarse fi bers into smooth spherical granules. Fourier transform infrared spectroscopy analysis suggested that after chelated with Ca 2+, the spectra of gelatin peptides and its calcium-chelated form changed dramatically, indicating the occurrence of chelating reaction between gelatin peptides and Ca 2+. The calcium chelating rate of cod bone gelatin polypeptides decreased from 60.74% to 3.64% after simulated gastric digestion (pH 2.0) for 120 min because H +competed for the binding sites with Ca 2+, causing damage to the calcium-chelated form. The chelating rate increased from 10.74% to 53.38% after 120 min simulated intestinal digestion. However, there was almost 50% of free Ca 2+in the system, suggesting that the chelated structure is sensitive to the gastric environment but remains relatively stable in the intestinal system. The results of this study can provide theoretical support and technical reference for the development of new calcium supplements and for the high-value utilization of aquatic product processing byproducts.
Key words:gelatin peptide; calcium; chelating; response surface optimization; simulated gastrointestinal digestion
DOI:10.7506/spkx1002-6630-201624001
收稿日期:2016-05-04
基金项目:国家自然科学基金面上项目(31471606);国家自然科学基金青年科学基金项目(31401476);国家高技术研究发展计划(863计划)项目(2014AA093508)
作者简介:张凯(1993—),男,博士研究生,主要从事水产胶原蛋白及多肽研究。E-mail:decond@163.com
*通信作者:李八方(1953—),男,教授,博士,主要从事水产胶原蛋白及多肽研究。E-mail:bfl i@ouc.edu.cn
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2016)24-0001-07
引文格式:
张凯, 侯虎, 彭喆, 等. 鳕鱼骨明胶多肽螯合钙制备工艺及其在体外模拟消化液中的稳定性[J]. 食品科学, 2016, 37(24): 1-7. DOI:10.7506/spkx1002-6630-201624001. http://www.spkx.net.cn
ZHANG Kai, HOU Hu, PENG Zhe, et al. Optimization of preparation of calcium-chelated cod bone gelatin peptide and its stability in simulated gastrointestinal system[J]. Food Science, 2016, 37(24): 1-7. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201624001. http://www.spkx.net.cn