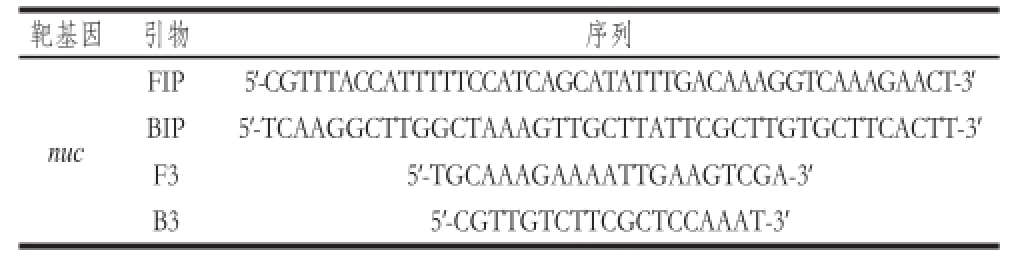
表1 LAMP反应引物序列
Table 1 Primer sequences targeting the nnuucc gene for LAMP reaction
?
曹 潇 1,赵力超 1,2,杨翠琪 1,谷立慧 1,欧阳广宇 1,陈 金 1,陈思锴 1,谭绮雯 1,王 丽 1,2,*
(1.华南农业大学食品学院,广东 广州 510642;2.广东省天然产物绿色加工与产品安全重点实验室,广东 广州 510640)
摘 要::建立一种将荧光染料叠氮溴化丙锭(propidium monoazide,PMA)与环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术相结合的方法,用于快速高效检测金黄色葡萄球菌(Staphylococcus aureus)。同时,采用人工污染金黄色葡萄球菌的速冻水饺和奶粉作为食品样品,研究PMA-LAMP方法的检测灵敏度。结果表明,PMA溶液质量浓度3 μg/mL,650 W卤素灯下曝光5 min,PMA能够完全抑制1.2×10 7copies/mL金黄色葡萄球菌死菌核酸扩增。PMA-LAMP方法能够在恒温65 ℃、60 min内完成对亚致死型金黄色葡萄球菌特异性nuc基因的特异性检测,其对亚致死状态金黄色葡萄球菌的检出限为34 CFU/mL,对食物样品速冻水饺和奶粉的检出限分别为17 CFU/mL和1.70×10 2CFU/mL。建立的PMA-LAMP方法可以有效检测亚致死态金黄色葡萄球菌,提供了一种新的检测技术和解决方案。
关键词:食品安全;金黄色葡萄球菌;亚致死状态;叠氮溴化丙锭-环介导等温扩增技术;快速检测
国内市场上的速冻水饺以及奶粉等食品也有被报道金黄色葡萄球菌检出超标,消费者使用后引起中毒症 [4-5]。传统检测金黄色葡萄球菌的方法有聚合酶链式反应(polymerase chain reaction,PCR)来扩增特异性基因nuc,另外也有用实时PCR检测金黄色葡萄球菌,但其耗费相对较高 [6-7],因此研究亚致死状态的金黄色葡萄球菌的快速检测方法显得尤为重要 [8-10]。环介导等温扩增(loop-mediated isothermal amplifi cation,LAMP)技术是一种新的核酸扩增方法,其特点是在65 ℃恒温条件下60 min内即可完成靶基因扩增 [11]。叠氮溴化丙锭(propidium monoazide,PMA)是一种选择性核酸交联染料,可以透过死细胞而不能透过活细胞的细胞膜 [12]。5 min以上的强烈光照可使进入细胞后的PMA与脱氧核糖核酸(deoxyribonucleic acid,DNA)共价交联,从而阻碍了死细胞中目标DNA的扩增,同时完全钝化游离的PMA以避免出现“假阴性”结果 [13]。而亚致死型细菌是一种细胞膜没有损伤的活菌,将PMA与LAMP技术相结合,可以将亚致死型细菌同死菌区分开来。
本实验利用低温结合低质量浓度防腐剂物理手段,诱使金黄色葡萄球菌进入亚致死状态,利用PMA排除死细胞的DNA干扰,建立PMA-LAMP方法快速检测金黄色葡萄球菌,对其检测效果进行评价,以期建立新的技术体系对亚致死型食源致病细菌的监测检验研究工作提供参考。
1.1 菌种与试剂
金黄色葡萄球菌标准菌株(编号26003,购自中国医学细菌保藏管理中心),在4 ℃条件下保存在质量浓度75 g/L NaCl的营养琼脂斜面上。用0.5 mmol/L山梨酸钾、-20 ℃寡营养(含7.5% NaCl溶液)条件下经76 d体外诱导得到的经过扫描电镜和PCR检验的亚致死状态金黄色葡萄球菌 [14]。
PMA(生化试剂) 美国Biotium公司;Bst大片段DNA聚合酶 New England Biolab公司;营养琼脂、脑心浸液(brain heart infusion,BHI)培养基、血平板 广东环凯生物科技有限公司;异丙醇、二甲基亚砜(均为分析纯) 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
Gel Doc 2000凝胶成像系统 美国Bio-Rad公司;SAS-67120超纯水制备系统 美国Millipore公司;扫描电镜 德国TVIPS公司;GE-100电泳仪 杭州生物科技有限公司;650W卤素灯 德国Osram公司;5417R高速冷冻离心机 德国Eppendorf股份有限公司;HH•S11电热恒温水浴锅 上海瑞丰仪器仪表有限公司;LX系列立式压力蒸汽灭菌锅 四川射洪医疗设备厂。
1.3 方法
1.3.1 LAMP引物的设计
在NCBI数据库中获取金黄色葡萄球菌nuc基因序列,进行多重比对,选择最保守区域设计引物。LAMP反应需要4 条引物,包括两条外引物(F3和B3)、两条内引物(BIP和FIP),设计过程遵循LAMP引物设计原则。委托上海捷瑞生物技术公司合成引物,引物序列如表1所示。
表1 LAMP反应引物序列
Table 1 Primer sequences targeting the nnuucc gene for LAMP reaction

?
1.3.2 新鲜菌悬液的制备
取活化的金黄色葡萄球菌接种于灭菌的BHI培养基中,37 ℃振荡培养过夜,将菌悬液进行10 倍倍比稀释,采用涂布平板法确定菌悬液的浓度。
1.3.3 样品的PMA处理
PMA溶解于二甲基亚砜中,配制成0.5 mg/mL的PMA溶液,-20 ℃避光保存。取1 mL制备好的菌悬液置于1.5 mL的离心管中,加入6 μL 0.5 mg/mL的PMA溶液,使PMA的终质量浓度为3 μg/mL,PMA与菌悬液混合均匀后在室温条件下避光处理5 min,利用650 W的卤素灯曝光5 min,光照交联时,样品置于冰上,且在距离光源20 cm处。交联后的菌悬液10 000 r/min离心5 min,收集菌体用于DNA提取。
1.3.4 不同处理死细胞的PMA-LAMP扩增
分别利用热处理、异丙醇和紫外照射制备死细胞。条件如下:75 ℃水浴10 min、70%异丙醇处理10 min [15]和紫外灯照射10 min,处理后涂布营养琼脂平板,37 ℃培养24 h后观察,平板上细菌菌落总数为0时,认为细胞死亡。用PMA处理以上3 种方式处理的死细胞悬浮液,以不加PMA为对照组。对菌液使用裂解法裂解细胞 [16],裂解液作为LAMP反应的DNA模板进行LAMP扩增和电泳分析。
1.3.5 PMA质量浓度
取1 mL金黄色葡萄球菌活细胞和死细胞悬浮液置于无菌离心管中,加入PMA,使PMA的终质量浓度分别为0、1、3、5、10、20、50 μg/mL,研究PMA影响活菌DNA扩增的最大质量浓度和抑制死菌DNA扩增的最小质量浓度,对菌液使用裂解法裂解细胞,裂解液作为LAMP反应的DNA模板进行LAMP扩增和电泳分析。
1.3.6 曝光时间
取金黄色葡萄球菌活菌悬液(1.2×10 7CFU/mL)和死菌悬液(1.2×10 7copies/mL)各1 mL置于无菌离心管中,加入3 μg/mL(终质量浓度)PMA,在室温条件下避光处理5 min,然后用650 W卤素灯曝光,选取曝光时间为1、5、10、15、20 min和30 min。提取DNA作为反应的模板进行LAMP扩增和电泳分析。
1.3.7 PMA-LAMP方法检测金黄色葡萄球菌的灵敏度
将金黄色葡萄球菌菌悬液以无菌生理盐水进行10 倍倍比稀释,并选择1×10 -4、1×10 -5、1×10 -6、1×10 -7、1×10 -85 个稀释度进行计数。每个稀释度做两个平行,选择菌落总数在30~300之间的稀释度进行计数。取各个稀释度的菌悬液1 mL置于无菌离心管中,分别使用3 μg/mL(终质量浓度)的PMA进行处理,提取DNA模板进行LAMP扩增和电泳分析,以确定灵敏度。
1.3.8 实际样品检测
1.3.8.1 细菌培养及人工模拟菌液的制备
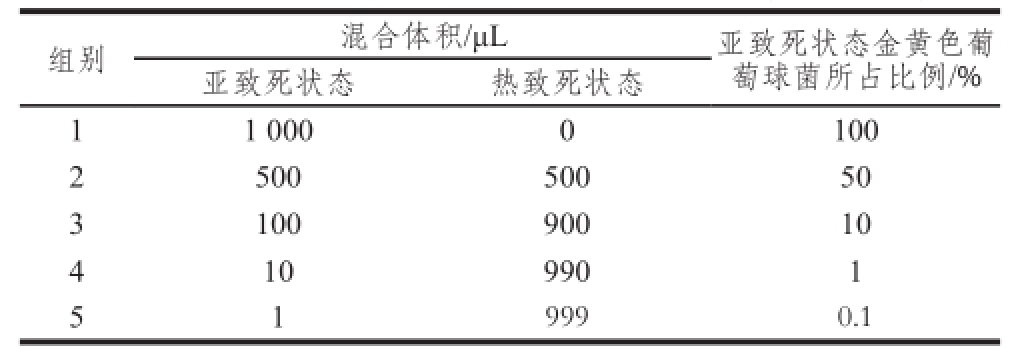
按表2进行不同亚致死状态金黄色葡萄球菌比例的菌液混合。
表2 混合体系中亚致死状态金黄色葡萄球菌所占的比例
Table 2 The proportion ofS . aurreeuuss with sublethal injury in mixed system
?
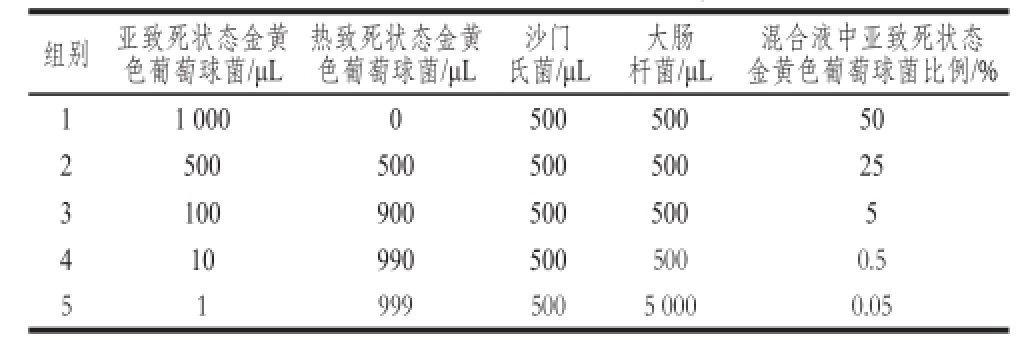
按无菌操作要求,把大肠杆菌、沙门氏菌和金黄色葡萄球菌接种至肉汤培养基中,37 ℃培养过夜。稀释使菌体细胞数为10 5CFU/mL。根据黄冰等 [17]的实验报道,检测常见的食品包括:生猪肉、生牛肉、生牛奶、卤味食品、冷冻食品、水产品中分离出的金黄色葡萄球菌菌株分别为28.6%、24.0%、32.7%、6.0%、17.8%、0.6%,以此来进行人工污染食品所用菌液的配比。将亚致死状态的金黄色葡萄球菌人工模拟液按照上表混匀后,再与大肠杆菌和沙门氏菌按表3混合。混合体系中细菌总数和大肠杆菌、沙门氏菌的数量保持恒定,以亚致死状态的金黄色葡萄球菌的数量设立梯度。
表3 混合体系中亚致死状态/热致死金黄色葡萄球菌及沙门氏菌、大肠杆菌所占的比例
Table 3 S. aurreeuuss,, Salmonneellllaa aanndd E. ccoollii in mixed system
?
1.3.8.2 样品前处理
所用速冻水饺和奶粉从超市随机采购,样品在人工污染亚致死型金黄色葡萄球菌之前,首先按照GB/T 4789.10—2010《食品微生物学检验 金黄色葡萄球菌检验》验证是否存在金黄色葡萄球菌,如果存在,首先将样品进行灭菌,然后进行国标法检测,检测结果为不含有金黄色葡萄球菌的前提下才可进行后续实验。将速冻水饺剪碎,取25 g样品(奶粉直接使用),加入225 mL无菌的磷酸盐缓冲溶液中充分均质,制成样品匀浆液。
1.3.8.3 不同比例亚致死状态金黄色葡萄球菌的样品检测
取1 mL不同比例的亚致死状态菌液分别接种至9 mL样品匀浆液中,混匀作为食品样品原样,分别将样品800 r/min离心3 min,除去速冻水饺的碎片,取上清液转移至新的无菌离心管中,10 000 r/min 离心5 min收集菌体,进行PMA处理,以提取的DNA为模板进行PMA-LAMP检测。未接种的样品做阴性对照。
1.3.8.4 含有非目标菌的样品检测
取1 mL按表3比例混合的菌液接种至9 mL匀浆液中,混匀作为食品样品原样,分别将样品800 r/min离心3 min,除去速冻水饺的碎片,取上清液转移至新的无菌离心管中,10 000 r/min离心5 min收集菌体,进行PMA处理,以提取的DNA为模板进行PMA-LAMP检测。同样的方法进行奶粉的污染和检测。
2.1 不同处理的死细胞的PMA-LAMP
未加入PMA处理的对照组中,不同胁迫条件处理的死细胞DNA均能扩增出特异性的阶梯状条带。加入PMA处理的实验组中,75 ℃水浴和70%异丙醇溶液处理10 min后得到的死细胞经过PMA处理后,其DNA的扩增受到抑制,无法扩增出阶梯状条带,PMA能有效阻止死细胞中的DNA的扩增,如图1所示。虽然紫外照射下的金黄色葡萄球菌已经进入死亡状态,但是因为紫外照射并没有破坏细菌的细胞膜,只是损伤了细胞中核酸的结构,PMA不能透过细胞膜与DNA结合,所以DNA扩增并没有受到PMA的影响。
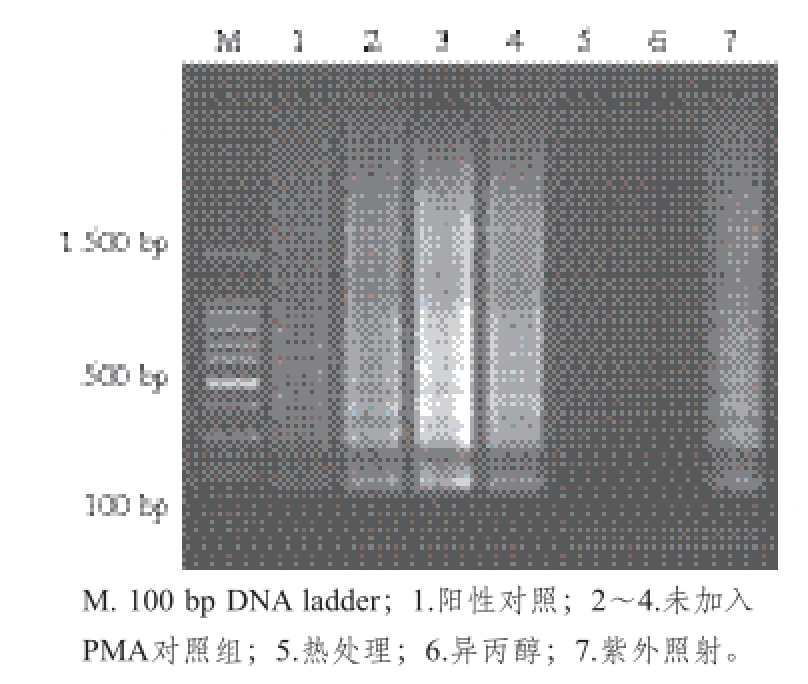
图1 不同胁迫条件对PMA-LAMP反应的影响
Fig. 1 Influence of different stress conditions on the PMA-LAMP reaction
2.2 PMA质量浓度的优化
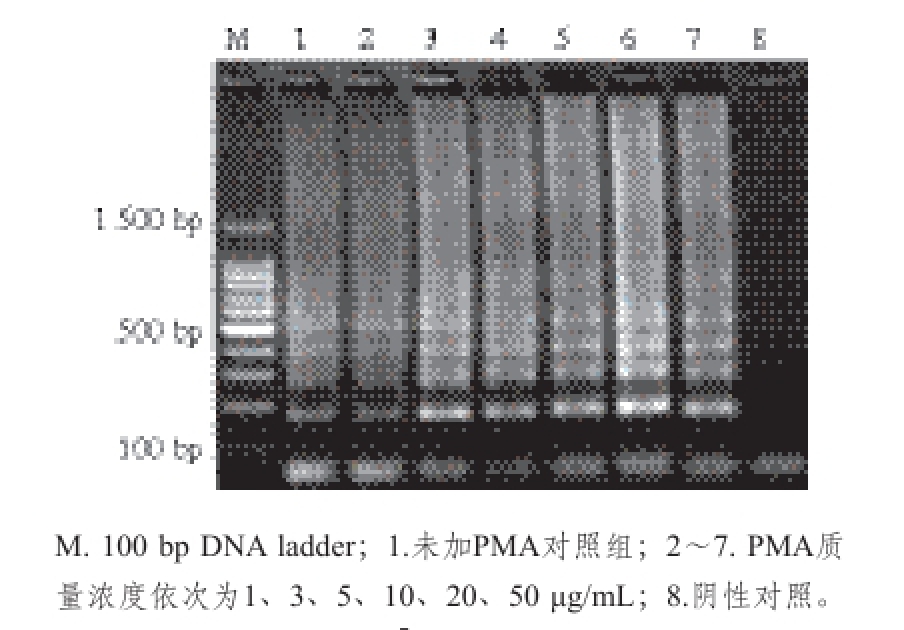
图2 PMA质量浓度对1.2×10
7CFU/mL金黄色葡萄球菌活细胞的影响
Fig. 2 Influence of PMA concentration on 1.2 × 10
7CFU/mL of DNA from S. aureus viable cells
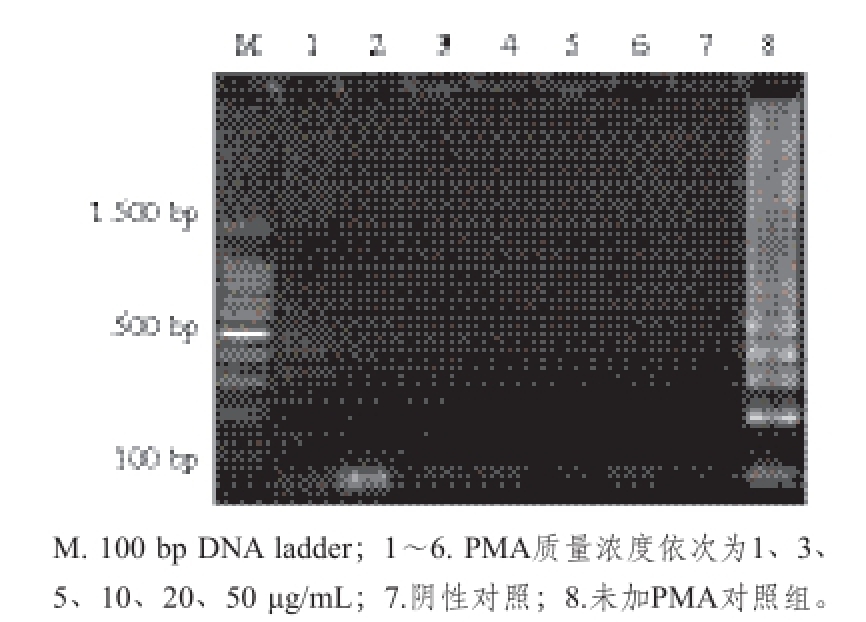
图3 PMA质量浓度对1.2×10
7copies/mL金黄色葡萄球菌死细胞的影响
Fig. 3 Influence of PMA concentration on 1.2 × 10
7copies/mL of DNA from S. aureus dead cells
由图2可知,当PMA的质量浓度高达50 μg/mL时,扩增出的条带仍然比较清晰明亮,表明PMA对活菌细胞影响不大。从图3可以看出,当PMA质量浓度为1 μg/mL,能扩增出条带,而当质量浓度增加至3 μg/mL的时候,能有效抑制死细胞DNA的扩增。因此,本实验选择的PMA处理质量浓度为3 μg/mL,以确保能够有效地抑制死菌DNA扩增,同时使用最小PMA处理质量浓度,从而不影响LAMP扩增的效果。
2.3 曝光时间的优化
使用3 μg/mL的PMA分别对浓度为1.2×10 7CFU/mL的活细胞与经过热处理的死细胞菌悬液进行处理,用方法中提到的不同曝光时间处理后的细菌悬液用裂解法进行裂解,以裂解液为模板进行LAMP反应。从图4可以看出,曝光时间为1~30 min时,活细胞均能扩增出特异性的阶梯状条带;图5显示经过1 min曝光处理后,可抑制10 7copies/mL死细胞DNA的扩增。综合上述结果,本实验选择的曝光时间为5 min,以确保多余的PMA能够全部被光分解,从而不影响LAMP扩增的效果,同时花费的时间短,能够有效地控制检测所需要的时间。

图4 曝光时间对活细胞PMA-LAMP反应的影响
Fig. 4 Influence of exposure time on PMA-LAMP reactions of viable cells
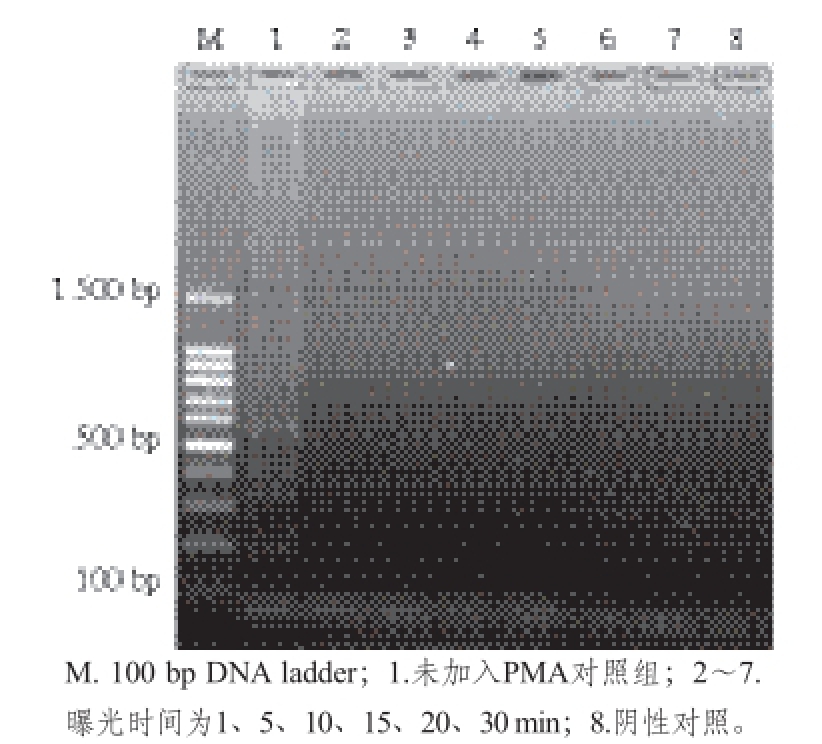
图5 曝光时间对死细胞PMA-LAMP反应的影响
Fig. 5 Influence of exposure time on PMA-LAMP reactions of dead cells
2.4 PMA-LAMP方法的建立及其灵敏度
以上实验结果显示,质量浓度为3 μg/mL的PMA可抑制浓度高达1.2×10 7copies/mL的金黄色葡萄球菌死细胞DNA的扩增,而对同浓度的活细胞扩增没有影响,因此为了能够有效地检测食品中的亚致死状态的金黄色葡萄球菌,确定PMA的作用质量浓度为3 μg/mL,650 W卤素灯曝光时间为5 min。将处理后的菌液进行裂解提取DNA,以此为模板进行LAMP反应,从而建立PMALAMP方法,以检测亚致死状态的金黄色葡萄球菌。
将3.4×10 9CFU/mL亚致死型金黄色葡萄球菌进行10 倍倍比梯度稀释,取各稀释液经上述PMA处理及曝光后,裂解菌悬液提取DNA,以此为模板进行LAMP反应,产物于以溴化乙锭为染料的2.0%琼脂糖凝胶电泳分析。结果见图6,当亚致死菌菌液浓度为34 CFU/mL或更高时,有特异性的扩增条带,所以本实验建立的PMA-LAMP检测亚致死型金黄色葡萄球菌的灵敏度为34 CFU/mL。

图6 PMA-LAMP检测方法的灵敏度
Fig. 6 Sensitivity of the PMA-LAMP method
2.5 PMA-LAMP方法的实用性
2.5.1 不同比例亚致死型金黄色葡萄球菌污染食品样品检测结果
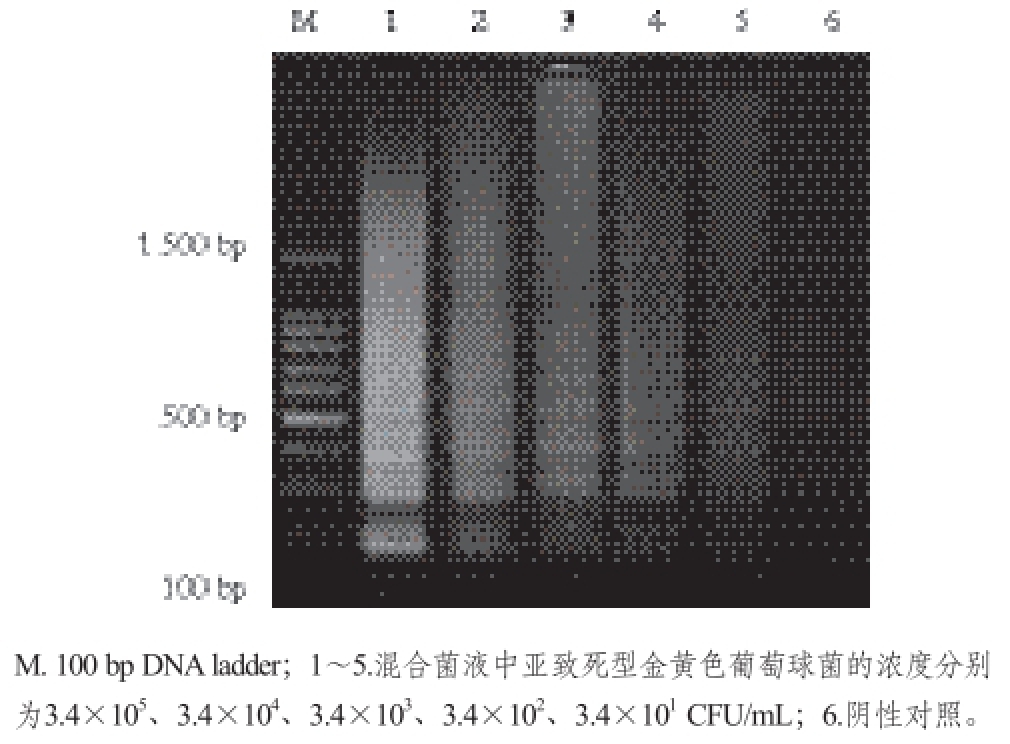
图7 人工污染奶粉中亚致死型金黄色葡萄球菌的PMA-LAMP检出限
Fig. 7 Limit of detection of PMA-LAMP for sublethally injured S. aureus in artificially contaminated milk powder
奶粉样品的PMA-LAMP检测如图7所示,1~5泳道均有扩增条带,阴性对照没有扩增条带,表明PMALAMP能够检测到人工模拟污染奶粉中亚致死型金黄色葡萄球菌的检出限为34 CFU/mL。
将含有不同比例亚致死型金黄色葡萄球菌的速冻水饺样品分别经过处理后,进行PMA-LAMP检测,检测结果见图8,1~4泳道均有扩增条带,而3.4×10 1CFU/mL浓度和阴性对照没有扩增条带,表明人工模拟污染速冻水饺中亚致死型金黄色葡萄球菌的检出限为3.4×10 2CFU/mL。

图8 人工污染速冻水饺中亚致死型金黄色葡萄球菌的PMA-LAMP检出限
Fig. 8 Limit of detection of PMA-LAMP for sublethally injured S. aureus in artificially contaminated frozen dumplings
2.5.2 同时含有非目标菌的食品样品检测结果
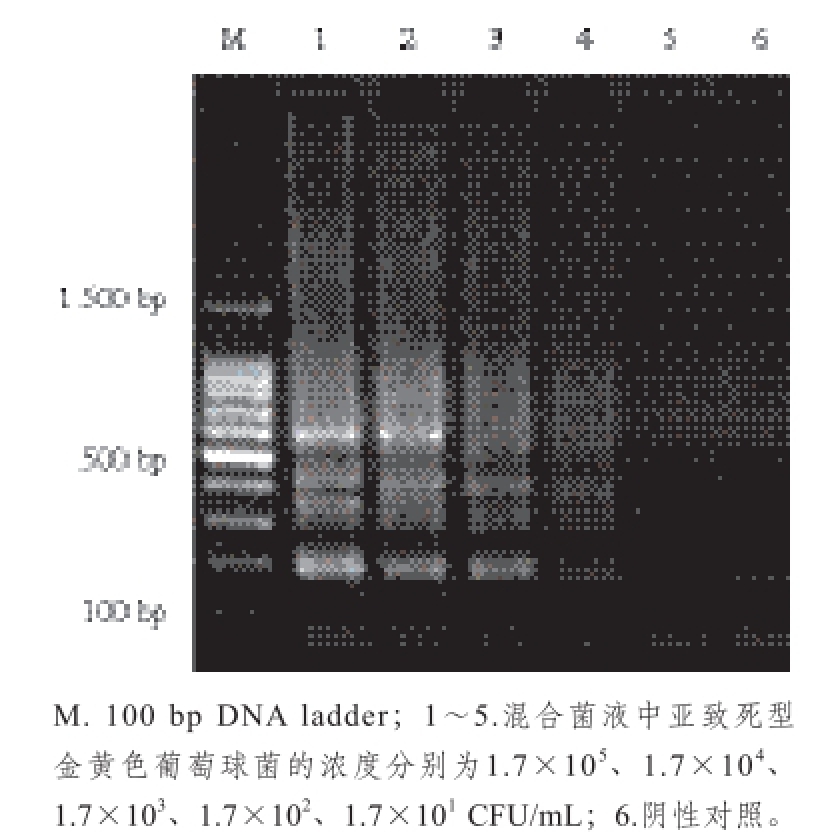
图9 含有非目标菌速冻水饺中亚致死型金黄色葡萄球菌的PMA-LAMP检出限
Fig. 9 Limit of detection of PMA-LAMP for sublethally injured S. aureus in frozen dumplings containing non-target bacteria
对速冻水饺处理后,进行PMA-LAMP检测,检测结果见图9,1~4泳道均有扩增条带,说明同时含有非目标菌对PMA-LAMP检测结果无影响,1.70×10 1CFU/mL和阴性对照没有扩增条带,能够检测到人工模拟同时含有非目标菌污染的速冻水饺中亚致死型金黄色葡萄球菌的检出限为1.70×10 2CFU/mL。
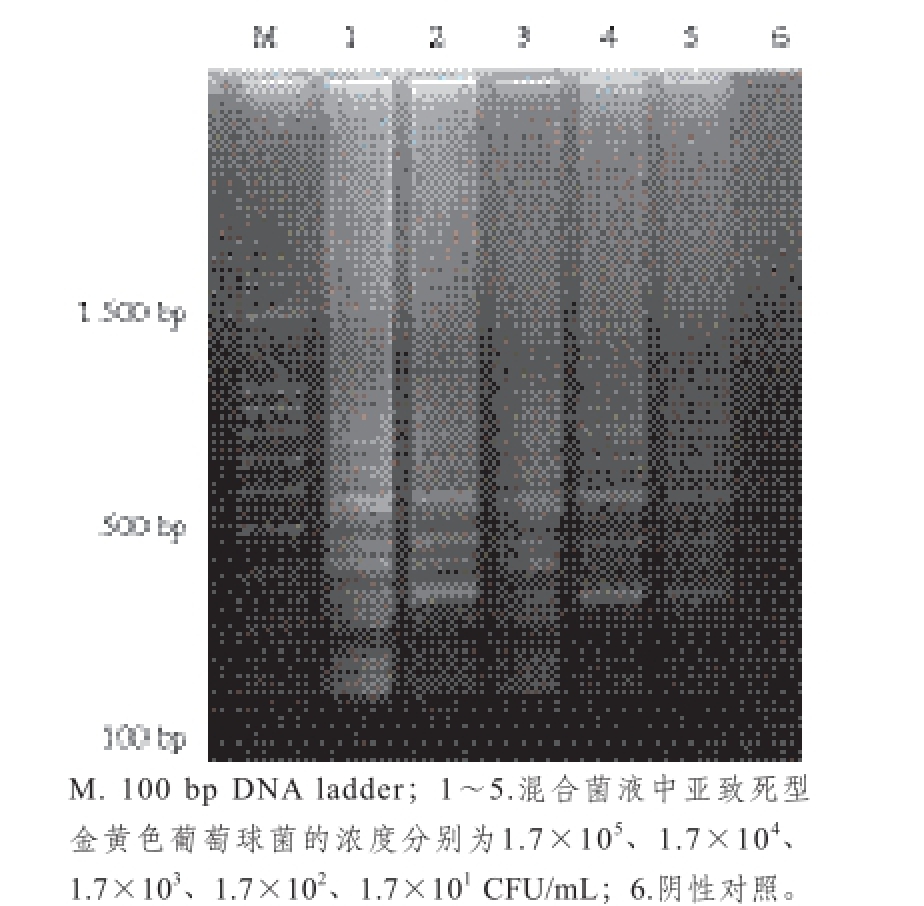
图10 含有非目标菌奶粉中亚致死型金黄色葡萄球菌的PMA-LAMP检出限
Fig. 10 Limit of detection of PMA-LAMP for sublethally injured S. aureus in milk powder containing non-target bacteria
同时含有非目标菌的奶粉中的检测结果如图10所示,1~5泳道均有扩增条带,阴性对照没有扩增条带,表明PMA-LAMP能够检测到人工模拟同时含有非目标菌污染的奶粉中亚致死型金黄色葡萄球菌的检出限为17 CFU/mL。
上述实验结果(图7~10)表明,PMA-LAMP检测含非目标菌奶粉中的亚致死型金黄色葡萄球菌的检出限为17 CFU/mL,检测含非目标菌速冻水饺中的检出限为1.70×10 2CFU/mL。
本研究利用nuc基因作为靶基因,建立PMA与LAMP技术相结合的方法快速检测金黄色葡萄球菌。nuc基因编码耐热核酸酶,研究表明,当对nuc基因中一段676 bp的序列来检测金黄色葡萄球菌,对金黄色葡萄球菌株和表皮葡萄球菌、化脓性链球菌、大肠埃希菌、铜绿假单胞杆菌、巴氏杆菌等非金黄色葡萄球菌的染色体DNA进行PCR扩增,结果发现只有金黄色葡萄球菌能扩增出目的片段,而非金黄色葡萄球菌没有扩增出目的片段,证明了nuc基因可以作为检测金黄色葡萄球菌的特异性基因 [18]。而对于另一常见的特异性基因mecA,只有耐甲氧西林的金黄色葡萄球菌具有mecA基因 [19],不适合作为检测金黄色葡萄球菌的特异性靶基因。nuc基因是金黄色葡萄球菌所独有的,可以作为金黄色葡萄球菌特异性的标志,符合率为100%。因此,对于亚致死型金黄色葡萄球菌的精确核酸检测,nuc基因是理想的靶基因 [20]。
检测样的PMA处理是影响PMA-LAMP反应的关键因素,乙锭单叠氮化合物对活细胞有毒性,具有较高的细胞膜透性,能穿过细菌活细胞完整的细胞膜与DNA交联 [21-22],而PMA对细胞的毒性比乙锭单叠氮化合物小,因此本实验选择PMA染料,结果显示其既能被排除在活细胞体外,又不会影响扩增,对检测结果的影响较小。PMA与菌悬液混合均匀后需在室温条件下避光处理5 min,利用650 W的卤素灯曝光5 min,样品距离光源20 cm。引物的特异性识别,4 条引物杂交到靶DNA上对于LAMP反应的效率十分关键,引物的T m值应满足F3、B3小于F1c、B1c,且使F3、B3序列的T m值介于60~65 ℃之间 [23-25]。本实验优化的最佳内外引物浓度比为1∶4。三磷酸脱氧核糖核苷(deoxyriboncleoside triphosphate,dNTP)是磷酸根的主要来源,其浓度的变化将会影响到缓冲液里Mg 2+浓度,过高会影响Bst DNA聚合酶的活性,过低导致扩增条带不明显,从而影响反应的结果,实验优化最佳的dNTP浓度为1.2 mmol/L。通过将PMA与LAMP结合,建立了快速检测亚致死型金黄色葡萄球菌的PMA-LAMP新方法,检测灵敏度达34 CFU/mL。
本实验建立的PMA-LAMP方法能够成功检测到亚致死型金黄色葡萄球菌。该方法较其他同类检测方法具有灵敏度高、操作简便、耗费低、快速的特点,无需依赖实验室精密仪器和专业人员,该技术可以在基层或者条件不便地区进行快速初筛应用。同时,本实验可为食品中隐性残留的亚致死型食源细菌的快速精准检测提供了一种新的方法。
参考文献:
[1] MASMOUDI S, DENIS M, MAALEJ S. Inactivation of the gene katA or sodA affects the transient entry into the viable but nonculturable response of Staphylococcus aureus in natural seawater at low temperature[J]. Marine Pollution Bulletin, 2010, 60(12): 2209-2214. DOI:10.1016/j.marpolbul.2010.08.017.
[2] 许奇, 王丽, 余碧丽, 等. 茶多酚影响肠道菌群活的非可培养状态(VBNC)状态转变的研究[J]. 食品与发酵工业, 2014, 40(8): 12-17. DOI:10.13995/j.cnki.11-1802/ts.2014.08.015.
[3] 田聪, 余以刚, 肖性龙, 等. 金黄色葡萄球菌活的非可培养状态复苏及PMA-qPCR检测[J]. 现代食品科技, 2013, 29(6): 1390-1394. DOI:10.13982/j.mfst.1673-9078.2013.06.001.
[4] CHIANG Y C, TSEN H Y, CHEN H Y. Multiplex PCR and a chromogenic DNA macroarray for the detection of Listeria monocytogens, Staphylococcus aureus, Streptococcus agalactiae, Enterobacter sakazakii, Escherichia coli O157:H7, Vibrio parahaemolyticus, Salmonella spp. and Pseudomonas fl uorescens in milk and meat samples[J]. Journal of Microbiological Methods, 2012, 88(1): 110-116. DOI:10.1016/j.mimet.2011.10.021.
[5] MELO F D, DALMINA K A, PEREIRA M N. Evaluation of the safety and quality of microbiological handmade cheese serrano and its relation to physical and chemical variables the period of maturity[J]. Acta Scientiae Veterinariae, 2013, 41(1): 1152.
[6] BRAKSTAD O G, AASBAKK K, MAELAND J A. Detection of Staphylococcus aureus by polymerase chain-reaction amplifi cation of the NUC gene[J]. Journal of Clinical Microbiology, 1992, 30(7): 1654-1660.
[7] HULETSKY A, GIROUX R, ROSSBACH V. New real-time PCR assay for rapid detection of methicillin-resistant Staphylococcus aureus directly from specimens containing a mixture of staphylococci[J]. Journal of Clinical Microbiology, 2004, 42(5): 1875-1884. DOI:10.1128/JCM.42.5.1875-1884.2004.
[8] 罗泽燕, 徐励琴, 刘思超, 等. 食品中金黄色葡萄球菌污染状况及其毒素检测[J]. 中国热带医学, 2014, 14(3): 296-298. DOI:10.13604/ j.cnki.46-1064/r.2014.03.002.
[9] CHEN X X, GAN M, XU H. Development of a rapid and sensitive quantum dot-based immunochromatographic strip by double labeling PCR products for detection of Staphylococcus aureus in food[J]. Food Control, 2014, 46: 225-232. DOI:10.1016/j.foodcont.2014.04.044.
[10] 高路, 何聪芬, 李萌, 等. 金黄色葡萄球菌快速检测技术的研究进展[J]. 食品科学技术学报, 2014, 32(2): 51-55. DOI:10.3969/ j.issn.2095-6002.2014.02.010.
[11] WAN C X, YANG Y J, XU H G. Development of a propidium monoazide treatment combined with loop-mediated isothermal amplification (PMA-LAMP) assay for rapid detection of viable Listeria monocytogenes[J]. International Journal of Food Science and Technology, 2012, 47(11): 2460-2467. DOI:10.1111/j.1365-2621.2012.03123.x.
[12] CAWTHOM D M, WITTHUHN R. C. Selective PCR detection of viable Enterobacter sakazakii cells utilizing propidium monoazide or ethidium bromide monoazide[J]. Journal of Applied Microbiology, 2008, 105(4): 2460-2467. DOI:10.1111/j.1365-2672.2008.03851.x.
[13] 应国红, 王晓冲, 李军, 等. PMA在RT-PCR检测药品细菌污染中的应用[J]. 东北农业大学学报, 2013, 44(9): 91-95. DOI:10.3969/ j.issn.1005-9369.2013.09.017.
[14] 刘德欣, 刘佩萤, 陈颖翘, 等. 金黄色葡萄球菌活的非可培养状态的诱导和复苏[J]. 食品工业科技, 2014, 35(3): 163-167. DOI:10.13386/ j.issn1002-0306.2014.03.012 .
[15] 陈慧娇, 陈丽萍. 异丙醇消毒效果研究[J]. 健康必读(下旬刊), 2012, 2(2): 183.
[16] 默克专利股份公司. 用于裂解细胞的方法: CN103492550A[P/ OL]. (2014-01-01)[2016-05-06]. http://www.google.com/patents/ CN103492550A?hl=zh-CN&cl=en.
[17] 黄冰, 邓志爱, 谭铭雄, 等. 食品中金黄色葡萄球菌污染状况、产肠毒素特性及耐药性研究[J]. 中国卫生检验杂志, 2009(6): 1380-1382.
[18] GARCIA-ALVAREZ L, HOLDEN M T G, LINDSAY H. Meticillinresistant Staphylococcus aureus with a novel mecA homologue in human and bovine populations in the UK and Denmark: a descriptive study[J]. Lancet Infectious Disease, 2011, 11(8): 595-603. DOI:10.1016/S1473-3099(11)70126-8.
[19] 高正琴, 邢华, 李厚达. PCR技术在检测鼠金黄色葡萄球菌中的应用研究[J]. 中国实验动物学报, 2003, 11(1): 26-28. DOI:10.3969/ j.issn.1005-4847.2003.01.008.
[20] SASAKI T, TSUBAKISHITA S, TANAKA Y. Multiplex-PCR method for species identification of coagulase-positive staphylococci[J]. Journal of Clinical Microbiology, 2010, 48(3): 765-769. DOI:10.1128/ JCM.01232-09.
[21] NOCKER A, CHEUNG C Y, CAMPER A K. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells[J]. Journal of Microbiological Methods, 2006, 67(2): 310-320. DOI:10.1016/j.mimet.2006.04.015.
[22] GARCIA-CAYUELA T, TABASCO R, PELAEZ C. Simultaneous detection and enumeration of viable lactic acid bacteria and bifi dobacteria in fermented milk by using propidium monoazide and real-time PCR[J]. International Dairy Journal, 2009, 19(7): 405-409. DOI:10.1016/j.idairyj.2009.02.001.
[23] WANG L, SHI L, SU J Y, et al. Detection of Vibrio parahaemolyticus in food samples using in situ loop-mediated isothermal amplifi cation method[J]. Gene, 2013, 515(2): 421-425. DOI:10.1016/ j.gene.2012.12.039.
[24] WANG L, LI Y, CHU J, et al. Development and application of a simple loop-mediated isothermal amplifi cation method on rapid detection of Listeria monocytogenes strains[J]. Molecular Biology Reports, 2012, 39(1): 445-449. DOI:10.1007/s11033-011-0757-7.
[25] 蒋侃, 吕沁风, 汪新, 等. 三重LAMP法检测食品中沙门氏菌、单增李斯特菌和金黄色葡萄球菌[J]. 食品科学, 2013, 34(24): 182-187. DOI:10.7506/spkx1002-6630-201324038.
Establishment of PMA-LAMP Method for Rapid Detection of Staphylococcus aureus with Sublethal Injury
CAO Xiao
1, ZHAO Lichao
1,2, YANG Cuiqi
1, GU Lihui
1, OUYANG Guangyu
1, CHEN Jin
1, CHEN Sikai
1, TAN Qiwen
1, WANG Li
1,2,*
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China; 2. Guangdong Province Key Laboratory for Green Processing of Natural Products and Product Safety, Guangzhou 510640, China)
Abstract:In this study, a loop-mediated isothermal amplifi cation (LAMP) assay combined with propidium monoazide (PMA) treatment was developed for the rapid and effi cient detection of Staphylococcus aureus with sublethal injury. The sensitivity of PMA-LAMP was investigated by artifi cially contaminating food samples including frozen dumplings and milk powder with S. aureus. The results showed that a concentration of 3 μg/mL PMA was optimal for completely restraining the amplifi cation of 1.2 × 10 7copies/mL of DNA from dead S. aureus which was exposed to a 650 W halogen lamp for 5 min. PMA-LAMP could achieve the specifi c detection of the unique nuc gene of S. aureus with sublethal injury at a constant temperature of 65 ℃ within 60 min with a sensitivity of 34 CFU/mL. In addition, the PMA-LAMP assay was proved effi cient by using it to detect the viable cells in artifi cially contaminated samples, with a sensitivity of 17 CFU/mL for artifi cially contaminated milk powder and 1.70 × 10 2CFU/mL in artifi cially contaminated frozen dumplings. It can be concluded that the PMA-LAMP assay can effi ciently detect S. aureus with sublethal injury and provide a new technique for detecting S. aureus in food samples.
Key words:food safety; Staphylococcus aureus; sublethal state; propidium monoazide-loop-mediated isothermal amplifi cation (PMA-LAMP); rapid detection织及器官的化脓性炎症,建立快速、准确的检测方法对预防和控制金黄色葡萄球菌的传染具有重要意义。亚致死型细菌是细菌在不良生存环境下的一种特殊自我保护状态,高/低温、高压、pH值或盐度等的改变都可能引起细菌进入此种状态。亚致死型细菌虽然丧失了在选择性平板上生长繁殖的能力,但生命体征是活的仍保留原菌的毒力和致病性,在适宜的生长条件下,亚致死型细菌能够复苏,恢复生长繁殖,迅速达到致病剂量,成为逃避检测的“隐性污染源”对食品安全造成严重的威胁 [1-2]。研究表明,金黄色葡萄球菌在食品加工过程中会进入一种生命亚致死的状态即活的非可培养状态,该状态不易被传统平板计数法检出,增加了食品风险评估的不确定性 [3]。
DOI:10.7506/spkx1002-6630-201624023
中图分类号:TS207.4
文献标志码:A
文章编号:1002-6630(2016)24-0149-07
引文格式:
曹潇, 赵力超, 杨翠琪, 等. 基于叠氮溴化丙锭与恒温核酸扩增技术快速检测亚致死状态食源金黄色葡萄球菌[J]. 食品科学, 2016, 37(24): 149-155. DOI:10.7506/spkx1002-6630-201624023. http://www.spkx.net.cn
CAO Xiao, ZHAO Lichao, YANG Cuiqi, et al. Establishment of PMA-LAMP method for rapid detection of Staphylococcus aureus with sublethal injury[J]. Food Science, 2016, 37(24): 149-155. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201624023. http://www.spkx.net.cn
金黄色葡萄球菌(Staphylococcus aureus)是一种人畜共患病的重要致病菌,主要经食品传播,引起食物中毒、组
收稿日期:2016-05-06
基金项目:国家自然科学基金青年科学基金项目(31301445);广东省科技计划项目(2016A040403103);
2015年国家星火计划项目(2015GA780080);广东省级“质量工程项目”
作者简介:曹潇(1992—),女,硕士研究生,研究方向为食品微生态与质量安全。E-mail:1920331908@qq.com
*通信作者:王丽(1980—),女,副教授,博士,研究方向为食品微生态与质量安全。E-mail:wangli_scau@scau.edu.cn