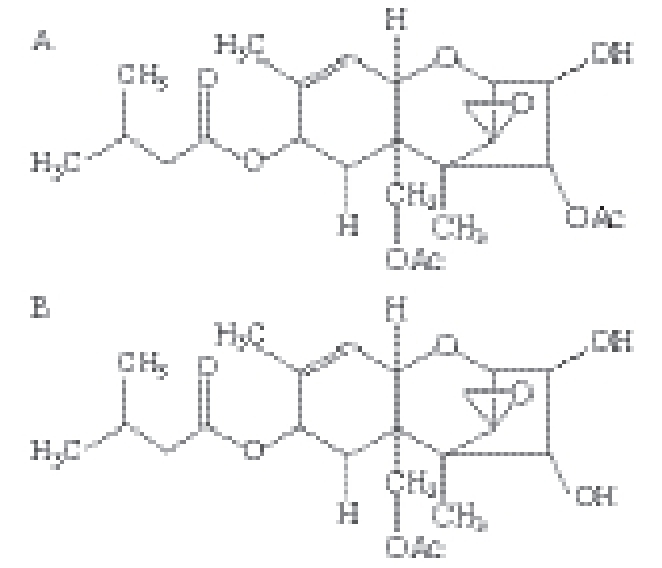
图1 T-2(A)和HT-2(B)毒素结构式
Fig. 1 Chemical structures of T-2 toxin (A) and HT-2 toxin (B)
王小博 1,施 琦 1,2,王雅玲 1,*,廖建萌 3,刘 阳 2,吴移山 2,高 平 3,*,励建荣 4
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东 湛江 524088;2.广东省湛江市质量计量监督检测所,国家海产品质量监督检验中心(湛江),广东 湛江 524096;3.湛江市食品药品监督管理局,广东 湛江 524022;4.渤海大学 辽宁省食品安全重点实验室,辽宁 锦州 121013)
摘 要::建立高效液相色谱-串联质谱定量快速检测罗非鱼、南美白对虾和黄金贝中的T-2毒素与HT-2毒素方法。以10 mL乙酸乙酯作为提取溶剂,振荡提取,无水硫酸钠除水,定量移取5 mL提取液氮气吹干后用1 mL含有0.1%甲酸的甲醇-5 mmol/L乙酸铵溶液(3∶7,V/V)复溶,正己烷脱脂净化,基质匹配法外标定量。3 种水产品中T-2毒素和HT-2毒素的检出限分别为2 μg/kg和4 μg/kg。T-2毒素质量浓度为2~100 ng/mL,HT-2毒素质量浓度为4~200 ng/mL,范围内线性良好。在3 种样本中进行3 个水平添加实验(n=6),T-2毒素回收率为84.3%~109.9%,HT-2毒素的回收率为90.9%~103.2%。T-2毒素的相对标准偏差为2.0%~8.7%,HT-2毒素的相对标准偏差为2.6%~10.6%。本方法简便快速、准确度好、精密度高,适用于3 种代表性水产品中T-2与HT-2毒素的同时检测。
关键词:T-2毒素;HT-2毒素;高效液相色谱-串联质谱
T-2毒素(图1A)是单端孢霉烯族毒素中毒性最强的毒素 [1],对人和动物具有广泛而强烈的毒性,可经呼吸道、胃肠道、皮肤黏膜等多种途径进入机体,造成多系统多器官损伤 [2-6]。T-2毒素化学性质稳定,在各种有机试剂或温和的酸性条件下回流不受影响,有研究报道T-2毒素常温放置6~7 a或高温至200 ℃毒力仍无减弱 [7]。早在1973年联合国粮农组织和世界卫生组织在日内瓦召开的联席会议上,就将这类毒素定为天然存在的最危险的食品污染源 [8]。HT-2毒素(图1B)是T-2毒素在生物体内的主要代谢产物,同属于单端孢霉烯族毒素,结构上除了C-4上的官能团有差异,其他均相同。与T-2毒素一样,它同样具有免疫抑制性,能导致一系列病变的发生 [9-12]。

图1 T-2(A)和HT-2(B)毒素结构式
Fig. 1 Chemical structures of T-2 toxin (A) and HT-2 toxin (B)
T-2毒素与HT-2毒素主要由镰孢菌产生,广泛存在于自然环境中,农作物、动物饲料及养殖环境因其造成的污染和病害常有报道 [7,13-14]。但水产动物在养殖过程中摄食被T-2毒素污染的饲料或者被环境中产T-2毒素镰孢菌感染的情况却被人们忽视。如果误食被T-2毒素污染的水产品,则会对人类的健康造成不利影响。
现有的T-2毒素与HT-2毒素的检测对象主要集中在饲料、谷物或以其为原料的食品,水产品中这两种毒素的同时检测方法至今还较为缺乏。真菌毒素检测方法大致可分为生物学测定法和物理化学测定法。物理化学测定法主要有薄层色谱法、气相色谱法、液相色谱法、气相或液相与质谱联用法。薄层色谱法因为不能准确定量而使用受限;气相色谱法和液相色谱法需要对毒素进行衍生,步骤繁琐;相比之下,高效液相色谱-串联质谱联用技术较其他方法具有更高的灵敏度和更低的检测限,近年来在真菌毒素检测方面受到广泛关注 [15-19]。本实验建立了高效液相色谱-串联质谱联用技术检测3 种代表性水产品——凡纳滨对虾、罗非鱼和黄金贝中的T-2毒素与HT-2毒素,针对基质特殊性在前处理方法上进行了优化,使方法更加快速简便、定量准确,可操作性更强。
1.1 材料与试剂
南美白对虾(8.0±0.5) g、罗非鱼(500.0±30.0) g和黄金贝(110.0±10.0) g 东海岛(广东,湛江)恒兴水产品养殖基地;T-2毒素标准品(纯度≥98%)、HT-2毒素标准品(纯度≥98%) 美国ENZO生物公司;Pribolab T-2/HT-2免疫亲和柱(规格:3 mL)北京泰乐祺科技有限公司;中性氧化铝柱(规格:1 000 mg/6 mL) 上海博势生物科技有限公司;二氧化硅固相萃取柱(规格:500 mg/6 mL) 杭州格图科技有限公司;甲醇(一级色谱纯,纯度≥99.9%) 天津四友精细化学品有限公司;乙腈(色谱纯,纯度≥99.9%) 广东光华科技股份有限公司;乙酸铵(分析纯) 美国Sigma-Aldrich公司;超纯水arium 611VF超纯水机制备;其余试剂均为国产分析纯。
1.2 仪器与设备
TSQ Quantum Access高效液相色谱-串联质谱联用仪美国Thermo Fisher公司;XS205电子分析天平 美国Metteler Toledo公司;HU-3120B可温控超声波提取器 天津恒奥科技发展有限公司;VTX-3000L旋涡混合器 日本Vortex公司;Multi Reax旋涡振荡器 德国Heidolph公司;Organomation Assiciates氮吹仪 日本JNC公司;离心机上海安亭科学仪器厂。
1.3 方法
1.3.1 标准溶液的配制
将1.0 mg T-2毒素标准品与1.0 mg HT-2标准品用乙腈分别溶解,置于两个10 mL容量瓶中乙腈定容。配制成质量浓度均为0.1 mg/mL标准储备液。取1 mL储备液于100 mL容量瓶甲醇定容,得质量浓度均为1 μg/mL的T-2毒素与HT-2毒素标准溶液。配得标准溶液均置于-20 ℃冰箱保存。
根据需要将T-2与HT-2标准溶液混合配制所需质量浓度的标准使用液。使用液现配现用,溶剂为含有0.1%甲酸的甲醇-5 mmol/L乙酸铵溶液(3∶7,V/V)。
1.3.2 仪器条件
1.3.2.1 质谱条件
喷雾电压:4 500 V;鞘气压力:35 arb;辅助气压:15 arb;毛细管温度:270 ℃;碰撞压力:1.5 mTorr。选择二级质谱中响应值较高的两个子离子作为定性离子,响应值最高的作为定量离子进行选择离子扫描模式质谱条件优化,结果如表1所示。
表1 子离子SRM碰撞能优化结果
Table 1 Daughter ions and corresponding collision energy under SRM mode
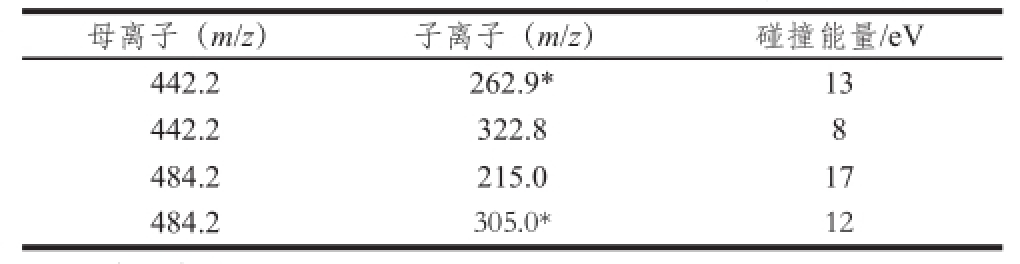
注:*.定量离子。
?
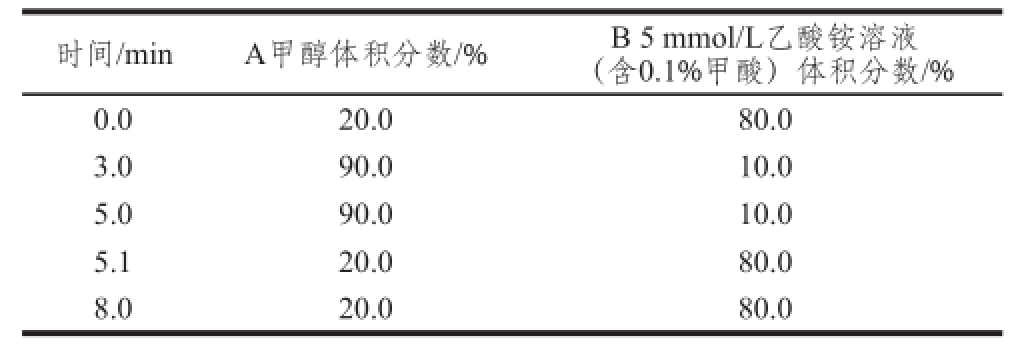
1.3.2.2 色谱条件
色谱柱:Hypersil Gold(100 mm×2.1 mm,5 μm);进样量:10 μL;流动相:A为甲醇,B为5 mmol/L乙酸铵溶液(含0.1%甲酸),梯度洗脱条件见表2。
表2 高效液相色谱梯度洗脱条件
Table 2 Gradient elution conditions of HPLC
?
1.3.3 样品前处理
1.3.3.1 T-2/HT-2毒素的提取
选取虾、鱼和贝的优势品种南美白对虾(以下简称虾)、罗非鱼(以下简称鱼)和黄金贝(以下简称贝)可食肌肉部分作为典型检测对象。将鱼去鳞去皮、虾去头去壳、贝去壳取肌肉组织绞碎并使其均质后称取2.00 g,置于50 mL离心管中,准确加入10 mL乙酸乙酯,涡旋振荡10 min(2 000 r/min),加入无水硫酸钠5~8 g,涡旋振荡5 min(2 000 r/min),离心10 min(4 000 r/min)后收集上清液。
1.3.3.2 净化
正己烷脱脂净化:准确移取上清液5 mL,40 ℃条件下氮气吹干后用1 mL含有0.1%甲酸的甲醇-5 mmol/L乙酸铵溶液(3∶7,V/V)溶解,加入1 mL正己烷除脂,取下层液过0.22 μm滤膜待测分析。
采用Pribolab T-2/HT-2免疫亲和柱进行净化:取5 mL上清液直接过Pribolab T-2/HT-2免疫亲和柱,弃掉流出液,以6 mL超纯水淋洗,压入空气确保液体全部流出,用5 mL甲醇缓慢洗脱,残留的洗脱液用空气压出,收集全部的洗脱液,于40 ℃条件下氮气吹干后用1 mL含有0.1%甲酸的甲醇-5 mmol/L乙酸铵溶液(3∶7,V/V)溶解,过0.22 μm滤膜待测分析。
中性氧化铝柱净化:先用6 mL乙腈活化,取5 mL上清液过中性氧化铝柱,再用6 mL的超纯水淋洗,并用6 mL乙腈洗脱,收集洗脱液液,于40 ℃条件下氮气吹干后用1 mL含有0.1%甲酸的甲醇-5 mmol/L乙酸铵溶液(3∶7,V/V)溶解,过0.22 μm滤膜待测分析。
二氧化硅固相萃取柱净化:用6 mL甲醇活化,取5 mL上清液过二氧化硅固相萃取柱,用6 mL的超纯水淋洗,再用6 mL甲醇洗脱,收集洗脱液。洗脱液于40 ℃条件下氮气吹干后用1 mL含有0.1%甲酸的甲醇-5 mmol/L乙酸铵溶液(3∶7,V/V)溶解,过0.22 μm滤膜待测分析。
2.1 色谱条件的优化
在一系列C 18柱型(SunFire、Agilent TC-C 18、Diamonsil、Hypersil Gold)中选择分离效果最优的Hypersil Gold(100 mm×2.1 mm,5 μm)柱。在此条件下峰形尖锐对称、选择性优、灵敏度高、稳定性好。高效液相色谱-串联质谱联用技术检测方法灵敏度的影响因素除了化合物本身性质外,还有流动相的组成。本方法通过比较甲醇-水、乙腈-水、甲醇-乙酸铵和乙腈-乙酸铵后,发现目标化合物易与NH 4 +结合形成[M+NH 4] +结构,加入乙酸铵不仅能提高响应值,还能使方法稳定性更好,甲醇与乙腈虽然都能实现目标化合物的分离,但甲醇效果更好,所以选择了甲醇和乙酸铵溶液为流动相,加入0.1%甲酸可以在正离子监测模式下增强分析灵敏度。通过对比分析,最终确定流动相为甲醇-5 mmol/L乙酸铵溶液(含0.1%甲酸)。
2.2 质谱条件的确定
用质量浓度为1 μg/mL的T-2、HT-2毒素混合标准溶液进行一级质谱扫描确定母离子,根据毒素分子质量设置扫描范围,T-2毒素与HT-2毒素在电喷雾源正离子电离模式下易获取NH 4 +,形成[M+NH 4] +。确定母离子后用二级质谱扫描模式确定子离子,二级质谱扫描通过碰撞气和碰撞电压作用获得不同碎片离子,选丰度较高的两个子离子作为定性离子,其中丰度最高的子离子为定量离子。T-2毒素丢失—CH 2CH(CH 3) 2、—CH 2OCOCH 3、—(CH 3) 2获得m/z 305.0的子离子,丢失—OCOCH 2CH(CH 3) 2、—(OCOCH 3) 2、—OH获得m/z 215.0的子离子,HT-2毒素丢失—CH 2CH(CH 3) 2、—CH 2OCOCH 3、—CH 3获得m/z 262.9的子离子,丢失—OCOCH 3、—(CH 3) 2获得m/z 322.8的子离子。
2.3 前处理条件的选择
2.3.1 提取溶剂的选择
方法前处理条件中,提取溶剂的选择很关键,选择合适的提取溶剂不仅能提高目标物的提取效率,同时能减少内源物质的干扰。通过对比在虾肉样品中添加T-2毒素质量浓度20 ng/mL、HT-2毒素质量浓度40 ng/mL的混合标准溶液后,经甲醇、乙腈、二氯甲烷、乙酸乙酯的提取(表3),二氯甲烷提取回收率为(61.2±7.3)%,甲醇为(44.5±7.3)%,乙腈提取的回收率不足20%,只有乙酸乙酯对T-2毒素和HT-2毒素的提取回收率稳定的保持在80%~120%范围内。结果表明乙酸乙酯作为提取试剂效果最好,这与大多数文献 [20-25]报道的一定比例的乙腈或甲醇溶液作为提取试剂提取谷物或饲料中的T-2毒素有所差异。由于水产品中水分含量比谷物和饲料中大得多,所以乙腈或甲醇溶液作为提取试剂并不适用,不仅提取效率受影响,而且在后期氮吹或旋转蒸发过程中耗时会很长。本方法提取试剂定量加入,准确移取半量吹干,不仅节约了前处理时间,使得前处理快速简单化,同时短时间快速提取也有利于基质效应的降低。
表3 不同试剂对虾肉中T-2及HT-2毒素的提取效果( =3)
Table 3 Extraction efficiencies of T-2 and HT-2 toxins in shrimps with different solvents ( = 3)
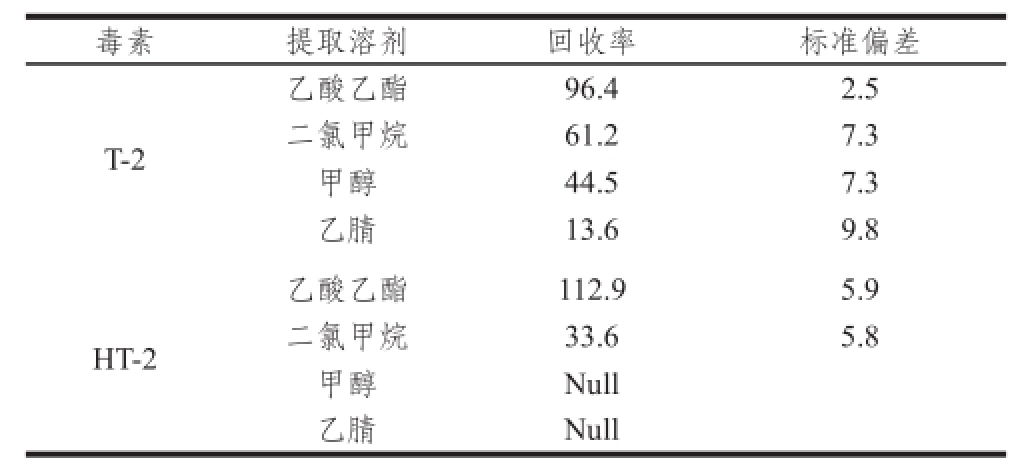
注:Null.未检出。
?
2.3.2 提取环境酸碱度选择
通过实验比较pH 3.5、pH 7.0和pH 8.0环境下的提取效果(图2),结果显示pH值对T-2与HT-2毒素同时提取效果影响不大(P>0.05),均能满足提取要求,但偏碱性环境中两种毒素提取效率的差异会增大,可能原因为T-2毒素在弱碱性环境中不稳定,易水解为HT-2毒素或T-2三醇、T-2四醇等产物。而两种毒素在强酸环境下也不稳定,会引起骨架重排,因此提取过程没有必要加入酸或碱来调节环境酸碱度。

图2 不同pH值条件下提取虾肉中T-2及HT-2毒素的回收率(n=6)
Fig. 2 Recoveries of T-2 and HT-2 toxins in shrimps extracted at different pH values (n = 6)
2.3.3 净化方式的选择
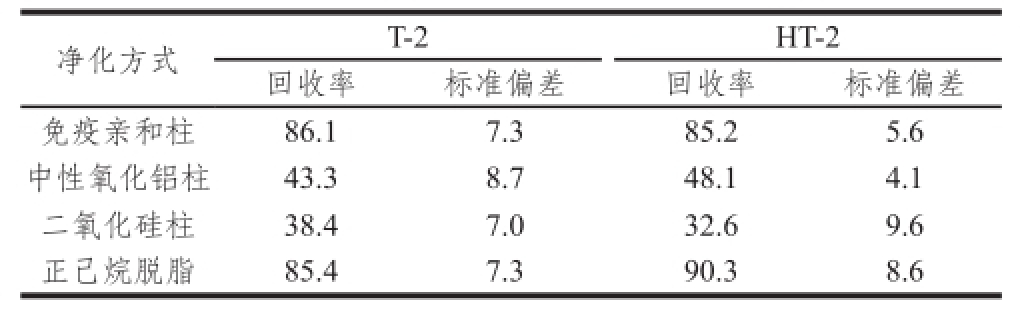
试样经免疫亲和柱、中性氧化铝柱、二氧化硅固相萃取柱纯化,与未过柱样品检测结果比较后发现(表4),经中性氧化铝柱和二氧化硅柱对回收率有明显影响(回收率均低于50%),免疫亲和柱纯化样品灵敏度和峰形差异不明显,但免疫亲和柱价格昂贵,不利于方法的推广,本方法用无水硫酸钠除去水分,用正己烷除脂净化即可满足检测要求,同时节省了前处理时间和检测成本。
表4 不同净化方式对虾肉中T-2及HT-2毒素回收率的影响( =3)
Table 4 Recoveries of T-2 and HT-2 toxins in shrimps with different purification methods (n = 3) %
?
2.4 方法验证
2.4.1 线性和测定下限
表5 3 种水产品中T-2与HT-2毒素的线性范围、线性方程和相关系数
Table 5 Linear ranges, regression equations and correlation coefficients for T-2 and HT-2 toxins in three aquatic products
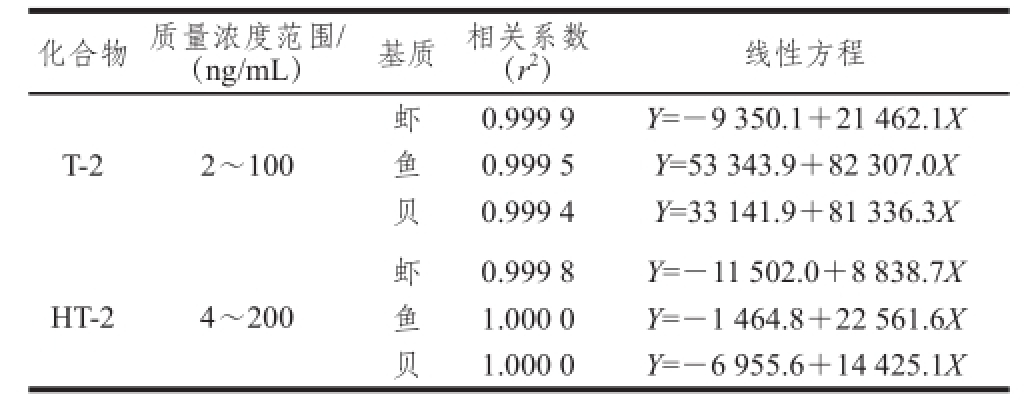
注 :X为T-2毒素或HT-2毒素质量浓度,Y为对应的峰面积。
?
移取适量的混合标准中间溶液,加入空白阴性样品中,使空白样品加标量T-2毒素为0、2、10、20、40、100 ng/mL,HT-2为0、4、20、40、80、200 ng/mL,加入系列标准溶液的空白样品按1.3.2节方法进行前处理后上机测定。分别以T-2毒素、HT-2毒素质量浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线,线性相关系数(r 2)均大于0.999(表5)。因此可确定T-2毒素的测定下限为2 μg/kg,HT-2的测定下限为4 μg/kg。
2.4.2 选择性
选择性是通过空白样品与加标样品的比较来评价。看样品中是否存在内源物质的干扰。空白与加标样品均按照前文所述前处理方法进行处理。通过测定空白样品与加入20 ng/mL T-2与40 ng/mL HT-2的混合标准溶液后的样品比较,选择性良好(图3)。T-2与HT-2毒素在建立的条件下均有较强的响应,并且两者能完全分离开,此方法的选择性好。
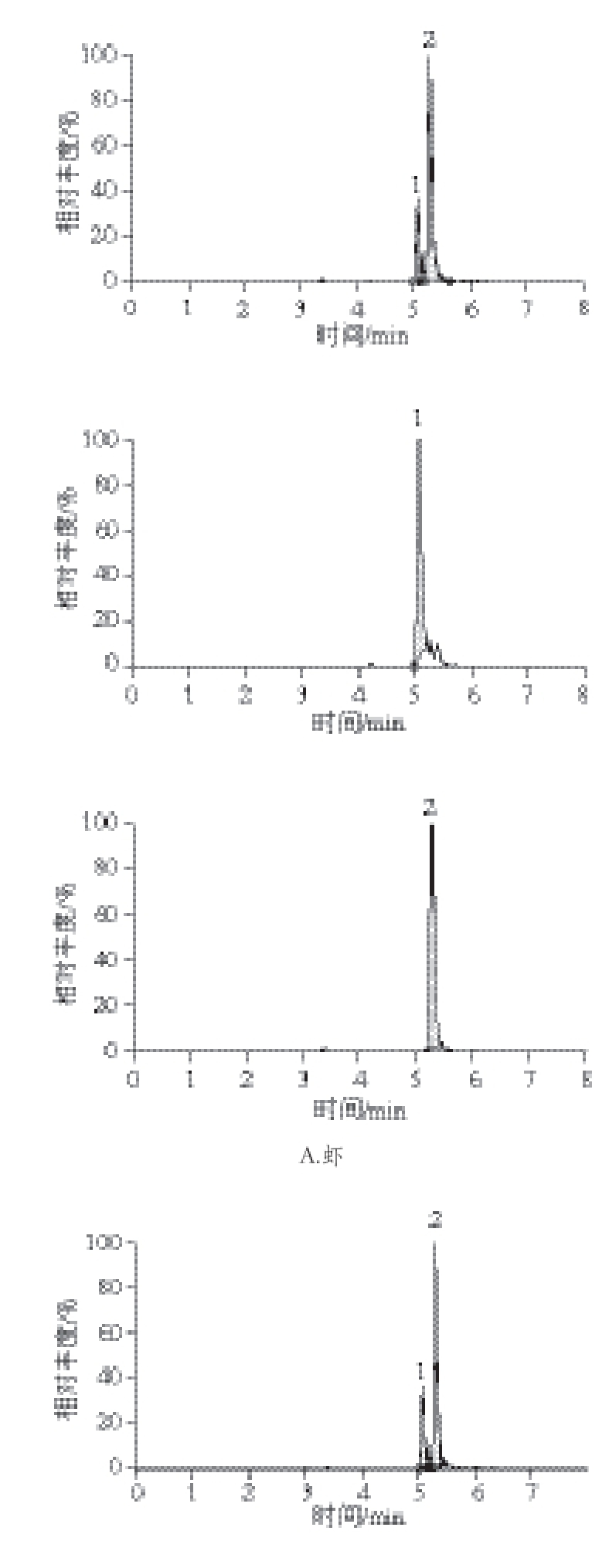
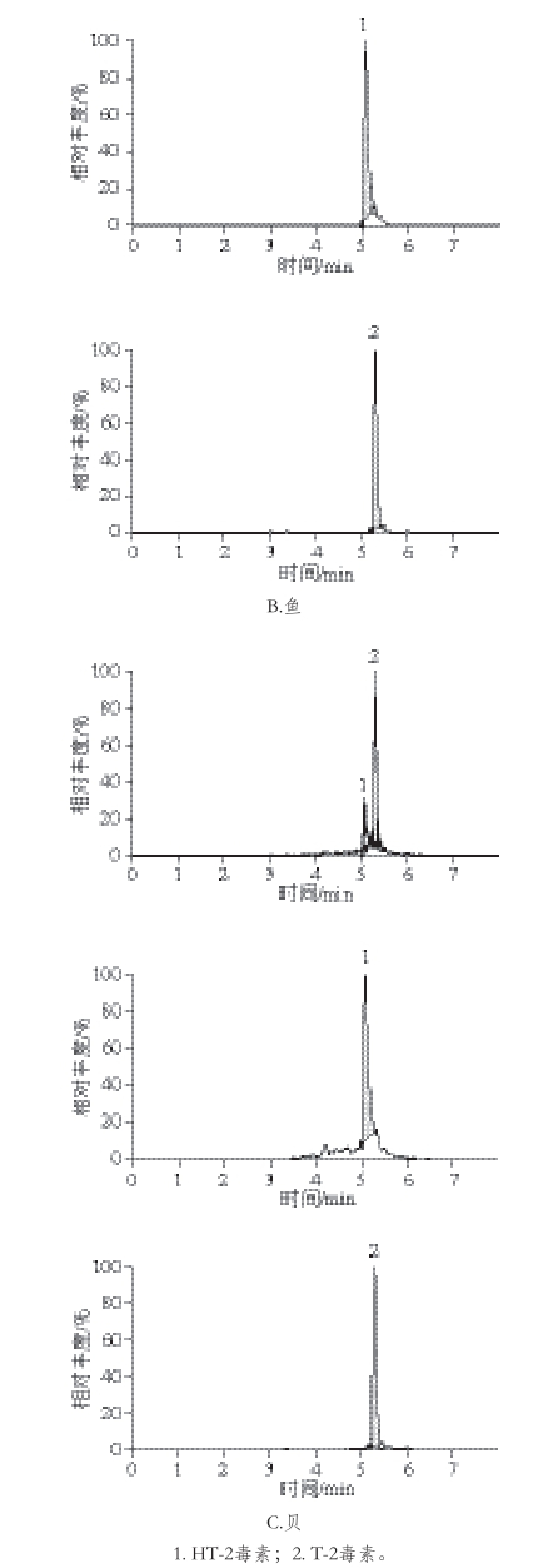
图3 加标样品中T-2与HT-2毒素的总离子流图
Fig. 3 Total ion chromatograms of T-2 and HT-2 toxins in spiked samples
2.4.3 回收率和精密度实验结果
在虾肉、鱼肉和贝肉的空白样品中分别添加T-2/HT-2三个水平为2/4、20/40、100/200 μg/kg的标准溶液,每个水平平行测定6 次计算方法的回收率和精密度,结果为T-2毒素回收率在84.3%~109.9%之间,HT-2毒素的回收率在90.9%~103.2%之间,均满足80%~120%的范围内。T-2的相对标准偏差在2.0%~8.7%之间,HT-2的相对标准偏差在2.6%~10.6%之间,不超过15%。结果显示本方法具有良好的准确度和精密度(表6),符合分析要求。
表6 高效液相色谱-串联质谱联用技术方法测定虾、鱼和贝肌肉中T-2与HT-2毒素的准确度与精密度(n==66)
Table 6 Accuracy and precision in the HPLC-MS/MS analysis of T-2 and HT-2 toxins in three aquatic products (n == 66))

?
2.5 实际样品的测定结果
采用该方法测定了罗非鱼、南美白对虾和黄金贝样本各10 个,结果在两个南美白对虾样本中检出T-2毒素,含量分别为2.8 μg/kg和6.7 μg/kg,前者同时检出HT-2毒素,含量为5.1 μg/kg,可能为饲料污染导致虾体内蓄积,鱼和贝中未检出。
本实验通过对前处理方法及高效液相色谱和质谱条件的优化建立了3 种代表性水产品(罗非鱼、南美白对虾、黄金贝)中T-2毒素与HT-2毒素的高效液相色谱-串联质谱同步检测方法。由于水产品中水分含量高,不采用大多数文献报道的乙腈或甲醇溶液作为提取溶剂,而选用乙酸乙酯提取,无水硫酸钠除水,正己烷脱脂净化,前处理方法简便快速,提取效果好,基质效应低。水产品中T-2毒素与HT-2毒素易与Na +结合,使得质谱检测产生的子离子不稳定,定性定量受干扰,在定容溶剂和流动相中均加入乙酸铵确保毒素尽可能全部以[M+NH 4] +形式存在,使定性定量更为准确。在提取前加入标准与样品一同处理的基质匹配定量法相比于大多数文献采用的标准溶液直接绘制曲线和基质溶液加标绘制曲线法定量更为准确。本方法对水产品中T-2、HT-2毒素的快速定量检测具有一定参考价值。
参考文献:
[1] MONA A, BHASKAR A, LAKSHMANA R. Involvement of mitogenactivated protein kinase pathway in T-2 toxin-induced cell cycle alteration and apoptosis in human neuroblastoma cells[J]. Molecular Neurobiology, 2015, 51: 1379-1394. DOI:10.1007/s12035-014-8816-4.
[2] AGRAWAL M, YADAV P, LOMASH V, et al. T-2 toxin induced skin inflammation and cutaneous injury in mice[J]. Toxicology, 2012, 302: 255-265. DOI:10.1016/j.tox.2012.08.007.
[3] KUNIO D, NORIAKI I, SHINYA S. T-2 toxin-induced toxicity in pregnant mice and rats[J]. International Journal of Molecular Sciences, 2008, 9(11): 2146-2158. DOI:10.3390/ijms9112146.
[4] 方海琴, 李利忠, 赵增明, 等. T-2毒素对小鼠胚胎干细胞线粒体功能的抑制作用[J]. 中国药理学与毒理学杂志, 2014, 28(3): 415-420. DOI:10.3867/j.issn.1000-3002.2014.03.018.
[5] FANG H Q, WU Y L, GUO J B, et al. T-2 toxin induces apoptosis in differentiated murine embryonic stem cells through reactive oxygen species-mediated mitochondrial pathway[J]. Apoptosis, 2012, 17(8): 895-907. DOI:10.1007/s10495-012-0724-3.
[6] YAN D, KANG P, YANG J, et al. The effect of Kashin-Beck diseaseaffected feed and T-2 toxin on the bone development of Wistar rats[J]. International Journal of Rheumatic Diseases, 2010, 13(3): 266-272. DOI:10.1111/j.1756-185X.2010.01530.x.
[7] 王雅玲. 养殖环境真菌气溶胶及相关真菌毒素的检测[D]. 泰安:山东农业大学, 2006.
[8] 刘志诚, 于守洋. 营养与食品卫生学[M]. 北京: 人民卫生出版社, 1991: 148.
[9] 牟仁祥, 曹赵云, 金连登, 等. 免疫亲和柱净化-液相色谱质谱法对粮谷中T-2与HT-2毒素的测定[J]. 分析测试学报, 2009, 28(3): 368-371.
[10] LI S Q, SONG J, YANG H, et al. An immunoc hromatographic assay for rapid and direct detection of 3-amino-5-morpholino-2-oxazolidone (AMOZ) in meat and feed samples[J]. Journal of the Science of Food and Agriculture, 2014, 94(4): 760-767. DOI:10.1002/jsfa.6423.
[11] TINASHE B R, VICTOR J J, JUSTIN M H, et al. Production, characterization and utility of a panel of monoclonal antibodies for the detection of toluene diisocyanate haptenated proteins[J]. Journal of Immunological Methods, 2011, 373: 127-135. DOI:10.1016/ j.jim.2011.08.011.
[12] 邱妹, 陈海燕, 孙力军, 等. 低剂量T-2/HT-2毒素生物转化产物的遗传毒性研究[J]. 现代食品科技, 2015, 31(8): 42-46. DOI:10.13982/ j.mfst.1673-9078.2015.8.008.
[13] WANG X C, LIU X D, LIU J C, et al. Contamination level of T-2 and HT-2 toxin in cereal crops from Aba Area in Sichuan Province, China[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 88(3): 396-400. DOI:10.1007/s00128-011-0478-6.
[14] RIZZO I, VEDOYA G, MAURUTTO S, et al. Assessment of toxigenic fungi on Argentinean medicinal herbs[J]. Microbiological Research, 2004, 159(2): 113-120. DOI:10.1016/J.MICRES.2004.01.013.
[15] TSIPLAKOU E, ANAGNOSTOPOULOS C, LIAPIS K, et al. Determination of mycotoxins in feedstuffs and ruminant’s milk using an easy and simple LC-MS/MS multiresidue method[J]. Talanta, 2014, 130: 8-19. DOI:10.1016/j.talanta.2014.06.018.
[16] 孙利, 霍江莲, 崔维刚, 等. 粮食产品中真菌毒素的色谱及质谱检测技术研究进展[J]. 食品科学, 2013, 34(19): 367-375. DOI:10.7506/ spkx1002-6630-201319075.
[17] RUBERT J, SOLER C, MAÑES J. Application of an HPLC-MS/MS method for mycotoxin analysis in commercial baby foods[J]. Food Chemistry, 2012, 133: 176-183. DOI:10.1016/j.foodchem.2011.12.035.
[18] SAITO K, IKEICHI R, KATAOKA H. Determination of ochratoxins in nuts and grain samples by in-tube solid-phase microextraction coupled with liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2012, 1220: 1-6. DOI:10.1016/ j.chroma.2011.11.008.
[19] MIROSLAW W, WOJCIECH P. Molecular modelling of a template substitute and monomers used in molecular imprinting for aflatoxin B 1micro-HPLC analysis[J]. Molecular Simulation, 2012, 38(11): 1-4. DOI:10.1080/08927022.2012.667876.
[20] MARÍA I V, ELENA L, ELENA G P. Simultaneous determination of type-A and type-B trichothecenes in barley samples by GC-MS[J]. Food Control, 2011, 22(8): 1428-1434. DOI:10.1016/j.foodcont.2011.03.004.
[21] MARCIN B, RENATA J, KRYSTYNA S, et al. An LC-IT-MS/MS-based method to determine trichothecenes in grain products[J]. Food Analytical Methods, 2014, 7(5): 1056-1065. DOI:10.1007/s12161-013-9713-6.
[22] WANG Y, CAO X Y, LI Y S, et al. Simultaneous determination of type-A and type-B trichothecenes in rice by UPLC-MS/MS[J]. Analytical Methods, 2012, 4(12): 4077-4082. DOI:10.1039/C2AY25755F.
[23] 王晓春, 汤奇峰, 李鹏飞. 高效液相色谱-三重四极杆串联质谱测定谷物中T-2毒素和HT-2毒素[J]. 分析试验室, 2011, 30(9): 62-65. DOI:10.13595/j.cnki.issn1000-0720.2011.0252.
[24] 芦欣. 谷物品中多种真菌毒素的LC-MS/MS检测方法研究[D].天津: 天津科技大学, 2014.
[25] 任贝贝. 液相色谱串联质谱法对食品中霉菌毒素的检测研究[D].石家庄: 河北师范大学, 2013.
Determination of T-2 and HT-2 Toxins in Three Aquatic Products by High Performance Liquid Chromatography-Tandem Mass Spectrometry
WANG Xiaobo
1, SHI Qi
1,2, WANG Yaling
1,*, LIAO Jianmeng
3, LIU Yang
2, WU Yishan
2, GAO Ping
3,*, LI Jianrong
4
(1. Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution, College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088, China; 2. Zhanjiang Institute of Supervision & Test on Quality & Measure, National Marine Products Quality Supervision & Inspection Center, Zhanjiang 524096, China; 3. Zhanjiang Food and Drug Administration, Zhanjiang 524022, China; 4. Liaoning Key Laboratory of Food Safety, Bohai University, Jinzhou 121013, China)
Abstract:A fast high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) method was developed for the quantitative determination of T-2 and HT-2 toxins in tilapia, Litopenaeus vannamei and golden scallop. After being homogenized, samples were extracted with 10 mL of neutral ethyl acetate by vibration, and after removing the moisture with sodium sulfate, 5 mL of the upper layer was concentrated with nitrogen blowing, re-dissolved with 1 mL of 0.1% formic acid in methyl alcohol:5 mmol/L ammonium acetate (3:7, V/V), and degreased with hexane. The target compounds were quantifi ed by the matrix-matched external standard method. Under optimized conditions, the lower limits of quantitation (LLOQs) for T-2 and HT-2 toxins in three aquatic products were 2 and 4 μg/kg, respectively. The linear range was 2–100 ng/mL for T-2 toxin and 4–200 ng/mL for HT-2 toxin. The average recoveries for three aquatic samples at three spiked levels ranged from 84.3% to 109.9% for T-2 toxin and 90.9% to 103.2% for HT-2 toxin. The relative standard deviations (RSDs) were in a range of 2.0%–8.7% for T-2 toxin and 2.6%–10.6% for HT-2 toxin (n = 6). The method is simple, rapid, accurate, precise and suitable for the simultaneous detection of T-2 and HT-2 toxins in the three representative aquatic products.
Key words:T-2 toxin; HT-2 toxin; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)
DOI:10.7506/spkx1002-6630-201624025
收稿日期:2016-05-05
基金项目:国家自然科学基金面上项目(31171634;31371777);广东省科技计划项目(2014B020205006);
广东省海洋与渔业局项目(粤财农[2015]115号)
作者简介:王小博(1990—),男,硕士研究生,研究方向为水产品质量与安全。E-mail:1030830636@qq.com
*通信作者:王雅玲(1965—),女,教授,博士,研究方向为水产品质量与安全。E-mail:wangylchina@163.com
高平(1981—),男,高级工程师,硕士,研究方向为食品检测技术。E-mail:649754017@qq.com
中图分类号:TS254.7
文献标志码:A
文章编号:1002-6630(2016)24-0164-06
引文格式:
王小博, 施琦, 王雅玲, 等. 高效液相色谱-串联质谱法测定3 种水产品中的T-2毒素与HT-2毒素[J]. 食品科学, 2016,
37(24): 164-169.
DOI:10.7506/spkx1002-6630-201624025. http://www.spkx.net.cn
WANG Xiaobo, SHI Qi, WANG Yaling, et al. Determination of T-2 and HT-2 toxins in three aquatic products by high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2016, 37(24): 164-169. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201624025. http://www.spkx.net.cn