表1 DEHP及DEHP-D
4的气相色谱-串联质谱分析参数
Table 1 GC-MS/MS parameters for DEHP and DEHP-D
4

注:*.定量离子。
?
刘平香 1,2,陈红平 1,3,高贯威 1,2,张明露 1,2,王国庆 1,3,刘 新 1,3,*
(1.中国农业科学院茶叶研究所,浙江 杭州 310008;2.中国农业科学院研究生院,北京 100081;3.农业部茶叶产品质量安全风险评估实验室(杭州),浙江 杭州 310008)
摘 要::在排查茶叶冲泡和样品前处理过程中邻苯二甲酸二(2-乙基)己酯(di-(2-ethylhexyl) phthalate,DEHP)背景污染基础上,采用同位素模拟-气相色谱-串联质谱法研究茶汤中DEHP的浸出率。结果表明,有机试剂、实验器皿以及旋转蒸发浓缩过程会产生DEHP污染,背景污染造成DEHP在茶汤中的浸出率偏高,为13%~400%。同位素DEHP-D 4模拟冲泡实验结果表明,DEHP-D 4在茶汤中的浸出率为4.5%~11.9%,浸出率与茶叶中DEHP-D 4质量浓度相关性较小,但与茶叶种类、冲泡方式和冲泡次数相关。该研究结果为茶叶中DEHP风险评估提供技术支撑,为制定茶叶中DEHP最大残留限量标准提供基础数据。
关键词:茶;邻苯二甲酸二(2-乙基)己酯;同位素模拟;浸出率;气相色谱-串联质谱
邻苯二甲酸酯(phthalate esters,PAEs)是世界上使用最多、应用最广的增塑剂种类 [1-2],其中,邻苯二甲酸二(2-乙基)己酯(di-(2-ethylhexyl) phthalate,DEHP)占到PAEs产量的50% [3]。DEHP在塑料中呈游离状态,极易迁移至环境和食品中,造成食品安全隐患。欧盟食品安全委员会规定了DEHP的每日允许摄入量为0.05 mg/kg [4],我国规定了食品及食品添加剂中DEHP的最大残留量为1.5 mg/kg [5],但茶叶中DEHP尚未制定限量标准。
茶是世界上最受欢迎的无酒精饮料之一 [6],具有生长周期长、加工复杂、贮藏时间长等特点。由于DEHP广泛存在于环境及包装等塑料制品中,茶叶在种植、加工和贮藏过程中不可避免受到DEHP的污染。前期研究结果表明,茶叶中DEHP的检出率为100%,最大残留量达到0.285 mg/kg [7]。因此,掌握茶叶中DEHP对人体的暴露水平,进一步开展风险评估,对于提高茶叶质量安全具有重要意义。茶汤是有害物质危害人体健康的主要途径,是茶叶中DEHP风险评估的关键参数,然而目前有关茶汤中DEHP浸出率的研究鲜见报道。
DEHP的检测方法主要有气相色谱法 [8]、液相色谱法 [9]、气相色谱-串联质谱法 [10]以及液相色谱-串联质谱法 [11-12]等,样品前处理方法主要有液液萃取 [13]、液液微萃取 [14]、固相萃取 [15]、固相微萃取 [16]等。由于DEHP的广泛存在性,使其在前处理过程中很容易受到来源于有机试剂、器皿、操作等因素的背景污染 [17]。因此,污染背景的排查及控制仍是目前DEHP检测定量的难点。
同位素之间具有相同的质子数,而中子数不同,导致同位素质量数差异,但其标记的同位素化合物之间具有相同的物理化学性质。气相色谱-串联质谱分析技术利用同位素质量数之间的差异,监测同位素标记的分子离子峰、特征离子或子离子(串联质谱模式),从而校正基质效应引入的定量误差,并广泛应用于复杂样品中环境污染物的定量分析,如PAEs、多环芳烃等 [18-19]。
鉴于同位素模拟-气相色谱-串联质谱分析方法灵敏度高、选择性强、抗污染能力好的优点,本实验在解析茶汤冲泡过程和样品前处理过程中DEHP背景污染基础上,建立茶汤中DEHP及DEHP-D 4同位素的气相色谱-串联质谱检测方法;利用同位素模拟实验,研究茶叶DEHP-D 4残留量、冲泡方式与冲泡次数对茶汤中DEHP-D 4浸出率的影响。本研究对茶叶中DEHP风险评估、指导消费者安全健康饮茶具有重要的理论和现实意义。
1.1 材料、试剂与仪器
龙井和铁观音干茶 市购。
丙酮、乙腈、正己烷(均为色谱纯) 美国Tedia公司;甲醇(色谱纯) 天津四友精细化学品公司;无水乙醇(ACS级)、水(液相色谱-串联质谱级)上海阿拉丁生化科技股份有限公司;无水硫酸钠、无水硫酸镁、氯化钠(分析纯,使用前分别在马弗炉450 ℃灼烧4 h) 北京化学试剂公司;N-丙基乙二胺(primary secondary amine,PSA)、石墨化碳黑(graphitized carbon black,GCB) 天津博纳艾尔杰公司;DEHP、DEHP-D 4(纯度均大于98%) 德国Dr. Ehrenstorfer GmbH公司。
450气相色谱仪、300串联四极杆质谱仪 美国Varian公司;Mass Workstation 6.9.2气相色谱-质谱工作站;T10高速均质器 德国IKA公司;高速冷冻离心机上海卢湘仪离心机仪器有限公司;AL104电子天平梅特勒-托利多仪器(上海)有限公司。
1.2 方法
1.2.1 溶液的配制
1.2.1.1 标准溶液的配制
DEHP用正己烷配制成250 mg/L的标准储备液,DEHP-D 4用丙酮配成100 mg/L的标准储备液,均于棕色储存瓶中在4 ℃条件下保存。分别取DEHP、DEHP-D 4标准储备液2、5 mL,用正己烷定容至100 mL,得到质量浓度为5 mg/L的DEHP和DEHP-D 4标准溶液,贮存于4 ℃条件下待用。
1.2.1.2 工作液的配制
分别取不同体积的标准溶液用正己烷配制成1、5、10、25、50、100 μg/L的工作溶液待用。定量分析采用基质标准溶液,其配制方法为:将2 mL空白基质浓缩近干后,用2 mL工作液溶解,得到与工作液相同质量浓度的基质标准溶液。
1.2.2 色谱与质谱条件
色谱柱:VF-5 MS(30 m×0.25 mm,0.25 μm);载气:氦气(纯度≥99.999%);流速:1.0 mL/min;进样量:1 μL;进样方式:不分流;进样口温度:250 ℃;连接杆温度:280 ℃;升温程序:初始柱温80 ℃,保持1 min,以15 ℃/min速率升温到180 ℃,保持2 min,以5 ℃/min速率升温到280 ℃,保持10.33 min。
电离方式:电子电离源;电离能量:70 eV;灯丝电流:50 mA;电子倍增管电压:1 000 V;四极杆温度:40 ℃;离子源温度:230 ℃;溶剂延迟:5 min;碰撞气:氩气(纯度99.999%);碰撞气压力:0.3 Pa。DEHP和DEHP-D 4的保留时间、特征离子对、定量离子对及优化碰撞能量见表1。
表1 DEHP及DEHP-D
4的气相色谱-串联质谱分析参数
Table 1 GC-MS/MS parameters for DEHP and DEHP-D
4

注:*.定量离子。
?
1.2.3 茶汤冲泡实验
称取3.0 g干茶,分别加入0.3 mL质量浓度为0.5、1、5 mg/L的DEHP-D 4标样,室温条件下避光保存过夜(约10 h),龙井茶按照GB/T 23776—2009《茶叶感官审评方法》中方法进行冲泡,铁观音按照绿茶和乌龙茶两种审评方法冲泡(绿茶审评方法:3 g干茶,于150 mL审评杯中用沸水冲泡5 min,冲泡2 次;乌龙茶审评方法:5 g干茶,于110 mL倒钟形评茶杯中用沸水冲泡3 次,冲泡时间依次为2、3、5 min),泡茶用水为液相色谱-串联质谱级水。
1.2.4 样品处理
干茶:参照Yin Peng等 [7]的方法。准确称取2.0 g磨碎茶样于40 mL的玻璃离心管中,加入5 mL的液相色谱-串联质谱级水润湿,涡旋30 s后静置30 min;加入10 mL乙腈,18 000 r/min均质2 min;提取液中加入2.0 g NaCl和2.0 g无水MgSO 4,剧烈振荡1 min后离心10 min(4 000 r/min);取2 mL上清液加入到预先装有200 mg PSA、100 mg GCB和100 mg MgSO 4的8 mL锥形玻璃离心管中,剧烈振荡1min后离心10 min(4 000 r/min);最后用玻璃吸管将上清液转移至2 mL进样瓶中,气相色谱-串联质谱进样分析。
茶汤:茶汤中DEHP与DEHP-D 4的提取采用液液萃取方法。取25 mL茶汤,加3 g NaCl,将茶汤与正己烷以1∶1(25 mL∶25 mL)的比例液液萃取;加1 mL无水乙醇破乳后,将上层正己烷过无水硫酸钠到50 mL鸡心瓶中,旋蒸至1 mL左右,用正己烷定容至2 mL;将溶液转移至2 mL进样瓶,气相色谱-串联质谱进样分析。
1.2.5 浸出率计算
茶汤中DEHP及DEHP-D 4浸出率的计算公式如下:
式中:C 1、C 2分别为茶汤和干茶中DEHP-D 4或DEHP含量(茶汤:μg/L,干茶:μg/kg);V为茶汤体积/mL;M为干茶质量/g。
2.1 DEHP背景污染排查与控制
DEHP极易受到有机试剂、实验器皿以及其他接触材料的污染,导致实验结果出现假阳性或者数据偏高等错误结果。因此,本实验对有机试剂、器皿等进行污染排查,试图控制DEHP背景污染。
考察了分析纯、ACS级、色谱纯、农残级4 种无水乙醇,只有ACS级无水乙醇中未受到DEHP污染(图1A~D)。因此,选用ACS级无水乙醇作为液液萃取中的破乳试剂。丙酮中DEHP含量达到15~22 μg/L,污染较严重(图1E),乙腈、正己烷中未检出DEHP(图1F~G)。因此,分别采用乙腈和正己烷作为干茶和茶汤中DEHP的提取溶剂。为减少塑料器皿造成DEHP背景污染,茶叶、茶汤中DEHP的检测过程中均采用玻璃器皿或瓷制品,所有器皿在甲醇中浸泡过夜,在120 ℃烘箱中烘4 h以上(移液管、容量瓶等用来定量的玻璃器材在40 ℃条件下烘干),再用正己烷淋洗以避免交叉污染。实验发现,过滤步骤中DEHP污染严重,主要污染来源于滤纸,因此,采用正己烷浸泡过夜的脱脂棉代替滤纸。另外,由于样品瓶盖与样品溶剂的相互作用,样品置于进样瓶中搁置时间太长会使DEHP等干扰物增加 [20],所以本实验中进样瓶在加盖前均加锡箔纸阻隔。
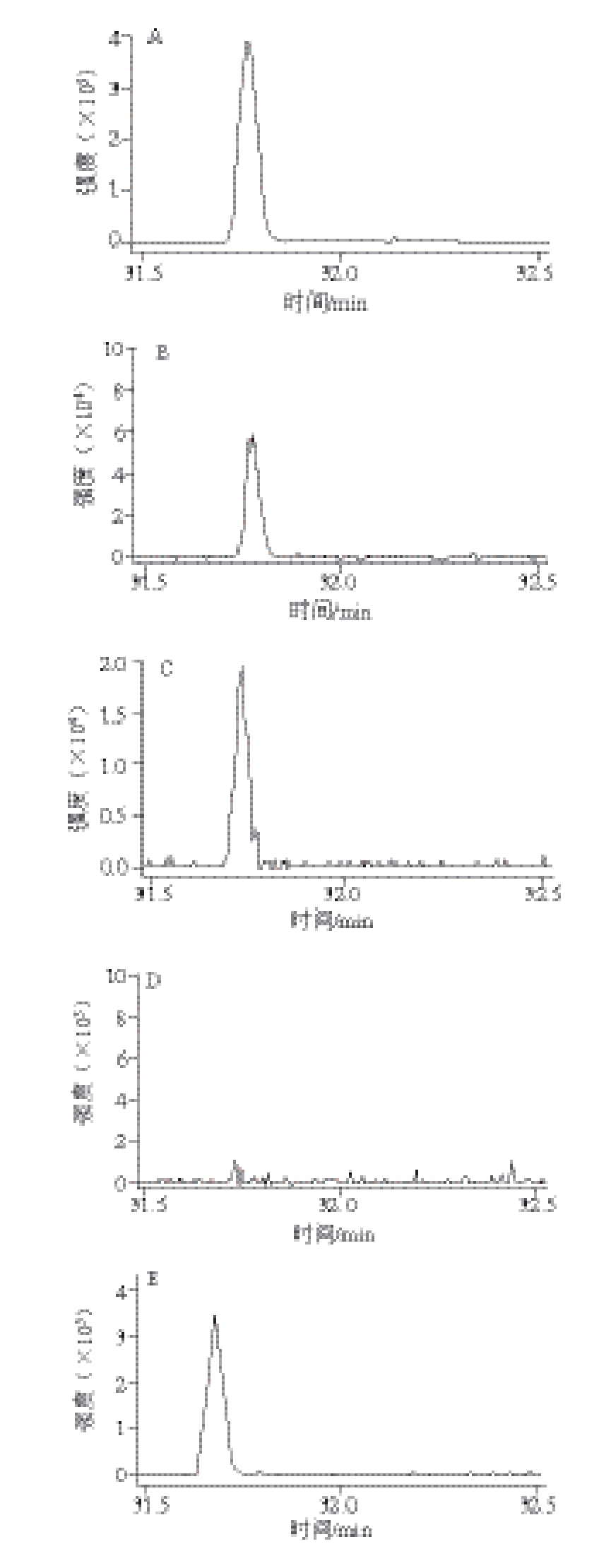
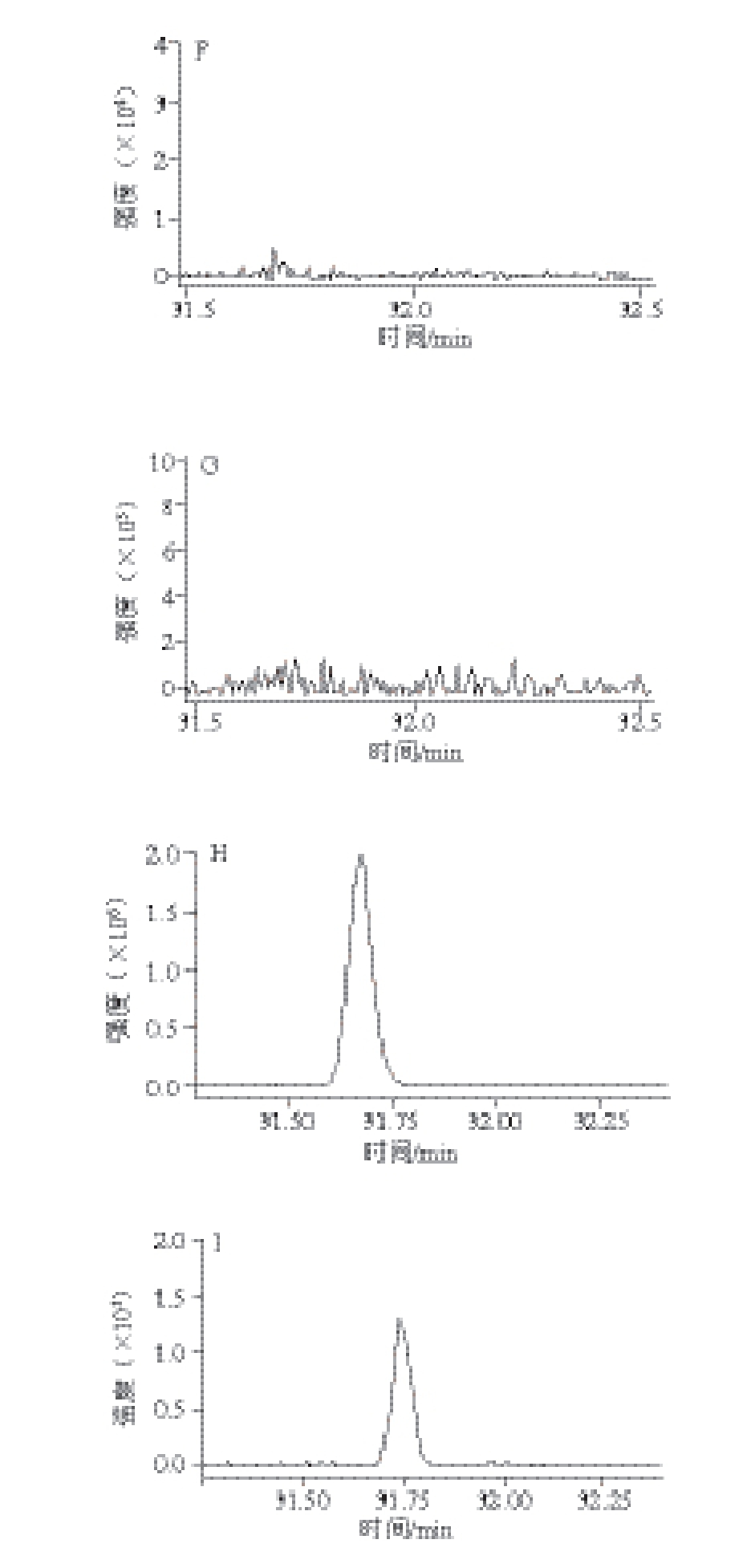
图1 农残级无水乙醇(A)、分析纯无水乙醇(B)、色谱级无水乙醇(C)、ACS级无水乙醇(D)、丙酮(E)、乙腈(F)、正己烷(G),G控制前(H)、控制后(I)的DEHP背景污染气相色谱-串联质谱图谱
Fig. 1 GC-MS/MS chromatograms of DEHP obtained from pesticide analysis grade ethanol (A), analytically pure ethanol (B), chromatographically pure ethanol (C), ACS grade ethanol (D), acetone (E), n-hexane (F), acetonitrile (G), without control (H), and under control (I)
经过对实验过程中使用试剂的逐一排查及对器皿和其他相关材料的严格控制,DEHP背景污染水平由控制前的100~120 μg/L减小到控制后的15~20 μg/L左右(图1H、I),降低5~6 倍。根据实际干茶样品中DEHP含量范围(32~285 μg/kg) [7],推断DEHP浸出率结果偏高,为13%~400%左右。尽管实验中对有机试剂、器皿以及其他接触材料进行DEHP污染控制,但由于茶汤中DEHP的含量极低,需采用旋转蒸发浓缩进行富集。然而,旋蒸浓缩仪采用塑料密封圈,导致浓缩过程中部分挥发后的有机试剂回流过程中与塑料密封圈接触,造成15~20 μg/L左右的DEHP背景污染。尽管采取了严格的背景控制,仍不能满足茶汤中检测的需求。DEHP-D 4是由氢(H)的同位素氘(D)取代DEHP苯环上4 个H原子而得到的,其分子质量与DEHP相差4D。尽管DEHP-D 4与DEHP在气相色谱-串联质谱分析时具有相同的保留时间,但其母离子/子离子对存在差异,因此采用气相色谱-串联质谱分析时,DEHP-D 4能有效避开样品前处理或茶叶冲泡过程中引入的DEHP背景干扰;同时,DEHP-D 4与DEHP具有相同的物理化学性质,因此,本研究采用同位素模拟实验的手段研究DEHP在茶汤中的浸出规律,有效避免了背景污染问题。
2.2 方法评价
由于茶汤检测过程中DEHP背景污染对浸出率存在显著干扰,因此本实验通过DEHP-D 4模拟实验考察DEHP在茶叶中的浸出率,所以只考察茶叶、茶汤中DEHP-D 4检测方法的准确度和精密度(表2)。干茶和茶汤中,DEHP-D 4在质量浓度为1~100 μg/L的范围内与峰面积呈良好线性关系,相关系数不小于0.997 3。根据实际样品中DEHP的含量,对干茶和茶汤分别进行低、中、高3 个水平的添加标准样品回收率实验。干茶的添加量分别为50、200、500 μg/kg,茶汤的添加量分别为0.1、0.2、0.5 μg/L,各重复6 次。结果(表2)表明,干茶和茶汤中DEHP-D 4的回收率分别在82.1%~87.3%和74.1%~81.0%,相对标准偏差(relative standard deviations,RSD)小于20%,干茶中DEHP-D 4的检出限(limits of detection,LOD)和定量限(limits of quantitation,LOQ)分别为2.0 μg/kg和5.0 μg/kg,茶汤中DEHP-D 4的LOD和LOQ分别为0.016 μg/L和0.064 μg/L,该方法能够满足干茶和茶汤中DEHP-D 4的检测。
表2 D4的线性方程、相关系数(R2)、线性范围以及方法的回收率、RSD、检出限和定量限
Table 2 Linear equations, determination coefficients ( ranges, recoveries, relative standard deviations (RSDs), limits of detection (LODs) and quantitation (LOQs) of DEHP-D
4in tea and tea infusion
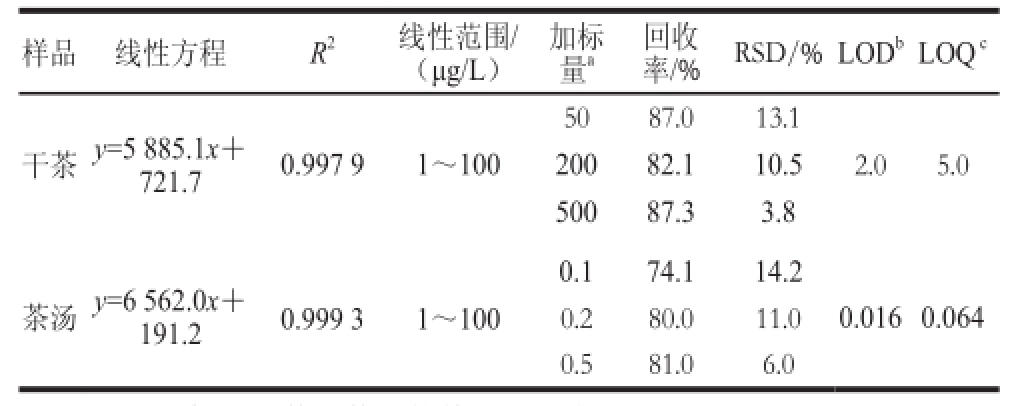
注:a、b、c标注干茶和茶汤的单位分别为μg/kg和μg/L。
?
2.3 同位素模拟实验结果
由于DEHP在环境中广泛存在,在实验过程中背景污染难以控制,从而使得茶汤样品中DEHP的定量分析存在严重背景污染隐患 [17]。采用同位素模拟实验模拟DEHP在茶汤中的浸出率,不仅能够实现“零”背景污染,还能在很大程度上模拟实际样品中DEHP的浸出率。前期初步研究表明,绿茶、乌龙茶中DEHP平均污染量分别为32、138 μg/kg,最高污染量为285、135 μg/kg [7],因此,本实验中DEHP-D 4的加标量分别为50、100、500 μg/kg 3 个水平。样品加入0.3 mL标准溶液后,室温条件下避光保存过夜(约10 h)。干茶及茶汤气相色谱-串联质谱典型图谱见图2。
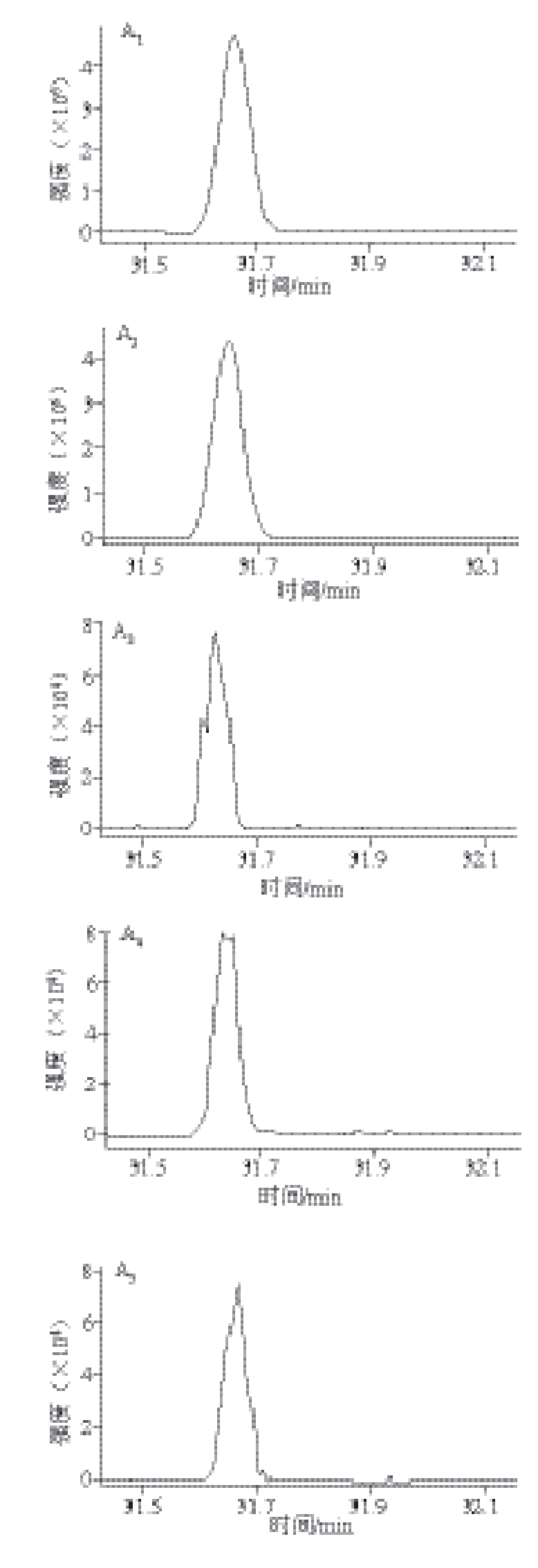

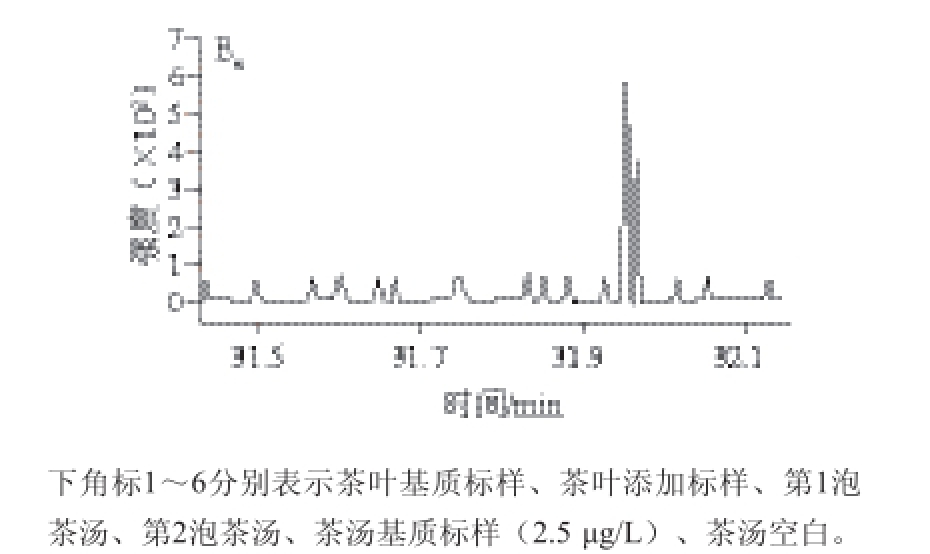
图2 龙井(A)和铁观音(B)冲泡过程中DEHP-D
4的气相色谱--串联质谱图谱
Fig. 2 GC-MS/MS chromatograms of DEHP-D
4obtained from tea matrix-match standard solution (1), spiked standard solution (2), first infusion (3), second infusion (4), infusion matrix-match standard solution (5) (2.5 μg/L), and blank infusion (6) during the brewing of Longjing (A) and Tieguanyin (B) tea
在GB/T 23776—2009绿茶审评法冲泡方式下,龙井和铁观音冲泡过程中DEHP-D 4总浸出率不存在明显差异,分别为9.0%~11.9%和7.2%~10.7%(表3),低于Du Liping等 [21]的研究结果(浸出率25%~60%、茶水比1∶50、冲泡时间5 min)。本实验采用同位素添加标准溶液模拟茶汤冲泡实验,由于添加的DEHP-D 4未能完全进入茶叶组织,因此模拟实验中DEHP-D 4的浸出率理论上高于实际样品浸出率。因此,根据本实验DEHP-D 4模拟实验结果,茶汤中DEHP的浸出率应低于本实验中DEHP-D 4最大的浸出率(11.9%)。
本研究采用添加标准溶液实验研究干茶中DEHP-D 4残留量对浸出规律的影响。在50、100、500 μg/kg三个水平下,DEHP-D 4在茶汤中的浸出率没有显著差异。Chen Hongping等 [22]的研究结果也表明,干茶中农药残留量与其在茶汤中的浸出率没有显著相关性。因此,茶汤中DEHP-D 4的浸出率与其在水中的溶解度(0.27 mg/L,25 ℃) [23]和辛醇/水分配系数(lgK ow)(7.60) [24]相关,茶叶中DEHP-D 4残留量对浸出率影响较小。以铁观音分别按照绿茶和乌龙茶冲泡方式为例,当茶叶中DEHP-D 4的含量为50~500 μg/kg时,DEHP-D 4在第1泡茶汤中的浸出率分别为5.1%~7.7%和4.1%~4.5%。
本实验考察了不同冲泡方式和冲泡次数对DEHP-D 4浸出率的影响。结果表明,铁观音按照绿茶冲泡方式时,DEHP-D 4浸出率(7.2%~10.7%)高于乌龙茶冲泡方式(4.5%~6.6%)。冲泡次数对DEHP-D 4在茶汤中的浸出率因茶类而异。龙井茶第1、2泡之间DEHP-D 4浸出率比例约为1∶1,没有明显差异;铁观音在按照两种审评标准进行冲泡时,浸出率均随着冲泡次数的增加而降低,第1、2泡茶汤的浸出率比例约在2∶1~6∶1之间,DEHP-D 4在第1泡茶汤中的浸出率显著高于第2泡。
表3 DEHP-D
4在龙井茶和铁观音茶汤中的浸出率
Table 3 Transfer rates of DEHP-D
4from Longjing and Tieguanyin tea during brewing

注:/.未进行第3次冲泡实验。
?
茶汤中DEHP在前处理及检测过程中极易受到来自试剂及器材的污染,严重影响定量结果,致使DEHP在茶汤中的浸出率在原有基础上提高13%~400%。同位素DEHP-D 4模拟冲泡实验结果表明,DEHP-D 4在茶汤中的浸出率与自身的理化性质有密切的关系,DEHP-D 4水溶解度较低,lgK ow较高,在茶汤中的浸出率为4.5%~11.9%。DEHP-D 4在茶汤中的浸出率随茶水比的增加略有降低,与干茶中DEHP-D 4原始质量浓度没有相关性。冲泡次数间浸出率的差异与茶叶自身理化性质有一定关系,龙井茶第1、2泡之间浸出率没有明显差异,铁观音茶汤中DEHP-D 4浸出率随冲泡次数的增加而降低。尽管采用添加DEHP-D 4模拟实验推测茶汤中DEHP浸出率与实际样品中DEHP浸出率存在差异,但同位素模拟实验克服了背景污染,实验操作简单,结果更可靠。本研究结果为茶叶中DEHP风险评估提供技术支撑,为制定茶叶中DEHP最大残留限量标准提供基础数据。
参考文献:
[1] STALES C A, PETERSON D R, PARKERTON T F, et al. The environmental fate of phthalate esters: a literature review[J]. Chemosphere, 1997, 35(4): 667-749. DOI:10.1016/S0045-6535(97)00195-1.
[2] MURPHY J. Additives for plastics handbook[M]. Elsevier, 2001. DOI:10.1016/B978-185617370-4/50022-1.
[3] S TRUTT M. What’s wrong with PVC?[J/OL]. Gree npeace International, 1997. http://ths.gardenweb.com/discussions/2632525/ whats-wrong-with-pvc-and-more.
[4] European Food Safety Authority. Opinion of the scientifi c panel on food additives, fl avourings, processing aids and materials in contact with fo od (AFC) on a request from the commission related to bis (2-ethylhexyl) phthalate (DEHP) for use in food contact materials Question N° EFSA-Q-200 3-191[J]. The EFSA Journal, 2005, 243: 1-20.
[5] 卫生部办公厅. 卫生部办公厅关于通报食品及食品添加剂邻苯二甲酸酯类物质最大残留量的函. 卫办监督函〔2011〕551号[B/ OL]. (2011-06-13)[2016-04-18]. http://www.scwst.gov.cn/index.php/ gg/3080-2011-06-22-01-56-56.
[6] BANSAL S, CHOUDHARY S, SHARMA M, et al. Tea: a native source of antimicrobial agents[J]. Food Research International, 2013, 53(2): 568-584. DOI:10.1016/j.foodres.2013.01.032.
[7] YIN P, LIU X, CHEN H, et al. Determination of 16 phthalate esters in tea samples using a modifi ed QuEChERS sample preparation method combined with GC-MS/MS[J]. Food Add itives and Contaminants: Part A, 2014, 31(8): 1406-1413. DOI:10.1080/19440049.2014.933490.
[8] 杨瑛, 樊文娟. GC-FID法测定塑料包材中16 种邻苯二甲酸酯类化合物[J]. 食品科学, 2013, 34(20): 250-254. DOI:10.7506/ spkx1002-6630-201320053.
[9] 周阿蒙, 王哲君, 陈君良, 等. 基于聚苯乙烯纳米磁性材料的基质分散-固相萃取/液相色谱法测定白酒中的邻苯二甲酸酯[J]. 分析测试学报, 2014(11): 1219-1223. DOI:10.3969/ j.issn.1004-4957.2014.11.002.
[10] 蔡艳, 赵家青, 贺小雨, 等. 食用油中邻苯二甲酸酯和己二酸酯的GC-MS定量分析与迁移特性研究[J]. 食品科学, 2014, 35(12): 191-195. DOI:10.7506/spkx1002-6630-201412039.
[11] 刘杰, 郁宏燕, 鲍立杰, 等. 液相色谱-串联质谱法测定饮料中16 种邻苯二甲酸酯[J]. 食品科学, 2012, 33(18): 211-215.
[ 12] XU D, DENG X, FANG E, et al. Determination of 23 phthalic acid esters in food by liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2014, 1324: 49-56. DOI:10.1016/ j.chroma.2013.11.017.
[13] OSTROVSKÝ I, ČABALA R, KUBINEC R, et al. Determination of phthalate sum in fatty food by gas chromatography[J]. Food Chemistry, 2011, 124(1): 392-395. DOI:10.1016/j.foodchem.2010.06.045.
[14] MARCH J G, CERDÀ V. An innovative arrangement for in-vial membrane-assisted liquid-liquid microextraction: application to the determination of esters of phthalic acid in alcoholic beverages by gas chromatography-mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2015, 407(14): 4213-4217. DOI:10.1007/s00216-015-8646-x.
[15] 曹小妹, 吴晓燕, 李挥, 等. 固相萃取-气相色谱法测定食品包装材料中邻苯二甲酸酯类物质[J]. 食品科学, 2012, 33(10): 251-254.
[16] YE C, GAO J, YANG C, et al. Development and application of an SPME/GC method for the determination of trace phthalates in beer using a calix[6]arene fi ber[J]. Analytica Chimica Acta, 2009, 641(1/2): 64-74. DOI:10.1016/j.aca.2009.02.052.
[17] FANKHAUSER-NOTI A, GROB K. Blank problems in trace analysis of diethylhexyl and dibutyl phthalate: investigation of the sources, tips and tricks[J]. Analytica Chimica Acta, 2007, 582(2): 353-360. DOI:10.1016/j.aca.2006.09.012.
[18] IERAPETRITIS I, LIOUPIS A, LAMPI E. Determination of phthalates into veg etable oils by isotopic dilution gas chromatography mass spectrometry[J]. Food Analytical Methods, 2014, 7(7): 1451-1457. DOI:10.1007/s12161-013-9770-x.
[19] 杨君, 王建华, 宫萍, 等. 同位素稀释-气相色谱-三重四极杆串联质谱法测定植物油中的多环芳烃[J]. 食品科学, 2013, 34(22): 202-207. DO I:10.7506/spkx1002-6630-201322041.
[20] 王卫华, 邵明武, 马联弟. 超声波辅助萃取同位素稀释质谱法测定聚氯乙烯中6 种邻苯二甲酸酯[J]. 化学分析计量, 2013(6): 17-20. DOI:10.3969/j.issn.1008-6145.2013.06.005.
[21] DU Liping, MA Lijuan, QIAO Yang, et al. Determination of phthalate esters in teas and tea infusions by gas chromatography-mass spectrometry[J]. Food Chemistry, 2016, 197: 1200-1206. DOI:10.1016/ j.aca.2006.09.012.
[22] CHEN Hongping, PAN Meiling, PAN Rong, et al. Transfer rates of 19 typical pesticides and the relationship with their physicochemical property[J]. Journal of Agricultural and Food Chemistry, 2015, 63(2): 723-730. DOI:10.1021/jf506103d.
[23] BARRIO-LAGE G A, PARSONS F Z, NARBAITZ R M, et al. Enhanced anaerobic biodegradation of vinyl chloride in ground water[J]. Environmental Toxicology and Chemistry, 1990, 9(4): 403-415. DOI:10.1002/etc.5620090402.
[24] de BRUJIN J, BUSSER F, SEINEN W, et al. Determination of octanol/ water partition coeffi cients for hydrophobic organic chemicals with the“slow-stirring” method[J]. Environment al Toxicology and Chemistry, 1989, 8: 499-512. DOI:10.1002/etc.5620080607.
Determination of Transfer Rates of Di-(2-ethylhexyl) phthalate during Tea Brewing by Gas Chromatography-Tandem Mass Spectrometry with Isotope Simulation Technique
LIU Pingxiang
1,2, CHEN Hongping
1,3, GAO Guanwei
1,2, ZHANG Minglu
1,2, WANG Guoqing
1,3, LIU Xin
1,3,*
(1. Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. Tea Quality and Safety and Risk Assessment (Hangzhou), Ministry of Agriculture, Hangzhou 310008, China)
Abstract:The secondary contaminant of di-(2-ethylhexyl) phthalate (DEHP) during tea infusion and sample preparation was investigated and controlled in this study. The aim of this research was to evaluate the transfer rate of DEHP during tea infusion using isotope DEHP-D 4simulation and gas chromatography-tandem mass spectrometry (GC-MS/MS). Serious secondary contaminant of DEHP could occur in the reagents and vessels used and the process of rotary evaporation, amounting to 13%–400%. Transfer rate of DEHP-D 4was found in the range of 4.5%–11.9%, which was related with tea category, brewing method and number of brewing cycles, but not with the concentration of DEHP-D 4spiked in tea. This fi nding is helpful for the risk assessment of DEHP and the formulation of maximum residue limit of DEHP in tea.
Key words:tea; di-(2-ethylhexyl) phthalate; isotope simulation; transfer rate; gas chromatography-tandem mass spectrometry
DOI:10.7506/spkx1002-6630-201624033
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2016)24-0209-07
引文格式:
刘平香, 陈红平, 高贯威, 等. 同位素模拟-气相色谱-串联质谱法测定邻苯二甲酸二(2-乙基)己酯在茶汤中的浸出率[J].食品科学, 2016, 37(24): 209-215. DOI:10.7506/spkx1002-6630-201624033. http://www.spkx.net.cn
LIU Pingxiang, CHEN Hongping, GAO Guanwei, et al. Determination of transfer rates of di-(2-ethylhexyl) phthalate during tea brewing by gas chromatography-tandem mass spectrometry with isotope simulation technique[J]. Food Science, 2016, 37(24): 209-215. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201624033. http://www.spkx.net.cn
收稿日期:2016-04-19
基金项目:国家现代农业(茶叶)产业技术体系建设专项(nycytx-26);
中国农业科学院创新团队茶叶质量与风险评估团队项目(CAAS-ASTIP-2014-TRICAAS-06)
作者简介:刘平香(1990—),女,硕士研究生,研究方向为茶叶加工与质量控制。E-mail:liupingxiang@tricaas.com
*通信作者:刘新(1961—),男,研究员,硕士,研究方向为茶叶质量安全与标准。E-mail:liuxin@tricaas.com