表1 实验所用菌株
Table 1 Experimental strains

?
宋春美,朱政辉,李建武,刘 箐*
(上海理工大学医疗器械与食品学院,上海 200093)
摘 要::目的:以乳粉中污染的阪崎肠杆菌(Enterobacter sakazakii)为检测目标,开发一种能快速检测其污染的试剂盒。方法:以两株阪崎肠杆菌单克隆抗体分别为包被抗体和检测抗体,建立双抗体夹心酶联免疫吸附实验方法,优化各个反应条件,制成在2 h内能发生显色反应的检测试剂盒。结果:包被抗体的最佳工作质量浓度为10 μg/mL,检测抗体的最佳稀释倍数为1∶5 000。试剂盒的检测限为10 4CFU/mL,在10 4~10 8CFU/mL范围内OD 450 nm值与阪崎肠杆菌浓度的常用对数值呈线性关系。特异性实验中,试剂盒可检出3 株阪崎肠杆菌标准菌株,对其他9 株食品中常见致病菌的检测均呈阴性。模拟带菌实验中,初始菌浓度为1 CFU/mL的模拟样品经过8 h前增菌后,通过该试剂盒便可检出。该试剂盒的批内、批间变异系数均小于6%,至少可在室温保存6 个月。结论:该双抗体夹心试剂盒具有灵敏度高、特异性好、精密度高、稳定性强等优点,可应用于乳粉中阪崎肠杆菌的快速检测。
关键词:双抗体夹心法;酶联免疫吸附试剂盒;灵敏;快速检测;致病菌
2016年1月,国家食品药品监督管理总局对婴幼儿配方乳粉实施监督抽检,198 批次抽检样品中6批次不合格。其中,不符合食品安全国家标准、存在食品安全风险的样品2 批次,均为检出阪崎肠杆菌不符合食品安全国家标准。阪崎肠杆菌(Enterobacter sakazakii),属于肠杆菌科克罗诺杆菌属,是人和动物肠道内寄生的一种有周生鞭毛、能运动、无芽孢、兼性厌氧的革兰氏阴性杆菌,广泛分布于自然界中 [1]。它是一种重要的食源性条件致病菌,容易感染低体重儿或免疫力低下的婴幼儿,引起新生儿脑膜炎、菌血症、小肠结肠炎等疾病,甚至引起肿瘤或致死,幸存者也易导致神经系统后遗症 [2-3]。国际食品微生物标准委员会在2002年将阪崎肠杆菌列为“严重危害特定人群生命、引起长期慢性实质性后遗症的一种致病菌” [4]。联合国粮食及农业组织和世界卫生组织认为阪崎肠杆菌的所有种都有致病性 [5]。近年来,阪崎肠杆菌散发和爆发的病例在全球范围内的报道较多,已经引起世界范围内的广泛关注。其感染源头尚不清楚,但在感染事件的调查中发现婴幼儿乳粉是主要感染渠道。
目前检测阪崎肠杆菌的方法主要有传统方法、分子生物学方法、免疫学方法和其他方法 [6-10]等。传统的阪崎肠杆菌分离检测方法,依赖于生化和形态学特点,包括前增菌、选择性增菌、选择性分离培养、生化鉴定4 个步骤,以美国食品与药品监督管理局颁布的“三管增菌法” [11]和Iversen等 [12]发表的阪崎肠杆菌显色培养基为代表。传统的检测方法准确,但存在操作繁琐、耗时长、不易分辨结果等缺点。分子生物学检测技术的不断完善和发展,克服了传统检测方法存在的问题,也使得针对阪崎肠杆菌开展的快速检测方法迅速发展,这些方法主要包括改良的聚合酶链式反应(polymerase chain reaction,PCR) [13]、实时定量PCR [14]、PCR联用技术 [15-16]及环介导等温扩增技术 [17]等,它们前处理繁琐,且需昂贵的检测仪器,对于大批量的样本检测有诸多限制。免疫学检测方法具有简便快速、特异性强、灵敏度高的特点,适于大量样本的检测 [18-20],但高特异性、能配对的致病菌单克隆抗体难以制备是制约其发展的瓶颈。
目前针对阪崎肠杆菌单克隆抗体及在此基础上建立的酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法已有报道 [21-23],但检测阪崎肠杆菌双抗体夹心ELISA试剂盒的研制,国内外尚鲜见报道。本实验以甲醛灭活的阪崎肠杆菌全菌为免疫原,免疫8 周龄Balb/c小鼠,制备了2 株阪崎肠杆菌单克隆抗体,在此基础上建立了检测阪崎肠杆菌的双抗体夹心ELISA方法并对反应条件进行优化,研制了快速ELISA试剂盒,可用于检测乳粉中的阪崎肠杆菌,该法的建立为监测食源性致病菌感染及临床快速诊断提供了一种有效的技术手段。
1.1 材料、试剂与仪器
1.1.1 材料与菌株
模拟带菌实验样品:A、B、C 3 种脱脂乳粉均购于上海市卜蜂莲花连锁超市。
本实验采用的菌株均来源于美国模式培养物保藏所(American type culture collection,ATCC),购于广州环凯微生物科技有限公司,如表1所示,使用前均用PCR法进行鉴定。
表1 实验所用菌株
Table 1 Experimental strains

?
1.1.2 试剂
阪崎肠杆菌单克隆抗体C8(1.9 mg/mL)、8G9(2.4 mg/mL)及其辣根过氧化物酶(horse radish peroxidase,HRP)酶标抗体C8-HRP、8G9-HRP,由本实验室研制;3,3’,5,5’-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)显色试剂、细菌培养基、其他试剂为进口或国产分析纯产品。
包被缓冲液(pH 9.6,0.05 mol/L碳酸盐缓冲液):精确称取3.18 g Na 2CO 3和5.86 g NaHCO 3后,用双蒸水稀释至2 000 mL,摇匀放置。
洗涤缓冲液(pH 7.4,0.15 mol/L,磷酸盐吐温缓冲液(phosphate-tween buffer solution,PBST)):精确称取0.40 g KH 2PO 4、5.80 g Na 2HPO 4·12H 2O、16.00 g NaCl、0.40 g KCl,用双蒸水稀释至2 000 mL,加入1 mL Tween 20,摇匀放置。
终止液(2 mol/L,H 2SO 4):量取双蒸水356.6 mL,然后在双蒸水中沿壁逐滴加入浓硫酸,边加边搅拌至400 mL。
1.1.3 仪器与设备
ELX800酶标仪 美国Bio Tek公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司;LRH-70生化培养箱 上海一恒科技有限公司;Gene Amp ®PCR system9700 美国ABI公司;G:BOX F3凝胶成像系统 英国Syngene有限公司;Vortex-Genie 2旋涡混合器美国Scientific Industries公司;全自动高速酶标洗板机北京楠华科技有限公司。
1.2 方法
1.2.1 双抗体ELISA方法的建立
1)包被:用包被缓冲液将阪崎肠杆菌单克隆抗体稀释到一定浓度,每孔100 μL加到96 孔酶标板,包被2 h,用洗涤缓冲液洗板3 次。2)封闭:每孔加入150 μL封闭液,反应一定时间后,用洗涤缓冲液洗板3 次。3)加样:加入100 μL标准菌液或待检样品,以空白培养基为阴性对照,30 min后用洗涤缓冲液洗板3 次。4)加酶标抗体:每孔加入100 μL一定浓度的酶标抗体,反应1 h后洗涤3 次。5)底物显色:每孔加入现配的TMB底物溶液100 μL,显色10 min。6)终止反应:每孔加入终止液50 μL。7)结果判定:读取OD 450 nm值,以测定孔OD 450 nm值/阴性对照孔OD 450 nm即P/N≥2.1时判断为阳性。
样品前处理:无菌称取10 g乳粉样品加入已预热至44 ℃装有90 mL缓冲蛋白胨水的锥形瓶中,用手缓缓地摇动至充分溶解,37 ℃培养若干小时后,直接取样检测。
1.2.2 双抗体夹心ELISA反应条件的优化
1.2.2.1 抗体的配对
将阪崎肠杆菌单克隆抗体C8和8G9分别作为包被抗体,C8-HRP、8G9-HRP分别作为检测抗体,进行交叉抗体配对检测,将阪崎肠杆菌023、024、025分别稀释到10 3~10 8CFU/mL,按照双抗体夹心ELISA步骤进行测定,重复3 次,选择相同菌浓度条件下检测平均OD 450 nm值最高,阴性最低的配对方式为最佳抗体配对方式。
1.2.2.2 包被抗体和酶标抗体最佳工作质量浓度的确定
采用棋盘滴定法测定,用包被缓冲液将一抗分别稀释到2、6、10、14 μg/mL,进行梯度包被,将酶标二抗分别稀释1 000、3 000、5 000、7 000 倍,按照双抗体夹心ELISA步骤进行测定,重复3 次。以10 8CFU/mL的阪崎肠杆菌标准菌为阳性对照,以阳性对照值在1左右,阴性对照值小于0.1的条件为最佳工作质量浓度 [24]。
1.2.2.3 最佳封闭条件的确定
用最佳一抗包被浓度包被96 孔板,分别选择30 g/L的牛血清蛋白(bovine serum albumin,BSA)和脱脂乳粉水溶液进行封闭,分别在37 ℃封闭0.5、1、2 h,将阪崎肠杆菌023分别稀释为10 3~10 8CFU/mL,按照双抗体夹心ELISA步骤进行测定,选择检测相同菌浓度条件下OD 450 nm值最高的封闭物为最佳封闭物,以获得最高OD 450 nm值的最少封闭时间为最佳封闭时间。
1.2.3 阪崎肠杆菌双抗体夹心ELISA试剂盒的组装
1.2.3.1 阪崎肠杆菌试剂盒的配制
8×12 孔酶标板(最佳抗体包被,最佳封闭物封闭);1号液(最佳浓度的酶标抗体);2号液(底物缓冲液A);3号液(底物缓冲液B);4号液(终止液);5号液(阴性对照);PBST等。
1.2.3.2 阪崎肠杆菌试剂盒的操作步骤及结果判断
第1步,由待测样品数量确定所需酶标板数目,并标记样品孔、对照孔、空白孔,样品孔加入待测样品,对照孔加入5号液,室温放置30 min,PBST洗3 次;第2步,每孔加入1号液100 μL,室温放置1 h,PBST洗3 次;第3步,每孔加入2、3号混合液(1∶1,V/V)各50 μL,室温反应10 min,每孔加入50 μL 4号液终止反应;第4步,用酶标仪读取各孔OD 450 nm值,并记录数据,以P/N≥2.1时判断为阳性。若需定量分析,将各样品的OD 450 nm值代入线性回归方程,计算样品浓度的对数值x,求其反对数,即为样品增菌后中所含阪崎肠杆菌浓度。
1.2.4 阪崎肠杆菌双抗体夹心ELISA试剂盒的性能测试
1.2.4.1 灵敏度及定量分析
将阪崎肠杆菌分别稀释为10 8、10 7、10 6、10 5、10 4、10 3CFU/mL,以空白培养基为阴性对照,按照试剂盒检测步骤进行检测,重复6 次,以平均OD 450 nm值在不小于阴性值×2.1时对应的最小菌液浓度为最低检测限。以抗原浓度的对数值为横坐标,以平均OD 450 nm值为纵坐标,绘制标准曲线。
1.2.4.2 特异性实验
将10 8CFU/mL的大肠杆菌O157:H7、单增李斯特菌、猪霍乱沙门氏菌、鼠伤寒沙门氏菌、肠炎沙门氏菌、福氏志贺氏菌、鲍氏志贺氏菌、小肠耶尔森氏菌、蜡样肠杆菌,按照试剂盒检测步骤进行检测,重复6 次,当平均OD 450 nm值不小于阴性值×2.1时,判断为阳性,即与阪崎肠杆菌有交叉反应。
1.2.4.3 精密度实验
用6 个不同批次的试剂盒检测3 个浓度梯度的阪崎肠杆菌标准菌,每个浓度设6 个重复,计算批内变异系数和批间变异系数。
1.2.4.4 稳定性实验
将试剂盒室温条件下放置,分别于0、1、2、3、4、5、6月时取出,测定10 5CFU/mL的阪崎肠杆菌标准菌,每月平行检测6 次,记录OD 450 nm值,以检测时间为横坐标,每月OD 450 nm平均值为纵坐标,绘制图标,并根据6个月全部数据计算变异系数。
1.2.4.5 模拟带菌实验
选择3 种不同品牌乳粉A、B、C为模拟样品:无菌称取10 g样品加入已预热至44 ℃装有90 mL缓冲蛋白胨水的锥形瓶中,每份样品接种100 CFU阪崎肠杆菌标准菌,阴性对照不加菌,置37 ℃培养,每隔2 h取出1 mL样品后直接用试剂盒进行检测,重复6 次。
1.3 数据统计分析
实验数据和绘图采用Office Microsoft Excel 2010和GraphPad Prism 5数据分析软件。
2.1 双抗体夹心ELISA反应条件的优化
2.1.1 抗体的配对
分别采用C8、8G9为包被抗体,C8-HRP、8G9-HRP为检测抗体,进行交叉抗体配对检测,3 次重复检测的平均值如表2所示,当C8为包被抗体,8G9-HRP为检测抗体时,OD 450 nm值较另一组高,且023、024、025三种菌在同种配对情况下OD 450 nm值相差不大,所有阴性值均正常,因此,阪崎肠杆菌双抗体夹心ELISA最佳抗体配对为C8包板,8G9-HRP为检测抗体。本研究建立的双抗体夹心法是通过两种抗体直接检测抗原,免去了加入酶标抗IgG抗体的步骤,不仅节省了检测时间,也降低了检测成本。
表2 抗体配对结果
Table 2 Antibody pairing results

注:A为C8包板,8G9-HRP;B为8G9包板,C8-HRP。表中数据为

±s,n=3,表3同。
?
2.1.2 包被抗体和酶标抗体最佳工作质量浓度的确定
包被是将抗原或抗体固定到固相载体上的一种非特异性的物理吸附过程。一般选择蛋白的包被质量浓度为20~100 μg/mL,以pH值为9.6的碳酸盐缓冲液为包被液。以C8为包被抗体,8G9为酶标抗体,检测10 8CFU/mL的阪崎肠杆菌标准菌,检测结果如表3所示,确定包被抗体的最佳工作质量浓度为10 μg/mL,酶标抗体的最佳稀释度为1∶5 000,此时阳性对照OD 450 nm值在1.0左右,阴性对照OD 450 nm值小于0.1。
表3 包被抗体和酶标抗体的最佳工作质量浓度检测结果
Table 3 Optimal working concentrations of coating antibody and HRP-labeled antibody

?
2.1.3 最佳封闭条件的确定
封闭的作用是用高质量浓度的无关蛋白质溶液填充酶标板孔底包被原未占据的空隙,减少非特异性吸附,提高ELISA方法准确度。以10 μg/mL的C8为包被抗体,1∶5 000稀释的8G9为酶标抗体,检测浓度为10 3~10 8CFU/mL的阪崎肠杆菌标准菌,结果如图1所示,以30 g/L的BSA和脱脂乳粉水溶液封闭后,OD 450 nm值相差并不大,均能达到防止非特异性吸附的目的,BSA较脱脂乳粉成本高,故选择30 g/L的脱脂乳粉为最佳封闭物。封闭1 h与2 h的检测灵敏度相当,故选择37 ℃,封闭1 h做为最佳封闭时间。

图1 BSA、脱脂乳粉及不同封闭时间对ELISA检测结果的影响
Fig. 1 Effect of BSA, skim milk powder and different blocking times on ELISA detection results
2.2 阪崎肠杆菌双抗体夹心ELISA试剂盒的性能测试
2.2.1 灵敏度及定量分析结果
用试剂盒检测10 3~10 8CFU/mL的阪崎肠杆菌标准菌,绘制标准曲线如图2所示,线性回归方程为Y=0.186 8x-0.402 9,相关系数R²为0.979 1,结果显示双抗体夹心ELISA试剂盒的最低检测限为10 4CFU/mL,方法的线性检测范围为10 4~10 8CFU/mL,如图2角图所示,R²为0.993 7,显示了高度的线性相关性。当抗原浓度低于10 4CFU/mL时,实验数据线性拟合效果不好,需对样品进一步增菌后建立拟合曲线。本研究建立的定量分析方法只能确定样品经过前增菌后的细菌的量,对于需要确定增菌前样品中细菌含量的检测,还需要借助国标规定的微生物学检测方法。
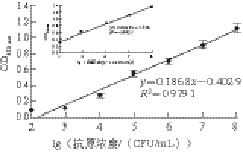
图2 双抗体夹心ELISA试剂盒灵敏度检测结果
Fig. 2 Sensitivity of the double-antibody sandwich ELISA kit
2.2.2 特异性实验结果
特异性分析选用了3 株阪崎肠杆菌和9 株其他常见食源性致病菌,用试剂盒测定其浓度为10 8CFU/mL时相应的OD 450 nm值,OD 450 nm值越低,特异性越强。结果如图3所示,阪崎肠杆菌(023、024、025)均可检出,其他9 种常见食源性致病菌均显示阴性,表明该试剂盒具有较好的特异性。
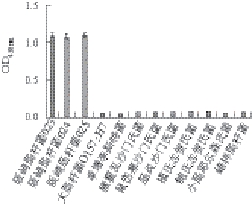
图3 双抗体夹心ELISA试剂盒特异性检测结果
Fig. 3 Specificity of the double-antibody sandwich ELISA kit
2.2.3 精密度实验结果
用6 批试剂盒检测3 个浓度的标准菌,测定OD 450 nm值,结果如表4所示,批内和批间变异系数均小于6%,说明该试剂盒的精密度较好。
表4 双抗体夹心ELISA试剂盒精密度检测结果(n==66)
Table 4 Pre n==66))

?
2.2.4 稳定性实验结果
用阪崎肠杆菌ELISA试剂盒分别于0、1、2、3、4、5、6月时测定10 5CFU/mL的阪崎肠杆菌标准菌,结果如图4所示,6 个月中试剂盒检测10 5CFU/mL的阪崎肠杆菌标准菌的平均OD 450 nm值为0.448,标准偏差为0.017,变异系数为3.79,说明试剂盒稳定性良好,保质期至少为6 个月。

图4 双抗体夹心ELISA试剂盒稳定性检测结果
Fig. 4 Stability of the double-antibody sandwich ELISA kit
2.3 模拟带菌实验结果
为了进一步确定该试剂盒的可行性,选择3 种不同品牌的乳粉进行检测,与此同时,将3 种乳粉添加目标菌后再检测。结果显示3 种不同品牌的乳粉,经培养后无阪崎肠杆菌检出。添加阪崎肠杆菌后,经过8 h培养后均可检出,如图5所示。经过前增菌后试剂盒的灵敏度提高到1 CFU/mL,即含有1 CFU/mL阪崎肠杆菌的乳粉样品经8 h培养可检出。初步证明该试剂盒可用于乳粉中阪崎肠杆菌的快速检测。

图5 模拟样品的检测结果
Fig. 5 Results of detection of spiked samples with the double-antibody sandwich ELISA kit
本研究以2 株抗阪崎肠杆菌的单克隆抗体为前提,建立了检测阪崎肠杆菌的双抗体夹心ELISA方法,并优化了ELISA的反应条件。在最佳优化条件的基础上组装了ELISA试剂盒,该试剂盒的检测限为10 4CFU/mL,与几种常见食源性致病菌均无交叉反应,批内、批间变异系数均小于6%。用该试剂盒检测3 种模拟带菌乳粉样品,初始目的菌浓度为1 CFU/mL的3 种样品经过8 h培养后均可检出。该试剂盒灵敏度高、特异性好、精密度高、稳定性好,至少可在室温保存6 个月,增菌后2 h内便可出检测结果且无需特殊设备,成本低廉,不仅为重大食源性致病菌的诊断治疗和流行病学调查提供强有力的技术手段,而且有潜力填补目前国内外市场上检测阪崎肠杆菌试剂盒的空白,具有较强的实际应用价值和良好的应用前景。
参考文献:
[1] KANDHAI M, HEUVELINK A, REIJ M, et al. A study into the occurrence of Cronobacter spp. in the Netherlands between 2001 and 2005[J]. Food Control, 2010, 21(8): 1127-1136. DOI:10.1016/ J.FOODCONT.2010.01.007.
[2] HEALY B, COONEY S, O’BRIEN S, et al. Cronobacter (Enterobacter sakazakii): an opportunistic foodborne pathogen[J]. Foodborne Pathogens and Disease, 2010, 7(4): 339-350. DOI:10.1089/fpd.2009.0379.
[3] 李艳娟, 李朝旭, 房新平, 等. 婴幼儿乳粉中阪崎肠杆菌污染防控及检验技术的研究进展[J]. 中国乳品工业, 2015, 43(5): 38-42. DOI:10.3969/j.issn.1001-2230.2015.05.009.
[4] MICROORGANISMS I F. Microorganisms in foods v. 7: Microbiological testing in food saf ety management[M]. Kluwer Academic/Plenum Publishers, 2002.
[5] FAO/WHO. Enterobacter sakazakii (Cronobacter spp.) in powdered follow-up formulae[C]//Microbiological risk assessment series No. 15. Room. FAO and WHO meeting, Washingtom DC, USA, 2008: 15-18.
[6] 韩伟, 顾鸣, 杨捷琳. 建立一种快速检测坂歧肠杆菌的方法[J]. 食品科学, 2006, 27(2): 208-212. DOI:10.3321/j.issn:1002-6630.2006.02.046.
[7] HU X, DOU W, ZHAO G. Electrochemical immunosensor for Enterobacter sakazakii detection based on electrochemically reduced graphene oxide-gold nanoparticle/ionic liquid modified electrode[J]. Journal of E lectroanalytical Chemistry, 2015, 756: 43-48. DOI:10.1016/j.jelechem.2015.08.009.
[8] HU X, DOU W, FU L, et al. A disposab le immunosensor for Enterobacter sakazakii based on an electrochemically reduced graphene oxide-modifi ed electrode[J]. Analytical Biochemistry, 2013, 434(2): 218-220. DOI:10.1016/j.ab.2012.11.013.
[9] DOU W, TANG W, ZHAO G. A disposable electrochemical immunosensor arrays using 4-channel screen-printed carbon electrode for simultaneous detection of Escherichia coli O157:H7 and Enterobacter sakazakii[J]. Electrochimica Acta, 2013, 97: 79-85. DOI:10.1016/j.electacta.2013.02.136.
[10] 封莉, 黄继超, 刘欣, 等. 食源性致病菌快速检测技术研究进展[J].食品科学, 2012, 33(21): 332-339.
[11] FOOD U, ADMINISTRATION D. Isolation and enumeration of Enterobac ter sakazakii from dehydrated powdered infant formula[M]//Bacteriological analytical manual. 8th ed. AOAC International, Gaithersburg, Md. 2002.
[12] IVERSEN C, FORSYTHE S. Isolation of Enterobacter sakazakii and other Enterobacteriaceae from powdered infant formula milk and related products[J]. Food Microbiology, 2004, 21(6): 771-777. DOI:10.1016/j.fm.2004.01.009.
[13] QIMING C, TINGTING T, XIAOMEI B, et al. Mining for sensitive and reliable species-specific primers for PCR for detection o f Cronobacter sakazakii by a bioinformatics approach[J]. Journal of Dairy Science, 2015, 98(8): 5091-5101. DOI:10.3168/jds.2015-9304.
[14] WANG X, ZHU C, XU X, et al. Real-time PCR with internal amplification control for the detection of Cronobacter spp. (Enterobacter sakazakii) in food samples[J]. Food Control, 2012, 25(1): 144-149. DOI:10. 1016/j.foodcont.2011.10.037.
[15] ZHAO Y, ZHANG X, ZHANG H, et al. Rapid and sensitive detection of Enterobacter sakazakii by cross-priming amplification combined with immuno-blotting analysis[J]. Molecular and Cellular Pr obes, 2010, 24(6): 396-400. DOI:10.1016/j.mcp.2010.09.001.
[16] RUAN J, LI M, LIU Y P, et al. Rapid and sensitive detection of Cronobacter spp. (previously Enterobacter sakazakii) in food by duplex PCR combined with capillary electrophoresis-laser-induced fl uore scence detector[J]. Journal of Chromatography B, 2013, 921: 15-20. DOI:10.1016/j.jchromb.2013.01.008.
[17] NIESSEN L, LUO J, DENSCHLAG C, et al. The application of loopmediated isothermal amplifi cation (LAMP) in food testing for bacter ial pathogens and fungal contaminants[J]. Food Microbiology, 2013, 36(2): 191-206. DOI:10.1016/j.fm.2013.04.017.
[18] USHARANI J, NAGALEEKAR V K, THOMAS P, et al. Development of a recombinant flagellin based ELISA for the detection of Clostridium chauvoei[J]. Anaerobe, 2015, 33: 48-54. DOI:10.1016/ j.anaerobe.2015.02.001.
[19] DESINGU P, SINGH S, DHAMA K, et al. Development of slide ELISA (SELISA) for detection of four poultry viral pathogens by direct heat fi xation of viruses on glass slides[J]. Journal of Virological Methods, 2014, 209: 76-81. DOI:1 0.1016/j.jviromet.2014.08.010.
[20] SHI Q, SONG C, ZHAO S, et al. A new spot quality control for protein macroarray based on immunological detection[J]. Talanta, 2015, 138: 176-182. DOI:10.1016/j.talanta.2015.01.036.
[21] 马卫静, 李克生, 杜惠芬, 等. 抗阪崎肠杆菌 LPS单克隆抗体的制备及初步应用[J]. 中国预防兽医学报, 2013, 35(2): 155-159. DOI:10.3969/j.issn.1008-0589.2013.02.18.
[22] 周鹤峰, 邵敏, 李长福, 等. 检测阪崎肠杆菌间接ELISA方法的建立[J]. 中国乳品工业, 2013, 41(1): 51-54. DOI:10.3969/ j.issn.1001-2230.2013.01.013.
[23] 汪琳, 李勐伟, 刑佑尚, 等. 阪崎肠杆菌单克隆抗体制备及ELISA检测方法的建立[J]. 中国畜牧兽医, 2013(12): 52-55.
[24] PAN Y J, FANG H C, YANG H C, et al. Capsular polysaccharide synthesis regions in Klebsiella pneumoniae serotype K57 and a new capsular serotype[J]. Journal of Clinical Microbiology, 2008, 46(7): 2231-2240. DOI:10.1128/JCM.01716-07.
Development of a Test Kit for Rapid Detection of Enterobacter sakazakii Contamination in Milk Powder
SONG Chunmei, ZHU Zhenghui, LI Jianwu, LIU Qing
*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Purpose: To develop a rapid detection kit for Enterobacter sakazakii contamination in milk powder. Methods: A double-antibody sandwich ELISA assay was developed using two monoclonal antibodies against E. sakazakii as the capture antibody and detection antibody, respectively. A test kit that could show a color reaction within 2 h was developed through the optimization of the ELISA reaction. Results: The optimum working concentration of the capture antibody was 10 μg/mL and the optimum dilution of the detection antibody was 1:5 000. The limit of detection (LOD) of the kit was 10 4CFU/mL and a linear relationship between OD 450 nmvalues and the lg values of E. sakazakii concentration was observed in the range of 10 4–10 8CFU/mL. In specifi city test, three reference strains of E. sakazakii could be detected by the kit whereas other nine strains of common foodborne pathogens were detected as negative. The LOD of the kit was substantially improved to 1 CFU/mL of the original bacterial content after pre-incubation of model samples in broth for 8 h. Both the intra-assay and inter-assay coeffi cients of variation of the kit were lower than 6%. It could be stored at room temperature for at least six months. Conclusions: The established double-antibody sandwich ELISA kit is suitable for the rapid detection of E. sakazakii in milk powder with high sensitivity, high specifi city, high precision and strong stability.
Key words:double-antibody sandwich; ELISA kit; sensitive; rapid assay; pathogenic bacteria
DOI:10.7506/spkx1002-6630-201624037
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)24-0233-06
引文格式:
宋春美, 朱政辉, 李建武, 等. 乳粉中阪崎肠杆菌污染检测试剂盒的研制[J]. 食品科学, 2016, 37(24): 233-238. DOI:10.7506/spkx1002-6630-201624037. http://www.spkx.net.cn
SONG Chunmei, ZHU Zhenghui, LI Jianwu, et al. Development of a test kit for rapid detection of Enterobacter sakazakii contamination in milk powder[J]. Food Science, 2016, 37(24): 233-238. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201624037. http://www.spkx.net.cn
收稿日期:2016-03-02
基金项目:上海市“科技创新行动计划”长三角科技联合攻关领域项目;中国博士后基金项目(2015M581637);2016年度上海理工大学国家级项目培育基金项目(16HJPY-QN09)
作者简介:宋春美(1985—),女,讲师,博士,研究方向为食品安全快速检测技术。E-mail:zhiya007@qq.com
*通信作者:刘箐(1970—),男,教授,博士,研究方向为食品安全快速检测技术。E-mail:liuq@usst.edu.cn