表1 MQCA的多反应监测条件
Table 1 Conditions of multiple reaction monitoring for MQCA
注:*.定量离子。
?
李佩佩 1,2,张小军 1,2,*,严忠雍 1,2,陈 思 1,2,伦丽丽 3,高学慧 1,4,刘文静 1,4
(1.浙江省海洋水产研究所,浙江 舟山 316021;2.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江 舟山316021;3.江苏美正生物科技有限公司,江苏 无锡 214135;4.浙江海洋大学食品与医药学院,浙江 舟山 316021)
摘 要::将特异性强的免疫亲和柱应用到3-甲基-喹噁啉-2-羧酸(methyl-3-quinoxaline-2-carboxylic acid,MQCA)的净化中,建立鱼虾中MQCA的免疫亲和柱净化-超高效液相色谱-串联质谱的快速分析方法。匀质好的样品经2 mol/L盐酸溶液酸解后,将提取液pH值调节至7~8,经过免疫亲和柱富集和净化后,采用超高效液相色谱-串联质谱测定,外标法定量。以甲醇-0.1%甲酸溶液为流动相,梯度洗脱分离,电喷雾正离子多反应监测模式监测。结果显示,水产品中MQCA在1.0~50.0 ng/mL范围内呈良好线性,线性相关系数大于0.995,定量限为1.0 μg/kg。MQCA在1.0、5.0 μg/kg和20.0 μg/kg 3 种添加水平条件下的加标回收率为74.2%~86.5%,相对标准偏差小于10%。结果表明本方法重复性好、灵敏度高,适合水产品中MQCA的实际测定。
关键词:免疫亲和柱;超高效液相色谱-串联质谱;鱼虾;3-甲基-喹噁啉-2-羧酸
喹噁林类药物喹乙醇具有广谱抗菌、促进动物生长的作用,曾被广泛用于畜禽和水产养殖业。研究表明喹乙醇对大多数动物有明显的致畸作用,对人也有潜在致畸形、致突变、致癌作用 [1]。欧盟于1998年就已经禁止使用喹乙醇 [2],中国农业部168号公告中禁止喹乙醇用于家禽及水产养殖 [3]。然而由于喹乙醇价廉和使用方便,目前仍有违法添加的现象。喹乙醇本身不稳定,在体内代谢迅速,3-甲基-喹噁啉-2-羧酸(methyl-3-quinoxaline-2-carboxylic acid,MQCA)是其主要代谢产物,在体内滞留时间长,含量与总残留关系稳定,被规定为喹乙醇的残留标识物 [4]。实验证明MQCA同时也是喹烯酮、乙酰甲喹的代谢产物 [5-6],因此对于MQCA的定量测定对于监控喹乙醇、喹烯酮和乙酰甲喹等喹噁林类药物的使用具有重要意义。
目前水产品中MQCA的检测主要采用高效液相色谱法 [7-12]和高效液相色谱-串联质谱法 [13-19]。液相色谱-串联质谱技术因其定性准确、灵敏度高等优势而被广泛采用。鱼虾中干扰物质较多,样品前处理中提取后的样品需要经过净化浓缩步骤以尽量降低基质效应影响,固相萃取是MQCA最常用的净化方式 [13-17,19]。根据MQCA的化学结构和性质,常采用HLB柱 [13]和阴离子交换柱(MAX柱) [14]净化样品。HLB为通用性柱子,针对性不强,样品净化效果不理想;MAX柱淋洗液组成略复杂,且至少需要10 mL洗脱液才能将MQCA充分洗脱 [10];免疫亲和柱是一种基于抗原抗体反应的新型层析柱,利用生物大分子具有对一类生物大分子特异识别和可逆结合的特性制作而成,具有特异性强、富集率高和净化效能好的优势,对目标物质的吸附和净化具有独特的专一性。已成功应用于黄曲霉毒素 [20-21]、玉米赤霉醇类化合物 [22-23]、河豚毒素 [24-25]等物质的净化和富集中,而目前鲜见采用免疫亲和柱作为净化手段检测水产品中MQCA的文献报道。本研究成功建立免疫亲和柱净化、超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)检测鱼和虾肉中MQCA残留量的方法。方法基质干扰低、特异性强、重复性、回收率均较好,操作简便,适合于实际样品的检测。
1.1 材料与试剂
实验所用的水产品为草鱼(Ctenopharyngodon idellus)、大黄鱼(Larimichthys crocea)和对虾(Penaeus orientalis),均购自浙江省舟山市东河市场。按照SC/T 3016—2004《水产品抽样方法》的规定处理后作为检测样品。实验中所有阴性样本均通过农业部1077号公告-5-2008《水产品中喹乙醇代谢物残留量的测定高效液相色谱法》验证不含MQCA。
MQCA标准品(纯度≥98.0%) 德国Dr. Ehrenstorfer公司;甲醇、乙腈(均为色谱纯) 德国Merck公司;甲酸(分析纯) 美国Sigma公司;乙酸、盐酸、Na 2HPO 4•12H 2O、NaH 2PO 4•2H 2O、NaCl、NaOH(均为分析纯) 国药集团化学试剂有限公司;实验用水为Milli-Q制备超纯水(电阻率≥18.2 MΩ·cm)。
1.2 仪器与设备
Acquity TMUPLC仪、Quattro Premier XE串联四极杆质谱仪、HLB固相萃取柱(60 mg/3 mL)、MAX混合型阴离子交换柱(60 mg/3 mL) 美国Waters公司;MS2旋涡混合器 德国IK公司;Centrifuge 5810高速离心机 德国Eppendorf公司;N-EVAP112氮吹仪美国Organomation公司;12通道固相萃取装置 美国Supelco公司;FG2型pH计 梅特勒-托利多国际贸易(上海)有限公司;MQCA免疫亲和柱(柱容量1 mL)北京华安麦科生物技术有限公司。
1.3 方法
1.3.1 溶液的配制
MQCA标准溶液:准确称取5.00 mg MQCA标准品,用甲醇溶解并定容至50 mL,溶液质量浓度为100 μg/mL,-20 ℃避光保存。中间液和使用液用0.1%甲酸-乙腈(9∶1,V/V)溶液逐级稀释至所需质量浓度。磷酸盐缓冲液(phosphate buffered saline,PBS):分别称取Na 2HPO 4•12H 2O 6.45 g、NaH 2PO 4•2H 2O 1.09 g、NaCl 4.25 g,用水溶解并定容至500 mL。
1.3.2 样品提取
从市场上采集的样品按照SC/T 3016—2004《水产品抽样方法》的规定处理后于-18 ℃密封保存。鱼肉去皮,虾去壳,切成不大于0.5 cm×0.5 cm×0.5 cm的小块后混匀,充分匀浆,使用前先解冻。
称取已充分匀质的样品5.00 g置于50 mL具塞离心管中,加入10 mL 2 mol/L盐酸溶液,涡旋振荡2 min后置于气浴恒温振荡器中60 ℃条件下恒温酸解30 min,冷却至室温后,8 000 r/min离心5 min,移取上清液至另一个50 mL离心管中,残渣中加入10 mL 2 mol/L盐酸溶液重复提取一次,合并提取液并用超纯水定容至25 mL,混匀后用定量滤纸过滤。准确移取过滤后的提取液5 mL用4.0 mol/L NaOH溶液调pH值至7~8,待净化。
1.3.3 免疫亲和柱净化
取出免疫亲和柱,待回至室温后去掉亲和柱堵头,放出柱内保存液,将1.3.2节中得到的5 mL提取液上柱。以1 滴/2 s的速率过免疫亲和柱。上样结束后,先后用4 mL PBS和4 mL水淋洗亲和柱,挤干柱内残留液,弃去以上全部流出液,用4 mL 2%乙酸-甲醇溶液洗脱目标物。洗脱液于50℃水浴中氮气吹干,加入1 mL初始流动相溶解残渣,经0.22 μm滤膜过滤后进UPLC-MS/MS检测。
1.3.4 UPLC条件
Waters Acquity UPLC BEH C 18柱(50 mm×2.1 mm,1.7 μm);进样量10 μL;样品室温度10 ℃,柱温40 ℃;流动相:A为0.1%甲酸溶液,B为甲醇,梯度洗脱程序如下:0~3min,90%~10% A;3~4 min,10%~90% A;4~5 min,A保持90%不变;流速0.3 mL/min。
1.3.5 质谱条件
电喷雾离子源;正离子扫描模式;检测方式:多反应监测;毛细管电压3.5 kV;离子源温度120 ℃;脱溶剂气温度380 ℃;锥孔气为高纯氮气,流量50 L/h;脱溶剂气为高纯氮气,流量600 L/h。MQCA的质谱多反应监测条件如表1所示。
表1 MQCA的多反应监测条件
Table 1 Conditions of multiple reaction monitoring for MQCA
注:*.定量离子。
?
2.1 色谱条件优化
采用普通C 18柱分析MQCA易形成拖尾现象,本研究选用粒径只有1.7 μm的ACQUITY UPLC BEH C 18柱分析目标物,同时在正离子模式下加入一定的有机酸,可提高分离度和离子化效率,在优化的色谱条件下MQCA峰形尖锐,能够在6 min内完成目标物分离和色谱柱平衡。采用5.0 μg/L的MQCA标准溶液,比较了甲醇、乙腈分别作为有机相与0.1%甲酸溶液组合成流动相的效果。乙腈作为流动相时,MQCA的灵敏度略高于用甲醇作流动相,但MQCA出峰时间为1.4 min,在实际样品分析时可能会受杂质的干扰。甲醇作为流动相时目标物的出峰时间比乙腈延后0.5 min左右,峰强度增强,峰形尖锐,综合比较选择甲醇-0.1%甲酸溶液作为流动相。
2.2 质谱条件优化
根据MQCA的化学结构,在正离子扫描模式下用蠕动泵以5.0 μg/mL的MQCA标准溶液进行流动注射分析,对质谱参数进行优化。通过一级质谱全扫描分析,确定MQCA的分子离子,调试选择最佳锥孔电压和毛细管电压,其中[M+H] +(m/z 188.9)丰度最高,因此选择离子m/z 188.9作为母离子。继续对分析物离子进行二级质谱分析,获取碎片离子信息,并对碰撞能量等质谱参数进行优化,选择最强和次强的2 个离子分别作为定量离子和定性离子。最终确定的质谱参数见表1。
2.3 提取方法选择
MQCA分子结构中含有羧基,为弱酸性物质,极性相对较高,与蛋白结合紧密,因此提取前需要将蛋白水解以释放MQCA。MQCA常用的水解方式包括酶解 [19]、酸解 [10,13-14,26-27]和碱解 [28]。酶解虽然条件温和,但需要16 h,且酶解后还需要加入一定量的酸灭活蛋白酶,步骤繁琐;强碱可有效水解蛋白质,大大降低提取液中的杂质成分,提高后续净化效果 [28],但碱水解通常反应较为剧烈,会造成少量MQCA 降解,且反应后需要调节pH值至酸性 [27]。研究表明采用2 mol/L盐酸溶液水解MQCA的反应较碱水解温和,提取后过固相萃取柱净化的方法回收率高、基质干扰少 [10,13-14]。根据免疫亲和柱对上柱液的要求和实验的简便性,采用2 mol/L盐酸溶液水解和提取加入一定量MQCA后的样品。实验发现提取2 次时MQCA的回收率比提取一次平均提高20%,因此选择重复提取MQCA,可保证MQCA的提取效率,同时避免使用有机试剂,缩短操作时间,简化实验步骤。
2.4 免疫亲和柱条件优化
2.4.1 洗脱液类型和洗脱体积的选择
实验中先用4 mL PBS淋洗除去内源性杂质,因PBS为非挥发性盐,会损害质谱,因此再用4 mL水淋洗除去PBS。比较了1%氨水-甲醇溶液、1%乙酸-甲醇溶液和2%乙酸-甲醇溶液3 个不同pH值的洗脱液的洗脱效果。分别向3 个装有等量PBS的离心管中添加20 ng的MQCA标准品,经过免疫亲和柱上样、淋洗步骤后,分别持续加入5.0 mL 3 种洗脱液进行洗脱,用离心管每1 mL收集1 管流出液。收集完毕后氮吹、流动相定容并上机检测MQCA含量。3 种洗脱液对MQCA的洗脱曲线见图1。结果表明3 种洗脱液对MQCA的洗脱回收率相差无几,其中,2%乙酸-甲醇溶液洗脱速率高于1%乙酸-甲醇溶液;4 mL 2%乙酸-甲醇洗脱液中检测不到MQCA,1%乙酸-甲醇溶液洗脱液则需要5 mL才能将MQCA完全洗脱;1%氨水-甲醇溶液的洗脱速率和2%乙酸-甲醇溶液一致,但考虑到上机流动相也为酸性,为保持MQCA溶解环境的一致性,选择2%乙酸-甲醇溶液洗脱目标物,同时为确保目标物收集完全,洗脱液收集体积选择4 mL。

图1 不同洗脱液和洗脱体积对MQCA的洗脱影响
Fig. 1 Effect of different elution solvents and elution volumes on the elution efficiency of MQCA
2.4.2 不同固相萃取柱净化效果比较
水产品中MQCA提取液净化常用到的固相萃取柱为HLB柱和MAX柱。实验比较了免疫亲和柱与其他2 种固相萃取柱对大黄鱼样品的净化和MQCA的回收效果。将阴性加标样品经盐酸溶液提取和酸解后分别根据3 种柱子的不同性质进行下一步的净化实验,最后上机检测。比较了经3 种柱子净化后MQCA的回收率和基质效应。结果表明采用免疫亲和柱和HLB柱净化后MQCA的回收率明显高于MAX柱。阴性大黄鱼加标样品经HLB柱和免疫亲和柱净化后,采用免疫亲和柱净化MQCA的回收率略高于HLB柱,分别对采用HLB柱和免疫亲和柱净化后的样品进行基质效应评估。HLB柱总体的基质效应为78%~125%,大于免疫亲和柱总体的基质效应(95%~112%),见图2。
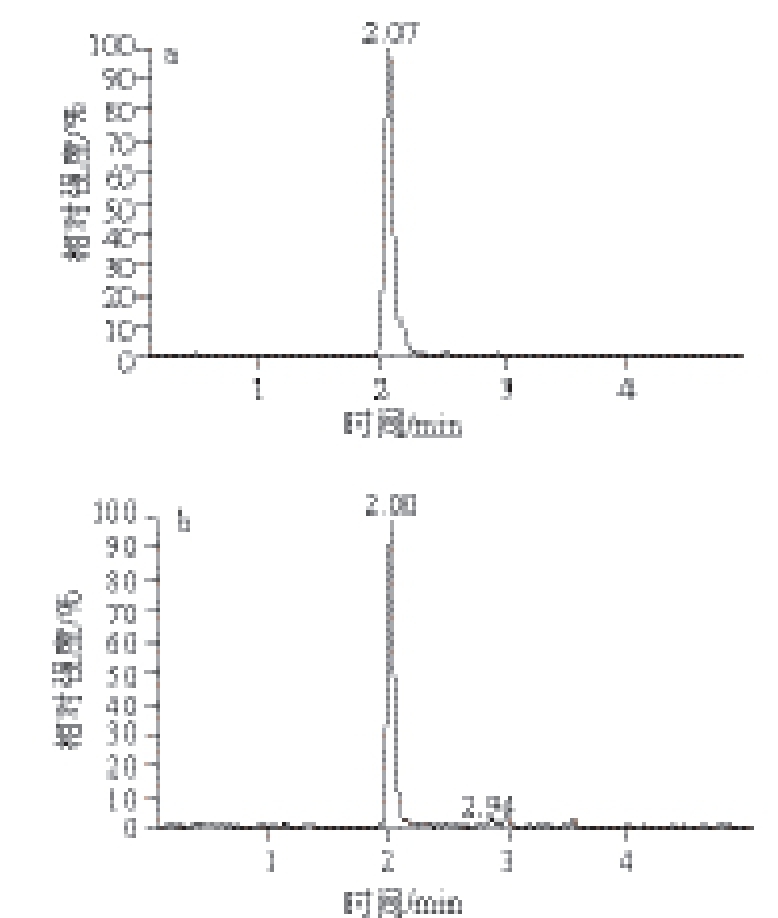
图2 20 ng/mL MQCA标准品(a)和20μgg/kg阴性大黄鱼加标样品经免疫亲和柱净化后(b)的多反应监测图
Fig. 2 MRM chromatograms of MQCA standard solution at 20 ng/mL and spiked large yellow croake sample at 20 μgg/kg cleaned up by IAC
2.4.3 基质效应评估
参照Matuszewski等 [29]建立的方法考察基质效应的影响,选择脂肪含量低的草鱼、脂肪含量高的大黄鱼和色素含量高的南美白对虾作为代表性的水产品,每种水产品做3 个平行样,分别测定MQCA标准品溶液的色谱峰面积(S 1)和空白样品基质提取液添加标准溶液后的色谱峰面积(S 2),以比值S 1/S 2来评价绝对基质效应。实验结果显示草鱼中MQCA的基质效应为95%~105%;大黄鱼中MQCA的基质效应为98%~112%;南美白对虾中基质效应为96%~107%。总体的基质效应为95%~112%,波动范围在±15%以内,在可以接受的范围内。表明免疫亲和柱的净化效果好,基质效应小。本实验标准曲线采用溶剂外标法定量,未采用基质匹配。
2.5 线性范围和检出限
经实验测试,MQCA免疫亲和柱的柱容量为150 ng。用MQCA标准使用溶液配制质量浓度为1.0、2.0、5.0、10.0、20.0、50.0 ng/mL的标准溶液。以定量离子的峰面积对质量浓度进行线性回归。在1.0~50 ng/mL质量浓度范围内回归方程为y=200.074x-14.352 3,线性范围良好,相关系数均大于0.995。如图3所示,以3 倍信噪比确定本方法的检出限为0.4 μg/kg,以10 倍信噪比确定本方法的定量限为1.0 μg/kg。本方法中MQCA的定量限低于大多数其他文献中用液相色谱-质谱法测定MQCA的定量限,远低于我国农业部规定的肌肉中MQCA的最大残留限量(4.0 μg/kg)。
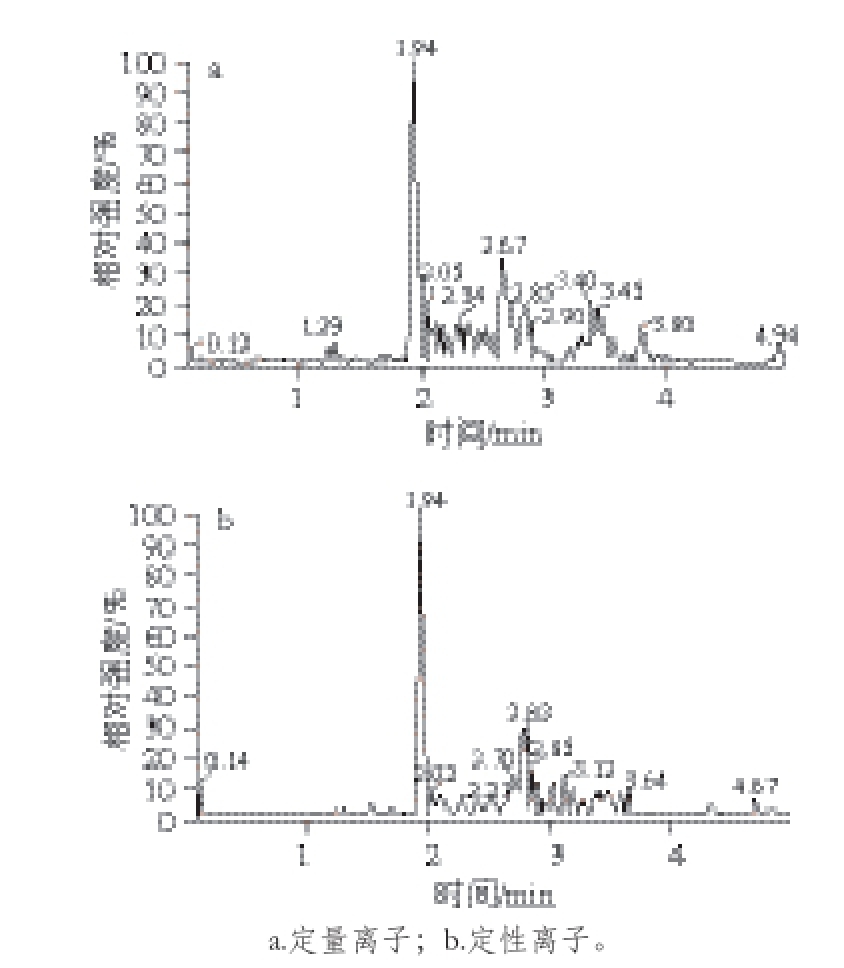
图3 阴性大黄鱼样品定量限加标多反应监测图
Fig. 3 MRM chromatograms of large yellow croaker sample spiked at a level equal to the LOQ
2.6 方法回收率和精密度
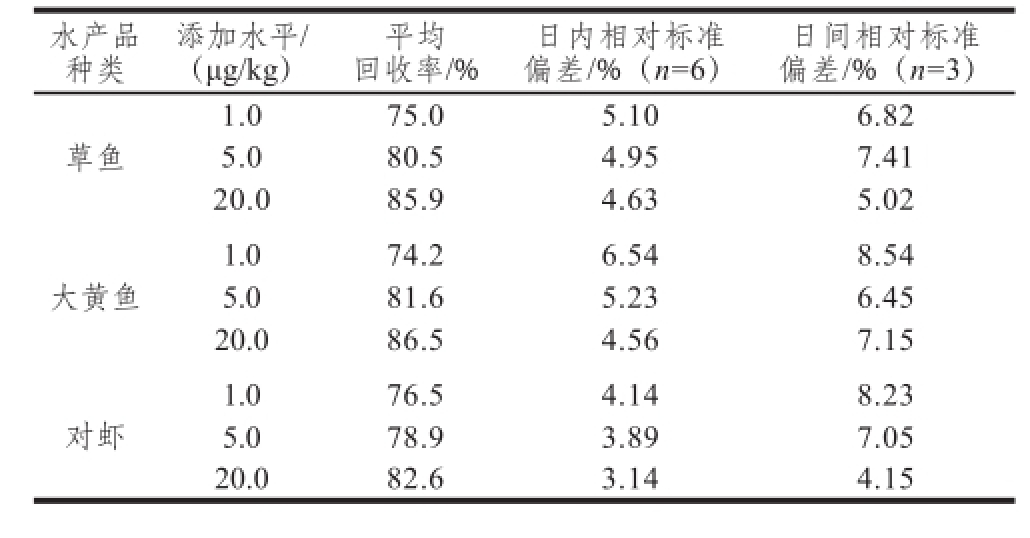
分别准确称取经验证不含MQCA的草鱼、大黄鱼、对虾肉(5±0.02)g,分别添加3 个不同质量浓度的MQCA标准溶液,使得添加后的3 种样品中MQCA含量分别为1.0、5.0、20.0 μg/kg,每个添加水平按照本方法重复测定6 次,连续测定3 d,计算加标回收率、日内精密度和日间精密度。如表2所示,MQCA在1.0、5.0、20.0 μg/kg 3 个添加水平条件下和3 种样品基质中的平均回收率为74.2%~86.5%,相对标准偏差为3.14%~6.54%。
表2 MQCA的加标回收率和精密度实验
Table 2 Recoveries and precision (RSDs) of MQCA from spiked fish and shrimp samples
?
2.7 实际样品分析
根据历年对水产品中MQCA的常规监测结果,淡水鱼中MQCA的检出率较高。采用本方法对2015年农业部风险监测项目中包括草鱼、鲤鱼、鲫鱼等不同种类共200 个淡水鱼样品中MQCA的残留量进行检测。200 个样品中未检出MQCA。同时抽取部分样品用农业部1077号公告-5-2008《水产品中喹乙醇代谢物残留量的测定 高效液相色谱法》规定的方法和文献报道的HLB柱或MAX柱净化-UPLC-MS/MS法进行检测,与使用本方法的检测结果一致。
本研究利用免疫亲和柱高特异性和净化效果好的优点,通过研究与免疫亲和柱适宜的样品提取方法、上柱液类型、淋洗液组成、洗脱液类型,UPLC-MS/MS的流动相类型及组成等因素,建立了免疫亲和柱净化-UPLCMS/MS检测水产品中MQCA的方法。实验过程有机溶剂耗用量低于以往其他方法,绿色、环保、经济,且实验简便易操作,基质效应低,回收率高,结合UPLCMS/MS的高灵敏度和精密度,本方法的检出限可低至0.4 μg/kg,已成功应用于实际样品分析。
参考文献:
[1] 杨波, 陈吉红. 喹乙醇在水产动物中的应用及其安全性评价[J].兽药与饲料添加剂, 2006, 11(2): 13-17.
[2] BOSTSOGLOU N A, FLETOURIS D J. Drug pharmacology, food safety, and analysis residues in foods[M]. New York: Marcel Dekker, 2001.
[3] 农业部. 饲料药物添加剂使用规范: 农业部公告第168号[S]. 北京:中国标准出版社, 2001.
[4] 范立鹏, 段振娟, 方国臻, 等. 动物源性食品中喹恶啉类药物残留检测方法研究进展[J]. 中国食品学报, 2012, 12(9): 171-178.
[5] 黄玲利, 李娟, 王旭, 等. 喹烯酮的食品安全性研究进展[J]. 中国兽药杂志, 2013, 47(6): 56-59.
[6] 薛良辰. 喹乙醇在鲫鱼体内的消除规律及残留检测技术研究[D].广州: 华南理工大学, 2012.
[7] 全国水产标准化技术委员会水产品加工分技术委员会. 水产品中喹乙醇代谢物残留量的测定高效液相色谱法: 农业部1077号公告-5-2008[S]. 北京: 中国农业出版社, 2008.
[8] 梅景良, 吴聪明, 程林丽, 等. HPLC法同步检测鲤鱼、对虾中喹乙醇与MQCA残留[J]. 海洋科学, 2011, 35(11): 41-46.
[9] 吴玉杰, 陈冬梅, 陶燕飞, 等. 高效液相色谱法测定动物组织中3-甲基喹噁林-2-羧酸残留量[J]. 分析科学学报, 2009, 25(4): 427-430.
[10] 贝亦江, 王扬, 何丰, 等. 高效液相色谱法测定水产品中喹乙醇代谢物残留量[J]. 食品科学, 2013, 34(10): 255-258. DOI:10.7506/ spkx1002-6630-201310056.
[11] WU Yujie, YU Huan, WANG Yulian, et al. Development of a highperformance liquid chromatography method for the simultaneous quantifi cation of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues[J]. Journal of Chromatography A, 2007, 1146(1): 1-7. DOI:10.1016/j.chroma.2006.11.024.
[12] YAO Yunshan, SHEN Jianzhong, WU Congming. Determination of 3-methylquinoxaline-2-carboxylic acid in porcine liver by high performance liquid chromatography[J]. China Animal Husbandry and Veterinary Medicine, 2011, 38(2): 187-190.
[13] 郭霞, 孙振中, 戚隽渊, 等. 南美白对虾中喹乙醇及其代谢物3-甲基喹噁林-2-羧酸残留的高效液相色谱-串联质谱检测[J]. 中国农业大学学报, 2014, 19(1): 156-160. DOI:10.11841/j.issn.1007-4333.2014.01.22.
[14] ZHANG Xiaojun, ZHENG Bin, ZHANG Hong, et al. Determination of marker residue of olaquindox in fi sh tissue by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Separation Science, 2011, 34(4): 469-474. DOI:10.1002/jssc.201000722.
[15] MEROU A, KAKLAMANOS G, THEODORIDIS G. Determination of carbadox and metabolites of carbadox and olaquindox in muscle tissue using high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography B, 2012, 881/882(1): 90-95. DOI:10.1016/j.jchromb.2011.12.007.
[16] BODI D, RINGLING C, SCHÖDEL C, et al. Investigation of matrix effects on the determination of carbadox and olaquindox in feed by LCMS/MS[J]. Chromatographia, 2013, 76(11/12): 651-662. DOI:10.1007/ s10337-013-2444-4.
[17] SNIEGOCKI T, GBYLIK-SIKORSAK M, POSYNIAK A, et al. Determination of carbadox and olaquindox metabolites in swine muscle by liquid chromatography/mass spectrometry[J]. Journal of Chromatography B, 2014, 944: 25-29. DOI:10.1016/ j.jchromb.2013.09.039.
[18] 梅光明, 郑斌, 陈雪昌, 等. 超高效液相色谱-质谱联用法测定水产品中喹乙醇代谢物残留量[J]. 浙江海洋学院学报, 2010, 29(3): 254-259. DOI:10.3969/j.issn.1008-830X.2010.03.010.
[19] 欧阳姗, 庞国芳, 谢丽琪, 等. 动物组织中卡巴氧和喹乙醇以及相关代谢产物的液相色谱-串联质谱检测方法[J]. 分析测试学报, 2008, 27(6): 590-594. DOI:10.3969/j.issn.1004-4957.2008.06.006.
[20] 牛军小, 苏军, 徐晓枫, 等. 免疫亲和柱净化-反相高效液相色谱法检测乳与乳制品中黄曲霉毒素M1[J]. 中国卫生检验杂志, 2014, 24(7): 940-945.
[21] 薛昆鹏, 郭会琴, 余冲, 等. 免疫亲和柱净化-大体积流通池高效液相色谱法同时检测食品6 种黄曲霉毒素[J]. 现代食品科技, 2015, 6(12): 5017-5022.
[22] 李贤良, 游丽娜, 郗存显, 等. 免疫亲和柱净化-液相色谱-串联质谱法同时测定猪肉中6 种玉米赤霉醇类化合物残留量[J]. 分析化学, 2013, 41(8): 1147-1152. DOI:10.3724/SP.J.1096.2013.30141.
[23] 游丽娜, 李贤良, 郗存显, 等. 免疫亲和柱净化-高效液相色谱法同时检测鸡蛋中6 种玉米赤霉醇类化合物残留量[J]. 色谱, 2012, 30(10): 1021-1025. DOI:10.3724/SP.J.1123.2012.08016.
[24] 张秀尧, 蔡欣欣, 张晓艺, 等. 免疫亲和柱净化-超高效亲水色谱-三重四极杆质谱联用法测定人尿液和血浆中河豚毒素[J]. 分析化学, 2014, 42(11): 1611-1616. DOI:10.11895/j.issn.0253-3820.140560.
[25] 严忠雍, 张小军, 李奇富, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素[J]. 分析化学, 2015, 43(2): 277-281. DOI:10.11895/j.issn.0253-3820.140704.
[26] 孙伟红, 翟毓秀, 邢丽红, 等. 喹噁啉类药物及其代谢产物在刺参体内的分析和鉴定[J]. 中国渔业质量与标准, 2015, 5(2): 49-55.
[27] 张小军, 郑斌, 陈雪昌, 等. 高效液相色谱法测定动物组织中喹乙醇标示残留物[J]. 食品科学, 2010, 31(24): 289-292.
[28] 于海霞, 张小军, 杨会成, 等. 碱水解-高效液相色谱法测定草鱼组织中喹乙醇代谢物的残留[J]. 中国渔业质量与标准, 2012, 2(1): 67-70.
[29] MATUSZEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Analytical Chemistry, 2003, 75(13): 3019-3030. DOI:10.1021/ac020361s.
Determination of Methyl-3-quinoxaline-2-carboxylic Acid in Fish and Shrimp Samples by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry with Immunoaffi nity Column Cleanup
LI Peipei
1,2, ZHANG Xiaojun
1,2,*, YAN Zhongyong
1,2, CHEN Si
1,2, LUN Lili
3, GAO Xuehui
1,4, LIU Wenjing
1,4
(1. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316021, China; 2. Key Laboratory of Sustainable Utilization of Technology Research for Fishery Resource of Zhejiang Province, Zhoushan 316021, China; 3. Jiangsu Meizheng Biotechnology Co. Ltd., Wuxi 214135, China; 4. School of Food Science and Pharmaceutics, Zhejiang Ocean University, Zhoushan 316021, China)
Abstract:A new approach for the determination of methyl-3-quinoxaline-2-carboxylic acid (MQCA) residue in fi sh and shrimp samples by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) based on immunoaffinity column (IAC) purifi cation was developed. MQCA was extracted from samples with 2 mol/L hydrochloric acid and adjusted with water to pH 7–8. After being cleaned up and concentrated by immunoaffi nity column, the analyte was analyzed by UPLCMS/MS with electrospray ionization in positive ion mode (ESI +) using multiple reaction monitoring (MRM) and quantitatively determined by an external standard method. The separation was performed on an ACQUITY UPLC BEH C 18column with a gradient system consisting of 0.1% formic acid (V/V) and methanol as the mobile phase. Good linearity in response was obtained in the concentration range of 1.0–50.0 ng/mL with correlation coeffi cients larger than 0.995. The limit of quantification (LOQ) was 1.0 μg/kg. The average recoveries of MQCA at spiked concentrations of 1.0, 5.0, and 20.0 μg/kg ranged from 74.2% to 86.5% with relative standard deviations (n = 5) less than 10%. The method is simple, fast, sensitive and reliable, and suitable for the determination of MQCA residue in fi sh and shrimp samples.
Key words:immunoaffi nity column; ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); fi sh and shrimp samples; methyl-3-quinoxaline-2-carboxylic acid (MQCA)
DOI:10.7506/spkx1002-6630-201624041
中图分类号:O657.63
文献标志码:A
文章编号:1002-6630(2016)24-0257-05
收稿日期:2016-04-19
基金项目:浙江省公益性技术研究项目(2014C32087);浙江省属科研院所专项(2016F30022)
作者简介:李佩佩(1986—),女,工程师,硕士,主要从事渔业环境监测和水产品质量安全研究。E-mail:liwanzhao999@163.com
*通信作者:张小军(1982—),男,高级工程师,博士,主要从事水产品加工与质量安全研究。E-mail:xiaojun3627@163. com
引文格式:
李佩佩, 张小军, 严忠雍, 等. 免疫亲和柱净化-超高效液相色谱-串联质谱检测鱼虾中3-甲基-喹噁啉-2-羧酸[J]. 食品科学, 2016, 37(24): 257-261. DOI:10.7506/spkx1002-6630-201624041. http://www.spkx.net.cn
LI Peipei, ZHANG Xiaojun, YAN Zhongyong, et al. Determination of methyl-3-quinoxaline-2-carboxylic acid in fi sh and shrimp samples by ultra performance liquid chromatography-tandem mass spectrometry with immunoaffi nity column cleanup[J]. Food Science, 2016, 37(24): 257-261. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201624041. http://www.spkx. net.cn