表1 果皮塌陷指数和变色指数评分标准
Table 1 Evaluation criterion of collapse and discoloration of citrus peel rind
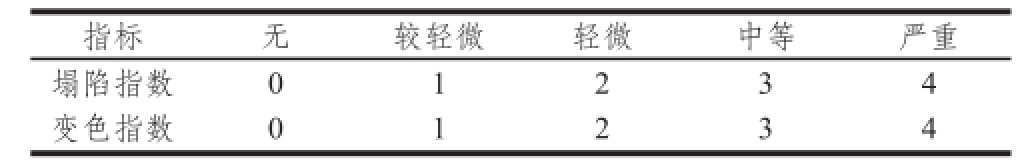
注:塌陷指数=Σ(塌陷级别×该级别果实占总果实的百分比);变色指数=Σ(变色级别×该级别果实占总果实的百分比)。
?
许佳妮,曹 琦,邓丽莉,姚世响,王威浩,曾凯芳*
(西南大学食品科学学院,重庆 400715)
摘 要::以接近成熟的低成熟度果实为实验材料,以果皮塌陷指数、变色指数以及与细胞膜相关的物质为测定指标,围绕果实膜脂降解途径展开,研究橙油处理致柑橘果实油胞病对果皮膜脂代谢的影响。结果表明,橙油处理可引起柑橘油胞病的发生,病症随贮藏时间的延长而加剧;橙油对果皮具有光毒性,细胞膜系统参与果实对油胞病的响应。橙油处理致油胞病使得磷脂酶D活性增加,磷脂酰胆碱、磷脂酰肌醇含量下降,磷脂酸含量上升,表明细胞膜水解加剧。发病早期脂氧合酶活性高于健康果实,使得果皮脂肪酸不饱和度下降,活性氧急剧产生,膜脂发生过氧化反应;过量的活性氧攻击细胞膜使得丙二醛含量和相对电导率持续上升;细胞膜结构和功能受损,从而促使油胞病发生并加剧油胞病症状。橙油致柑橘果实油胞病机制的明确为进一步研究柑橘油胞病及其防控措施提供了理论依据。
关键词:脐橙;油胞病;橙油处理;膜脂代谢
柑橘果实油胞病,又称油斑病、虎斑病、脂斑病、绿斑病,是柑橘一种常见的生理性病害,目前在我国柑橘主产区果园中均有大面积发生 [1-3]。柑橘油胞病可发生在果实生长发育期或采后贮藏运输期,不同成熟度的果实对油胞病的敏感度不同;当果实接近成熟时会出现油胞病爆发的现象 [4-5]。
油胞病发病初期果皮出现形状不规则的浅绿色或淡黄色病斑,病斑内油胞周围组织稍凹陷,油胞凸起,病健分界逐渐明显;随病症加重,病斑内油胞塌陷萎缩,病害区果皮下沉,病斑颜色由黄色加深至深褐色 [1-3,5-6]。油胞病本身仅发生在果实外表皮,影响果实外观品质而对其内在品质影响不大,因而在经济欠发达时期易受生产者和消费者的忽视。然而,随着我国经济的发展和人们生活水平的提高,消费者不仅关注果实的内在品质,也对果实的外观品质提出更高的要求。柑橘油胞病大大降低了果实的外观和商品性,造成了不容忽视的经济损失;此外,病变部位易受病原菌如青霉、绿霉等污染而引起果实腐烂,油胞病严重制约柑橘产业的可持续发展 [7]。
关于柑橘果皮油胞病发生的原因,基本确定是由于柑橘果皮在各种不利外部因素如温度、湿度、气体成分、光照以及机械损伤的影响下受损,导致油胞释放出具有光毒性的橙油而引起相应的生理病症 [3,8-9]。然而,橙油如何致使果皮发生油胞病,其作用机制目前尚不清楚;而油胞病的根本发病机制也没有得到深入的研究。多项电子显微镜观察结果表明,油胞病发病过程中柑橘果皮组织内部超微结构发生显著变化;果皮细胞膜的降解是对油胞病最早的反馈,而膜系统完整性的破坏使得细胞器和细胞壁也受到损伤,细胞受到严重的伤害甚至死亡 [1,9-11]。虽然细胞膜系统参与植物逆境响应已在许多研究中得到证实 [12-13],但关于细胞膜系统对橙油所致油胞病的响应仅停留在电子显微镜观察水平,而鲜少有系统的研究。
因此,本实验以膜脂降解途径为关注点,以接近成熟的柑橘果实作为试材,通过橙油处理使果皮发生油胞病,测定果皮不同发病阶段柑橘果实细胞膜的结构物质变化和关键酶活性变化,明确细胞膜系统对油胞病的响应机制,进一步研究油胞病的发病机制,以期为油胞病的控制提供理论指导。
1.1 材料
供试脐橙果实(Citrus sinensis L. Osbeck)采于2014年11—12月,产地为重庆北碚区,剔除病果、伤果,挑选色泽光亮、果色均匀、大小均一的新鲜果实(可溶性固形物含量为(9.30±0.36)%,可滴定酸含量为(1.01±0.04)%,固酸比为9.21±0.52,L*为75.03±2.20,a*为7.76±1.05,b*为66.49±1.39)。根据GB 12947—2008《鲜柑橘》(甜橙类果实采收时可溶性固形物含量不小于9.5%,可滴定酸含量不小于1.0%,固酸比不小于9.5),该供试果实为接近成熟的低成熟度脐橙果实。
1.2 方法
1.2.1 橙油处理致油胞病
橙油处理参照刘丽丹 [8]、Wild [14]等的方法并加改进。制备宽为2 cm的滤纸条,每1 cm 2滤纸条滴上20 μL 100%纯度的橙油,连续处理;此后,将滤纸条放在胶带上,将胶带沿果实赤道部位缠绕一圈;对照果实不进行橙油处理,将附有滤纸条的胶带沿果实赤道部位缠绕一圈。此后,用厚度为0.015 mm的聚乙烯袋将对照组果实和处理组果实进行单果包装,于20 ℃、85%~95%相对湿度条件下贮藏4 h,拆除胶带,再用聚乙烯袋单果包装后置于20 ℃、85%~95%相对湿度条件下避光贮藏。
果实分别于贮藏期间第0、2、4、12、60、132小时观察果皮塌陷指数和变色指数,并在对应时间点对果皮赤道处滤纸处理部位取样,取下的样品置于-80 ℃冰箱中用于指标的测定。每组8 个果实,重复3 次。
1.2.2 塌陷指数和褐变指数的测定
参照Knight等 [9]的评定方法进行评价,评分标准见表1。
表1 果皮塌陷指数和变色指数评分标准
Table 1 Evaluation criterion of collapse and discoloration of citrus peel rind

注:塌陷指数=Σ(塌陷级别×该级别果实占总果实的百分比);变色指数=Σ(变色级别×该级别果实占总果实的百分比)。
?
1.2.3 指标测定
1.2.3.1 磷脂酶D(phospholipase D,PLD)的提取及活力测定
参照Sirikesorn等 [15]的方法并加以改进。以每小时内将底物转为为1 nmol p-硝基苯酚的酶量定义为1 个酶活性单位(U),PLD活性单位以U/mg pro表示;重复3 次测定。
1.2.3.2 磷脂酰肌醇(phosphatidylinositol,PI)、磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酸(phosphatidic acid,PA)的提取及含量测定
PI、PC、PA的提取 [16]:称取3 g柑橘样品,加入30 mL氯仿-甲醇溶液(2∶1,V/V),超声振荡1 h,静置提取1 h,抽滤;滤液中加入8 mL饱和NaCl溶液,振荡摇匀,静止分层;将下层的氯仿层分离,用无水Na 2SO 4干燥,然后经真空旋转蒸发仪(37 ℃)浓缩至干,得到脂质。脂质溶于1 mL氯仿中,用于PI、PC含量测定。
对于PA含量的测定,所得脂质需溶于2 mL氯仿中备用,进行下一步净化。将2 mL脂质提取液倒入氨基硅胶固相萃取柱(已经过氯仿活化),依次用2 mL氯仿-异丙醇(2∶1,V/V),3 mL乙酸-乙醚混合溶液(2∶144,V/V)洗脱柱子,弃去洗脱液,用8 mL甲醇洗出磷脂并收集,经真空旋转蒸发仪(37 ℃)浓缩至干,得到脂质并溶于1 mL甲醇中。
检测条件:1)PI、PC的测定:色谱柱:YMCPack SIL-06(250 mm×4.6 mm,5 μm);进样量10 μL,柱温35 ℃,流速0.8 mL/min,测定波长205 nm。采用等度洗脱的方式,流动相为乙腈-甲醇-85%磷酸比例70∶30∶0.15(V/V)。2) PA的测定:色谱柱:YMCPack SIL-06(250 mm×4.6 mm,5 μm);进样量1 μL,柱温35℃,流速0.6 mL/min,测定波长205 nm。采用等度洗脱的方式,流动相为乙腈-甲醇体积比60∶40。
定性定量分析:实验采用以不同质量浓度的PI、PC、PA标准溶液制作标准曲线,通过保留时间进行定性,通过与标准溶液质量浓度对比进行定量,含量以mg/g表示(以鲜质量计)。
1.2.3.3 脂肪酸的测定
1)脂肪酸的提取:脂肪酸含量测定参照Bang等 [16]的方法并加以改进:称取3 g柑橘样品,加入30 mL氯仿-甲醇溶液(2∶1,V/V),超声振荡1 h,静置提取1 h,抽滤;滤液中加入8 mL饱和NaCl溶液,振荡摇匀,静止分层,下层的氯仿层即为脂肪提取液;脂肪提取液用无水Na 2SO 4干燥后,经真空旋转蒸发仪(37 ℃)浓缩,得到脂肪。
在脂肪中加入1.8 mL苯和石油醚的混合溶剂(1∶1,V/V),轻轻摇动使之溶解。再加入1.2 mL 0.4 mol/L KOH-甲醇溶液,混匀,在45 ℃水浴中反应30 min。加0.6 mL正己烷使甲酯溶于其中,最后加0.6 mL饱和NaCl溶液使全部有机相甲酯溶液上升至试管上部。澄清后吸取上清液,装入进样小瓶中,即可用于气相色谱-质谱分析。
2)检测条件:色谱柱:DB.FFAP毛细管色谱柱(30 m×0.25 mm,0.25 μm);分流比5∶1,进样量1 μL,载气氦气,流速3 mL/min,进样口和检测器的温度均为250 ℃。柱箱的升温程序为:起始温度为160 ℃,保持3 min,以4 ℃/min升到175 ℃并保持2 min,再以4 ℃/min升到185 ℃并保持2 min,最后以10 ℃/min升到230 ℃并保持3 min [17]。
3)定性定量分析:实验采用MS谱库相似度检索定性及峰面积定量分析,采取峰面积归一化法测定各脂肪酸的相对含量。
1.2.3.4 脂氧合酶(lipoxygenase,LOX)的提取及活力测定
LOX活性测定参照Barros等 [18]的方法并加以改进。以每分钟反应体系吸光度变化0.01定义为1个酶活性单位(U),LOX活性单位以U/mg pro表示;重复3 次测定。1.2.3.5 超氧阴离子自由基(O 2 -·)产生速率、H 2O 2含量的测定
O 2 -·产生速率测定参照Tian Min等 [19]的方法并加以改进,O 2 -·产生速率以nmol/(min·g)表示(以鲜质量计);重复3 次测定。
H 2O 2含量测定参照Patterson等 [20]的方法并加以改进,H 2O 2含量以μmol/g表示(以鲜质量计);重复3 次测定。
1.2.3.6 丙二醛(malonaldehyde,MDA)含量和相对电导率测定
参照曹建康 [21]、Song Lili [22]等的方法并加以改进;重复3 次测定。
1.3 数据分析
应用Excel 2010软件统计分析所有数据,计算标准误并制图;应用Excel 2010软件对数据进行t检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 橙油处理对脐橙果皮外观形态的影响
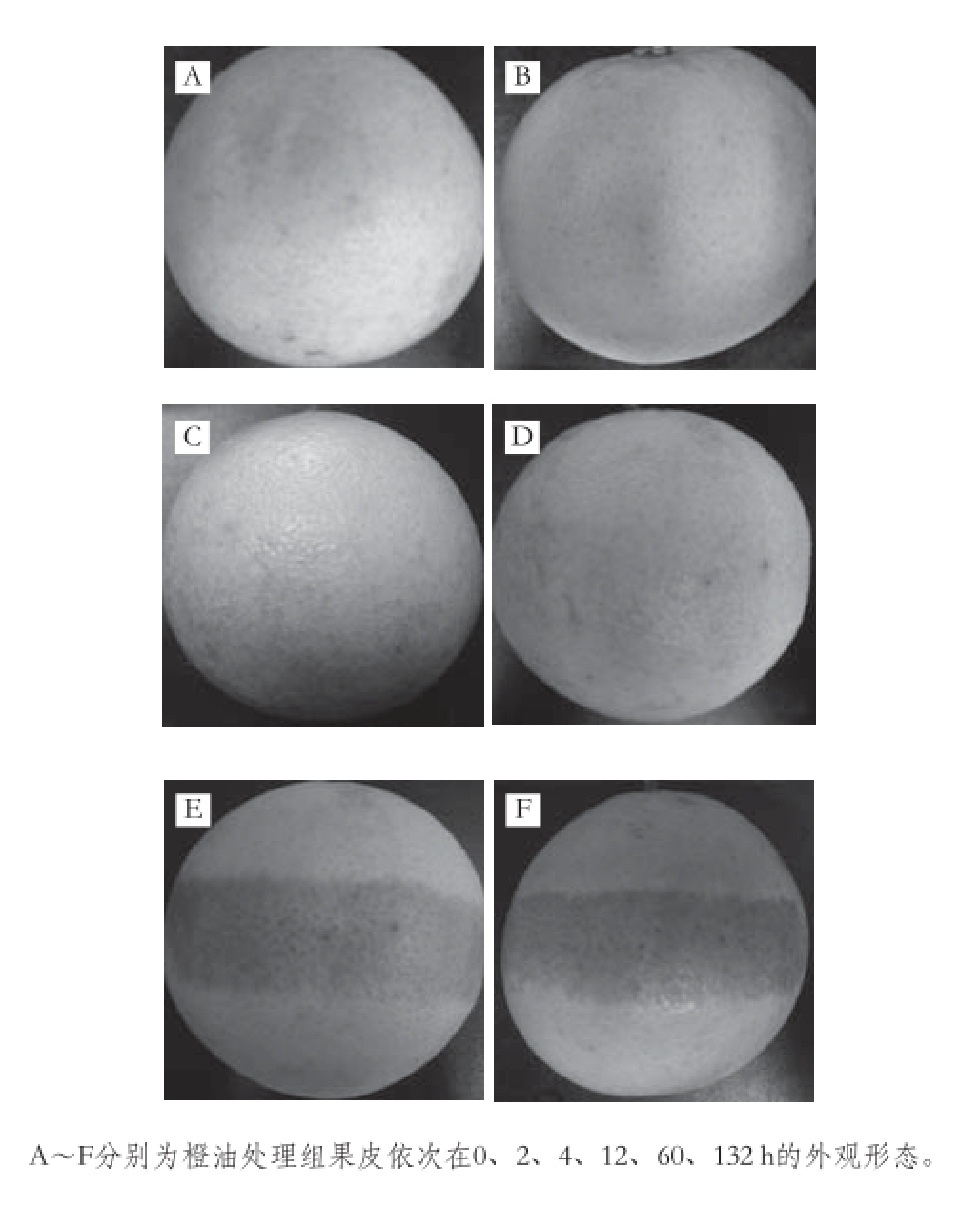
图1 橙油处理对脐橙果皮外观形态的影响
Fig. 1 Effects of oil treatment on peel appearance of Navel orange
如图1所示,橙油处理组在诱导后2 h(发病潜伏期)仍未有明显的油胞病症状;4 h(发病初期)后可观察到轻微的油胞凸出,病斑颜色尚未有明显变化;12 h(发病前期)时,发病部位呈浅黄色,油胞大量向外凸起,油胞间组织微向下凹陷,病健界限明显;60 h(发病中期)时,病斑处油胞微下陷,颜色逐渐加深;至贮藏132 h(发病后期),病斑处油胞完全塌陷,果面出现凹陷的坑体,病斑颜色加深至深褐色。
2.2 橙油处理对脐橙果皮塌陷指数和变色指数的影响
贮藏期间,对照组塌陷指数和变色指数为0,这主要是因为贮藏时间较短(132 h),果实油胞病自然发病进程缓慢,因而未观察到任何病斑。由图2可知,橙油处理组的塌陷指数随贮藏时间的延长不断增加,在贮藏132 h时达到3.33,表明橙油处理可促使果皮凹陷。橙油处理组的变色指数变化规律与塌陷指数规律一致,在132 h时达到3.47,在果皮上表现为病斑颜色不断加深。

图2 橙油处理对脐橙果皮塌陷指数(A)和变色指数(B)的影响
Fig. 2 Effects of oil treatment on rind collapse index (A) and rind discoloration index (B) of Navel orange
2.3 橙油处理对脐橙果皮细胞膜系统的影响
2.3.1 橙油处理对脐橙果皮PLD活性及PC、PI、PA含量的影响
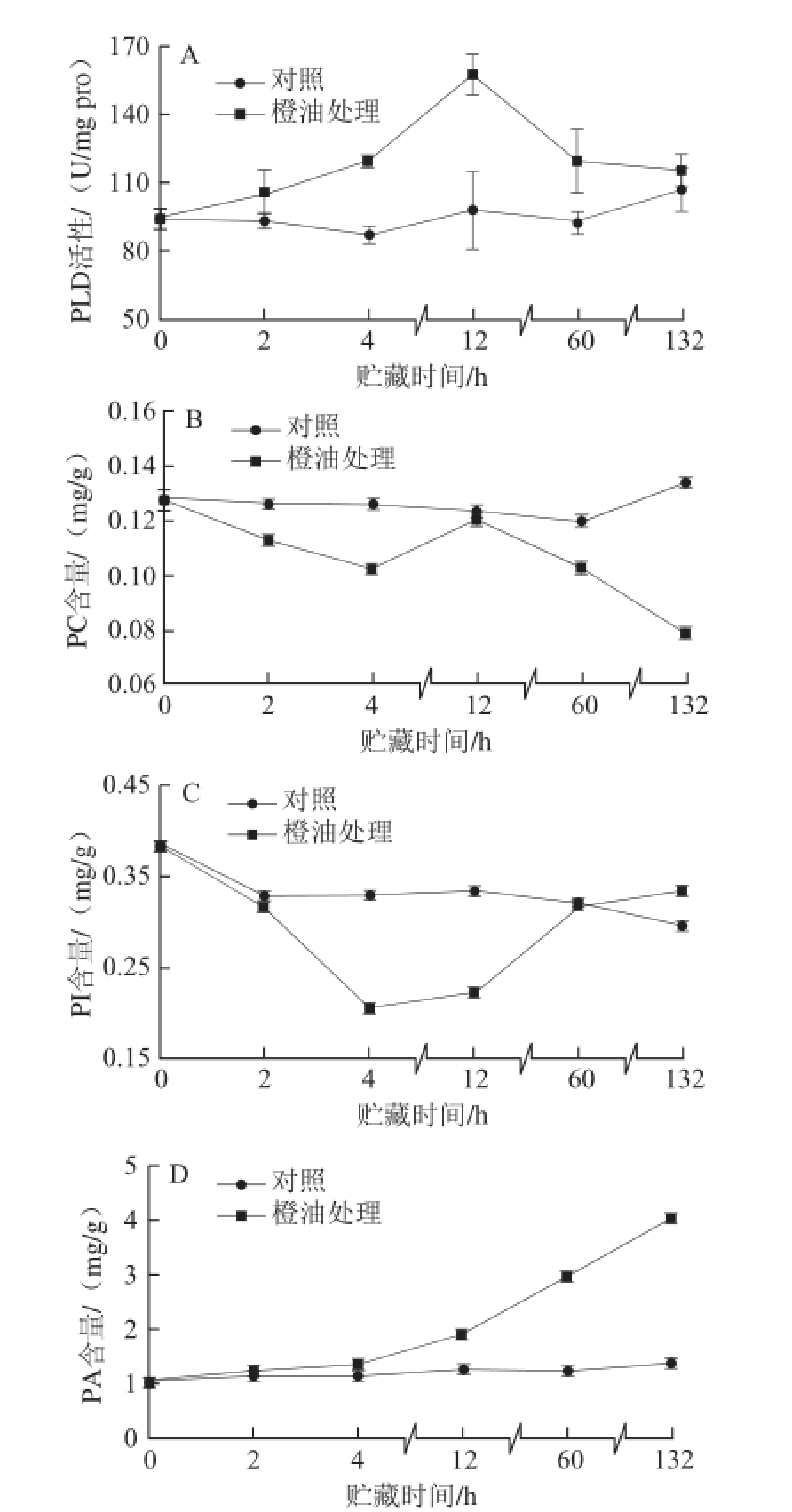
图3 橙油处理对脐橙果皮PLD活性(A)、PC含量(B)、PI含量(C)和PA含量(D)的影响
Fig. 3 Effects of oil treatment on PLD activity (A), PC content (B), PI content (C) and PA content (D) in Navel orange peel
如图3A所示,对照组PLD活性几乎保持不变,橙油处理可促使果皮PLD活性上升。橙油处理组PLD活性呈现先上升后下降的趋势;PLD活性在贮藏0~4 h缓慢上升,4~12 h急剧上升至达到峰值,12~60 h迅速下降,132 h时与对照组无显著性差异(P>0.05)。在贮藏4、12、60 h时橙油处理组PLD活性均显著高于对照组,分别为对照组的1.37、1.60、1.29 倍(P<0.05)。由此可见,当果实处于逆境胁迫时,PLD活性有所增加,细胞膜降解进程加快。
PLD活性的增强促使果实细胞膜磷脂水解加剧,其中PC是PLD的主要底物。由图3B可知,对照组在贮藏期间PC含量变化不大;而橙油处理导致果皮PC含量有所减少。橙油处理组PC含量整体呈现下降趋势,但在贮藏12 h时有所回升;除贮藏12 h外,橙油处理组PC含量均显著低于对照组(P<0.05),在132 h时是对照组的58.97%(P<0.01)。
表2 橙油处理对脐橙果皮脂肪酸相对含量的影响
Table 2 Effect of oil treatment on fatty acids of Navel orange peel %
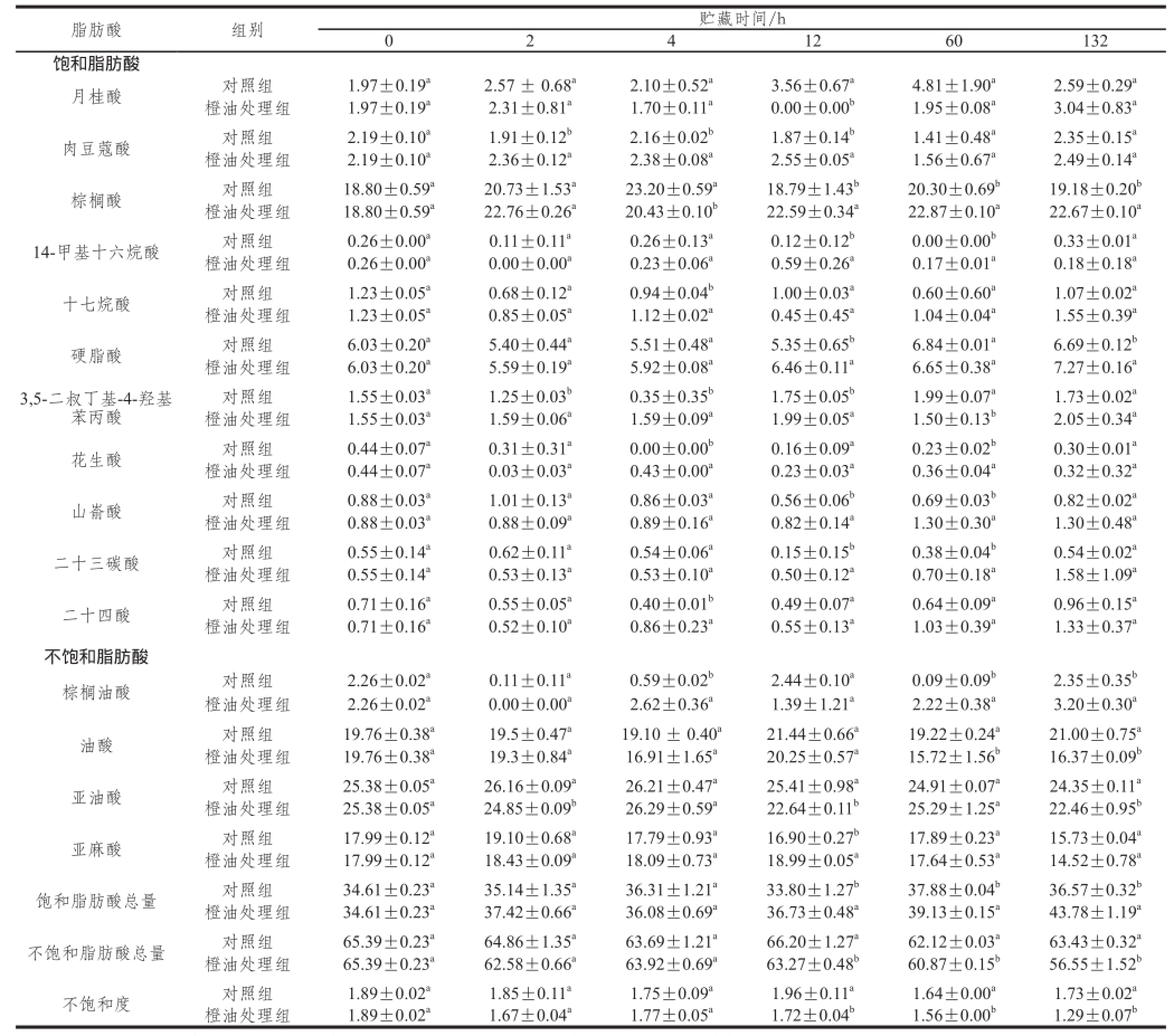
注:饱和脂肪酸总量为各饱和脂肪酸相对含量之和;不饱和脂肪酸总量为各不饱和脂肪酸相对含量之和;不饱和度=不饱和脂肪酸总量/饱和脂肪酸总量。同一指标、同一贮藏时间值肩标不同字母表示差异显著(P<0.05)。
?
PI是细胞膜磷脂组成的重要成分,橙油胁迫导致的细胞膜水解使得PI含量发生变化。由图3C可知,贮藏期间,对照组PI含量呈现较平缓的下降趋势;而橙油处理组PI含量呈现先下降后上升的趋势。橙油处理组PI含量在贮藏0~4 h急剧下降至最低值,4~60 h有所回升并在60 h时与对照组达到同一水平(P>0.05)。除60、132 h外,橙油处理组的PI含量均显著低于对照组(P<0.05),在贮藏4、12 h时分别为对照组的62.52%、66.74%(P<0.01)。
PA是PLD水解细胞膜的直接产物。由图3D可知,橙油胁迫导致的细胞膜水解均使得PA含量持续上升,而对照组PA含量几乎保持不变。橙油处理组PA含量在0~4 h缓慢上升,4 h后迅速上升;整个贮藏期间均显著高于对照组(P<0.05);橙油处理组PA含量在贮藏132 h时是对照组的2.92 倍(P<0.01)。由此可见,油胞病发病期间细胞膜降解加强,PA大量积累。
2.3.2 橙油处理对脐橙果皮脂肪酸含量的影响
脂肪酸是生物膜的重要组分,脂肪酸含量以及比例的变化与细胞膜稳定性和流动性密切相关。研究表明,不饱和脂肪酸比例越大,细胞膜流动性和功能性越强,果实的抗逆性越好 [13]。如表2所示,对照组和橙油处理组的脂肪酸组成成分在贮藏期间未发生改变;但橙油处理组不饱和脂肪酸总量逐渐降低,而饱和脂肪酸总量逐渐增大,这一现象表明橙油处理致油胞病使得果皮不饱和脂肪酸逐渐被氧化。脂肪酸不饱和度(不饱和脂肪酸含量/饱和脂肪酸含量)是衡量膜脂脂肪酸不饱和程度的重要指标之一 [23]。贮藏期间,橙油处理组脂肪酸不饱和度均呈现下降趋势,始终低于对照组;橙油处理组脂肪酸不饱和度在贮藏12、60、132 h时分别是对照组的87.97%、94.86%、74.46%,差异达到显著水平(P<0.05)。
油酸、亚油酸和亚麻酸是脐橙果皮中不饱和脂肪酸的重要组分;其中,亚油酸含量最高。对照组亚油酸含量呈现缓慢下降趋势;而橙油处理组亚油酸含量上下波动,但整体上同样呈现下降趋势;处理组在贮藏2、12、132 h时显著低于对照组,分别是对照组95.00%、89.08%、92.25%(P<0.05)。棕榈酸和硬脂酸是脐橙果皮中饱和脂肪酸的的重要组分。橙油处理组的棕榈酸含量在贮藏期间上下波动,但硬脂酸含量整体上呈现上升趋势。橙油处理组硬脂酸含量在贮藏12、132 h时分别是对照组的1.21 倍和1.09 倍,差异达到极显著(P<0.01)。

图4 橙油处理对脐橙果皮LOX活性的影响
Fig. 4 Effects of oil treatment on LOX activity in Navel orange peel
2.3.3 橙油处理对脐橙果皮LOX活性的影响在植物组织中,LOX主要催化多不饱和脂肪酸中的亚油酸和亚麻酸发生加氧反应,膜脂发生过氧化。如图4所示,对照组LOX活性在贮藏0~12 h无明显变化,12~60 h迅速上升后在贮藏后期基本保持不变;而橙油处理组LOX活性呈现先下降后上升再下降的趋势。贮藏过程中,橙油处理组的LOX活性经过小幅度下降后,在2~4 h急剧上升,至12 h达到峰值;橙油处理组LOX活性在贮藏4、12 h分别是对照组的2.13、2.54 倍(P<0.01);贮藏12~60 h期间,橙油处理组LOX活性急剧下降并在贮藏60、132 h时低于对照组(P<0.01)。由此表明,LOX参与果实对油胞病的响应,LOX在逆境期间被激活,促进膜脂过氧化。
2.3.4 橙油处理对脐橙果皮O 2 −·产生速率、H 2O 2含量、MDA含量、相对电导率的影响
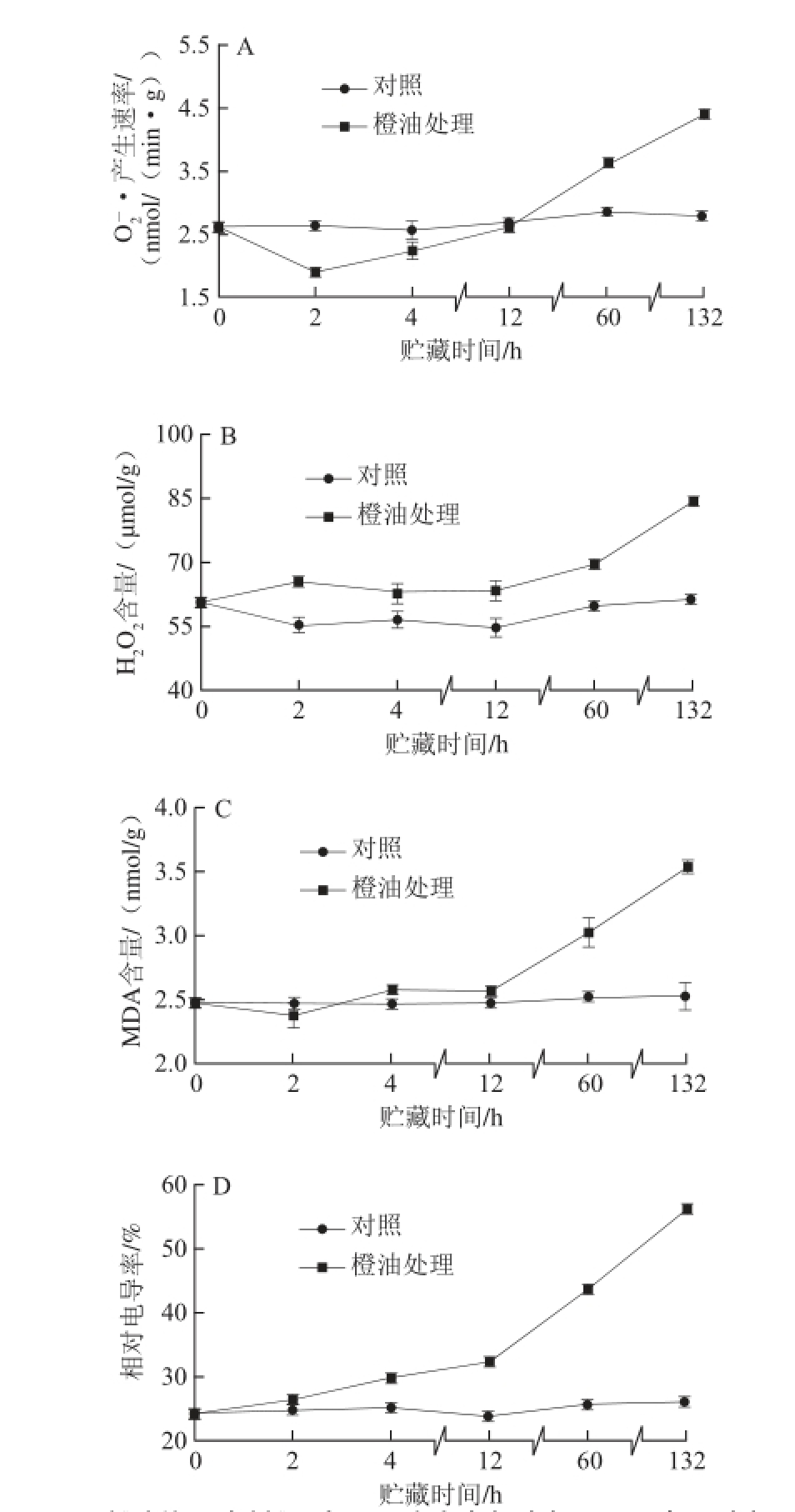
图5 橙油处理对脐橙果皮O
2
-·产生速率(AA)、HH
2O
2含量(BB)、MDA含量(C)、相对电导率(D)的影响
Fig. 5 Effects of oil treatment on O
2
−· production rate (A), H
2O
2content (B), MDA content (C) and cell membrane permeability (D) in Navel orange peel
由图5A可知,对照组O 2 -·产生速率几乎保持不变。而橙油处理组O 2 -·产生速率除在0~2 h出现小幅度下降外,在其余贮藏时间均保持上升趋势;橙油处理组O 2 -·产生速率在12 h后超过对照组,在60 h和132 h均与对照组有极显著差异(P<0.01)。在贮藏60、132 h时,橙油处理组O 2 -·产生速率分别是对照组的1.26、1.58倍(P<0.01)。
由图5B可知,对照组H 2O 2含量贮藏期间变化幅度很小。橙油处理组H 2O 2含量在0~12 h有所波动但始终显著高于对照组(P<0.05),12 h后H 2O 2含量快速上升并在132 h达到最大值;在贮藏60、132 h时,橙油处理组H 2O 2含量是对照组的1.16、1.38 倍(P<0.01)。
MDA是膜脂过氧化的产物,是衡量细胞膜受伤程度的重要指标。由图5C可知,贮藏期间对照组MDA含量变化不大。橙油处理组MDA含量在贮藏0~12 h变化不大,但在12 h后大幅度上升;MDA含量在贮藏60、132 h时分别是对照组的1.20、1.40 倍(P<0.01)。橙油处理均可促使MDA累积,由此表明油胞病发病期间果皮膜脂过氧化作用加剧。
当细胞膜的结构受到破坏后,细胞膜通透性随之增加,细胞内电解质外渗。如图5D所示,对照组相对电导率变化不大,始终保持在较低水平。而橙油处理组相对电导率在0~12 h上升较慢,12 h后急剧上升;在60、132 h时,该相对电导率分别是对照组的1.68、2.13倍(P<0.01)。
柑橘油胞病是柑橘类果实在生长发育或采后贮藏期间,果皮内部橙油外渗后对果皮细胞造成光毒性损伤而引起的生理性病害。当果实发生油胞病时,果皮表面会出现不规则的浅黄色或黄褐色斑块,而发病部位易受青霉菌、绿霉菌侵染而导致果实腐烂,大大降低了果实的外观品质和商品价值,造成柑橘产业巨大的经济损失 [7]。基于机体内橙油外渗是引起果实油胞病的关键因素,以往实验中多采用外源橙油涂抹果皮的方式引起果实油胞病并进行后续研究,为油胞病的机理探索提供了理论依据 [8-10,14]。在本实验中,橙油处理同样可引起果皮发生油胞病,其发病症状与果实油胞病自然发病症状相似;但发病进程较自然发病果进程快。橙油处理组在贮藏4 h时可观察到轻微的油胞凸起症状,此后病斑处油胞经历大量凸起、逐渐凹陷、完全塌陷的历程,病斑颜色也由原来的浅绿色或浅黄色逐渐加深至深褐色。橙油处理可诱导果皮塌陷和变色,随贮藏时间的延长,果皮的塌陷指数和变色指数不断升高,这与Knight等 [9]的研究结果一致;然而,由于贮藏时间较短(132 h),对照果实在贮藏期间尚未观察到任何病斑。
实验室以往研究表明,油胞病发病期间,柑橘果皮超微结构发生变化,细胞代谢紊乱,严重时造成细胞死亡 [10]。果皮细胞膜的降解是对油胞病最早的响应;在诱导发病实验中,“华盛顿”脐橙果实在橙油处理30 min后即可观察到果皮细胞膜轻微破损 [9];另一品种“Shamout”甜橙则在橙油处理3 h后观察到相同的细胞膜破损现象 [1];而在本实验中,橙油处理使果皮MDA含量和电导率持续上升,表明油胞病发病期间细胞膜受到损伤,与细胞膜超微结构观察结果一致。细胞膜结构的变化引起其功能的改变,细胞渗透调节能力下降,细胞质外流,细胞生理代谢紊乱 [10-11,24];因此可以推测细胞膜降解在果皮细胞对油胞病响应中具有关键作用;这也与关世英等 [25]认为的逆境胁迫下,细胞膜最先受到伤害的研究结果一致。以往研究表明,细胞膜的水解和过氧化是在PLD、LOX和活性氧的协同作用下发生的,细胞膜系统的结构和功能受到损伤,生成MDA并造成质膜通透性的改变 [26-28]。
植物组织内存在的磷脂酶主要是PLD,它是细胞膜降解途径中的起始酶类和关键酶类,以磷脂特别是PC为底物生成产物PA [28-33]。在本实验中,橙油处理组PLD活性在贮藏0~12 h呈现上升趋势,始终高于对照组;表明PLD在油胞病早期(0~12 h)对细胞膜的水解能力增强,这与电子显微镜观察所得“细胞膜的降解是对油胞病最早的响应”的结论一致。PLD活性的增加使得底物PC含量明显减少,产物PA含量显著增加;同时,膜脂的另一组成成分PI含量在贮藏0~12 h也呈现下降趋势。
细胞膜水解产物PA可在磷脂酸磷酸酯酶、非特异性酯酰基水解酶的作用下生成脂肪酸 [ 28,34]。目前,在甜橙 [13]、蓝莓 [35]、水稻 [36]、甜椒 [37]等果蔬的研究表明,果实的生理伤害与其膜脂脂肪酸的种类、比例及含量有密切关系。其中,不饱和脂肪酸有助于细胞膜的流动性和细胞内外物质交换;但在逆境胁迫下,细胞膜中不饱和脂肪酸会被LOX氧化,从而使细胞膜发生过氧化反应。在本实验中,橙油处理使得脐橙果皮不饱和脂肪酸相对含量逐渐降低,饱和脂肪酸相对含量逐渐增大,这一现象表明油胞病发病过程中,果皮不饱和脂肪酸逐渐被氧化。脂肪酸不饱和度(不饱和脂肪酸含量/饱和脂肪酸含量)是衡量膜脂脂肪酸不饱和程度的重要指标 [23]。在本实验中,橙油处理组的脂肪酸不饱和度始终低于对照组,并在整个贮藏期间呈现下降趋势,从而使得细胞膜流动性下降、通透性增大,这和其他果实在逆境胁迫下膜脂不饱和程度的变化规律一致 [35,38-40]。LOX是果实内膜脂过氧化的启动酶和关键酶,以不饱和脂肪酸特别是亚油酸和亚麻酸为直接底物。在油胞病早期(0~12 h),橙油处理组LOX活性高于对照组,细胞膜过氧化进程加快,活性氧含量增加,这与以往研究中逆境胁迫可促使果实LOX活性增强的结论一致 [41]。橙油处理组LOX活性在油胞病中后期均呈现下降趋势,60 h和132 h时均显著低于对照组,这可能由于亚油酸和亚麻酸的消耗导致这两类脂肪酸含量不足,因而降低了LOX的活性 [42]。果实在正常的生理代谢过程中都会产生活性氧,植物体内的活性氧主要是O 2 -·和H 2O 2。正常情况下活性氧的生成量不大,产生和清除处于动态平衡中,对果实组织无不良影响。但当果实遭遇逆境胁迫时,活性氧产生速率逐渐增大,积累过多会导致活性氧平衡被打破,膜脂发生过氧化反应。研究发现,活性氧的快速产生与柑橘果皮生理性病害的发生有关 [8,24,43]。在本实验中,橙油胁迫使得脐橙果皮O 2 -·产生速率和H 2O 2含量在贮藏期间持续升高。在贮藏0~4 h,橙油处理组的O 2 -·产生速率低于对照组,这可能由于橙油处理致油胞病引发了果实内部的抗氧化响应;但橙油处理组的H 2O 2含量在贮藏期间始终高于对照组。MDA是细胞膜氧化的次生物,是常用的膜脂过氧化指标,反映果实遭受逆境伤害和衰老的程度。而当膜结构遭到破坏时,细胞膜的通透性发生改变,相对电导率增大。在本实验中,橙油处理致活性氧的积累对细胞膜发起进攻使得细胞膜降解,因而发病果实MDA和相对电导率持续增加。以往研究同样发现,当锦橙 [12]、椪柑 [12]、温州蜜柑 [12]、苹果梨 [44]等发生褐斑病时,果皮相对电导率也不断上升,相对电导率的增大与褐斑病的发生密切相关。
综上所述:橙油处理可诱导脐橙果皮发生油胞病。当果实发生油胞病时,其发病症状随贮藏时间的延长而加剧;橙油处理可促使PLD活性增强而使得细胞膜水解进程加快;促使LOX活性增强使得不饱和脂肪酸含量降低,活性氧急剧产生,膜脂发生过氧化;细胞膜的结构受到损伤,MDA含量和相对电导率持续上升。橙油处理致果实油胞病机制的进一步明确为研究油胞病的防治手段提供了理论指导。在以后实验中,若能从橙油作用的角度入手,探索一种有效防止橙油损伤果皮组织的措施,将为油胞病的控制提供新的、更加可行的思路和方法。
参考文献:
[1] SHOMER I, ERNER Y. The nature of oleocellosis in citrus fruits[J]. Botanical Gazette, 1989, 150(3): 281-288.
[2] 涂俊凡, 吴黎明, 彭抒昂. 柑橘油胞凹陷病组织结构特征的研究[J]. 湖北农业科学, 2010, 49(7): 1633-1637. DOI:10.3969/ j.issn.0439-8114.2010.07.030.
[3] FAWCETT H S. A spotting of citrus fruits due to the action of oil liberated from the rind[J]. California Agricultural Experiment Station, 1916, 266: 259-270.
[4] ZHENG Yongqiang, HE Shaolan, YI Shilai, et al. Predicting oleocellosis sensitivity in citrus using VNIR reflectance spectroscopy[J]. Scientia Horticulturae, 2010, 125(3): 401-405. DOI:10.1016/j.scienta.2010.04.036.
[5] ALFÉREZ F, ZACARIAS L. Postharvest pitting in navel oranges at non-chilling temperature: influence of relative humidity[J]. Acta Horticulturae, 2001, 553: 307-308. DOI:10.17660/ ActaHortic.2001.553.74.
[6] MAGWAZA L S, OPARA U L, TERRY L A, et al. Prediction of ‘Nules Clementine’ mandarin susceptibility to rind breakdown disorder using Vis/NIR spectroscopy[J]. Postharvest Biology and Technology, 2012, 74: 1-10. DOI:10.1016/j.postharvbio.2012.06.007.
[7] 张进, 吴良欢, 武美燕. 柑橘油斑病研究概况与展望[J]. 科技通报, 2006, 22(2): 196-199. DOI:10.3969/j.issn.1001-7119.2006.02.013.
[8] 刘丽丹. 橘油及振动胁迫诱导采后柑橘油胞病致果皮劣变抗氧化机制研究[D]. 重庆: 西南大学, 2012.
[9] KNIGHT T G, KLIEBER A S, SEDGLEY M T. Structural basis of the rind disorder oleocellosis in Washington Navel Orange (Citrus sinensis L. Osbeck)[J]. Annals of Botany, 2002, 90(6): 765-773. DOI:10.1093/aob/ mcf 258.
[10] 崔文静. 橙油和振动诱导柑橘油胞病致果皮结构劣变机制[D].重庆: 西南大学, 2013.
[11] AGUSTI M, ALMELA V, JUAN M, et al. Histological and physiological characterization of rind breakdown of ‘Navelate’ sweet orange[J]. Annals of Botany, 2001, 88(3): 415-422. DOI:10.1006/ anbo.2001.1482.
[12] 李聪敏. 柑橘贮藏期果皮褐斑的生理生化机理研究[D]. 重庆: 西南大学, 2009.
[13] 徐永杰. 甜橙果实发育及贮藏过程中细胞膜稳定性研究[D]. 武汉:华中农业大学, 2007.
[14] WILD B. New method for quantitatively assessing susceptibility of citrus fruit to oleocellosis development and some factors that affect its expression[J]. Animal Production Science, 1998, 38(3): 279-285. DOI:10.1071/EA96070.
[15] SIRIKESORN L, KETSA S, van DOORN W G. Low temperatureinduced water-soaking of Dendrobium inflorescences: relation with phospholipase D activity, thiobarbaturic-acid-staining membrane degradation products, and membrane fatty acid composition[J]. Postharvest Biology and Technology, 2013, 80: 47-55. DOI:10.1016/ j.postharvbio.2013.01.007.
[16] BANG D Y, BYEON S K, MOON M H. Rapid and simple extraction of lipids from blood plasma and urine for liquid chromatography-tandem mass spectrometry[J]. Jounal of Chromatography A, 2014, 1331(3): 19-26. DOI:10.1016/j.chroma.2014.01.024.
[17] MIRDEHGHAN S H, RAHEMI M, MARTÍNEZ-ROMERO D, et al. Reduction of pomegranate chilling injury during storage after heat treatment: role of polyamines[J]. Postharvest Biology and Technology, 2007, 44(1): 19-25. DOI:10.1016/j.postharvbio.2006.11.001.
[18] BARROS É A, BROETTO F, BRESSAN D F, et al. Chemical composition and lipoxygenase activity in soybeans (Glycine max L. Merr.) submitted to gamma irradiation[J]. Radiation Physics and Chemistry, 2014, 98(5): 29-32. DOI:10.1016/j.radphyschem.2013.12.040. [19] TIAN Min, GU Qing, ZHU Muyuan. The involvement of hydrogen peroxide and antioxidant enzymes in the process of shoot organogenesis of strawberry callus[J]. Plant Science, 2003, 165(4): 701-707. DOI:10.1016/S0168-9452(03)00224-3.
[20] PATTERSON B D, MACRAE E A, FERGUSON I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV)[J]. Analytical Biochemistry, 1984, 139( 2): 487-492. DOI:10.1016/0003-2697(84)90039-3.
[21] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007: 68-70.
[22] SONG Lili, LIU Hai, YOU Yanli, et al. Quality deterioration of cut carnation flowers involves in antioxidant systems and energy status[J]. Scientia Horticulturae, 2014, 170(3): 45-52. DOI:10.1016/ j.scienta.2014.02.035.
[23] 乔勇进, 冯双庆, 李丽萍, 等. 热处理、多胺处理对黄瓜膜脂肪酸变化的影响[J]. 食品科学, 2006, 27(5): 246-249. DOI:10.3321/ j.issn:1002-6630.2006.05.055.
[24] MEDEIRA M C, MAIA M I, VITOR R F. The first stages of preharvest ‘Peel Pitting’ development in ‘Encore’ Mandarin: a histological and ultrastructural study[J]. Annals of Botany, 1999, 83(6): 667-673. DOI:10.1006/anbo.1999.0867.
[25] 关世英, 苏维埃. 与磷脂酰甘油有关的植物抗冷机理研究进展[J].植物生理学通讯, 1995, 31(3): 167-173.
[26] 王海燕, 孙磊. 磷脂酶D调控植物抗逆性的机理研究进展[J]. 中国农学通报, 2011, 27(21): 13-17.
[27] WANG Qing, DING Tian, ZUO Jinhua, et al. Amelioration ofpostharvest chill ing injury in sweet pepper by glycine betaine[J]. Postharvest Biology and Technology, 2016, 112: 114-120. DOI:10.1016/ j.postharvbio.2015.07.008.
[28] 袁海英, 陈力耕, 何新华, 等. 磷脂酶D在果实发育和成熟过程中的作用[J]. 园艺学报, 2005, 32(5): 933-938. DOI:10.3321/j.issn:0513-353X.2005.05.046.
[29] LI Maoyin, HONG Yueyun, WANG Xuemin. Phospholipase D and phosphatidic acid-mediated signaling in plants[J]. Biochimica et Biophysica Acta, 2009, 1791(9): 927-935. DOI:10.1016/ j.bbalip.2009.02.017.
[30] MAO Linchun, WANG Guoze, ZHU Cheng gang, et al. Involvement of phospholipase D and lipoxygenase in response to chilling stress in postharvest cucumber fruits[J]. Plant Science, 2007, 172(2): 400- 405. DOI:10.1016/j.plantsci.2006.10.002.
[31] MAO Linchun, PANG Huaqing, WANG Guoze, et al. Phospholipase D and lipoxygenase activity of cucumber fruit in response to chilling stress[J]. Postharvest Biology and Technology, 2007, 44(1): 42-47. DOI:10.1016/j.postharvbio.2006.11.009.
[32] ZHAO Yuying, QIAN Chunlu, CHEN Jicheng, et al. Responses of phospholipase D and lipoxygenase to mechanical wounding in postharvest cucumber fruits[J]. Journal of Zhejiang University-SCIENCE B, 2010, 11(6): 443-450. DOI:10.1631/jzus.B0900357.
[33] 赵宇瑛. 黄瓜磷脂酶和抗氧化系统对采后机械损伤胁迫的响应[D].杭州: 浙江大学, 2011.
[34] PALIYATH G, DROILLARD M J. The mechanism of membrane deterioration and disassembly during senescence[J]. Plant Physiology and Biochemistry, 1992, 30(6): 789-812.
[35] 周倩. 冷藏蓝莓果蒂凹陷的发生机理及控制技术研究[D]. 沈阳: 沈阳农业大学, 2014.
[36] 王萍, 张成军, 陈国祥, 等. 低温对水稻幼苗类囊体膜脂肪酸组分和膜脂过氧化的影响[J]. 中国水稻科学, 2006, 20(4): 401-405. DOI:10.3321/j.issn:1001-7216.2006.04.011.
[37] 李新国, 毕玉平, 赵世杰, 等. 短时低温胁迫对甜椒叶绿体超微结构和光系统的影响[J]. 中国农业科学, 2005, 38(6): 1226-1231. DOI:10.3321/j.issn:0578-1752.2005.06.023.
[38] CAO Shifeng, YANG Zhenfeng, CAI Yuting, et al. Fatty acid composition and antioxidant system in relation to susceptibility of loquat fruit to chilling injury[J]. Food Chemistry, 2011, 127(4): 1777-1783. DOI:10.1016/j.foodchem.2011.02.059.
[39] WANG C Y, KRAMER G F, WHIT AKER B D. Temperature preconditioning increases to tolerance to chilling injury and alters lipid composition in zucchini squash[J]. Journal of Plant Physiology, 1992, 140(2): 229-235. DOI:10.1016/S0176-1617(11)80940-5.
[40] CHENG Shunchang, WEI Baodong, ZHOU Qian, et al. 1-Methylcyclopropene alleviates chilling injury by regulating energy metabolism and fatty acid content in ‘Nanguo’ pears[J]. Postharvest Biology and Technology, 20 15, 109: 130-136. DOI:10.1016/ j.postharvbio.2015.05.012.
[41] LIU Hai, SONG Lili, YOU Yanli, et al. Cold storage duration affects litchi fruit quality, membrane permeability, enzyme activities and energy charge during shelf time at ambient temperature[J]. Postharvest Biology and Technology, 2011, 60(1): 24-30. DOI:10.1016/ j.postharvbio.2010.11.008.
[42] 许文平, 陈昆松, 李方, 等. 脂氧合酶、 茉莉酸和水杨酸对猕猴桃果实后熟软化进程中乙烯生物合成的调控[J]. 植物生理学报, 2000, 26(6): 507-514.
[43] ZACARIAS L, ALFEREZ F, G ARIGLIO N, et al. Rind breakdown in Navelate oranges: infl uence of rootstock[M]. Florida: Pro. Inter. Soc. Citri, 2001.
[44] 吴明江, 于萍, 潘林, 等. 苹果梨果皮衰老及褐变的研究[J]. 黑龙江农业科学, 2000(4): 14-15. DOI:10.3969/j.issn.1002-2767.2000.04.006.
Mechanisms of Membrane Lipid Metabolism in Citrus Fruit at Low Ripening Stage in Response to Oleocellosis
XU Jiani, CAO Qi, DENG Lili, YAO Shixiang, WANG Weihao, ZENG Kaifang*
(College of Food Science, Southwest University, Chongqing 400715, China)
Abstract:The effects of oleocellosis induced by orange oil on the membrane lipid metabolism of Navel orange at low ripening stage (nearly ripe) were studied based on collapse index, discoloration index and cell membrane-related substances. Results showed that oil treatment could induce oleocellosis in Navel orange and the severity of oleocellosis increased as time prolonged. Orange oil exerted phototoxic effects on the fruit peel; the cell membrane system was involved in the response of the fruit to oleocellosis. Oil treatment increased phospholipase D (PLD) activity, decreased phosphatidylcholine (PC) and phosphatidylinositol (PI) and enhanced phosphatidic acid (PA) contents, indicating that the severity of cell membrane degradation increased as oleocellosis developed. Lipoxygenase (LOX) activity was also enhanced by oil treatment during the early storage period, thereby leading to the decrease of unsaturated/saturated fatty acid ratio and the accumulation of reactive oxygen species (ROS). Malondialdehyde (MDA) and electrolyte leakage were increased due to the increased contents of hydrogen peroxide (H 2O 2) and superoxide anion (O 2 −·) during the whole storage. Cell membrane damage contributed to the occurrence of oleocellosis and led to the increase of oleocellosis severity during storage. This study could provide a theoretical reference for exploring the mechanisms and control strategies of oleocellosis.
Key words:Navel orange; oleocellosis; orange oil treatment; membrane lipid metabolism
DOI:10.7506/spkx1002-6630-201624042
中图分类号:S609.3;S667.7
文献标志码:A
文章编号:1002-6630(2016)24-0262-09
引文格式:
许佳妮, 曹琦, 邓丽莉, 等. 低成熟度柑橘果实油胞病发病进程中的膜脂代谢[J]. 食品科学, 2016, 37(24): 262-270. DOI:10.7506/spkx1002-6630-201624042. http://www.spkx.net.cn
XU Jiani, CAO Qi, DENG Lili, et al. Mechanisms of membrane lipid metabolism in citrus fruit at low ripening stage in response to oleocellosis[J]. Food Science, 2016, 37(24): 262-270. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201624042. http://www.spkx.net.cn
收稿日期:2016-06-07
基金项目:国家自然科学基金面上项目(31471631);“十二五”国家科技支撑计划项目(2015BAD16B07)
作者简介:许佳妮(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:xujiani199008@163.com
*通信作者:曾凯芳(1972—),女,教授,博士,研究方向为农产品加工与贮藏工程。E-mail:zengkaifang@163.com