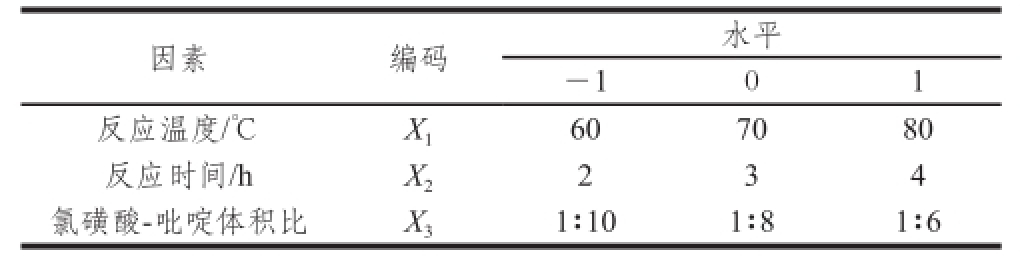
表1 Box-Behnken试验因素与水平
Table 1 Coded levels and corresponding actual levels for independent variables used in Box-Behnken design
?
郭金英,朱蓓茹,任国艳,吴 影,王 萍,崔国庭,李政军
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
摘 要::液体培养发菜细胞,发菜细胞经去藻体、浓缩、透析、脱蛋白、醇沉、DEAE-52离子交换柱层析分级、Sephadex-100葡聚糖凝胶柱分级处理得到发菜胞外精多糖。以硫酸根的取代度为指标,在单因素试验的基础上,利用Box-Behnken设计进行响应面试验,建立因素与响应值之间的数学模型,确定适宜的发菜胞外多糖硫酸化条件。结果表明,发菜胞外多糖硫酸化修饰最佳条件为反应温度71 ℃、反应时间3 h、氯磺酸-吡啶体积比1∶7,在此条件下,硫酸化取代度为5.05。红外光谱检测表明,硫酸基团已与多糖分子结合。
关键词:发菜;多糖;硫酸化;红外光谱
发菜是一种陆生蓝细菌,在生长的过程中,发菜细胞分泌大量的胶状物质 [1],包裹在细胞及藻丝体外,形成对细胞起保护作用的胶质鞘,能御外部恶劣的生长环境。发菜细胞在液体培养的过程中会分泌一些胞外多糖 [2],其中以荚膜的形式附着在细胞表面的胞外多糖称为荚膜多糖。发菜胞外多糖具有多种生物活性,日本微细藻类综合研究所和富山医科药科大学的药理实验结果表明,发菜胞外多糖对单纯疱疹病毒等多种包被病毒具有明显的抗病毒活性 [3-4]。发菜胞外多糖具有清除自由基的功能 [5],在一定的浓度范围内,清除能力与多糖的浓度呈现一定的正相关。因此,发菜胞外多糖是一种具有开发潜力的功能性食品新资源 [6-7]。
对多糖进行修饰能够改变多糖的理化性质及其结构,常用的多糖化学修饰方法有多糖的磷酸化、硫酸化、羧甲基化和乙酰化 [8-9]等,其中硫酸化修饰是结构修饰中最有效的手段 [10]。硫酸酯化多糖是多糖大分子链中单糖分子上的羟基被硫酸根所取代而形成的天然及半合成的酸性多糖,多糖硫酸化后,可以改变多糖的生物学特性,硫酸化多糖具有增强机体免疫功能 [11]、抗凝血 [12]、抗肿瘤 [13]、抗病毒 [14]、抗氧化 [15]等多种生物活性。随着越来越多的硫酸化多糖的功能活性被发现,深入研究硫酸化修饰对多糖生物活性的影响,对硫酸化多糖的开发及应用具有深远的意义。
发菜胞外多糖是吡喃型多糖 [16],这种类型的多糖常用的硫酸化方法是氯磺酸-吡啶法。经此方法修饰得到的多糖,其取代度往往因试剂比例、反应时间、反应温度的不同而有所差异,进而影响到酯化产物的生物活性 [17]。有关发菜胞外多糖硫酸化的研究鲜见报道。
本实验提取纯化人工培养发菜胞外多糖,采用响应面法分析发菜胞外多糖硫酸化条件,并结合红外光谱对发菜硫酸化胞外多糖进行解析。
1.1 材料与试剂
发菜采集于宁夏贺兰山东麓,河南科技大学微生物实验室分离、纯化、保存。
DEAE-52离子交换柱、Sephadex-100葡聚糖凝胶柱上海宝曼生物科技有限公司。
1.2 仪器与设备
FA1004分析天平 上海上平仪器公司;KQ-3200超声清洗机 上海远怀化工科技有限公司;MPA傅里叶变换红外光谱仪 日本布鲁克公司;LG-5真空冷冻干燥机 上海离心机械研究所;UV-2550紫外-可见分光光度计 日本Shimadzu公司;A0640174 85-1磁力搅拌器上海泸西分析仪器厂。
1.3 方法
1.3.1 发菜胞外多糖的提取纯化
将冷冻干燥后的多糖溶于水,离心除沉淀后,过DEAE-52离子交换柱进行分离。洗脱条件控制如下:先用150mL的蒸馏水进行洗脱,再用300 mL 0.2 mol/L氯化钠溶液进行洗脱,采用自动部分收集器收集,流速1 mL/min,每管8 mL,硫酸-苯酚法 [18-19]逐管进行显色,在490 nm波长处测定吸光度,以管数为横坐标、吸光度为纵坐标绘制洗脱曲线。
收集主峰,浓缩,用蒸馏水透析后,通过Sephadex-100葡聚糖凝胶柱进行进一步的分离纯化。用300 mL蒸馏水进行洗脱,流速0.4 mL/min,每管收集4 mL,自动部分收集器收集,硫酸-苯酚法逐管进行显色,在490 nm波长处测定吸光度,以管数为横坐标、吸光度为纵坐标绘制洗脱曲线。收集主峰,浓缩,冷冻干燥,得发菜纯多糖。
1.3.2 发菜胞外多糖硫酸化
酯化试剂的制备:将带有冷凝装置和搅拌装置的三颈烧瓶放入氯化钙冰盐浴中,先向三颈烧瓶中加入一定量的吡啶进行预冷,然后边搅拌边一滴一滴的加入氯磺酸,烧瓶底部可见大量的淡黄色固体即为酯化试剂,-20 ℃保存 [20-21]。依照上述方法制备氯磺酸-吡啶体积比为1∶2、1∶4、1∶6、1∶8、1∶10的酯化试剂。
硫酸化修饰:称取50 mg的发菜胞外多糖用甲酰胺溶解,在室温条件下超声30 min,加入酯化试剂,进行酯化反应。反应结束后冰浴冷却至室温,用4 ℃ 4 mol/L的氢氧化钠溶液中和至中性,装入截留相对分子质量为8 000~14 000的透析袋中,先用自来水透析2 d,再用蒸馏水透析1 d,每3 h换一次水。取透析袋中的溶液加入3 倍体积的无水乙醇,4 ℃静置24 h,收集沉淀,真空冷冻干燥得到硫酸酯化多糖。
1.3.3 单因素试验设计
以硫酸根取代度为考察指标,选取甲酰胺用量、酯化试剂用量、反应时间、反应温度、氯磺酸-吡啶体积比5 个因素进行单因素试验,均按1.3.2节的方法对发菜胞外多糖进行硫酸酯化。
发菜胞外多糖50 mg、反应时间3 h、反应温度60℃、氯磺酸-吡啶体积比1∶6、酯化试剂用量20 mL,甲酰胺用量分别为10、20、30、40、50 mL,研究甲酰胺用量对取代度的影响;发菜胞外多糖50 mg、反应时间3 h、反应温度60℃、氯磺酸-吡啶体积比1∶6、甲酰胺用量30 mL,酯化试剂用量分别为5、10、15、20、25 mL,研究酯化试剂用量对取代度的影响;发菜胞外多糖50 mg、反应时间3 h、氯磺酸-吡啶体积比1∶6、甲酰胺用量30 mL、酯化试剂用量20 mL,反应温度分别为50、60、70、80、90 ℃,研究反应温度对取代度的影响;发菜胞外多糖50 mg、氯磺酸-吡啶体积比1∶6、甲酰胺用量30 mL、酯化试剂用量20 mL、反应温度60 ℃,反应时间分别为1、2、3、4、5 h,研究反应时间对取代度的影响;发菜胞外多糖50 mg、甲酰胺用量30 mL、酯化试剂用量20 mL、反应温度60 ℃、反应时间3 h,氯磺酸-吡啶体积比分别为1∶2、1∶4、1∶6、1∶8、1∶10,研究氯磺酸-吡啶体积比对取代度的影响。
1.3.4 响应面试验设计
根据单因素试验的结果,选取反应温度、反应时间、氯磺酸-吡啶体积比3 个因素作为考察的对象,分别用X 1、X 2、X 3表示,用1、0、-1分别表示自变量的高中低水平。根据Box-Behnken设计三因素三水平的编码表(表1),采用Origin 8.5和Design-Expert 8.0进行试验数据的处理和响应面分析。
表1 Box-Behnken试验因素与水平
Table 1 Coded levels and corresponding actual levels for independent variables used in Box-Behnken design

?
1.3.5 硫酸化发菜胞外多糖取代度的测定
采用氯化钡比浊法 [22]测定硫酸化发菜胞外多糖的硫酸基含量。
硫酸根标准溶液:准确称取105 ℃干燥至恒质量的K 2SO 4217.5 mg,以1 mol/L HCl溶解,定容至100 mL的容量瓶中,摇匀,即得到硫酸基标准储备液,其中硫酸根的含量为1.2 mg/mL。硫酸根标准曲线的绘制:分别吸取该溶液0.00、0.04、0.08、0.12、0.16、0.20 mL,各以1 mol/L HCl溶液补足至0.2 mL,以0.2 mL HCl溶液作为空白对照,加入3.8 mL的三氯乙酸溶液及1.0 mL的氯化钡-明胶溶液,充分混合后在室温条件下静止20 min,用分光光度计测定混合液在360 nm波长处的吸光度A 1。以1 mL的明胶溶液替换氯化钡-明胶溶液依上述方法进行操作,测得吸光度A 2,以硫酸基质量浓度为横坐标(x),A 1-A 2值为纵坐标绘制标准曲线,得标准曲线回归方程y=2.650 7x+0.014 1,标准曲线相关系数R 2=0.996 3。
样品中硫酸根取代度的测定:待测样品溶解于1 mol/L HCl溶液中配制成1 mg/mL的溶液,沸水浴中密封水解4 h。取2份0.2 mL的水解液,同法测定氯化钡-明胶组和单一明胶组的吸光度,计算两组测样差值。将测样差值代入标准曲线,得样品溶液中硫酸基质量浓度,除以样品质量浓度(1 mg/mL)得样品中硫酸基的质量分数(S)。取代度通过以下公式计算:
1.3.6 发菜硫酸化胞外多糖红外光谱分析
分别称取硫酸化前后的发菜胞外多糖2 mg,加入200 mg溴化钾在干燥的玛瑙研钵中研磨均匀,用压片机进行压片,在400~4 000 cm -1区间内扫描。
1.4 数据处理
数据均采用3 次独立重复实验的平均值和
 ±s表示;数据均用单向方差分析进行评价;P<0.05表示统计学显著水平。
±s表示;数据均用单向方差分析进行评价;P<0.05表示统计学显著水平。
2.1 发菜胞外多糖DEAE-52纤维素离子交换柱层析
多糖溶液DEAE-52纤维素离子交换柱洗脱曲线见图1。发菜胞外多糖只有一个洗脱峰,出峰的范围是17~26管,因此可以判断,发菜胞外多糖为酸性多糖。峰形较为对称,说明发菜胞外多糖的电荷性质比较均一。收集该组分经浓缩、透析、醇沉、真空真空冷冻干燥得到初步纯化的发菜胞外多糖,下一步用于凝胶柱层析纯化。
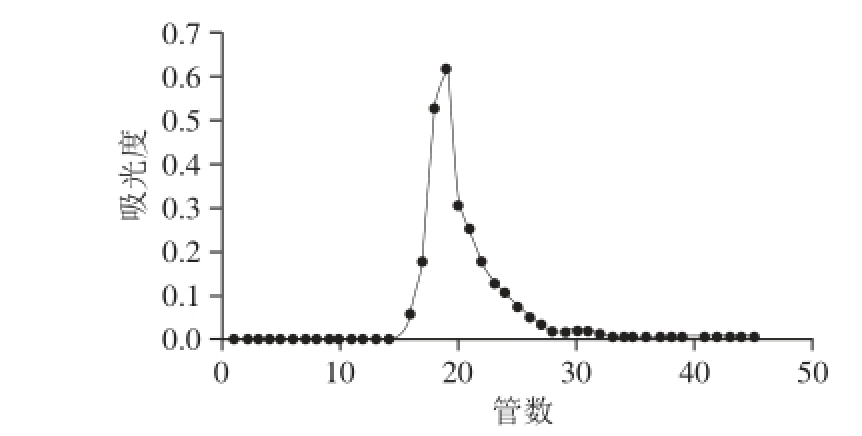
图1 发菜胞外多糖DEAE-52离子交换柱层析洗脱曲线
Fig. 1 Elution curve of Nostoc fl agelliforme exopolydsaccharide by DEAE-52 anion-exchange chromatography
2.2 发菜胞外多糖Sephadex G-100凝胶柱层析
葡聚糖凝胶工作的原理是根据凝胶柱内部孔径的大小,按照溶质分子的大小进行分离。初步分离的发菜胞外多糖经Sephadex G-100凝胶柱进一步纯化,洗脱曲线曲线见图2。可以看出多糖经凝胶柱层析后得到一个较为对称的峰,没有拖尾现象。收集该组分,经浓缩、冻干后得到纯化的发菜胞外多糖。采用苯酚-硫酸法测定纯化后多糖的含量为85.20%。
2.3 单因素试验结果
2.3.1 甲酰胺用量对发菜胞外多糖硫酸根取代度的影响
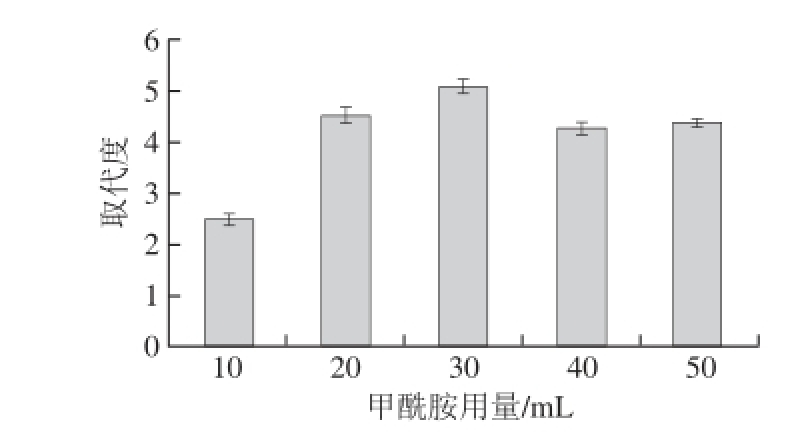
图3 甲酰胺用量对取代度的影响
Fig. 3 Effect of formamide dosage on DS
由图3可以看出,甲酰胺用量达到30 mL时,多糖的取代度达到临界值4.826,超过30 mL时,随着甲酰胺用量的增加,取代度降低,可能是随着甲酰胺用量增加,多糖溶解量增多,取代度升高,当超过30 mL时,多糖溶解量相对稳定,硫酸根取代度保持稳定。甲酰胺用量选择30 mL。
2.3.2 酯化试剂用量对发菜胞外多糖硫酸根取代度的影响

图4 酯化试剂用量对取代度的影响
Fig. 4 Effect of esterification reagent dosage on DS
由图4可以看出,酯化试剂用量从5~20 mL时多糖的取代度逐渐增加,当酯化试剂为20 mL时取代度最大达到4.753. 当剂量从20 mL上升至25 mL时,多糖的取代度明显下降,但在统计学上无显著差异(P>0.05),分析酯化剂用量增加,降低了反应体系pH值,多糖易发生降解反应,导致取代度降低。酯化试剂的剂量选择20 mL。
2.3.3 反应温度对发菜胞外多糖硫酸根取代度的影响

图5 反应温度对取代度的影响
Fig. 5 Effect of reaction temperature on DS
如图5所示,在50~70 ℃,发菜胞外多糖硫酸根取代度随着温度的升高而增加,并在70 ℃时达到峰值。当反应温度高于70 ℃时,取代度下降,可能是温度升高有利于反应的进行,温度过高使多糖发生降解。将反应温度设定在60~80 ℃之间有利于利用吡啶-氯磺酸法进行多糖的硫酸化。
2.3.4 反应时间对发菜胞外多糖硫酸根取代度的影响
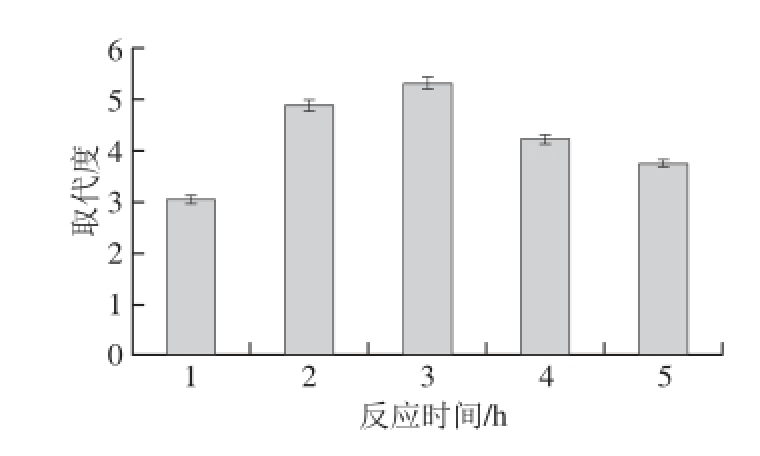
图6 反应时间对取代度的影响
Fig. 6 Effect of reaction time on DS
如图6所示,当反应时间从1~3 h,多糖的取代度一直在增加,超过3 h,多糖硫酸根取代度较低,当反应时间为3 h时硫酸化多糖的取代度最高。硫酸酯化反应是一个可逆反应,随着反应时间延长,反应趋于平衡,当反应继续进行,可能多糖发生降解反应,取代度降低。因此,在本试验中2~4 h被认为是最佳的反应时间。
2.3.5 氯磺酸-吡啶体积比对发菜胞外多糖硫酸根取代度的影响
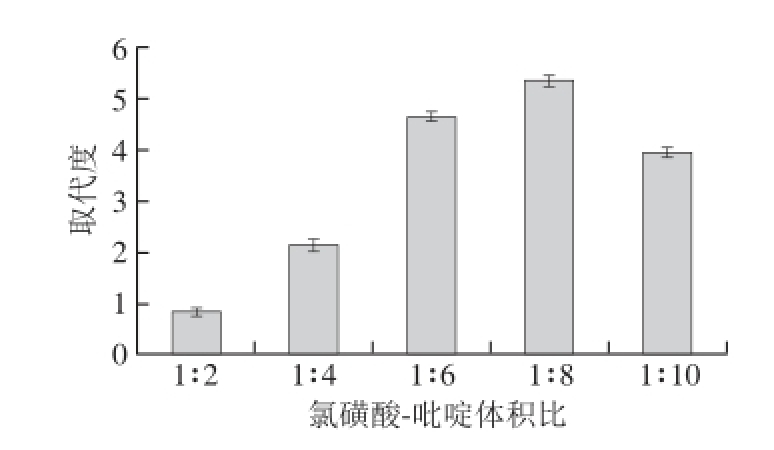
图7 氯磺酸-吡啶体积比对取代度的影响
Fig. 7 Effect of chlorosulfonic acid to pyridine ratio on DS
氯磺酸-吡啶体积比是多糖硫酸化过程中很重要的因素。如图7所示,氯磺酸-吡啶的比例不同,硫酸根的取代度也不同。低浓度的氯磺酸有利于多糖的硫酸化。当氯磺酸和吡啶体积比为1∶8时,取代度达到顶点。多糖在吡啶溶液中的溶解度较低,但氯磺酸与吡啶能发生络合反应,提高多糖溶解度,使得多糖硫酸根取代度提高。本试验中氯磺酸和吡啶的最佳比例是1∶8。
2.4 响应面优化试验结果
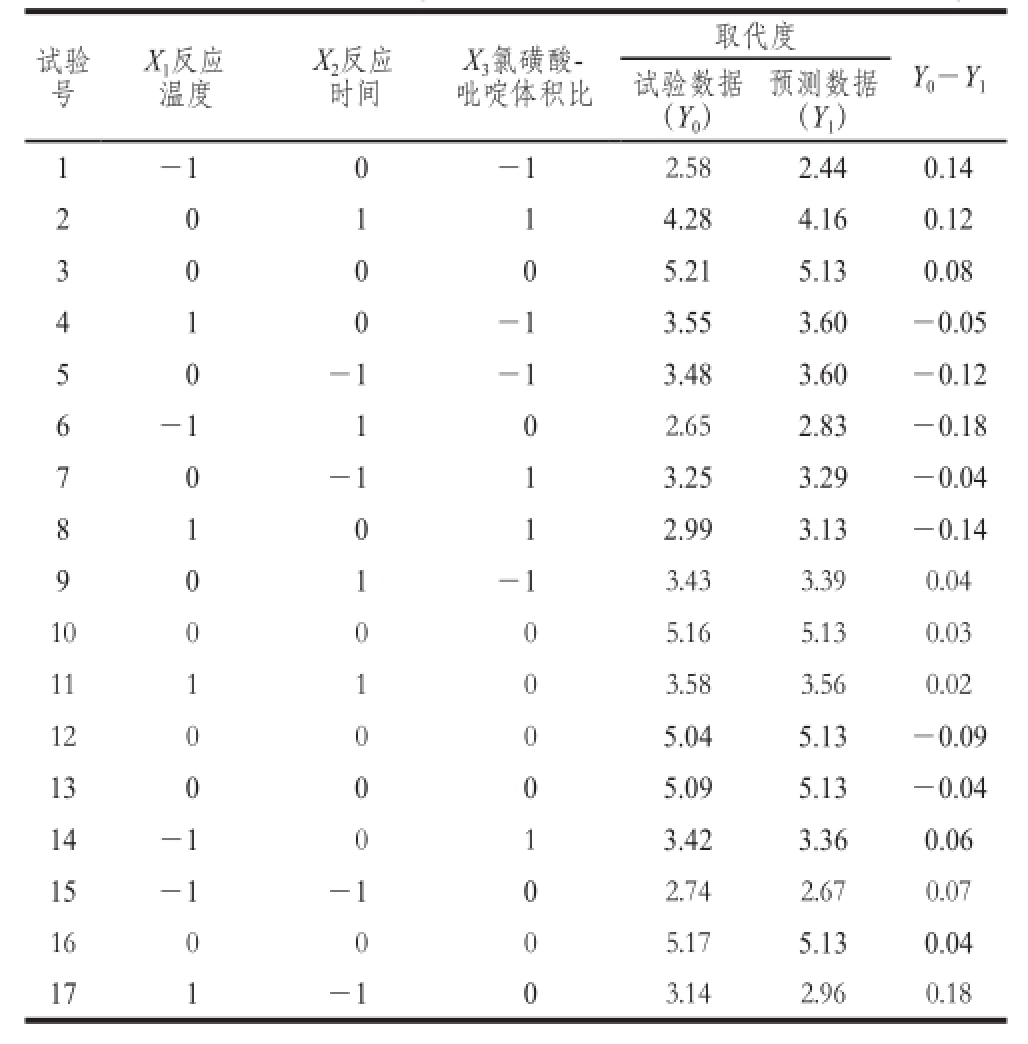
表2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis
?
矩阵设计和响应面试验的结果见表2。结果表明,使用响应面试验对不同反应条件的所有组合进行优化发现取代度(Y)介于2.58~5.21之间。分别在X 1=70 ℃、X 2=3 h、X 3=1∶8获得取代度的峰值。应用多个回归分析的试验数据,用下列二阶多项式方程描述预测响应面的数学模型。Y=5.13+0.23X 1+0.17X 2+0.11X 3+0.13X 1X 2-0.35X 1X 3+0.270X 2X 3-1.29X 1 2-0.81X 2 2-0.71X 3 2。
图8表示响应值和回归方程预测值的直观对照图,图中可以看出试验值和预测值几乎分布在同一条直线上,R 2 Adj=0.975 4,说明该模型能解释97.54%的响应值变化。

图8 试验值与模型预测值对照
Fig. 8 Comparison between predicted and observed values
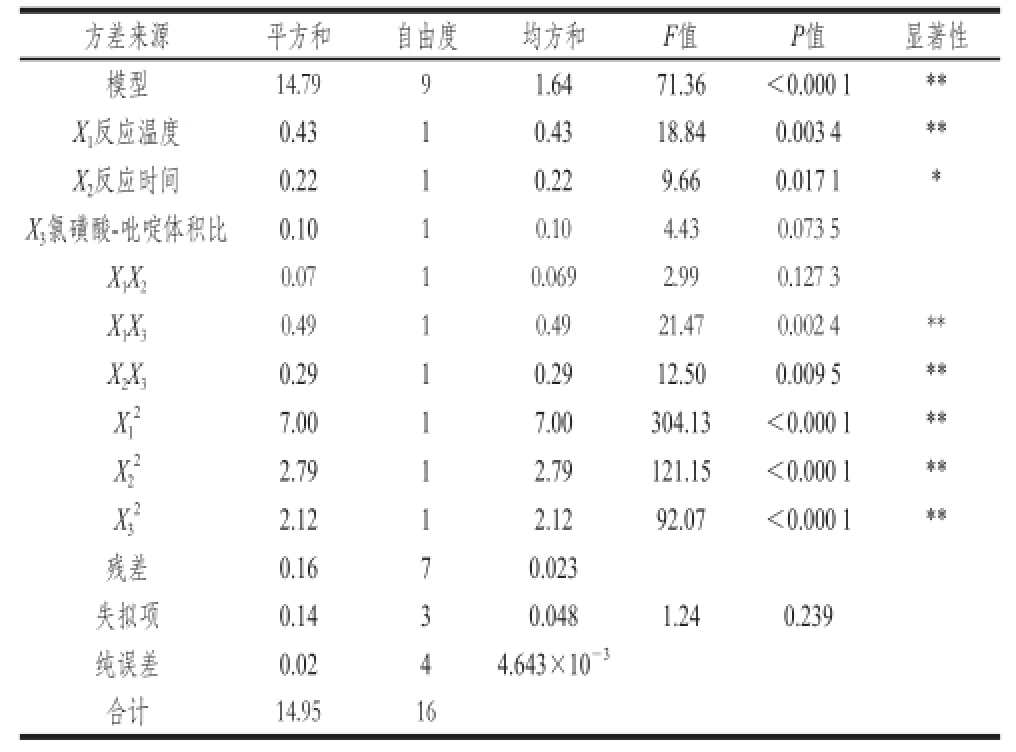
表3 回归方程方差分析
Table 3 Analysis of variances for the developed regression equation
注:*.差异显著,P<0.05;**.差异极显著,P<0.01。
?
由表3可知,该模型的F值为71.36,P<0.000 1,表明该模型是非常显著的。失拟项F值为1.24,P>0.05,不显著;以上均说明该模型拟合程度较好,试验误差小,可以用此模型分析预测发菜胞外多糖硫酸化工艺条件。独立变量(X 1、X 2),相互作用系数(X 1X 3、X 2X 3)和二次项系数(X 1 2、X 2 2、X 3 2)均显著(P<0.05)影响发菜胞外多糖的硫酸化。相反,反应温度和反应时间(X 1X 2)之间的相互作用效果则不显著。
2.5 自变量之间的交互作用


图9 各因素交互作用对取代度影响的响应面和等高线
Fig. 9 Response surface and contour plots forthe effects of Pyr to CSA ratio, reaction time and temperature on DS
图9a显示,当氯磺酸-吡啶体积比固定在1∶8时,反应温度和反应时间对多糖取代度的影响。随着反应温度的升高和反应时间的延长,取代度的值先增加再降低。当反应温度60~70℃、反应时间2~3 h时,取代度达到了5.0以上。
图9b显示,当反应温度固定在60 ℃时,氯磺酸-吡啶体积比和反应时间对多糖取代度的影响。随着反应时间的延长和氯磺酸比例的降低,取代度的值先逐渐增加后明显降低。当反应时间2~3 h、氯磺酸-吡啶体积比1∶6~1∶8时,取代度的值达到5.0以上。
图9c表明,当反应时间固定在3 h时,氯磺酸-吡啶体积比和反应温度对多糖硫酸化取代度的影响。当反应温度逐渐上升,氯磺酸比例逐渐下降时,取代度先快速上升,后明显下降。当反应温度60~70 ℃、氯磺酸-吡啶体积比1∶6~1∶8时,取代度达到5.0以上。
2.6 验证实验结果
根据二次多项式回归方程和响应面试验数据,当温度为70.85 ℃、反应时间3.12 h、氯磺酸-吡啶体积比1∶7.14时硫酸根取代度达到最高预测值5.16。为了验证这些数据,考虑到实验的可操作性,对最佳条件进行修改,反应条件如下:反应温度71 ℃、反应时间3 h、氯磺酸-吡啶体积比1∶7。在此条件下,硫酸根取代度为5.05,和预测值非常接近。因此基于响应面所得的优化工艺参数准确可靠。
2.7 多糖和硫酸化多糖的红外光谱分析
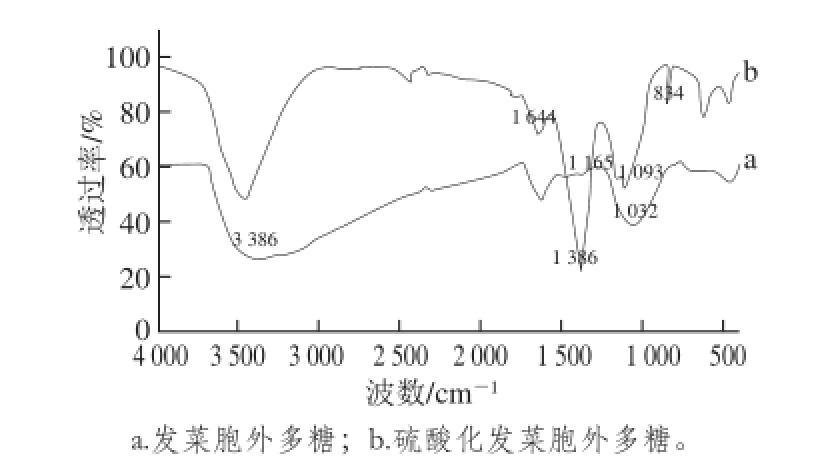
图10 发菜胞外多糖及硫酸化发菜胞外多糖的红外光谱图
Fig. 10 IR spectra of the polysaccharide and the sulfated polysaccharide
发菜胞外多糖和硫酸化发菜胞外多糖的红外光谱分析见图10,发菜胞外多糖的红外光谱显示出在波长为3 386 cm -1有一个比较宽的振动吸收峰即—OH的吸收峰。在1 644 cm -1和1 386 cm -1存在强烈的吸收峰表明存在羰基不对称伸缩振动和对称伸缩振动。1 093 cm -1和1 032 cm -1分别代表C=O的环醚C—O—C伸缩振动和C—O—H的—OH可变角振动。与多糖的波谱相比,硫酸酯化的多糖在1 165 cm -1和834 cm -1处有两个新的强烈的吸收峰分别代表不对称的S=O和对称振动的C—O—S键。其他的硫酸化多糖中也有类似的吸收 [23-24]。1 032 cm -1可变角伸缩振动的吸收峰显著下降,这可能是由于部分硫酸基取代羟基的结果 [25]。以上结论表明硫酸基团已经结合到了发菜胞外多糖分子上。
本研究制备发菜胞外多糖,采用氯磺酸-吡啶法分别研究了溶剂甲酰胺用量、酯化试剂用量、反应温度、反应时间、氯磺酸-吡啶体积比5 个单因素对硫酸化多糖取代度的影响。在单因素试验的基础上,选择反应时间、反应温度和氯磺酸-吡啶体积比进行Box-Behnken试验设计,使用Design-Expert 8.0软件进行数据拟合,建立各因素与响应值之间的数学模型,确定最佳多糖硫酸化条件。结果表明,最佳硫酸化条件为反应温度71 ℃、反应时间3 h、氯磺酸-吡啶体积比1∶7,在这个条件下,硫酸根取代度的值是5.05。对分离纯化的胞外多糖和经硫酸化的胞外多糖分别进行红外光谱检测,硫酸酯化的多糖在1165 cm -1和834 cm -1处有两个新的强烈的吸收峰分别代表不对称的S=O和对称振动的C—O—S键,表明硫酸根基团已经与多糖分子结合。
参考文献:
[1] WANG J H, LUO J P, ZHA X Q, et al. Comparison of antitumor activities of different polysaccharide fractions from the stems of Dendrobium nobile Lindl[J]. Carbohydrate Polymers, 2010, 79: 114-118. DOI:10.1016/j.carbpol.2009.07.032.
[2] KANEKIYO K, LEE J B, HAYASHI K, et al. Isolation of an antiviral polysaccharide nostoflan from a terrestrial cyanobacteria Nostoc fl agelliforme[J]. Journal of Narural Products, 2005, 68(7): 1037-1041. DOI:10.1021/np050056c.
[3] 陈雪峰. 发状念珠蓝细菌细胞固体界面培养研究[D]. 天津: 天津科技大学, 2009.
[4] KANEKIYO K, HAYASHI K, LEE J B, et al. Structure and antiviral activity of an acidic polysaccharide from an edible blue-green alga, Nostoc fl agelliforme[J]. Yakugaku Zasshi: Journal of the Pharmaceutical Society of Japan, 2008, 128(5): 725-731. DOI:10.1002/chin.200840267.
[5] 汤俊, 胡征宇. 3 种念珠藻多糖对自由基的清除作用[J]. 武汉植物学研究, 2006, 24(1): 63-66. DOI:10.3969/j.issn.2095-0837.2006.01.013.
[6] TAKENAKA H, YAMAGUCHI Y, SAKAKI S, et al. Safety evaluation of Nostoc flagelliforme (nostocales,cyanophyceae) as a potential food[J]. Food and Chemical Toxicology, 1998, 36(12): 1073-1077. DOI:10.1016/S0278-6915(98)00089-1.
[7] HAN P, SUN Y, WU X, et al. Emulsifying, flocculating,and physicochemical properties of exopolysaccharide produced by cyanobacterium Nostoc flagelliforme[J]. Applied Biochemistry and Biotechnology, 2014, 172(1): 36-49. DOI:10.1007/s12010-013-0505-7.
[8] SCHEPETKIN I, FAULKNER C, NELSON O L, et al. Macrophage immunomodulatory activity of polysaccharides isolated from Juniperus scopolorum[J]. International Immunopharmacology, 2005, 5(13/14): 1783-1799. DOI:10.1016/j.intimp.2005.05.009.
[9] 徐静静. 竹荪子实体水不溶性多糖的化学修饰及活性研究[D].无锡: 江南大学, 2012.
[10] 梁进. 茶叶多糖的化学修饰及体外抗凝血作用研究[D]. 合肥: 安徽农业大学, 2008.
[11] GENG Y, XING L, SUN M M, et al. Immunomodulatory effects of sulfated polysaccharides of pine pollen on mouse macrophages[J]. International Journal of Biological Macromolecules, 2016, 91: 846-855. DOI:10.1016/j.ijbiomac.2016.06.021.
[12] SHELMA R, SHARMA C P. Development of lauroyl sulfated chitosan for enhancing hemocompatibility of chitosan[J]. Colloids and Surfaces B Biointerfaces, 2011, 84(2): 561-570. DOI:10.1016/j.colsurfb. 2011.02.018.
[13] BAE I Y, KIM H Y, LEE S, et al. Effect of the degree of oxidation on the physicochemical and biological properties of Grifola frondosa polysaccharides[J]. Carbohydrate Polymers, 2011, 83: 1298-1302. DOI:10.1016/j.carbpol. 2010.09.037.
[14] TALARICO L B, PUJOL C A, ZIBETTI R G M, et al. The antiviral activity of sulfated polysaccharides against dengue virus is dependent on virus serotype and host cell[J]. Antiviral Research, 2005, 66(2/3): 103-110. DOI:10.1016/j.antiviral.2005.02.001.
[15] 陈士国, 李兆杰, 王玉明, 等. 鱿鱼墨多糖的硫酸酯化及抗凝血活性[J].高等学校化学学报, 2010, 31(12): 2407-2412.
[16] 陈雪峰, 贾士儒, 王岳, 等. 发菜多糖的红外光谱分析与抗氧化活性的研究[J]. 食品与发酵工业, 2009(7): 133-137. DOI:10.13995/ j.cnki.11-1802/ts. 2009.07.034.
[17] WANG J L, YANG T, TIAN J, et al. Optimization of reaction conditions by RSM and structure characterization of sulfated locust bean gum[J]. Carbohydrate Polymers, 2014, 114: 375-383. DOI:10.1016/j.carbpol. 2014.08.035.
[18] 郭金英, 杜洁, 李彤辉, 等. 发状念珠藻胞外多糖的抑菌与抗炎作用[J]. 食品科学, 2015, 36(9): 190-193. DOI:10.7506/spkx1002-6630-201509035.
[19] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 1990.
[20] 黄才欢. 茯苓多糖的提取方法及其改性研究[D]. 广州: 暨南大学, 2005.
[21] 刘波, 袁利鹏, 熊波, 等. 多糖的硫酸酯化及其对结构和功能活性的影响研究进展[J]. 食品工业科技, 2015, 36(22): 372-375. DOI:10.13386/j.issn1002-0306.2015.22.068.
[22] 王文. 皱皮木瓜多糖的提取、分离、表征及化学修饰[D]. 郑州:河南工业大学, 2013.
[23] 白雁, 龚海燕, 宋瑞丽, 等. 近红外漫反射光谱法快速测定山药药材中多糖的含量[J]. 中成药, 2010, 32(1): 110-112.
[24] WEI D F, WEI Y X, CHENG W D, et al. Sulfated modification, characterization and antitumor activities of Radix hedysari polysaccharide[J]. International Journal of Biological Macromolecules, 2012, 51: 471-476. DOI:10.1016/j.ijbiomac.2012.06.004.
[25] SAHA S, NAVID M H, BANDYOPADHYAY S S B, et al. Sulfated polysaccharides from Laminaria angustata: structural features and in vitro antiviral activities[J]. Carbohydrate Polymers, 2012, 87: 123-130. DOI:10.1016/j.carbpol. 2011.07.026.
Optimization of Sulfation Conditions and Infrared Spectroscopy Analysis of Nostoc fl agelliforme Exopolydsaccharide
GUO Jinying, ZHU Beiru, REN Guoyan, WU Ying, WANG Ping, CUI Guoting, LI Zhengjun
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
Abstract:A purified exopolydsaccharide was obtained from the cell-free culture broth of Nostoc flagelliforme cells by concentration, dialysis, deproteinization, alcohol precipitation and sequential column chromatographies on DEAE-52 cellulose and Sephadex-100. By combined use of one-factor-at-a-time method and Box-Behnken response surface methodology, the optimum sulfation conditions for maximum degree of substitution (DS) of sulfate groups in the polydsaccharide (5.05) were obtained as follows: reaction temperature, 71 ℃; reaction time, 3 h; and chlorosulfonic acid-pyridine ratio, 1:7 (V/V). The infrared spectroscopy analysis showed the binding of sulfuric acid groups to the polysaccharide molecule.
Key words:Nostoc fl agelliforme; polysaccharide; sulfation; infrared spectroscopy
DOI:10.7506/spkx1002-6630-201624009
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)24-0061-07
引文格式:
郭金英, 朱蓓茹, 任国艳, 等. 发菜胞外多糖硫酸化条件的优化及红外光谱分析[J]. 食品科学, 2016, 37(24): 61-67.
DOI:10.7506/spkx1002-6630-201624009. http://www.spkx.net.cn
GUO Jinying, ZHU Beiru, REN Guoyan, et al. Optimization of sulfation conditions and infrared spectroscopy analysis of Nostoc fl agelliforme exopolydsaccharide[J]. Food Science, 2016, 37(24): 61-67. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201624009. http://www.spkx.net.cn
收稿日期:2016-06-27
基金项目:河南省重点科技攻关计划项目(142102110038);河南科技大学博士科研启动基金项目;
河南科技大学大学生研究训练(SRTP)项目(2015068)
作者简介:郭金英(1971—),男,副教授,博士,研究方向为食物新资源。E-mail:guojinying8@163.com