表1 模拟小肠液配方
Table 1 Formulations of simulated intestinal fluid
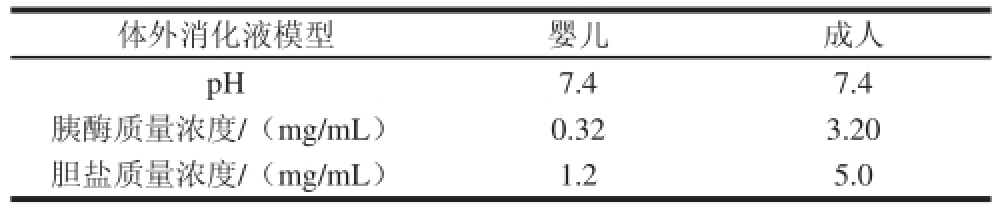
体外消化液模型婴儿成人pH7.47.4胰酶质量浓度/(mg/mL)0.323.20胆盐质量浓度/(mg/mL)1.25.0
刘玮琳,李 羚,魏富强,韩剑众*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
摘 要:以壳聚糖修饰的粗脂质体和纳米脂质体为研究对象,通过加速氧化(加热)、紫外照射-自由基诱导和模拟体外消化等处理后的脂质体平均粒径、表面电荷、丙二醛含量等的变化,表征壳聚糖修饰的粗脂质体的稳定性。结果表明,经过加热、紫外照射和消化处理后,壳聚糖修饰脂质体的稳定性明显比未修饰的脂质体高,并且壳聚糖的质量浓度越高,脂质体抵抗环境压力和体外消化稳定性越强。
关键词:脂质体;壳聚糖;消化;稳定性
http://www.spkx.net.cn
脂质体是由磷脂双分子层形成的、内部包含水相的封闭囊泡,具有缓释、细胞亲和、组织相容和靶向性等优点,已成功应用于生物、医药、化工、农业等领域 [1]。近年来,脂质体在食品中的应用日益受到关注,主要用于包裹营养素、酶、食品添加剂和抗菌剂等 [2-5]。然而,脂质体作为一种微粒分散体系,在贮藏过程中易氧化、絮凝,导致粒径变大和药物渗漏;而且,脂质体经口摄入后易被小肠中胆盐、酶等乳化、水解,降低了包埋物的生物利用率 [6]。目前通过物理化学作用在脂质体表面修饰蛋白、多糖或其他物质,用以增加脂质体双层膜结构的稳定性和提高芯材的可控性,已成为脂质体研究的新热点。Zhou Wei等 [7]制备了果胶修饰的VC脂质体并评价了其长期贮存的稳定性和皮肤渗透性;Liu Weilin等 [8]为了提高脂质膜的稳定性和防止运载的功能成分中链脂肪酸的泄漏,采用层层自组装静电沉积技术制备了海藻酸钠和壳聚糖双层修饰的纳米脂质体,表征了该新型脂质体的物化性质和消化动力学特性。
壳聚糖属天然高分子多糖,表面带正电荷,是一种阳离子聚合物,是自然界中继纤维素后的第二丰富的聚合物 [9]。目前,利用壳聚糖修饰脂质体的研究已有报道,如帅武平等 [10]制备壳聚糖修饰的脂质体,考察了不同相对分子质量壳聚糖对脂质体性质的影响;Zhao Guodong等 [11]研究了运载辅酶Q 10和α-硫辛酸的壳聚糖修饰脂质体抗氧化性;Peng Hailong等 [12]发现了N,N-十六烷基羧甲基/胆固醇脂质体可以用于生产含有红景天或其他生物活性食物成分的功能性食品的潜在载体系统。然而,以往的研究主要关注于修饰脂质体对包埋物性质的提高,而专门研究壳聚糖修饰脂质体的稳定性及体外消化特性较少,特别是从特殊人群如婴儿等消化的角度来探讨更是鲜见报道。
本实验室前期研究发现,脂质体在模拟体外消化过程中其结构易受小肠中酶、胆盐等影响,在胃部变化较小 [13]。因此,本研究以牛奶脂肪球膜(milk fat globular membrane,MFGM)中提取的磷脂为原料,采用传统的薄膜分散法制备粗脂质体,并用微孔滤膜处理得到纳米脂质体,再用壳聚糖修饰脂质体表面,表征其外观及物化性质;以平均粒径、Zeta电位、丙二醛(malondiadehyde,MDA)为指标,通过加速氧化(加热处理)和紫外照射-自由基诱导,同时从婴儿这种特殊人群的角度建立体外模拟小肠环境(成人对照)进行脂质体的模拟消化,研究修饰与未修饰脂质体的结构稳定性。
1.1 试剂
2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis (2-methylpropionamidine) dihydrochloride,AAPH) 上海阿拉丁生化科技股份有限公司;牛奶脂肪球膜中提取的磷脂(milk fat globular membrane,MFGM) 新西兰恒天然公司;胆固醇(C7529)、吐温-80(V900507)、VE(T3251)、壳聚糖(C8503)、尼罗红(Nile red)72485、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)46950、胰酶(P1750)、胆盐(B8631)等 美国Sigma公司;丙二醛检测试剂盒 南京建成生物工程研究所;实验用水均为超纯水。
1.2 仪器与设备
721型可见分光光度计 上海光谱有限公司;RE52-98型旋转蒸发器 上海亚荣生化仪器厂;D11971型超纯水系统、高速冷冻离心机 美国Thermo公司;Nano-ZS粒度仪 英国Malvern公司;MD ImageXpress Micro高内涵图像处理系统 美国分子仪器公司。
1.3 方法
1.3.1 壳聚糖修饰脂质体的制备
1.3.1.1 粗脂质体的制备
参照Liu Weilin等 [14]的方法,以MFGM中提取的磷脂为主要原料,采用薄膜分散法制备粗脂质体,步骤如下:将MFGM磷脂、胆固醇、吐温-80和VE按质量比为6∶1∶1.8∶0.12混合溶解在一定量的无水乙醇中,用恒温磁力搅拌器在40 ℃搅拌2 h使各成分溶解完全,然后采用旋转蒸发仪抽真空除去乙醇形成脂质薄膜,缓缓加入0.05 mol/L pH 7.4磷酸盐缓冲溶液(phosphate buffered saline,PBS),在低速旋转条件(60 r/min)条件下充分洗膜约1 h,获得脂质质量浓度约为8 mg/mL的粗脂质体,制备过程全程避光。
1.3.1.2 纳米脂质体的制备
采用0.22 μm的微孔滤膜将粗脂质体过筛处理,分别得到了1、2、4、8、12 次过筛的脂质体溶液,通过平均粒径的测定,选择最佳过膜次数。
1.3.1.3 壳聚糖修饰脂质体的制备
分别将粗脂质体和纳米脂质体缓慢滴入1 g/L和6 g/L的壳聚糖溶液中,体积比为1∶1,调节pH值为5.5,得到4 个样品,分别为:1 g/L壳聚糖修饰纳米脂质体a、6 g/L壳聚糖修饰纳米脂质体b、1 g/L壳聚糖修饰粗脂质体c和6 g/L壳聚糖修饰粗脂质体d,另外以未修饰的粗脂质体e为对照。
壳聚糖溶液的制备:分别称取0.05、0.3 g的壳聚糖粉末溶解在50 mL体积分数1%的乙酸溶液中,并用磁力搅拌器于常温过夜搅拌使其溶解充分,分别用滤纸过滤,获得澄清透明的1 g/L和6 g/L的壳聚糖溶液。
1.3.2 壳聚糖修饰脂质体的物化性质表征
1.3.2.1 物理性质
分别取样品a、b、c、d、e稀释3 倍,使用Malvern粒度分析仪测量平均粒径、多分散度(polydispersity index,PDI)和Zeta电位。
1.3.2.2 形貌
外观形貌:取a、b、c、d、e 5 个样品各装入洁净干燥的试管中拍照。
微观结构:用0.25 mg/mL的Nile red对脂质体染色,染色液与脂质体溶液体积比为1∶20;用2.8 mg/mL的FITC对壳聚糖染色,体积比为1∶25。用高内涵图像处理系统中的共聚焦功能拍照,观察脂质体的微观图像。
1.3.3 环境压力稳定性
1.3.3.1 加速氧化(热处理)稳定性
参照Klinkesorn等 [15]的方法并做部分修改。取一定量的新鲜样品a、b、c、d、e分别于70 ℃水浴中避光加热2 h,同时取同体积的样品不做加热处理,于避光条件下保存2 h作为对照,测定加热前后脂质体的平均粒径和Zeta电位,另外使用MDA检测试剂盒测定脂质体磷脂膜的氧化程度。
1.3.3.2 紫外(ultraviolet light,UV)照射稳定性
参照Wang Jiayu等 [16]的方法并做部分修改。将新制备的a、b、c、d、e样品分别加入AAPH,采用UV照射30 min,同时以加入AAPH但不进行UV照射的脂质体作为对照,AAPH在体系中的浓度均为0.05 mol/L。测量样品的平均粒径和Zeta电位,另外使用MDA检测试剂盒测定脂质体磷脂膜的氧化程度。
1.3.4 体外小肠消化稳定性
1.3.4.1 模拟小肠溶液(simulated intestinal fluid,SIF)的制备
参照Dupont等 [17]的方法,配制体外模拟婴儿和成人的小肠消化液,pH值为7.4,配方如表1所示。
表1 模拟小肠液配方
Table 1 Formulations of simulated intestinal fluid

体外消化液模型婴儿成人pH7.47.4胰酶质量浓度/(mg/mL)0.323.20胆盐质量浓度/(mg/mL)1.25.0
1.3.4.2 消化反应
将a、b、c、d分别与婴儿和成人SIF溶液混合,体积比为1∶1.5,另取脂质体e分别与婴儿、成人SIF溶液混合,体积比为1∶3,使得5 种样品中脂质体均占1/4的体积分数。调节混合液的pH值为7.4,在37 ℃水浴恒温摇床(95 r/min)中混匀预热。胰酶先用相应的SIF溶液溶解,反应开始计时为加入酶的瞬间。当脂质体消化1、5、60、120 min时,分别取样于95 ℃的恒温水浴锅中加热2 min使酶失活,用于测平均粒径和Zeta电位。
2.1 壳聚糖修饰脂质体环境压力稳定性质表征
表2 脂质体的平均粒径、PDI和Zeta电位
TTaabbllee 22 AAvveerraaggee ddiiaammeetteerr,, PPDDII aanndd ZZeettaa ppootteennttiiaall ooff lliippoossoommeess
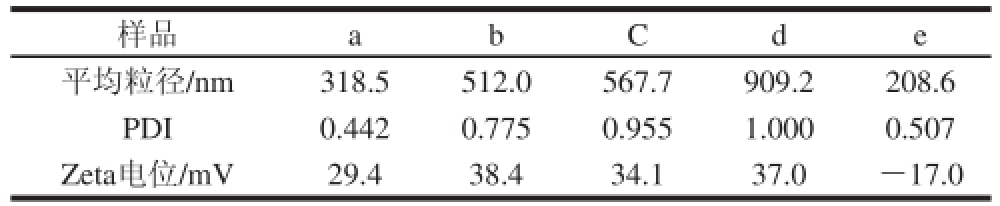
样品a bCde平均粒径/nm318.5512.0567.7909.2208.6 PDI0.4420.7750.9551.0000.507 Zeta电位/mV29.438.434.137.0-17.0
如表2所示,1 g/L壳聚糖修饰纳米脂质体a、6 g/L壳聚糖修饰纳米脂质体b、1 g/L壳聚糖修饰粗脂质体c、6 g/L壳聚糖修饰粗脂质体d、未修饰的粗脂质体e这5 种脂质体的平均粒径和Zeta电位各有不同,说明了脂质体粒径大小与壳聚糖及其质量浓度有直接关系。未修饰的脂质体平均粒径最小,呈负电性;随着修饰在表面的壳聚糖质量浓度增大,粒径随之变大,Zeta电位为正值且有所升高。壳聚糖的质量浓度提高可以使脂质体的修饰层厚度增加,导致其粒径的变大。同时,脂质体本身带负电,而壳聚糖表面带正电荷,故正电荷随着壳聚糖的量增加而有所增大。而PDI值整体较大,说明以薄膜分散法制备的脂质体粒径分布较不均匀,而当壳聚糖修饰后粒径分布更加不均匀。张激等 [18]也认为薄膜分散法制备得到的脂质体为大多囊脂质体,其所表现出的多分散度较大。
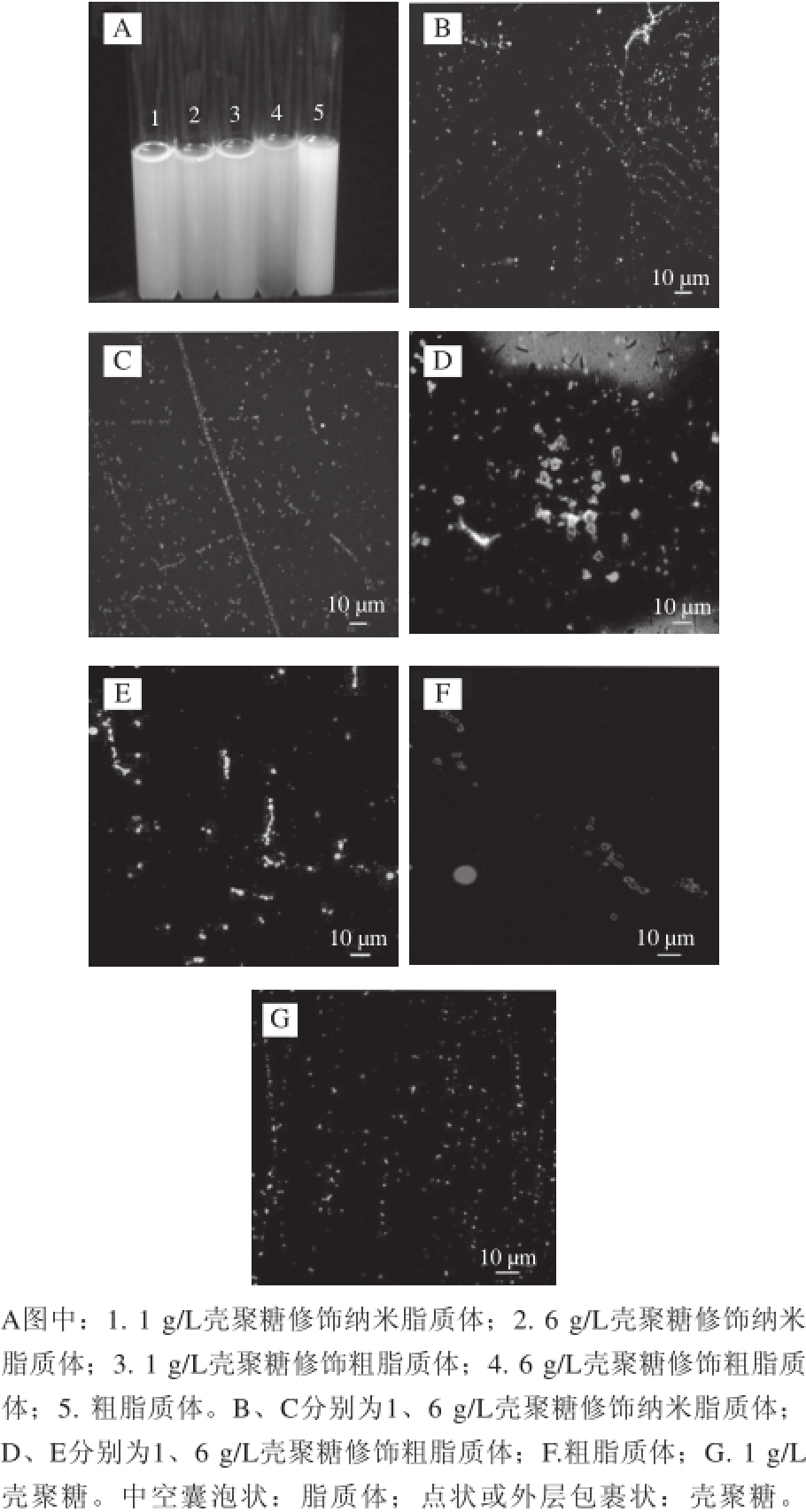
图1 脂质体的外观形貌和微观结构
Fig.1 Appearance and ultrastructure of liposomes
由图1A可知,修饰脂质体和未修饰脂质体的外观并无明显的差别,主要可能是脂质体与壳聚糖溶液本身的颜色并无太大差异,肉眼无法观察到区别。另外,用高内涵共聚焦功能观察脂质体的微观结构(图1B~1G)。修饰脂质体分内外两层,外层呈现外层包裹状的为FITC标记的壳聚糖,内层中空囊泡状的为Nile red标记的脂质体;而未修饰脂质体只呈现囊泡结构,壳聚糖只为点状结构。图1B和1C分别为1 g/L壳聚糖修饰纳米脂质体与6 g/L壳聚糖修饰纳米脂质体,两者粒径差距不大(符合粒径测量结果)。图1D和1E分别为1 g/L壳聚糖修饰粗脂质体和6 g/L壳聚糖修饰粗脂质体,由于被修饰的是粗脂质体,因此两个样品外观明显比1 g/L与6 g/L壳聚糖修饰纳米脂质体样品颗粒大,与粒度仪测量结果吻合。从未修饰脂质体,可以明显观察到脂质体小球内部中空结构;从修饰与未修饰的粗脂质体也可以明显观察到脂质体的中空结构。而由于纳米脂质体粒径太小、显微镜放大倍数有限,较难清晰观察到脂质体的囊泡结构。单纯的壳聚糖(图1G),并未加脂质体,视野中只有呈现点状颗粒结构,用于和其他图作对比。
2.2 环境压力稳定性研究
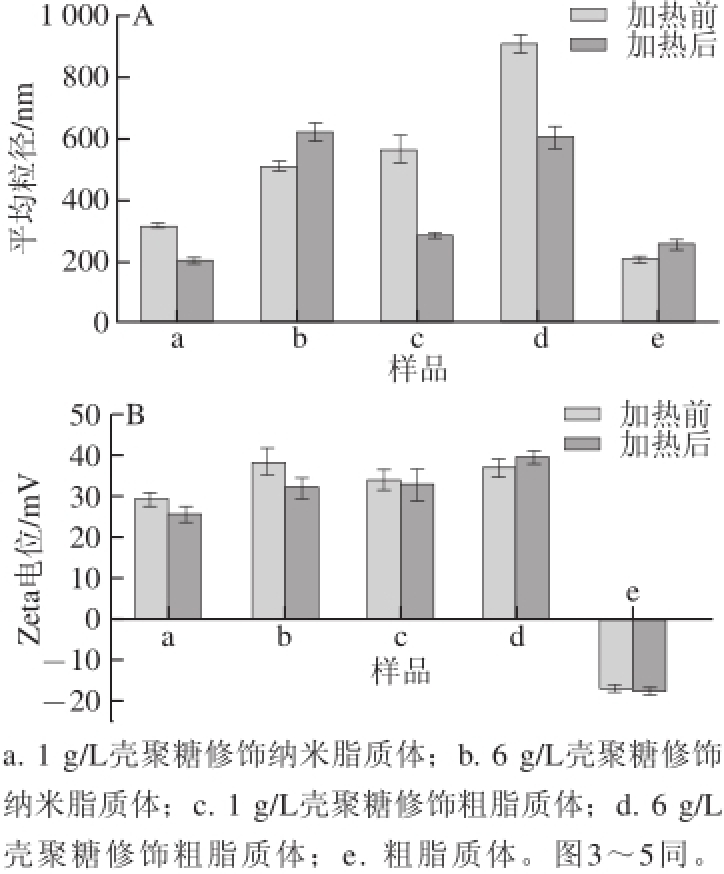
图2 加热前后脂质体的平均粒径(A)和Zeta电位(B)变化
Fig.2 Changes in average diameter (A) and Zeta potential (B) of liposomes before and after heat treatment
使用Malvern粒径电位仪测量加热前后(加速氧化稳定性)的壳聚糖修饰脂质体的平均粒径和Zeta电位。如图2结果为:a:1 g/L壳聚糖修饰纳质体加热前后粒径分别为(318.5±4.9) nm和(205.5±2.9) nm,电位分别为(29.4±1.5) mV和(25.8±1.5) mV;b:6 g/L壳聚糖修饰纳米脂质体加热前后粒径分别为(512.0±11.8) nm和(625.0±22.8) nm,电位分别为(38.4±3.1) mV和(32.0±2.0) mV;c:1 g/L壳聚糖修饰粗脂质体加热前后粒径分别为(567.7±36.6) nm和(286.4±7.4) nm,电位分别为(34.1±2.3) mV和(32.9±3.6) mV;d:6 g/L壳聚糖修饰粗脂质体加热前后粒径分别为(909.2±24.5) nm和(606.1±29.3) nm,电位分别为(37.0±1.8) mV和(39.4±1.4) mV;e:粗脂质体原液加热前后粒径分别为(208.6±4.3) nm和(253.9±12.1) nm,电位分别为(-17.0±1.2) mV和(-18.0±0.7) mV。粗脂质体e在加热前后,脂质体的Zeta电位整体呈现负电位性,是由于MFGM磷脂制备的脂质体本身在中性环境带负电荷;而壳聚糖在pH 5.5时带正电荷,修饰于脂质体表面后整体电荷呈正值。经热处理后5 种脂质体样品电位各有不同程度改变,Thompson等 [19]亦发现脂质体经加热处理会引起颗粒聚集和粒径、电位的变化。这可以说明加热对脂质体结构造成破坏,使壳聚糖和磷脂壁发生一定程度的降解,导致平均粒径以及Zeta电位的改变。
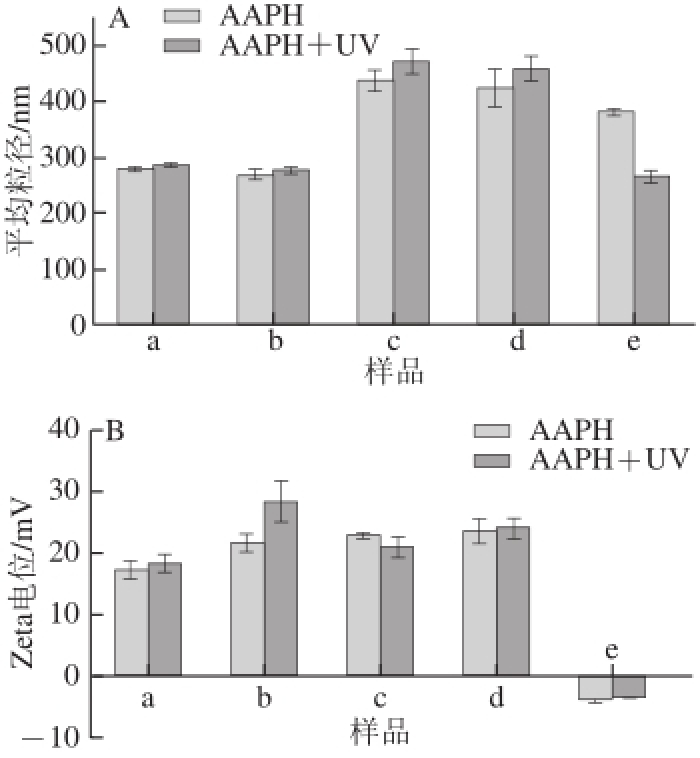
图3 脂质体经AAPH诱导-紫外照射前后的平均粒径(A)和Zeta电位(B)变化
Fig.3 Changes in average diameter (A) and Zeta potentials (B) of liposomes before and after combined treatment with AAPH-induced oxidation and UV irradiation
另外,采用Malvern粒径电位仪测量AAPH诱导-紫外照射前后的壳聚糖修饰脂质体的平均粒径和Zeta电位,同时以AAPH诱导氧化但不作紫外处理的脂质体为对照,结果见图3。a:1 g/L壳聚糖修饰纳米脂质体的粒径分别为(281.0±2.7) nm和(288.4±2.8) nm,电位分别为(17.4±1.4)mV和(18.3±1.4) mV;b:6 g/L壳聚糖修饰纳米脂质体的粒径分别为(269.2±7.4) nm和(276.9±4.6) nm,电位分别为(21.5±1.5) mV和(28.3±3.3) mV;c:1 g/L壳聚糖修饰粗脂质体的粒径分别为(439.3±19.9) nm和(474.1±20.5) nm,电位分别为(22.9±0.2) mV和(20.9±1.6) mV;d:6 g/L壳聚糖修饰粗脂质体的粒径分别为(426.7±32.4) nm和(460.5±22.2) nm,电位分别为(23.5±2.0) mV和(24.3±1.2) mV;e:粗脂质体原液的粒径分别为(384.7±2.9) nm和(268.8±8.5) nm,电位分别为(-3.7±0.5) mV和(-3.4±0.1) mV。经紫外照射后,a、b、c、d脂质体的平均粒径整体上略微有所增大,但增幅不明显;而e(粗脂质体)的粒径却大幅度减小,表明未修饰的脂质体经AAPH诱导-紫外照射后,脂质膜结构所有变化,稳定性较差。贺然等 [20]在研究对脂质体稳定性影响时提到,AAPH是一种自由基引发剂,在水溶液中可以自发产生羟自由基,从而引发磷脂的氧化,而紫外线可以直接作用于磷脂的脂肪酸侧链,产生自由基,引发磷脂氧化反应。Nieto等 [21]也有类似报道,指出经AAPH诱导氧化,脂质体的氧化速率明显加快。这是利用AAPH作为诱导氧化剂加速实验进程的依据。另外,与加热前后电位变化趋势类似,脂质体的Zeta电位在紫外照射后整体呈上升趋势;a、b、c、d样品皆为正电位,e样品为负。
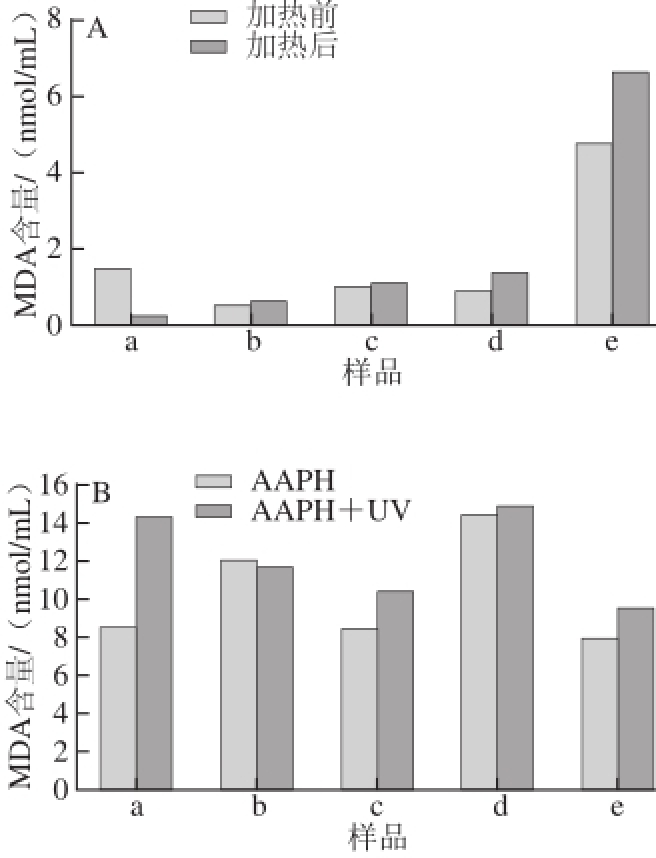
图4 加热(A)和AAPH诱导-紫外照射(B)前后的MDA含量变化
Fig.4 Changes in malondialdehyde (MDA) of before and after heating (A) and combined treatment with AAPH induced-oxidation and UV irradiation (B)
除平均粒径与表面电位外,还测量了脂质体在加热和紫外照射前后MDA含量变化,结果如图4所示。MDA是非酶系统产生的自由基攻击生物膜中的不饱和脂肪酸引发脂质过氧化作用而产生的脂质过氧化物 [22],其大小可以指示脂质体膜被氧化的程度。从整体上看,脂质体经加热或紫外处理后MDA值均有所上升。其中,经加热处理的e(未修饰的粗脂质体)相比于其他样品,MDA含量大幅提高,说明该脂质体磷脂被氧化的程度较高,稳定性较差;低质量浓度的壳聚糖修饰的脂质体较高质量浓度壳聚糖修饰的MDA含量变化大,表明壳聚糖质量浓度高,形成的外保护膜层较厚,对脂质体的磷脂膜保护较明显。该实验进一步说明,壳聚糖修饰脂质体可在一定程度上提高其稳定性。
2.3 体外小肠消化稳定性
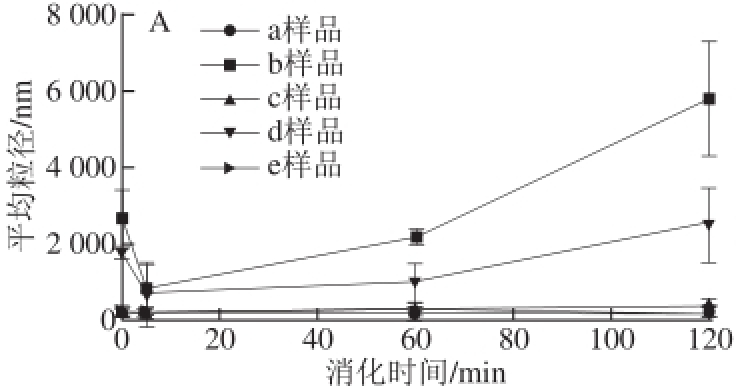
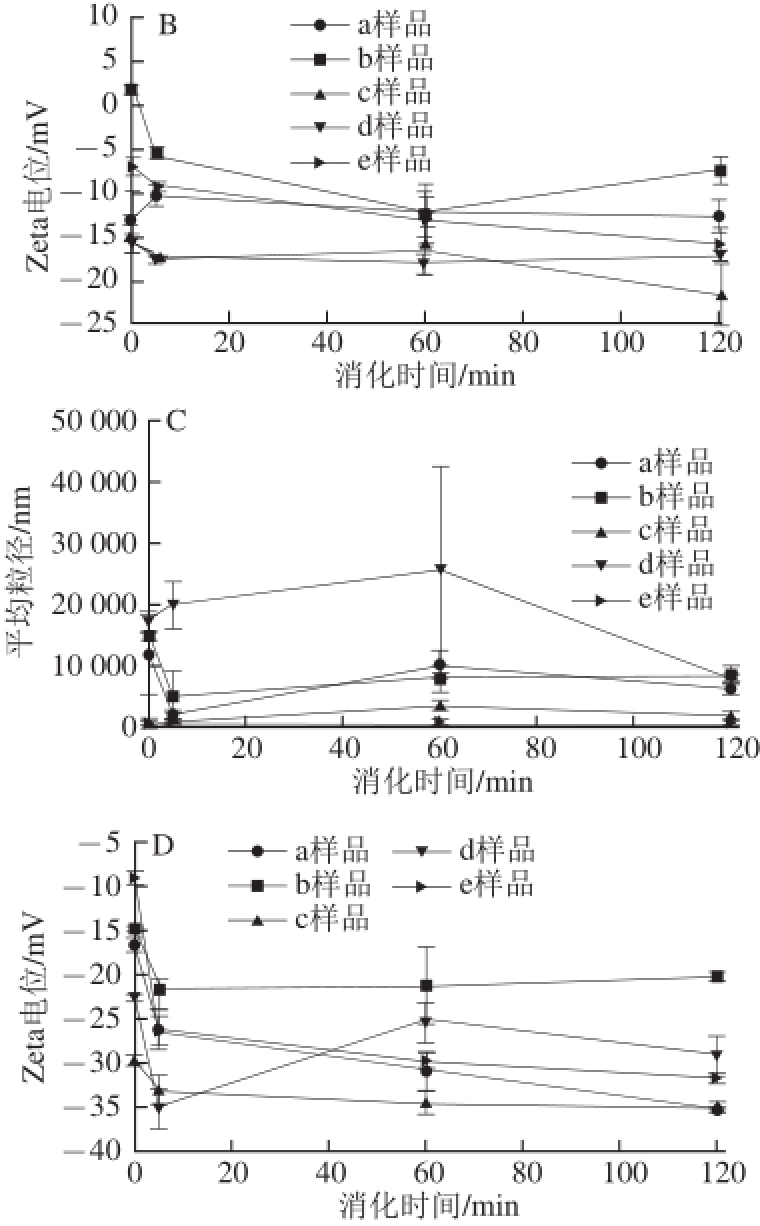
图5 脂质体在模拟婴儿(A和B)和成人(C和D)小肠液中不同消化时间的平均粒径和Zeta电位变化
Fig.5 Changes in average diameter and Zeta potential of liposomes during simulated infant (A and B) and adult (C and D) SIF digestion
由图5可知,脂质体在婴儿小肠环境中的粒径比成人中小,Zeta电位都有不同程度的降低,婴儿的降低幅度比成人小。这说明婴儿肠道对脂质体的影响小于成人,这是由于成人肠液中含有更高浓度的胆盐和胰酶。脂质体本身是一种脂质,胰酶中主要为胰蛋白酶、胰淀粉酶与胰脂肪酶,其中的胰脂肪酶是使脂质体结构改变的关键。脂肪酶即三酰基甘油酰基水解酶,可催化底物油脂水解,生成脂肪酸、甘油和甘油单酯或二酯,导致肠液环境对脂质体有较大的破坏性 [23]。而壳聚糖为多糖,在外层对脂质体有一定的保护作用,降低了胰酶与脂质的接触机会,从而减轻了脂质体的破坏程度 [24]。Zou Liqiang等 [25]研究了壳聚糖修饰纳米脂质体在模拟消化环境中的稳定性变化,发现在胃肠道环境下的颗粒大小没有明显变化,但与模拟肠液混合后立即形成沉淀物,也证明了肠液对脂质体稳定性的影响更大。
本研究通过显微镜观察得知脂质体和修饰脂质体已成功制备;壳聚糖修饰与未修饰脂质体经加热(加速氧化)、AAPH诱导-紫外照射和模拟小肠液体外消化处理结果表明:当脂质体受外界环境影响时,壳聚糖修饰的脂质体明显比未修饰的脂质体稳定;高质量浓度壳聚糖修饰的脂质体比低浓度壳聚糖修饰的脂质体具有更高的稳定性;相比在婴儿小肠液的消化,脂质体在成人小肠液消化过程中结构变化更为明显。
参考文献:
[1] TAYLOR T M, DAVIDSON P M, BRUCE B D, et al. Liposomal nanocapsules in food science and agriculture[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(7/8): 587-605. DOI:10.1080/10408390591001135.
[2] THOO Y Y, ABAS F, LAI O M, et al. Antioxidant synergism between ethanolic Centella asiatica extracts and α-tocopherol in model systems[J]. Food Chemistry, 2013, 138(2): 1215-1219. DOI:10.1016/ j.foodchem.2012.11.013.
[3] MAHERANI B, ARAB-TEHRANY E, KHEIROLOMOOM A, et al. Influence of lipid composition on physicochemical properties of nanoliposomes encapsulating natural dipeptide antioxidant L-carnosine[J]. Food Chemistry, 2012, 134(2): 632-640. DOI:10.1016/ j.foodchem.2012.02.098.
[4] NONGONIERMA A B, ABRLOVA M, KILCAWLEY K N. Encapsulation of a lactic acid bacteria cell-free extract in liposomes and use in cheddar cheese ripening[J]. Foods, 2013, 2(1): 100-119. DOI:10.3390/foods2010100.
[5] LIU W L, YE A Q, LIU W, et al. Liposomes as food ingredients and nutraceutical delivery systems[J]. Agro Food Industry Hi-Tech, 2013, 24(2): 68-71. DOI:10.1533/9780857095909.3.287.
[6] LIU W L, YE A Q, LIU W, et al. Behaviour of liposomes loaded with bovine serum albumin during in vitro digestion[J]. Food Chemistry, 2015, 175: 16-24. DOI:10.1016/j.foodchem.2014.11.108.
[7] ZHOU W, LIU W, ZOU L Q, et al. Storage stability and skin permeation of vitamin C liposomes improved by pectin coating[J]. Colloids and Surfaces B: Biointerfaces, 2014, 117: 330-337. DOI:10.1016/j.colsurfb.2014.02.036.
[8] LIU W, LIU J H, LIU W, et al. Improved physical and in vitro digestion stability of a polyelectrolyte delivery system based on layerby-layer self-assembly alginate-chitosan-coated nanoliposomes[J]. Journal of Agricultural and Food Chemistry, 2013, 61(17): 4133-4144. DOI:10.1021/jf305329n.
[9] PANYA A, LAGUERRE M, LECOMTE J, et al. Effects of chitosan and rosmarinate esters on the physical and oxidative stability of liposomes[J]. Journal of Agricultural Food Chemistry, 2010, 58: 4679-5684. DOI:10.1021/jf100133b.
[10] 帅武平, 张幸国, 陈金亮, 等. 壳聚糖修饰脂质体的制备和性质研究[J]. 中国药学杂志, 2007, 42(15): 1159-1163. DOI:10.3321/ j.issn:1001-2494.2007.15.011.
[11] ZHAO G D, SUN R, NI S L, et al. Development and characterisation of a novel chitosan-coated antioxidant liposome containing both coenzyme Q10 and alpha-lipoic acid[J]. Journal of Microencapsulation, 2015: 157-165. DOI:10.3109/02652048.2014.973072.
[12] PENG H L, LI W J, NING F J, et al. Amphiphilic chitosan derivativesbased liposomes: synthesis, development, and properties as a carrier for sustained release of salidroside[J]. Journal of Agricultural and Food Chemistry, 2014, 62(3): 626-633. DOI:10.1021/jf4039925.
[13] LIU W, YE A Q, LIU W, et al. Stability during in vitro digestion of lactoferrin-loaded liposomes prepared from milk fat globule membrane-derived phospholipids[J]. Journal of Dairy Science, 2013, 96(4): 2061-2070. DOI:10.3168/jds.2012-6072.
[14] LIU W L, YE A Q, LIU C M, et al. Structure and integrity of liposom es prepared from milk- or soybean-derived phospholipids during in vitro digestion[J]. Food Research International, 2012, 48(2): 499-506. DOI:10.1016/j.foodres.2012.04.017.
[15] KLINKESORN U, MCCLEMENTS D J. Influence of chitosan on stability and lipase digestibility of lecithin-stabilized tuna oil-inwater emulsions[J]. Food Chemistry, 2009, 114(4): 1308-1315. DOI:10.1016/j.foodchem.2008.11.012.
[16] WANG J Y, MARKS J, LEE K Y C. Nature of interactions between PEO-PPO-PEO triblock copolymers and lipid membranes: (I) effect of polymer hydrophobicity on its ability to protect liposomes from peroxidation[J]. Biomacromolecules, 2012, 13(9): 2616-2623. DOI:10.102-1/bm300847x.
[17] DUPONT D, MANDALARI G, MOLLE D, et al. Comparative resistance of food proteins to adult and infant in vitro digestion models[J]. Molecular Nutritio n and Food Research, 2010, 54(6): 767-780. DOI:10.1002/mnfr.200900142.
[18] 张激, 程艳菊, 吕浩, 等. 脂质体的研究新进展[J]. 南京工业大学学报, 2003, 25(4): 102-106. DOI:10.3969/j.issn.1671-7627.2003.04.024.
[19] THOMPSON A K, HAISMAN D, SINGH H. Ph ysical stability of liposomes prepared from milk fat globule membrane and soya phospholipids[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 6390-6397. DOI:10.1021/jf0605695.
[20] 贺然, 刘国琴, 李琳. β-谷甾醇对脂质体抗氧化性及膜结构稳定性的影响[J]. 中国油脂, 2012, 37(9): 57-61. DOI:10.3969/ j.issn.1003-7969.2012.09.015.
[21] NIETO G, HUVAERE D, SKIBSTED L H. Antioxidant activity of rosemary and thyme by-products and synergism with added antioxidant in a liposome system[J]. European Food Research and Technology, 2011, 233: 11-18. DOI:10.1007/s00217-011-1486-9.
[22] 魏茂提, 王世鑫, 李玉明, 等. 单纯收缩期高血压和双相高血压患者血清NOS活力及MDA水平的变化[J]. 中国慢性病预防与控制, 2001, 9(4): 149-150. DOI:10.3969/j.issn.1004-6194.2001.04.0 02.
[23] WILDE P J, CHU B S. Interfacial & colloidal aspects of lipid digestion[J]. Advances in Colloid and Interface Science, 2011, 165(1): 14-22. DOI:10.1016/j.cis.2011.02.004.
[24] GIBIS M, RAHN N, WEISS J. Physical and oxidative stability of uncoated and chitosan-coated liposomes containing grape seed extract[J]. Pharmaceutics, 2013, 5(3): 421-433. DOI:10.3390/ pharmaceutics5030421.
[25] ZOU L Q, PENG S F, LIU W, et al. A novel delivery system dextran sulfate coated amphiphilic chitosan derivatives-based nanoliposome: capacity to improve in vitro digestion stability of (−)-epigallocatechin gallate[J]. Food Research International, 2015, 69: 114-120. DOI:10.1016/j.foodres.2014.12.015.
Environmental Stress and in Vitro Digestion Stability of Chitosan-Coated Liposomes
LIU Weilin, LI Ling, WEI Fuqiang, HAN Jianzhong*
(School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China)
Abstract:Chitosan-modified crude liposomes and nano liposomes were studied for changes in average diameter, surface charge and malondialdehyde content after treatment with accelerated oxidation (heating), UV radiation combined with free radical inducement and in vitro simulated digestion. The results showed that, after each treatment, the stability of the chitosan-coated liposomes was significantly higher than bare liposomes. The higher the concentration of chitosan, the stronger the stability of coated liposomes under environment stress and digestion.
Key words:liposomes; chitosan; digestion; stability
DOI:10.7506/spkx1002-6630-201601002
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)01-0006-06
引文格式:
刘玮琳, 李羚, 魏富强, 等. 壳聚糖修饰脂质体的环境压力和体外消化稳定性[J]. 食品科学, 2016, 37(1): 6-11.
DOI:10.7506/spkx1002-6630-201601002. http://www.spkx.net.cn
LIU Weilin, LI Ling, WEI Fuqiang, et al. Environmental stress and in vitro digestion stability of chitosan-coated liposomes[J]. Food Science, 2016, 37(1): 6-11. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601002.
收稿日期:2015-03-01
基金项目:国家自然科学基金青年科学基金项目(31401482);浙江省教育厅科研项目(Y201432148);
浙江省食品科学与工程重中之重一级学科开放基金项目(JYTSP20142011);
浙江工商大学研究生科研创新基金项目(3100XJ1514117)
作者简介:刘玮琳(1984—),女,讲师,博士,研究方向为营养物及其运载体系的生物利用。E-mail:lwl512@zjgsu.edu.cn
*通信作者:韩剑众(1963—),男,教授,博士,研究方向为食品质量安全控制。E-mail:Hanjz@zjgsu.edu.cn