胡玲玲 1,2,李春阳 1,*,曾晓雄 2,吴建苏 3
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095;3.南京远望富硒农产品有限责任公司,江苏 南京 211500)
摘 要:采用碱提酸沉法提取了糙米和富硒发芽糙米中的蛋白,对其抗氧化活性进行分析测定,并与对照品芦丁和VC进行了比较。结果表明:富硒发芽糙米蛋白的总抗氧化能力(total antioxidant capacity,T-AOC)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、超氧阴离子自由基(O 2 -·)清除率和还原力低于芦丁和VC,氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)显著低于芦丁(P<0.05),但是显著高于糙米蛋白(P<0.05);富硒发芽糙米蛋白的羟自由基(·OH)清除能力与芦丁和VC相当,但显著高于糙米蛋白(P<0.05)。富硒发芽后的糙米蛋白抗氧化能力显著提高。
关键词:富硒发芽糙米;蛋白;抗氧化;清除自由基
http://www.spkx.net.cn
人体在利用氧的过程中会产生一些活性氧和自由基,这些活性氧和自由基一旦过剩,就会损伤细胞,进而使器官组织受损,引发疾病 [1]。尽管所有生物体内都具有内源性的抗氧化防御和修复系统,能在一定程度上抵抗机体的氧化,但是不足以彻底阻止机体氧化带来的损害,因此需要依靠摄入外源的抗氧化食品来抵御 [2-3]。
硒是人体必需的微量元素 [4-5],目前认为生物体内发挥生理功能的硒形态主要是以硒代半胱氨酸为活性中心的硒蛋白,其具有抗氧化、清除自由基等作用 [6-7]。如果机体缺硒,则体内硒蛋白的生物活性下降,产生自由基,引发链式反应,导致细胞膜发生氧化,细胞受损,诱发疾病。Molan等 [8]比较了富硒绿茶与普通绿茶的抗氧化活性,结果显示富硒绿茶的还原力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力显著高于普通绿茶。此外有研究显示,用富硒大蒜喂养小鼠增强了小鼠的抗疲劳性 [9]。研究表明,通过膳食摄入硒(1 mg/d)能显著提高机体的免疫能力,因此硒对机体生理是重要的也是必需的 [10-11]。糙米在生长发芽过程中,通过自身代谢作用,可以吸收无机硒转化为有机硒,从而显著提高自身的抗氧化能力。此外发芽也增加了糙米中的一些营养成分,特别是γ-氨基丁酸、谷胱甘肽、肌醇磷酸等活性物质,提高了富硒发芽糙米的营养活性 [12-14]。
本实验采用碱法提取糙米和富硒发芽糙米中的蛋白,从总抗氧化能力(total antioxidant capacity,T-AOC)、DPPH自由基清除率、羟自由基(·OH)清除率等方面比较了富硒发芽糙米蛋白和糙米蛋白的体外抗氧化活性,以期为富硒发芽糙米产品的开发、生产以及市场拓展提供可靠的理论依据。
1.1 材料与试剂
糙米,购于南京远望米业有限公司;富硒发芽糙米,由江苏省农业科学院农产品加工研究所实验室制备(硒含量0.870 mg/kg)。
硒标准储备液(100 μg/mL) 核工业北京化工冶金研究院;DPPH 美国Sigma公司;铁氰化钾、三氯乙酸、三氯化铁、无水乙醇 国药集团化学试剂有限公司;荧光素钠、2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride,AAPH)标准品 阿拉丁试剂有限公司;总抗氧化能力检测试剂盒 南京建成生物工程研究所;牛血清白蛋白标准品 上海源叶有限公司。
1.2 仪器与设备
TriStar LB 941微孔板式多功能分析仪 德国Berthold Technologies公司;752S紫外-可见分光光度计上海棱光技术有限公司;PHS-2C数显pH计 上海仪器仪表有限公司;Eyela FDU-1200冷冻干燥机 东京理化器械株式会社;PF6-2原子荧光分光光度计 北京普析通用仪器责任有限公司。
1.3 方法
1.3.1 糙米蛋白的制备
1.3.1.1 蛋白质的提取
将富硒发芽糙米和糙米粉碎,过100 目筛,按照1∶5(m/V)的比例加入正己烷,室温下搅拌脱脂4 h,通风干燥12 h。称取10 g脱脂富硒发芽糙米粉 [16]和糙米粉,加入200 mL 0.1 mol/L的NaOH溶液在40 ℃条件下恒温搅拌3 h,提取结束后在4 000 r/min条件下离心15 min,收集上清液,沉淀中再加200 mL 0.1 mol/L的NaOH溶液按上述条件再提取,合并上清液。用0.01 mol/L HCl溶液调节pH值至5.4,在4 000 r/min条件下离心15 min,弃上清液,沉淀水洗两次后冷冻干燥,得到蛋白 [5,17]。使用时用磷酸盐缓冲液(phosphate buffered saline,PBS)配成不同的质量浓度。
1.3.1.2 蛋白质含量的测定
准确称取0.1 mg考马斯亮蓝溶解于50 mL 90%的乙醇,与100 mL 85%的磷酸混合,加水定容至1 000 mL。取0、0.2、0.4、0.6、0.8、1.0 mL的0.1 mg/mL的标准蛋白加蒸馏水至1 mL,再加5 mL考马斯亮蓝溶液,静置5 min,在595 nm波长处测定吸光度,以标准蛋白质质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程为y=0.006x+0.008(R 2=0.999),标准曲线在蛋白质质量浓度0~100 μg/mL范围时具有良好的线性。样品中蛋白质含量测定同上 [15]。
1.3.2 硒含量的测定
参照GB 5009.93—2010《食品中硒的测定》氢化物原子荧光光谱法。
1.3.3 抗氧化性分析
1.3.3.1 总抗氧化能力的测定
按试剂盒说明书上的方法测定抗氧化能力。取两支试管,分别标记为测试管和对照管。分别 向两支试管中加1 mL试剂1,在测试管中加入0.2 mL的待测样本;分别向两支试管中加入2 mL试剂2和0.5 mL试剂3,然后用漩涡混匀器充分混匀, 37 ℃水浴30 min;分别向两支试管中加入0.2 mL试剂4,在对照管中加入0.2 mL的待测样本,然后再向两支试管中加入0.2 mL试剂5;最后混匀,放置10 min,蒸馏水调零,在520 nm波长处测定光密度值。
1.3.3.2 DPPH自由基清除率的测定
用95%的乙醇溶液配制0.2 mg/L的DPPH溶液,避光4 ℃保存,现配现用。取3 mL不同质量浓度的待测液,空白管加入3 mL 95%乙醇,最后加入2 mL DPPH溶液,在室温避光静置30 min,在517 nm波长处测定吸光度的变化。按下式计算DPPH自由基清除率 [18]。
1.3.3.3 ·OH清除率的测定
25 mL比色管中依次移取5 mL的1 mmol/L的硫酸亚铁溶液,空白管和样品管中各加5 mL的3 mmol/L过氧化氢溶液,本底管用蒸馏水,加入空白和样品,用3 mmol/L的水杨酸溶液定容至刻度。在37 ℃水浴锅中反应15 min,在510 nm波长处测定吸光度 [19]。
1.3.3.4
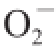 ·清除率测定
·清除率测定
取4.5 mL的0.05 mol/L Tris-HCl(pH 8.2)缓冲液置于37 ℃水浴中恒温30 min,空白管和样品管中加入0.5 mL的25 mmol/L邻苯三酚,本底管用蒸馏水代替,在样品管和本底管中加入不同体积的样品,混匀后在37 ℃水浴锅中反应5 min,最后加入1 mL的0.2 mol/L盐酸溶液终止反应。在420 nm波长处测定吸光度 [19]。
1.3.3.5 还原力的测定
取2 mL的待测液加入pH 6.6的PBS缓冲液2.5 mL和1%铁氰化钾溶液2.5 mL,混合后在50 ℃条件下放置20 min,加入10%的三氯乙酸溶液1 mL,5 000 r/min离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,混匀,静置10 min,在700 nm波长处测定吸光度。以80%的乙醇溶液作为空白对照。以待测液与空白对照吸光度的差值为样品的还原力。
1.3.3.6 氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)测定 [20-22]
在96 孔微孔板上加入100 μL不同质量浓度的富硒发芽糙米蛋白、糙米蛋白和芦丁待测液,同时加入不同质量浓度Trolox作对照,再用12 道移液器在每孔中加入50 μL 0.4 μmol/L荧光素钠混合,37 ℃反应15 min后,向每孔中加入50 μL 60 mmol/L的AAPH,选择激发波长485 nm,吸收波长535 nm,立即微孔板式多功能分析仪中测定荧光强度,连续测定100 min。实验所得的各微孔反应的荧光强度数据采用积分法计算荧光衰退曲线下面积(area under curve,AUC)。ORAC值由样品梯度质量浓度抗氧化保护面积(AUC 样品-net AUC)曲线与Trolox标准品梯度质量浓度抗氧化保护面积(AUC Trolox-net AUC)曲线的斜率比得出,ORAC值以Trolox当量表达,即μmol Trolox/g [23]。
1.4 数据处理
利用GraphPad prism6.0软件和SPSS 20.0处理数据 [24-25]。
2.1 富硒发芽糙米蛋白提取率及其硒含量
采用碱法提取富硒发芽糙米和糙米中的蛋白,糙米蛋白提取率为(52.36±1.37)%,富硒发芽糙米蛋白提取率为(50.22±2.74)%;糙米蛋白提取物中不含硒,富硒发芽糙米蛋白提取物中含硒(0.18±0.01)mg/kg。
2.2 总抗氧化能力
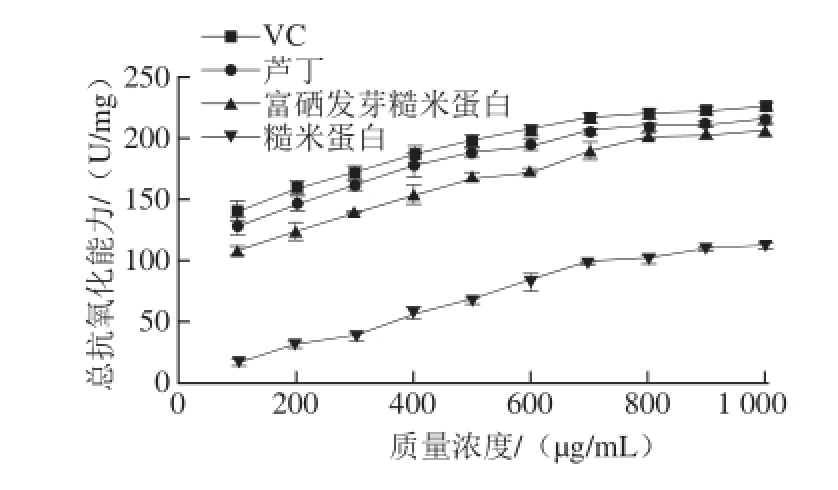
图1 不同质量浓度VC、芦丁、富硒发芽糙米蛋白和糙米蛋白的总抗氧化能力
Fig.1 T-AOC of Se-enriched germinated brown rice protein, ordinary brown rice protein, rutin and VC at various concentrations
由图1可知,随着质量浓度的升高,富硒发芽糙米蛋白、糙米蛋白、VC、芦丁的总抗氧化能力均逐渐增强,4 种物质总抗氧化能力的大小顺序为:VC>芦丁>富硒发芽糙米蛋白>糙米蛋白(P<0.05)。富硒发芽糙米中蛋白的总抗氧化能力显著高于糙米蛋白(P<0.05)是因为在富硒发芽糙米蛋白中硒以硒代半胱氨酸形式存在,能螯合起催化作用的金属离子,因此其总抗氧化能力显著高于糙米蛋白。
2.3 对DPPH自由基的清除能力
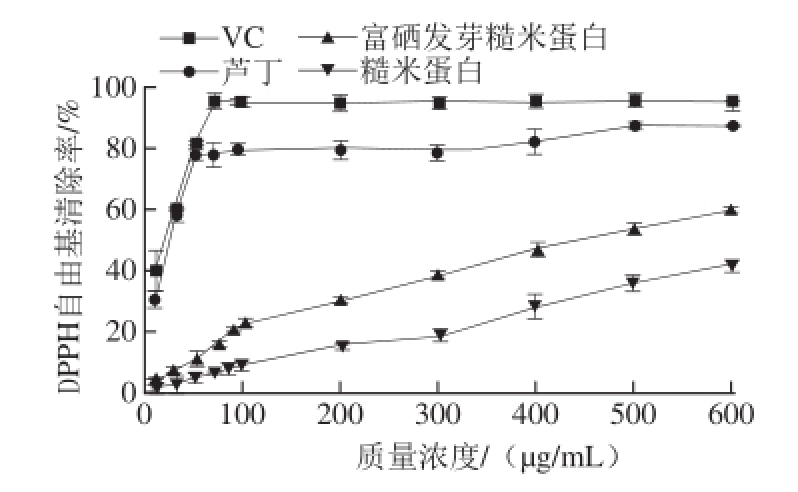
图2 不同质量浓度VC、芦丁、富硒发芽糙米蛋白和糙米蛋白的DPPH自由基清除率
Fig.2 DPPH radical scavenging activity of Se-enriched germinated brown rice protein, ordinary brown rice protein, rutin and VC at various concentrations
由图2可知,VC、芦丁、富硒发芽糙米蛋白、糙米蛋白都具有一定的DPPH自由基清除能力,VC和芦丁随着质量浓度的增加,其DPPH自由基清除能力先快速增强,之后基本不变;富硒发芽糙米蛋白、糙米蛋白随着样品质量浓度的增加,DPPH自由基清除能力也随之增加。在相同质量浓度下富硒发芽糙米蛋白的D PPH自由基清除率明显高于糙米蛋白,这是因为硒以硒代半胱氨酸存在于酶的活性中心,特别是谷胱甘肽过氧化物酶,具有很强的抗氧化性,能清除DPPH自由基。VC、芦丁、富硒发芽糙米蛋白和糙米蛋白清除DPPH自由基的IC 50值分别为15.30、18.12、445.2、902.8 μg/mL,因此清除DPPH自由基能力大小顺序为:VC>芦丁>富硒发芽糙米蛋白>糙米蛋白(P<0.05)。
2.4 对·OH的清除能力
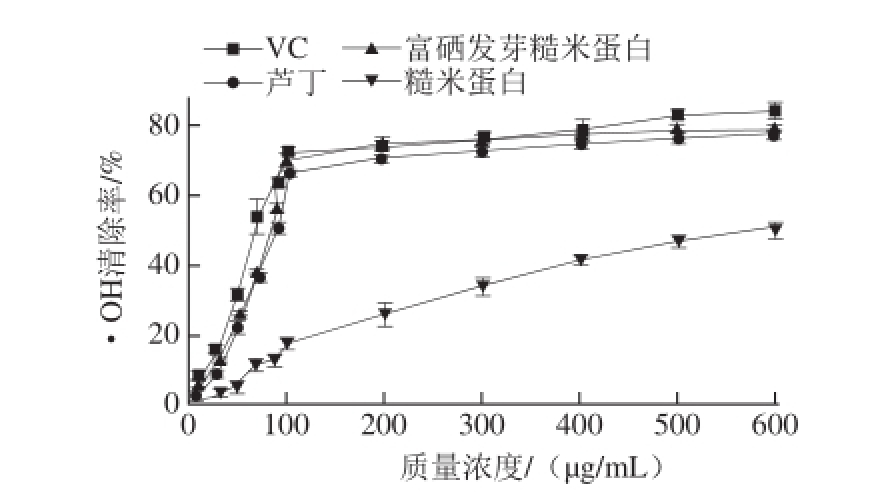
图3 不同质量浓度VC、芦丁、富硒发芽糙米蛋白和糙米蛋白的·OOHH清除率
Fig.3 Hydroxyl radical scavenging activity of Se-enriched germinated brown rice protein, ordinary brown rice protein, rutin and VC at various concentrations
由图3可知,VC、芦丁、富硒发芽糙米蛋白、糙米蛋白都有一定的·OH清除能力,且随着质量浓度的增加,VC、芦丁、富硒发芽糙米蛋白清除·OH能力明显增强,当质量浓度达到100 μg/mL时,清除能力基本保持不变;而糙米蛋白随着质量浓度的增加,其·OH清除能力逐渐增强。在相同质量浓度下,VC、芦丁和富硒发芽糙米蛋白的·OH清除能力差异很小,但均高于糙米蛋白。VC、芦丁、富硒发芽糙米蛋白、糙米蛋白清除·OH的IC 50值分别为75.38、106.9、97.61、609.2 μg/mL;富硒发芽糙米蛋白·OH清除率显著大于糙米蛋白清除率(P<0.05),这是因为硒蛋白以及含硒的酶类物质能够有效清除·OH。
2.5 对O 2 -·的清除能力
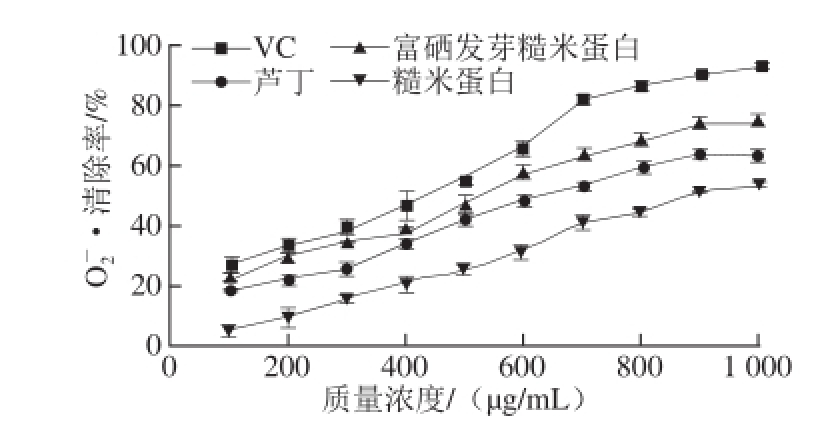
图4 不同质量浓度VC、芦丁、富硒发芽糙米蛋白和糙米蛋白的
 ·清除率
·清除率
Fig.4 Superoxide anion radical scavenging activity of Se-enriched germinated brown rice protein, ordinary brown rice protein, rutin and VC at various concentrations
由图4可知,随着质量浓度的增加,VC、芦丁、富硒发芽糙米蛋白、糙米蛋白
 ·清除能力逐渐增强,VC、芦丁、富硒发芽糙米蛋白、糙米蛋白清除
·清除能力逐渐增强,VC、芦丁、富硒发芽糙米蛋白、糙米蛋白清除
 ·的IC
50值分别为350.7、618.7、483.4、918.1 μg/mL,其
·的IC
50值分别为350.7、618.7、483.4、918.1 μg/mL,其
 ·清除能力大小顺序为VC>芦丁>富硒发芽糙米蛋白>糙米蛋白。这是由于以硒为活性中心的蛋白能有效清除
·清除能力大小顺序为VC>芦丁>富硒发芽糙米蛋白>糙米蛋白。这是由于以硒为活性中心的蛋白能有效清除
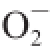 ·,因此富硒发芽糙米蛋白
·,因此富硒发芽糙米蛋白
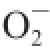 ·清除率显著大于糙米蛋白(P<0.05)。
·清除率显著大于糙米蛋白(P<0.05)。
2.6 还原力
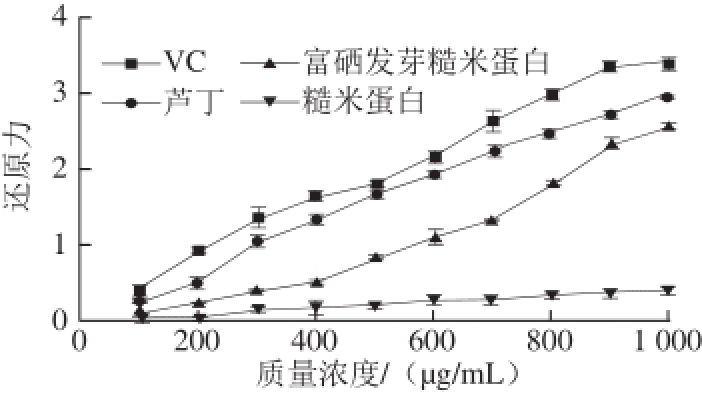
图5 不同质量浓度VC、芦丁、富硒发芽糙米蛋白和糙米蛋白的还原力
Fig.5 Reducing power of Se-enriched germinated brown rice protein, ordinary brown rice protein, rutin and VC at various concentrations
由图5可知,随着质量浓度的升高,VC、芦丁、富硒发芽糙米蛋白、糙米蛋白还原力也明显升高,在相同质量浓度下,VC的还原力显著高于芦丁、富硒发芽糙米蛋白和糙米蛋白。根据量效方程,对VC、芦丁、富硒发芽糙米蛋白、糙米蛋白还原力进行非线性拟合,拟合曲线相关系数R 2分别为0.993、0.991、0.990、0.992,拟合结果显著,IC 50值分别为101.333、169.333、381.392、1 200.670 μg/mL,及还原力大小为VC>芦丁>富硒发芽糙米蛋白>糙米蛋白(P<0.05)。这是因为在富硒发芽糙米蛋白中硒以硒代半胱氨酸形式存在,能有效除去起催化作用的金属离子。
2.7 氧化自由基吸收能力
图6a为不同梯度质量浓度Trolox、阳性对照(-AAPH)以及阴性对照(+AAPH)的荧光衰变曲线,图6b~c分别为3 种样品(芦丁、富硒发芽糙米蛋白、糙米蛋白)不同质量浓度梯度的荧光衰变曲线,随质量浓度的增加,样品抗氧化保护面积(AUC 样品-net AUC)增加。根据方法1.3.3.6节计算Trolox与3 种待测样品的抗氧化保护面积曲线斜率,计算得到芦丁的ORAC值为758.91 μmol Trolox/g,富硒发芽糙米蛋白的ORAC值为673.52 μmol Trolox/g,糙米蛋白的ORAC值为5.52 μmol Trolox/g。富硒发芽糙米蛋白和糙米蛋白ORAC值均低于芦丁,但富硒发芽糙米蛋白ORAC值显著高于糙米蛋白(P<0.05),说明富硒发芽糙米蛋白氧自由基吸收能力明显强于糙米蛋白。
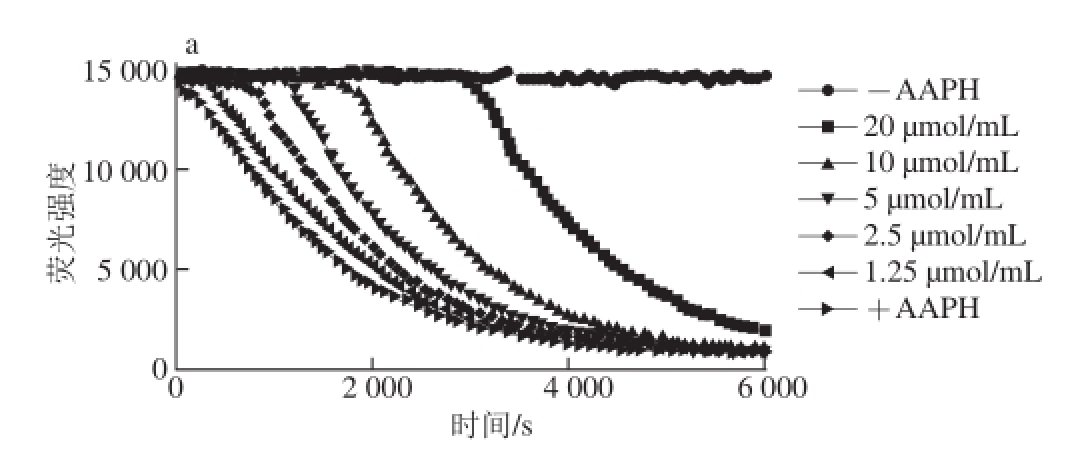
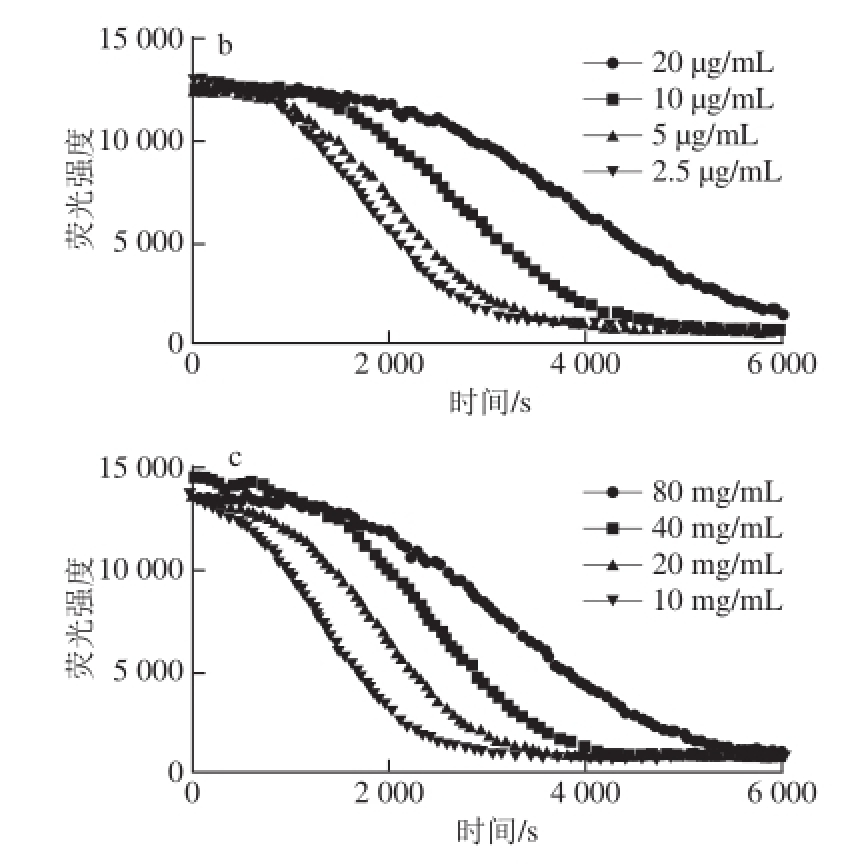
图6 Trolox、芦丁、富硒发芽糙米蛋白和糙米蛋白的荧光衰变曲线
Fig.6 Fluorescence decay curves of Trolox, rutin, Se-enriched germinated brown rice protein and ordinary brown rice protein at various concentrations
本实验通过碱法提取糙米和富硒发芽糙米蛋白,采用6 种抗氧化活性测定方法,对富硒发芽糙米蛋白和糙米蛋白抗氧化清除自由基能力进行了分析和研究,结果表明,富硒发芽糙米蛋白与VC和芦丁的·OH清除率无显著差异,均显著高于糙米蛋白;富硒发芽糙米蛋白的T-AOC、DPPH自由基清除能力、O 2 -·清除率、还原力均低于芦丁和VC,ORAC值低于芦丁,但是均显著高于糙米蛋白。研究结果表明,由于富硒发芽糙米蛋白中结合了硒,形成了以硒代半胱氨酸为中心得硒蛋白,抗氧化性和清除自由基能力显著增强 [6],因此富硒发芽糙米蛋白相对于糙米蛋白的抗氧化能力显著提高。
参考文献:
[1] 常虹, 张利燕, 周家华, 等. 理化因素对板栗雄花序黄酮清除羟自由基活性的影响[J]. 食品工业, 2015, 36(3): 111-114.
[2] 岳晶念. 富硒大蒜含硒蛋白提取分离、初步纯化及抗氧化活性的研究[D]. 武汉: 华中农业大学, 2009.
[3] 赵萍, 刘笑笑, 王雅, 等. 富硒小麦提取物中硒含量及其抗氧化特性[J]. 食品科学, 2014, 35(15): 94-98. DOI:10.7506/spkx1002-6630-201415019.
[4] DENNERT G, ZWAHLEN M, BRINKMAN M, et al. Selenium for preventing cancer[J]. The Cochrane Database of Systematic Reviews, 2011. DOI:10.1002/14651858.CD005195.pub3.
[5] LIPPMAN S M, KLEIN E A, GOODMAN P J, et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the selenium and vitamin E cancer prevention trial (SELECT)[J]. Jama, 2009, 301(1): 39-51. DOI:10.1001/jama.2008.864.
[6] 刘昆仑. 发芽糙米富硒特性及其硒蛋白抗氧化与抗肿瘤活性研究[D].南京: 南京农业大学, 2010.
[7] CAO J, GUO F C, ZHANG L Y, et al. Effects of dietary Selenomethionine supplementation on growth performance, antioxidant status, plasma selenium concentration, and immune function in weaning pigs[J]. Journal of Animal Science and Biotechnology, 2015, 6(1): 46-53. DOI:10.1186/2049-1891-5-46.
[8] MOLAN A L, FLANAGAN J, WEI W, et al. Selenium-containing green tea has higher antioxidant and prebiotic activities than regular green tea[J]. Food Chemistry, 2009, 114(3): 829-835. DOI:10.1016/ j.foodchem.2008.10.028.
[9] 李慧, 李伟, 范轶欧. 富硒蒜对小鼠缓解体力疲劳作用的实验研究[J]. 中国卫生检验杂志, 2008, 17(11): 1941-1942. DOI:10.3969/ j.issn.1004-8685.2007.11.008.
[10] SITTA A, VANZIN C S, BIANCINI G B, et al. Evidence that L-carnitine and selenium supplementation reduces oxidative stress in phenylketonuric patients[J]. Cellular and Molecular Neurobiology, 2015, 16(3). DOI:10.1007/s10571-010-9636-3.
[11] SITTA A, VANZIN C S, BIANCINI G B, et al. Evidence that L-carnitine and selenium supplementation reduces oxidative stress in phenylketonuric patients[J]. Cellular and Molecular Neurobiology, 2011, 31(3): 429-436. DOI:10.1007/s10571-010-9636-3.
[12] DWIVEDI Y. The neurobiological basis of suicide[M]. 4th ed. Boca Raton: CRC Press/Taylor & Francis, 2012: 65.
[13] STREETER C C, GERBARG P L, SAPER R B, et al. Effects of yoga on the autonomic nervous system, gamma-aminobutyric-acid, and allostasis in epilepsy, depression, and post-traumatic stress disorder[J]. Medical Hypotheses, 2012, 78(5): 571-579. DOI:10.1016/ j.mehy.2012.01.021.
[14] ENOMOTO T, TSE M T, FLORSCO S B. Reducing prefrontal gamma-aminobutyric acid activity induces cognitive, behavioral, and dopaminergic abnormalities that resemble schizophrenia[J]. Biological Psychiatry, 2011, 69(5): 432-441.
[15] 张卓, 赵萍, 郭健, 等. 富硒花生中含硒蛋白的提取及其抗氧化性的研究[J]. 食品工业科技, 2012, 33(4): 323-326.
[16] 胡玲玲, 李春阳, 曾晓雄. 响应曲面法优化糙米富硒发芽工艺研究[J].食品工业科技, 2015, 36(17): 234-238.
[17] 邱伟芬, 罗佩竹, 方勇, 等. 大米源硒代多肽的酶法制备及其抗氧化活性的研究[J]. 中国粮油学报, 2013, 28(4): 1-7. DOI:10.3969/ j.issn.1003-0174.2013.04.001.
[18] 李春阳, 冯进. 蓝莓叶多酚与蓝莓果渣多酚提取物抗氧化活性研究[J].食品工业科技, 2013, 34(7): 56-60.
[19] 樊秀花, 范志华, 何新益. 糙米发芽前后液化汁抗氧化性比较[J]. 中国粮油学报, 2013, 28(12): 1-4.
[20] 于丽伟, 王聪智, 何蓉蓉. 刺梨果汁对拘束负荷诱发小鼠肝损伤的保护作用[J]. 食品与生物技术学报, 2010, 29(5): 730-735.
[21] 杨涛, 吴辉辉, 徐青, 等. 抗氧化性能评价ORAC法及最新研究进展[J].食品工业科技, 2009, 30(7): 352-355.
[22] 曹亚兰, 赵谋明, 郑赛晶, 等. 以ORAC法为评价指标优化制备大豆抗氧化肽[J]. 食品与发酵工业, 2011, 37(10): 73-77.
[23] KEVERS C, SIPEL A, PINCEMAIL J, et al. Antioxidant capacity of hydrophilic food matrices: optimization and validation of ORAC assay[J]. Food Analytical Methods, 2014, 7(2): 409-416. DOI:10.1007/ s12161-013-964 0-6.
[24] KIS E, RAJNAI Z, IOJA E, et al. Mouse Bsep ATPase assay: a nonradioactive tool for assessment of the cholestatic potential of drugs[J]. Journal of Biomolecular Screening, 2009, 14(1): 10-15. DOI:10.1177/1087057108326145.
[25] KHAN R A, KHAN M R, SAHREEN S, et al. Assessment of flavonoids contents and in vitro antioxidant activity of Launaea procumbens[J]. Chemistry Central Journal, 2012, 6(1): 43-54. DOI:10.1186/1752-153X-6-43.
Antioxidant Activity of Selenium-Enriched Germinated Brown Rice Protein
HU Lingling
1,2, LI Chunyang
1,*, ZENG Xiaoxiong
2, WU Jiansu
3
(1. Institute of Agro-Food Science and Technology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 3. Jiangsu Yuanwang Selenium-rich Agricultural Produce Co. Ltd., Nanjing 211500, China)
Abstract:In this study, selenium-enriched germinated brown rice protein was extracted using alkali extraction and acid precipitation, and its antioxidant activity was compared with that of the
reference s:ubstances of rutin and VC. The results demonstrated that total antioxidant capacity (T-AOC), DPPH free radical scavenging activity, superoxide anion free radical scavenging activity, and reducing power of the protein were lower than those of rutin and VC, and its oxygen radical absorbance capacity (ORAC) was significantly lower than that of rutin (P < 0.05), but significantly higher than that of the protein extracted from the ungerminated ordinary brown rice protein (P < 0.05). Hydroxyl radical scavenging activity of Se-enriched germinated brown rice protein was similar to that of rutin, but significantly higher than that of ordinary brown rice protein (P < 0.05). Therefore, antioxidant activity of the protein from se-enriched germinated brown rice was significantly improved.
Key words:Se-enriched germinated brown rice; protein; antioxidant activity; free radical scavenging
DOI:10.7506/spkx1002-6630-201601018
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)01-0099-05
引文格式:
胡玲玲, 李春阳, 曾晓雄, 等. 富硒发芽糙米蛋白的抗氧化活性[J]. 食品科学, 2016, 37(1): 99-103. DOI:10.7506/ spkx1002-6630-201601018. http://www.spkx.net.cn
HU Lingling, LI Chunyang, ZENG Xiaoxiong, et al. Antioxidant activity of selenium-enriched germinated brown rice protein[J]. Food Science, 2016, 37(1): 99-103. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601018.
收稿日期:2015-07-11
基金项目:江苏省产学研前瞻性联合研究项目(BY2012037);江苏省农业自主创新基金项目(CX(12)3986)
作者简介:胡玲玲(1990—),女,硕士研究生,研究方向为食品科学与工程。E-mail:1214708667@qq.com
*通信作者:李春阳(1966—),男,研究员,博士,研究方向为营养与活性物质,农产品精深加工。E-mail:lichunyang968@163.com