陆 敏,李晓明,卢永翎,郑铁松,张 丹,吕丽爽*
(南京师范大学金陵女子学院,江苏 南京 210097)
摘 要:建立牛血清白蛋白(bovine serum albumin,BSA)-还原糖、牛血清白蛋白-甲基乙二醛/乙二醛(bovine serum album in-methylglyoxal/glyoxal,BSA-MGO/GO)反应体系,研究槲皮素对反应体系中晚期糖基化终产物(advanced glycation endproducts,AGEs)的抑制作用。考察了槲皮素在不同阶段对BSA-核糖体系中AGEs形成的抑制作用。 并对槲皮素抑制二羰基化合物对质粒pBR322DNA的损伤进行研究。结果表明:槲皮素具有抑制 BSA-还原糖、BSA-GO、BSA-MGO体系中AGEs形成的作用,达到显著抑制效果的浓度分别为1、0.25、0.25 mmol/L。槲皮素对BSA-MGO体系中AGEs产生的抑制作用强 于BSA-GO体系。在BSA-核糖体系中,反应初期随着反应时间的延长抑制作用不断增大,12 d后,抑制作用趋于平缓,维持在60%左右。槲皮素对二羰基化合物对DNA的损伤有抑制作用,且与浓度成一定相关性。
关键词:牛血清白蛋白;槲皮素;晚期糖基化终产物;质粒pBR322DNA
晚期糖基化终产物(a d v a n c e d g l y c a t i o n endproducts,AGEs)是还原糖和蛋白质、脂质、核酸的氨基发生非酶反应的终产物 [1]。它们是一系列复杂且异构化的化合物 [2],至今发现的AGEs包括N ε-羧甲基赖氨酸、N ε-羧乙基赖氨酸、戊糖素、交联素、咪唑啉、吡咯素、吡啶类衍生物、3-脱氧葡萄糖醛酸等,这些物质中大部分含有荧光性 [3]。人体中AGEs的形成是正常新陈代谢的一部分,但如果在组织中和体循环中含量过高,就有可能致病 [4]。AGEs的病理效应表现为它们能够促进氧化应激 [5],通过与细胞表面受体集合产生炎症 [6],与蛋白质发生交联并改变它们的结构 [7]。AGEs与一些退行性慢性疾病有密切关系,如糖尿病及正常老化 [8]、阿兹海默病 [9]、动脉粥样硬化 [10]。随着时间的增加,AGEs可以在皮肤和其他组织中积累,组织中AGEs的积累也是衰老的标志 [11]。与健康人群相比,糖尿病患者组织中的AGEs含量较高 [12]。
目前科学家们已经研发出各种抑制或逆转糖基化进展的药物,一些天然或合成的化合物已经被建议用作AGEs的抑制剂。许多植物提取物可通过阻止糖化氧化或者清除AGEs的前体物质乙二醛(glyoxal,GO)和甲基乙二醛等抑制AGEs形成 [13]。食源性类黄酮如芹菜素、木犀草素、槲皮素对糖尿病动物血液中的AGEs的形成具有抑制作用 [14]。槲皮素(3,5,7,30,40-五羟基黄酮),属于黄酮类化合物,是一种很强的抗氧化剂和自由基清除剂,可以通过减少谷胱甘肽(glutathione,GSH)耗竭 [15],提高抗氧化酶活性。它广泛存在于植物的花、果实中,已知有100多种中草药中含有槲皮素,如槐花、丹皮、槐花、丹皮、银杏叶、菟丝子等,在包括苹果、浆果、洋葱、茶、芸苔属蔬菜等食物中也富含槲皮素,研究发现它对人体健康有益,即具有抗氧化、抗癌、解毒和抗动脉粥样硬化的作用 [16]。蒋斌等 [17]发现,槲皮素对以D-葡萄糖为底物的蛋白质非酶糖基化反应体系(glucose-bovine serum albumin,G-BSA)、槲皮素对以DL-甘油醛为底物的蛋白质非酶糖基化反应体系(DL-glyceraldehyde-bovine serum albumin,GA-BSA)、槲皮素对以3-脱氧葡萄糖醛酮为底物的蛋白质非酶糖基化反应体系(3-deoxyglucosone-bovine serum albumin,3-DG-BSA)中AGEs的生成有显著抑制作用。本实验以自然界分布广泛的类黄酮化合物槲皮素为研究对象,研究其对牛血清白蛋白-甲基乙二醛(bovine serum albuminmethylglyoxal,BSA-MGO)及牛血清白蛋白-乙二醛(bovine serum albumin-glyoxal,BSA-GO)的蛋白糖基化模型中产生的AGEs的抑制作用,并探讨槲皮素对GO、MGO造成的DNA损伤的修复作用。
1.1 材料与试剂
BSA(分子生物级)、青霉素-链霉素混合液 生工生物工程(上海)股份有限公司;MGO(40%水溶液)、GO(40%水溶液) 美国Sigma公司;槲皮素(高效液相色谱纯98%) 南京广润生物制品有限公司;葡萄糖、果糖、 半乳糖 上海国药集团化学试剂有限公司;核糖 上海如吉生物科技发展有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 上海久亿化学试剂有限公司;10×Loading Buffer、琼脂糖、绿如蓝核酸染料 北京天恩泽基因科技有限公司;磷酸二氢钠、磷酸氢二钠、H 2O 2(30%)均为国产级分析纯试剂。
1.2 仪器与设备
XW-80A微型漩涡混合仪 上海沪西分析仪器厂有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;FA2104N电子分析天平 上海精密科学仪器有限公司;PHS-3C数字式pH计 上海三信仪表厂; F200多功能酶标仪 瑞士帝肯贸易有限公司;SHP-250型生化培养箱 上海三发科学仪器有限公司;ZQTY-70-T振荡培养箱 上海知楚仪器有限公司;SW-CJ-2F型双人双面净化工作台 苏州净化设备有限公司;LDZX-30FBS高压灭菌锅 上海申安医疗器械厂;DYY-12型电泳仪、WD-9403D型紫外分析仪 北京市六一仪器厂;5415R型离心机 上海锐聪实验室设备有限公司;Bio-Rad Universal Hood Ⅱ凝胶成像仪 上海思伯明仪器设备有限公司。
1.3 方法
1.3.1 荧光分光光度法分析槲皮素对AGEs形成的影响
1.3.1.1 槲皮素抑制BSA-还原糖体系中AGEs的形成
依据文献[18]的测定方法加以改进,用浓度为0.2 mmol/L pH 7.4的磷酸盐缓冲液(phosphate buffer solution,PBS)溶解BSA,在10 mL的样品管中加入0.2 mL青霉素和链霉素的混合溶液和4.5 mg/mL BSA稀释液2 mL,再加入稀释后的葡萄糖、果糖、半乳糖和核糖溶液,使4 种糖的最终浓度均为10 mmol/L,在上述的溶液体系中加入用DMSO溶解的不同浓度槲皮素溶液,加入PBS至6 mL,使其最终浓度分别为1、5、50、250、1 000 μmol/L,37 ℃水浴加热,30 d后-20 ℃冷冻贮藏。解冻后测定相对荧光值(relative fluorescence units,RFU)。
1.3.1.2 槲皮素抑制BSA-核糖体系中AGEs形成的过程
依据文献[19]的测定方法加以改进,用浓度为0.2 mmol/L pH 7.4的PBS溶解BSA,在10 mL的样品管中加入0.2 mL青霉素和链霉素的混合溶液和4.5 mg/mL BSA稀释液2 mL,再加入PBS稀释的核糖溶液,使其最终浓度为10 mmol/L,在上述的溶液体系中加入用DMSO溶解的不同浓度槲皮素溶液,加入PBS至6 mL,使其最终浓度分别为1 mmol/L,37 ℃恒温水浴加热,在0、1、3、6、12、18、30 d时分别取样0.5 mL于2 mL样品管,-20 ℃冷冻贮藏。解冻后测定RFU值。
1.3.1.3 槲皮素抑制BSA-MGO/GO体系中AGEs的形成过程
依据文献[20]的测定方法加以改进,用浓度为0.2 mmol/L pH 7.4的PBS溶解BSA,在10 mL的样品管中加入0.2 mL青霉素和链霉素的混合溶液和4.5 mg/mL BSA稀释液2 mL,再加入PBS稀释的MGO或GO溶液,使MGO或GO最终浓度分别为0.5 mmol/L,在上述的溶液体系中加入 DMSO溶解的不同浓度槲皮素溶液,并加入PBS至6 mL,使其最终浓度分别为0.25、0.5、1、2.5 mmol/L,37 ℃恒温培养箱加热,分别在0、1、3、6、12、18、30 d时取样0.5 mL于2 mL样品管,-20 ℃冷冻贮藏。解冻后测定RFU值。
1.3.1.4 抑制率的计算 [21]
1.3.2 槲皮素抑制二羰基化合物对质粒pBR322DNA的损伤
1.3.2.1 H 2O 2-MGO/GO体系对DNA的损伤
在0.5 mL小Eppendorf管中依次加入质量浓度为0.5 μg/μL的pBR322DNA 5 μL,并依次加入50 mmol/L pH 7.4的PBS 15 μL,30% H 2O 2/40% MGO/40% GO溶液5 μL,在37 ℃条件下保温30 min左右,加入10×Loading Buffer,终止反应 [22-26]。
1.3.2.2 槲皮素对DNA损伤的抑制
在0.5 mL小Eppendorf管中依次加入质量浓度为0.5 μg/μL的pBR322DNA 5 μL,50 mmol/L pH 7.4的PBS 10 μL,DMSO溶解并稀释得到不同质量浓度(0.5、1.0、1.5、2.0、2.5 mg/mL)的槲皮素溶液10 μL,40% GO 5 μL,在37 ℃条件下保温40 min左右,加入10×Loading Buffer,终止反应 [22-26]。
1.3.2.3 电泳
配制1.0%琼脂糖凝胶(绿如蓝核酸染料含量为0.5 μg/mL)。取上述反应液20 μL上样,恒压120 V电泳1 h后,将凝胶置于凝胶成像仪上,在紫外线照射下进行观察与照相,观察DNA的损伤及槲皮素抑制DNA损伤情况 [22,24,26-27]。
2.1 荧光分光光度法分析槲皮素对AGEs形成量的影响
2.1.1 不同浓度的槲皮素抑制不同还原糖引起的牛血清白蛋白糖基化的活性
反应体系的槲皮素浓度为1~1 000 μmol/L,选取葡萄糖、果糖、半乳糖、核糖4 种糖,研究槲皮素对BSA-还原糖体系中AGEs形成的抑制作用,结果如图1所示。在BSA-还原糖体系中,槲皮素可以明显抑制AGEs的形成,其对AGEs的抑制率随着槲皮素浓度的增加而显著增加。当槲皮素浓度为50 μmol/L时,对葡萄糖、果糖、半乳糖和核糖与BSA形成的AGEs的抑制率分别为18.76%、19.69%、19.06%、22.37%,而当槲皮素浓度增大到1 000 μmol/L时,对4 种糖的抑制率分别为75.05%、77.44%、73.23%、70.43% 。且随着槲皮素浓度的升高,在同一浓度下,对由不同种类还原糖和BSA产生的AGEs的抑制量之间的差距不大。

图1 槲皮素对BSA-还原糖体系中AGEs形成的影响
Fig.1 Effect of quercetin on the formation of AGEs in BSA-sugar system
2.1.2 槲皮素在不同时间点抑制BSA-核糖体系中AGEs形成的功效
槲皮素浓度在1 mmol/L条件下,在不同时间点,抑制BSA-核糖体系中AGEs形成的过程,结果如图2所示。
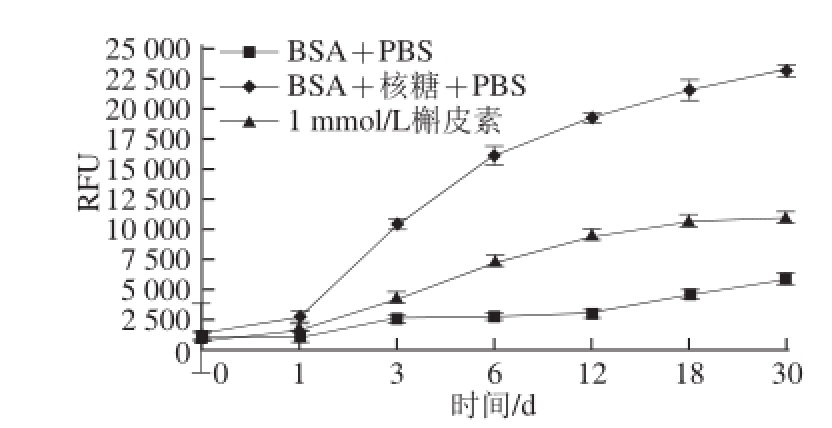
图2 槲皮素对BSA-核糖体系AGEs形成的影响
Fig.2 Effect of quercetin on the formation of AGEs in BSA-ribose system
李晓明等 [21]证实核糖引发蛋白糖基化的活性最强。由图2可知,在前12 d牛血清白蛋白与核糖作用产生的AGEs量随着时间的增加不断增加,12 d后,产生荧光性的AGEs的量趋于平稳。槲皮素添加到体系中,浓度为1 mmol/L,能有效地抑制AGEs的产生。在反应初始阶段,槲皮素抑制AGEs的活性随着时间的增加不断增加,当反应时间为3 d时,槲皮素对AGEs的抑制率达到63.05%,反应12 d时,其抑制率依然维持在60%左右,抑制率变化不大。
2.1.3 槲皮素对MGO/GO引起的牛血清白蛋白糖基化的抑制效果
由图3可知,随着时间的增加,BSA-MGO/GO体系中AGEs的生成量在不断增加。当加入浓度范围为0.25~2.5 mmol/L的槲皮素时,可显著抑制BSA-GO/MGO体系中生成的AGEs,槲皮素浓度为0.25 mmol/L时,抑制作用非常明显,且随着槲皮素浓度的增加抑制作用增强。在BSA-MGO体系中(图3A),当反应1 d,槲皮素浓度为0.25 mmol/L时,对AGEs的抑制率为91.22%。在BSA-GO体系中(图3B),当反应时间为1 d,槲皮素浓度为0.25 mmol/L时,对AGEs的抑制率为59.34%;当槲皮素的浓度为0.5 mmol/L时,对AGEs的抑制率为61.70%;当反应时间为30 d,槲皮素浓度为0.5 mmol/L,其对AGEs的抑制率可达76.75%。由两个体系对比可知,同样的槲皮素添加浓度(0.25 mmol/L),BSA-MGO(图3A)体系中槲皮素对AGEs抑制率达到90%以上时作用时间只有1 d,而BSA-GO(图3B)体系中30 d的抑制率还没有达到90%,可知槲皮素对BSA-MGO体系中产生的AGEs的抑制作用强于对BSA-GO体系的抑制。
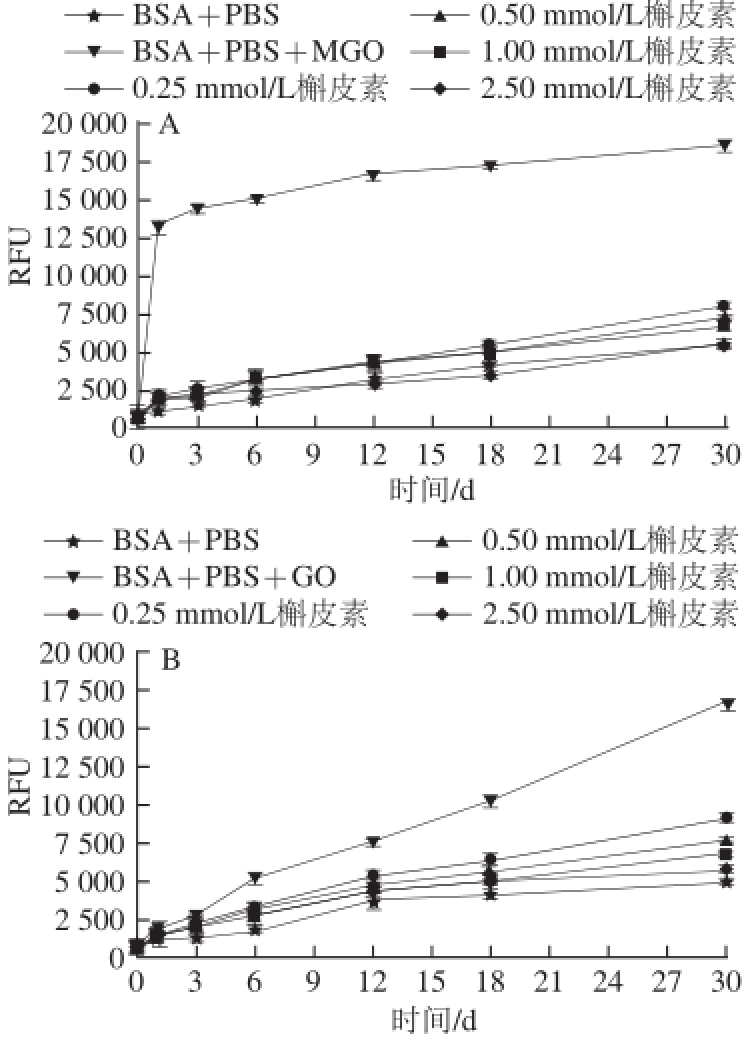
图3 槲皮素浓度对BSA-MGO/GO体系中产生的AGEs的抑制作用
Fig.3 Effect of quercetin concentration on the formation of AGEs in BSA-methylglyoxal/glyoxal system
2.2 槲皮素抑制二羰基化合物对质粒pBR322DNA的损伤
2.2.1 H 2O 2-MGO/GO体系对DNA损伤
天然状态的质粒DNA呈双链闭环的超螺旋结构,如受到外界因素损伤而致其中一条链断裂,构型可变为开环型,如两条链在同一部位发生断裂,则变为线性分子
[26]。3 种构型的DNA在琼脂糖电泳中的迁移率不同,超螺旋型条带迁移最快,其次是线性条带,开环型条带是最慢的
[27],故可用电泳法将它们分开。由图4可知,与对照组的DNA电泳条带相比,用H
2O
2、MGO和GO处理后的DNA条带明显不同,出现了开环型条带。用已证实的会造成质粒DNA损伤的H
2O
2
[26]作为阳性对照,根据MGO和GO的结构可知,正是由于氧化性较强的两者与PBS构成
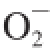 ·生成体系,在一定温度一定时间后,生成的
·生成体系,在一定温度一定时间后,生成的
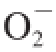 ·也造成质粒DNA 的链断裂,条带改变。
·也造成质粒DNA 的链断裂,条带改变。

图4 H 4 H
2O
2-MGO/GO体系对DNA的损伤电泳图
Fig.4 Electrophoretogram of DNA damage in H
2O
2-MGO/GO system
2.2.2 槲皮素抑制质粒pBR322DNA的损伤

图5 槲皮素抑制GO损伤DNA的电泳图
Fig.5 Inhibitory effect of quercetion on DNA damage induced by glyoxal
由图4可知,GO会引起DNA损伤,电泳图上则表现出开环形条带。槲皮素抑制GO引起的DNA损伤见图5。泳道1为未损伤的DNA条带,泳道2~6添加了不同质量浓度的槲皮素,可以看出槲皮素对由于GO造成的质粒DNA损伤具有一定程度的抑制作用。泳道2~6各条带均有部分是开环型,泳道6出现了较为明显的线性,随着槲皮素反应质量浓度的增大,双螺旋型DNA的比例逐渐增大,与槲皮素的反应质量浓度呈现一定的线性关系。
在BSA-还原糖体系中,不同还原糖种类对槲皮素抑制AGEs形成量影响不大。一定浓度的槲皮素对AGEs形成有显著的抑制作用,当浓度为1 mmol/L时,槲皮素对4 种还原糖的抑制率均在70%以上,此添加浓度为最佳添加量。在反应活性最高的BSA-核糖体系中,槲皮素抑制AGEs形成的活性随时间的增加不断增强,反应3 d的抑制率达到63.05%,而后的抑制活性无明显变化,反应到12 d,抑制率仍在60%左右。
在BSA-GO/MGO体系中,当槲皮素的添加浓度为0.25 mmol/L时,对这两个体系均有显著的抑制效果。添加浓度为0.5 mmol/L时,可以发现对MGO的抑制作用更强,1 d时的抑制率就达到90%以上。
槲皮素可以明显抑制二羰基化合物对DNA的损伤,同时抑制作用与槲皮素在反应体系中的浓度成一定正相关性。
参考文献:
[1] SINGH R, BARDEN A, MORI T, et al. Advanced glycation end-products: a review[J]. Diabetologia, 2001, 44(2): 129-146. DOI:10.1007/s001250051591.
[2] WU C H, HUANG S M, LIN J A, et al. Inhibition of advanced glycation end product formation by food stuffs[J]. Food & Function, 2011, 2(5): 224-234. DOI:10.1039/c1fo10026b.
[3] JOGLEKAR M M, PANASKAR S N, ARVINDEKAR A U. Inhibition of advanced glycation end product formation by cymene-a common food constituent[J]. Journal of Functional Foods, 2014, 6: 107-115. DOI:10.1016/j.jff.2013.09.024.
[4] POULSEN M W, HEDEGAARD R V, ANDERSEN J M, et al. Advanced glycation end products in food and their effects on health[J]. Food and Chemical Toxicology, 2013, 60(10): 10-37. DOI:10.1016/ j.fct.2013.06.052.
[5] RAHBAR S. Novel inhibitors of glycation and age formation[J]. Cell Biochemistry and Biophysics, 2007, 48(2/3): 147-157. DOI:10.1007/ s12013-007-0021-x.
[6] VLASSARA H. The age-receptor in the pathogenesis of diabetic complications[J]. Diabetes/Metabolism Research and Reviews, 2001, 17(6): 436-443. DOI:10.1002/dmrr.233.
[7] RAHBAR S, YERNENI K K, SCOTT S, et al. Novel inhibitors of advanced glycation endproducts (partΙΙ)[J]. Molecular Cell Biology Research Communications, 2000, 3(6): 360-366. DOI:10.1006/ mcbr.2000.0239.
[8] NASS N, BARTLING B, NAVARRETE SANTOS A, et al. Advanced glycation end products, diabetes and ageing[J]. Zeitschrift für Gerontologie und Geriatrie, 2007, 40(5): 349-356. DOI:10.1007/ s00391-007-0484-9.
[9] REDDY V P, OBRENOVICH M E, ATWOOD C S, et al. Involvement of Maillard reactions in alzheimer disease[J]. Neurotoxicity Research, 2002, 4(3): 191-209. DOI:10.1080/1029840290007321.
[10] TESSIER F J, INÈS B A. Health effects of dietary Maillard reaction products: the results of ICARE and other studies[J]. Amino Acids, 2012, 42(4): 1119-1131.DOI:10.1007/s00726-010-0776-z.
[11] CERAMI A. The unexpected pathway to the creation of the hba1c test and the discovery of AGE’s[J]. Journal of Internal Medicine, 2012, 271(3): 219-226. DOI:10.1111/j.1365-2796.2012.02514.x.
[12] DYER D G, DUNN J A, THORPE S R, et al. Accumulation of Maillard reaction products in skin collagen in diabetes and aging[J]. Journal of Clinical Investigation, 1993, 91(6): 2463-2469. DOI:10.1172/JCI116481.
[13] PENG X, CHENG K W, MA J, et al. Cinnamon bark proanthocyanidins as reactive carbonyl scavengers to prevent the formation of advanced glycation endproducts[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 1907-1911. DOI:10.1021/jf073065v.
[14] CLAUSSNITZER M, SKURK T, HAUNER H, et al. Effect of flavonoids on basal and insulin-stimulated 2-deoxyglucose uptake in adipocytes[J]. Molecular Nutrition & Food Research, 2011, 55(Suppl 1): 26-34. DOI:10.1002/mnfr.201000372.
[15] MOHAMMADI H S, GOUDARZI I, LASHKARBOLOUKI T, et al. Chronic administration of quercetin prevent spatial learning and memory deficits provoked by chronic stress in rats[J]. Behavioural Brain Research, 2014, 270: 196-205. DOI:10.1016/j.bbr.2014.05.015.
[16] HARWOOD M, DANIELEWSKA-NIKIEL B, BORZELLECA J F, et al. A critical review of the data related to the safety of quercetin and lack of evidence of in vivo toxicity, including lack of genotoxic/ carcinogenic properties[J]. Food and Chemical Toxicology, 2007, 45(11): 2179-2205. DOI:10.1016/j.fct.2007.05.015.
[17] 蒋斌, 吴秋燕, 江国荣. 槲皮素对体外糖基化终产物生成的影响[J]. 抗感染药学, 2005, 2(2): 74-76. DOI:10.3969/ j.issn.1672-7878.2005.02.007.
[18] KIM H Y, LEE J M, YOKOZAWA T, et al. Protective activity of flavonoid and flavonoid glycosides against glucose-mediated protein damage[J]. Food Chemistry, 2011, 126(3): 892-895. DOI:10.1016/ j.foodchem.2010.11.068.
[19] CHENG A S, CHENG Y H, CHIOU C H, et al. Resveratrol upregulates nrf2 expression to attenuate methylglyoxal-induced insulin resistance in Hep G2 cells[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 9180-9187. DOI:10.1021/jf302831d.
[20] LÜ L, SHAO X, CHEN H, et al. Genistein inhibits advanced glycation end product formation by trapping methylglyoxal[J]. Chemical Research in Toxicology, 2011, 24(4): 579-586. DOI:org/10.1021/ tx100457h.
[21] 李晓明, 邓荣华, 孔阳辉, 等. 芦丁抑制牛血清白蛋白糖基化[J]. 食品科学, 2014, 35(3): 85-89. DOI:10.7506/spkx1002-6630-201403018.
[22] YEUNG S Y, LAN W H, HUANG C S, et al. Scavenging property of three cresol isomers against H 2O 2, hypochlorite, superoxide and hydroxyl radicals[J]. Food and Chemical Toxicology, 2002, 40(10): 1403-1413. DOI:10.1016/S0278-6915(02)00102-3.
[23] 杨雷, 郭青榜, 卢艳, 等. 槲皮素对过氧化氢所致体外心肌细胞损伤的保护作用[J]. 中国临床康复, 2006,10(3): 60-62. DOI:10.3321/ j.issn:1673-8225.2006.03.025.
[24] KUMAR A, CHATTOPADHYAY S. DNA damage protecting activity and antioxidant potential of pudina extract[J]. Food Chemistry, 2007, 100(4): 1377-1384. DOI:10.1016/j.foodchem.2005.12.015.
[25] 所起凤, 杜文婷, 杨鸣鸣, 等. 过氧化氢诱导的人正常和早老细胞中DNA损伤及其修复研究[J]. 四川大学学报(医学版), 2011, 42(5): 610-615.
[26] 吕星, 陈吉中, 方允中. 抗环血酸-Fe 3+羟自由基生成体系对质粒pBR322DNA的损伤[J]. 军事医学, 1992, 16(4): 268-271.
[27] 孙宇立, 仲伟鉴. 姜黄素诱导质粒DNA氧化损伤的体外实验[J]. 环境与职业医学, 2006, 23(1): 31-33. DOI:10.3969/ j.issn.1006-3617.2006.01.010.
Inhibition of Quercetin on Protein Glycosylation and DNA Damage
LU Min, LI Xiaoming, LU Yongling, ZHENG Tiesong, ZHANG Dan, LÜ Lishuang*
(Ginling College, Nanjing Normal University, Nanjing 210097, China)
Abstract:Bovine serum albumin (BSA)-sugar and BSA-methylglyoxal/glyoxal (MGO/GO) reaction systems were established to study the inhibit ory activity of quercetin on the formation of advanced glycation endproducts (AGEs) in the reaction systems. The inhibitory effect of quercetin on the formation of AGEs at different stages in BSA-ribose system was expl ored. Meanwhile, the inhibitory effect of quercetin on DNA damage caused by dicarbonyl compounds in plasmi d pBR322 DNA was also studied. The results showed that quercetin inhibited the formation of AGEs in BSA-sugar and BSA-MGO/GO systems, especially at concent rations of 1, 0.25 and 0.25 mmol/L. The inhibitory effect of quercetin on the production of AGEs in BSA-MGO system was stronger than in BSA-GO system. During the initial stage of the r eaction between BSA and ribose, the inhibitory effect was increased with increasing reaction time and 12 days later, tended to remain at a level of approximately 60%. Therefore, quercetin has an inhibitory effect on DNA damage induced by dicarbonyl compounds in a concentration-dependent fashion.
Key words:bovine serum albumin; quercetin; advanced glycation end product (AGE); plasmid pBR322DNA
DOI:10.7506/spkx1002-6630-201601019
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)01-0104-05
引文格式:
陆敏, 李晓明, 卢永翎, 等. 槲皮素抑制蛋白糖基化及DNA损伤[J]. 食品科学, 2016, 37(1): 104-108. DOI:10.7506/ spkx1002-6630-201601019. http://www.spkx.net.cn
LU Min, L I Xiaoming, LU Yongling, et al. Inhibition of quercetin on protein glycosylation and DNA damage[J]. Food Science, 2016, 37(1): 104-108. (in Ch inese with English abstract) DOI:10.7506/spkx1002-6630-201601019. http://www.spkx.net.cn
收稿日期:2015-03-31
基金项目:江苏省基础研究计划(自然科学基金)项目(BK2012850);江苏省2014年度普通高校研究生科研创新计划项目(KYLX0730)
作者简介:陆敏(1989—),女,硕士研究生,研究方向为食品化学。E-mail:15050535612@163.com
*通信作者:吕丽爽(1969—),女,副教授,博士,研究方向为功能性食品成分的分离及活性。E-mail:lishuanglv@126.com