王 婷,赵 培,王雪青*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:以球等鞭金藻(Isochrysis galbana)3011为对象,通过研究降低培养温度后其超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性以及还原型谷胱甘肽(glutathione,GSH)、脂质过氧化产物丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)和二十二碳六烯酸(docosahexaenoic acid,DHA)含量的变化,以阐明低温环境对球等鞭金藻细胞抗氧化系统和DHA含量的影响。用流式细胞术结合荧光染色法测定低温环境对球等鞭金藻细胞内ROS水平的影响;并采用气相色谱法检测球等鞭金藻细胞内DHA含量。结果表明:在21、18、15 ℃低温环境处理下,球等鞭金藻细胞SOD、CAT和POD活性均随培养时间延长而呈现先升高后降低的趋势;温度越低,峰值出现越早,且峰值越大,峰后酶活性下降越快;GSH含量的变化趋势与上述酶活性的变化相似,MDA含量则持续增加;ROS水平随着温度的降低而呈现出较为复杂的变化,15 ℃和18 ℃诱导16 h出现ROS水平爆发,20 h时达到峰值,分别为(14.11±0.11)%和(14.74±0.58)%(P<0.05);经18 ℃低温诱导24 h后,球等鞭金藻细胞内DHA含量为0.105 mg/g,比对照组高0.06 mg/g。因此,低温环境可以作为提高代谢物产量的诱导子,使球等鞭金藻细胞产生主动防御反应,引起清除活性氧相关的酶活性的升高,同时也提高了DHA产量。
关键词:球等鞭金藻3011;抗氧化;低温;活性氧;二十二碳六烯酸
微藻是生活在海洋或者陆地中的微小生物,是最主要的初级生产者,对于稳定海洋生态系统有着非常重要的作用。一些环境因子发生变化,如温度除了能改变微藻的生长和发育速率、调控某些酶的活性之外,还会影响细胞的营养组成、营养素的利用率等,以达到主动适应环境改变的目的 [1]。有研究报道,低温可以改变机体内与抗氧化防御系统密切相关的酶的活性,导致细胞内自由基含量增加 [2-4]。在植物细胞与组织培养过程中,如青蒿、长春细胞,一定量的活性氧(reactive oxygen species,ROS)可充当环境刺激信号的二级信使,通过细胞信号的跨膜转导,实现环境因子对细胞代谢产物含量和组成的调控 [5-8]。
球等鞭金藻属于金藻门,普林藻纲,等鞭藻目,等鞭藻科。由于其个体小、无细胞壁、易消化、富含多糖及多不饱和脂肪酸二十二碳六烯酸(docosahexaenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)等代谢产物,是水产经济动物的开口饵料,同时也是生产DHA的潜力藻种。有研究显示低温可以促进多不饱和脂肪酸的形成 [9],因此通过低温环境刺激来提高细胞内DHA含量是其产业化的关键步骤。然而关于球等鞭金藻受到低温环境的刺激时,其与ROS密切相关的酶的变化以及一些次生代谢产物的积累尚未见报道。
本实验以适当的低温环境作为刺激因子,研究其对球等鞭金藻的抗氧化系统和DHA含量的影响,为提高球等鞭金藻细胞内DHA含量和产业化生产DHA提供可行的方法。
1.1 材料与试剂
球等鞭金藻(Isochrysis galbana)3011由中国海洋大学水产系实验室提供。
超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化物酶(peroxidase,POD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、还原型谷胱甘肽(glutathione,GSH)试剂盒、脂质过氧化产物丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所;2’,7’-二氢二氯荧光黄双乙酸钠(dichlorodihydro-fluorescein diacetate,DCFH-DA)、冰醋酸、磷酸盐缓冲液、DHA甲酯标准品(纯度≥99%) 美国Sigma公司。
1.2 仪器与设备
FACSCalibur流式细胞仪 美国BD公司;TI-U倒置式荧光显微镜 日本尼康公司。
1.3 方法
1.3.1 球等鞭金藻的培养
采用f/2培养基对球等鞭金藻进行培养,按体积分数10%接种,培养温度24~26 ℃,明/暗周期为14 h/10 h,光照度为4 500 lx,于光照培养箱中静置培养。
1.3.2 抗氧化指标的测定
取培养至对数后期的球等鞭金藻,经分瓶后分别在24、21、18、15 ℃条件下诱导培养48 h(每组3 个平行,其中24 ℃作为对照组),每6 h定时测定球等鞭金藻细胞的SOD、POD、CAT活力以及GSH、MDA含量。
1.3.2.1 粗酶液的提取及蛋白质量浓度的测定
取培养11 d至对数末期的球等鞭金藻液40 mL,8 000 r/min离心10 min,弃上清液,收获球等鞭金藻细胞。用4 mL的0.1 mol/L磷酸盐缓冲液(pH 7.8)重悬细胞,冰浴条件下超声破碎30 次(功率400 W、时间3 s、间隔3 s),4 ℃静置1 h,12 000 r/min离心20 min,上清液即为酶粗提液。取粗酶液1 mL并加入考马斯亮蓝溶液3 mL,在595 nm波长处测定吸光度。以吸光度为横坐标,蛋白质含量(mg/mL)为纵坐标,根据考马斯亮蓝法测定牛血清白蛋白所得的标准曲线方程y=1.105 6x-0.034 4(R 2=0.995),计算出蛋白质含量。
1.3.2.2 SOD活力测定
黄嘌呤在黄嘌呤氧化酶催化下产生超氧阴离子自由基(O 2 -•),当反应体系中有SOD时,O 2 -•可被氧化生成H 2O 2,其可氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,通过测定550 nm波长处吸光度的变化即可得出SOD活力,设3 个平行组,具体操作步骤严格按照试剂盒说明书方法进行。酶活力单位(U)定义为在上述反应条件下,抑制1 mL反应液中O 2 -•氧化后将氧化羟胺转变为亚硝酸盐,并与显色剂反应后形成紫红色络合物所需要的酶量。按照公式(1)计算SOD活力。
式中:0.5为说明书所提供的参数;对照组为以最适温度培养0 h的样品替代待测样。
1.3.2.3 POD活力测定
POD催化过氧化氢和愈创木酚产生醌类化合物,此化合物进一步缩合成有颜色的化合物,通过测定420 nm波长处吸光度的变化即可得出POD活力,设3 个平行组,具体操作步骤严格按照试剂盒说明书方法进行。酶活力单位(U)定义为在上述反应条件下,在30 min内以1 mL反应液中愈创木酚为底物催化过氧化氢形成醌类化合物进一步缩合成有色化合物所需要的酶量。按照公式(2)计算POD活力。
式中:12、1 000为说明书提供参数;1为比色光径系数;30为反应时间/min;对照组为以最适温度培养0 h的样品替代待测样。
1.3.2.4 CAT活力测定
CAT分解H 2O 2的反应可通过加入钼酸铵而迅速终止,剩余的H 2O 2与钼酸铵作用产生一种黄色的络合物,通过测定405 nm波长处吸光度的变化即可得出CAT活力,设3 个平行组,具体操作步骤严格按照试剂盒说明书方法进行。酶活力单位(U)定义为在上述反应条件下,在60 min内分解1 mL反应液中H 2O 2所需要的酶量。按照公式(3)计算CAT活力。
式中:271为说明书提供参数;60为反应时间/min;对照组为以最适温度培养0 h的样品替代待测样。
1.3.2.5 GSH含量测定
二硫代二硝基甲苯与巯基化合物反应产生黄色络合物,通过测定420 nm波长处吸光度的变化即可得出GSH含量,设3 个平行组,具体操作步骤严格按照试剂盒说明书方法进行。按照公式(4)计算GSH含量。
式中:307为GSH的摩尔质量/(g/mol);对照组为以最适温度培养0 h的样品替代待测样;空白组为以试剂盒中的试剂1替代待测样。
1.3.2.6 MDA含量测定
MDA与硫代巴比妥酸缩合形成红色产物,通过测定532 nm波长处吸光度的变化即可得出MDA含量,设3 个平行组,具体操作步骤严格按照试剂盒说明书方法进行。按照公式(5)计算MDA含量。
式中:对照组为以最适温度培养0 h的样品替代待测样;10 nmol/mL为标准品的浓度;标准组为以10 nmol/mL标准品替代待测样;空白组为以无水乙醇替代待测样。
1.3.3 ROS水平测定
采用流式细胞仪将培养至指数生长末期的球等鞭金藻细胞在24、21、18、15 ℃条件下分别诱导不同的时间,每4 h以流式细胞仪检测ROS水平,以倒置荧光显微镜镜检染色后细胞状态。并设3 个平行组,具体操作步骤为:样品以无菌磷酸盐缓冲液洗涤去杂质,10 000 r/min离心15 min,重复3 次,稀释至10 6个/mL以下,各取1 mL在24 ℃条件下培养的细胞样品作为对照,以0.5 μmol/L的终浓度进行Fluo-3-AM(钙离子荧光探针)染色,避光孵育15 min后上样。流式细胞仪用氲离子激光激发光源,功率15 mW,发射光波长488 nm,Fluo-3-AM的绿色荧光用525 nm/30 nm带通滤片收集,应用Cellquest软件收集、储存、处理数据。将各组细胞样品以相同浓度染料染色后涂于玻片上,立即置于倒置荧光显微镜下观察,细胞内酯酶水解生成的DCFH被细胞内的ROS氧化生成的荧光性的DCF,可被倒置荧光显微镜检测到,并照相记录 [10-12]。
1.3.4 DHA含量测定
采用气相色谱法(gas chromatography,GC)测定DHA含量,具体操作步骤如下。
1.3.4.1 多不饱和脂肪酸的提取
以76 mL乙醇-氢氧化钾溶液溶解1 g球等鞭金藻冻干粉,50 W超声破碎20 min,70 ℃浸提1 h,抽滤,用乙醇洗涤滤饼,加入20 mL去离子水扩大体积,用正己烷萃取,HCl调整溶液pH值后,加入正己烷进行皂化反应,旋转蒸发去除正己烷,用尿素包埋溶液中的饱和脂肪酸或者单不饱和脂肪酸后-20 ℃冷冻保存2 h(此过程一直在氮气保护下进行)。
1.3.4.2 多不饱和脂肪酸甲酯化
在1 g球等鞭金藻粉所得的多不饱和脂肪酸中,加入硫酸-甲醇溶液置于75 ℃条件下水浴甲酯化1 h,反应结束后加入生理盐水和正己烷,振荡混匀,静置分层,取上层溶液,加入适量的无水硫酸钠离心10 min,取上层溶液并用正己烷定容至10 mL,置于-20 ℃条件下保存。
1.3.4.3 DHA含量测定
采用GC法测定DHA含量。操作条件如下:色谱柱为HP-88型石英毛细管柱(100 m×0.25 mm,0.20 μm);色谱柱温度:210 ℃,恒温20 min,以3 ℃/min升温至240 ℃,维持20 min;进样口温度:260 ℃;FID检测器温度:260 ℃;进样方式:分流,分流比10∶1;进样量:1 μL;载气:高纯氮气(99.99%)。
1.3.4.4 DHA标准曲线的绘制
取不同质量浓度DHA-甲酯对照品溶液,分别进样1.0 μL,测定峰面积响应值,分别以DHA-甲酯质量浓度为横坐标,峰面积响应值为纵坐标,得到线性回归方程y=947.32x-4 032.5(R 2=0.999 1)。表明在DHA-甲酯质量浓度为2 000~20 000 μg/mL范围内,色谱峰面积与DHA-甲酯含量线性关系良好。
1.4 数据统计分析
采用SPSS 17.0软件对实验数据进行统计分析,以P<0.05为差异具有统计学意义。
2.1 球等鞭金藻在最适温度下的生长特性
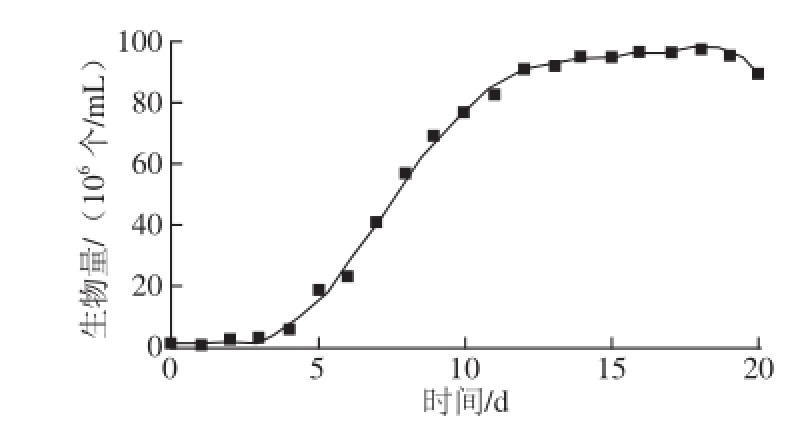
图1 球等鞭金藻3011在24 ℃条件下的生长曲线(n==33)
Fig.1 Growth curve of Isochrysis galbana 3011 at 24 ℃(n = 3)
图1 为球等鞭金藻细胞在最适温度(24 ℃)下培养测得的生长曲线,该曲线的回归方程为y=0.000 2x 5-0.003 6x 4-0.082 1x 3+2.274 0x 2-5.108 2x(R 2= 0.993 5)。球等鞭金藻的生长特点如下:第1~4天为生长停滞期,第5~10天为指数生长期,第11~13天为指数生长末期,第14~18天为静止期,第19天之后进入细胞衰亡期。本研究选取生物量最高的指数末期(第11天)作为低温诱导时间,同时后续实验将最适温度(24 ℃)设置为对照组。
2.2 低温环境对球等鞭金藻抗氧化系统的影响
2.2.1 低温诱导对球等鞭金藻SOD活性的影响
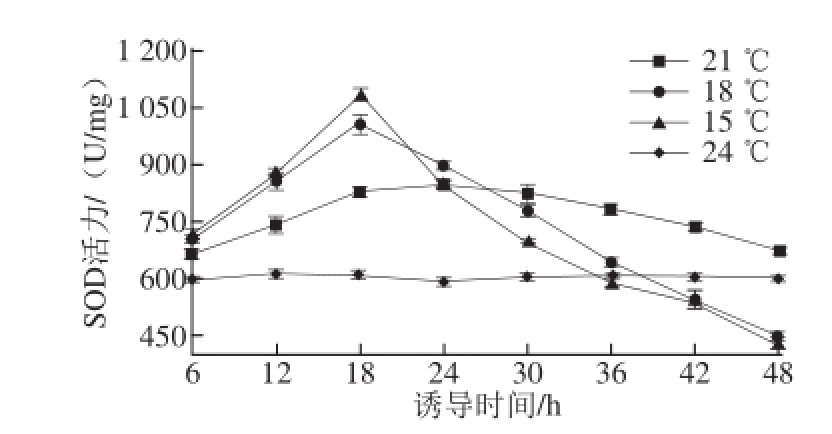
图2 低温诱导对球等鞭金藻SOD活性的影响
Fig.2 Effect of low temperature on SOD activity
不同温度对球等鞭金藻SOD活性的影响见图2。当低温诱导时间少于18 h时,与对照组比较,其他处理组的球等鞭金藻SOD活力均显著提高,而且诱导温度越低,SOD活力提高程度越大。随着处理时间延长,15、18、21 ℃处理组的球等鞭金藻SOD活力又依次开始下降,这3 个处理组球等鞭金藻SOD活力的最大值分别为1 079.63、1 009.2、849.27 U/mg,比对照组分别提高了179%、168%和141%。
2.2.2 低温诱导对球等鞭金藻CAT活性的影响
不同温度对球等鞭金藻CAT活性的影响见图3。球等鞭金藻经过较短时间(少于18 h)的低温诱导时,与对照组比较,球等鞭金藻的CAT活力显著提高,而且诱导温度越低,CAT活力提高程度越大。随着处理时间的延长,15 ℃处理组的球等鞭金藻CAT活性在18 h后开始下降,18 ℃处理组则发生在24 h之后,而21 ℃处理组在30 h之后才开始有缓慢下降。15、18、21 ℃处理组球等鞭金藻CAT活力的最大值分别为332.05、318.90、282.47 U/mg,比对照组分别提高了1.73、1.67、1.47 倍。
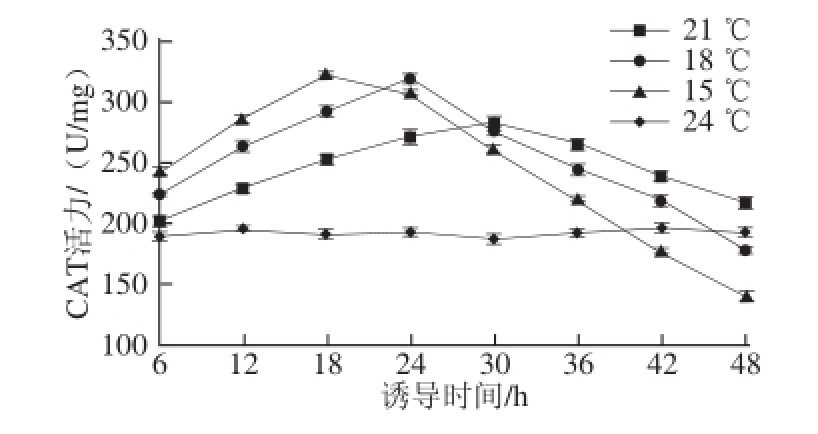
图3 低温诱导对球等鞭金藻CAT活性的影响
Fig.3 Effect of low temperature on CAT activity
2.2.3 低温诱导对球等鞭金藻POD活性的影响
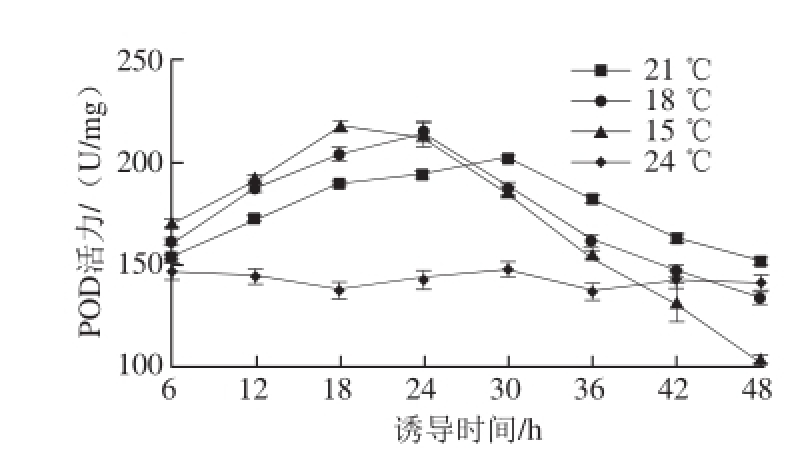
图4 低温诱导对球等鞭金藻POD活性的影响
Fig.4 Effect of low temperature on POD activity
低温对球等鞭金藻POD活性的影响如图4所示,在低温诱导18 h内,与对照组相比,球等鞭金藻POD酶活力有明显提高,并且诱导温度越低,POD活力提高程度越大。当诱导时间超过18 h时,15 ℃处理组的球等鞭金藻POD活力开始下降,6 h后(24 h时)18 ℃处理组POD活力也开始下降,当低温诱导至30 h时,21 ℃处理组的POD活力开始缓慢下降。48 h时,15、18 ℃处理组的POD活力已经低于对照组。15、18、21 ℃处理组球等鞭金藻的POD活力最大值分别为217.40、214.67、202.33 U/mg,比对照组分别提高了152%、150%、142%。
2.2.4 低温诱导对球等鞭金藻GSH含量的影响

图5 低温诱导对球等鞭金藻GSH含量的影响
Fig.5 Effect of low temperature on GSH content
如图5所示,3 个低温诱导处理组的球等鞭金藻GSH含量均呈现先增高后降低的趋势,但与上述3 种酶的区别在于48 h内,3 个低温诱导处理组的球等鞭金藻GSH含量始终高于对照组。当诱导时间少于18 h时,与对照组相比,GSH含量明显提高,而且温度越低,GSH含量增加速率越快。随着处理时间的延长,15 ℃处理组的球等鞭金藻GSH含量在18 h时开始下降,18 ℃处理组在24 h时GSH含量下降, 21 ℃处理组在30 h之后才开始缓慢下降。21、18、15 ℃处理组球等鞭金藻的GSH含量最大值分别为613.65、773.68、782.76 mg/g pro,比对照组分别提高了1.53、1.93、1.95 倍。
2.2.5 低温诱导对球等鞭金藻MDA含量的影响
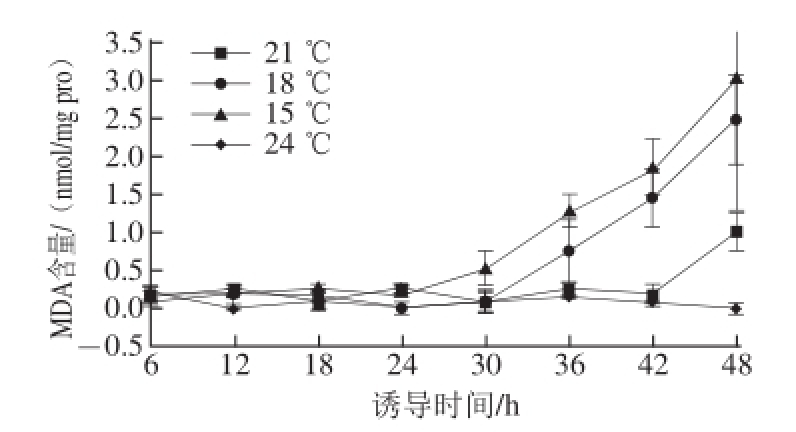
图6 低温诱导对球等鞭金藻MDA含量的影响
Fig.6 Effect of low temperature on MDA content
图6 显示了由低温所引起的球等鞭金藻细胞内MDA含量的变化,与对照组比较,各处理组球等鞭金藻在短时间(24 h内)的低温诱导处理下的MDA含量并无差异(P>0.05)。随着处理时间的延长,在30 h 时15 ℃处理组的球等鞭金藻MDA含量最先开始增加,6 h后(36 h 时)18 ℃处理组的MDA含量也出现了显著增加,而21 ℃处理组则是在48 h时才检测到MDA含量的存在。15、18、21 ℃处理组球等鞭金藻在48 h时的MDA含量分别为2.987、2.477、1.00 nmol/mg pro。
总之,球等鞭金藻3011经低温诱导,其细胞内SOD、POD和CAT活力以及GSH含量均显著提高。副产物MDA的水平受诱导温度和时间的双重影响,低温长时环境中MDA水平增加明显。因此,诱导温度越低,处理时间越长,对球等鞭金藻的正常生理代谢影响越大,引起细胞膜的损伤程度越高,从而导致球等鞭金藻细胞偏离正常水平生长。而合适的环境刺激(有效的低温和适当的时间)能使细胞有足够强烈的防御响应,诱导其加强合成DHA,同时对球等鞭金藻细胞本身的损伤较小。为此,本实验进一步检测了不同温度和时间诱导下球等鞭金藻细胞内的ROS水平,以确定适合DHA积累的最佳温度和时间。
2.3 低温诱导下球等鞭金藻的ROS水平
ROS为具有化学活性的含氧分子,主要包括超氧阴离子自由基、过氧化氢和羟自由基,因为核外未配对电子的存在,ROS具有很强的化学反应活性 [13]。伴随着机体正常呼吸代谢过程中,会产生一定量的ROS,这些ROS很快被细胞中的抗氧化酶或还原性物质清除掉。然而,当细胞受到外界环境(例如低温)影响时,ROS的生成量会急剧增多,超过机体自身的清除能力,过多的ROS可以使细胞的结构被破坏。图7是球等鞭金藻细胞在18 ℃条件下诱导4、20 h时ROS的产生状况。而球等鞭金藻在不同的低温条件下诱导不同时间,其细胞内ROS水平的变化情况见表1。当受到较短时间的低温诱导(少于12 h)时,低温处理组与对照组(24 ℃处理组)的ROS水平差异不显著。随着诱导时间延长,ROS水平呈现出不同程度地增加,21 ℃处理组的球等鞭金藻ROS含量缓慢增加,在24 h时出现最大值为(9.18±0.52)%;15、18 ℃处理组诱导16 h时出现明显的ROS水平爆发,与对照组相比具有显著差异(P<0.05),这两组在20 h时球等鞭金藻的ROS水平出现最大值分别为(14.11±0.11)%和(14.74±0.58)%。

图7 18 ℃诱导4 h(a)和20 h(b)球等鞭金藻3011的DCFH-DA染色荧光结果
Fig.7 DCFH-DA staining fluorescence of Isochrysis galbana 3011 induced at 18 ℃ for 4 (a) and 20 h (b)
表1 温度对球等鞭金藻3011 ROS水平的影响
Table 1 Effect of low temperature on ROS level of Isochrysis galbana 3011

注:a. 与对照组(24 ℃处理组)相比,差异显著(P<0.05)。
%温度/℃诱导时间/h 481216202428 157.52±0.648.15±0.568.42±0.62 11.22±0.58 a14.11±0.11 a9.98±0.76 a8.48±0.60 187.71±0.068.70±0.098.77±0.46 12.12±0.57 a14.74±0.58 a10.35±1.37 a9.29±0.53 217.78±0.128.46±1.168.50±0.578.44±1.068.41±0.539.18±0.528.57±0.36 247.98±0.538.43±1.198.81±0.068.15±0.638.21±0.678.47±0.617.54±1.15
2.4 低温诱导下球等鞭金藻的DHA产量
18 ℃诱导24、48 h后,球等鞭金藻细胞内的DHA水平分别为0.105、0.092 mg/g,而对照组(24 ℃,24 h)的DHA水平为0.045 mg/g。即经过18 ℃诱导24 h后球等鞭金藻细胞内的DHA含量比对照组高出1 倍多。因此,低温诱导是提高球等鞭金藻DHA产量的十分有效的方法。
正常情况下,机体内ROS的产生和清除是处于平衡状态的,此时机体ROS含量较低,对机体不会造成任何伤害。当受到环境胁迫(如低温)时,细胞膜的流动性降低,并产生大量ROS,发生脂质过氧化,导致MDA的积累。最初ROS被认为是氧化代谢中具很强毒性作用的副产物 [14],但随着研究的深入发现ROS在动植物的许多生理代谢过程中均具有害和有利的双重功能 [15],适量的ROS可以作为生物开启防御机制的重要信号,诱导许多参与防卫功能的次生代谢产物的生物合成及相关基因的表达。
本实验结果显示,经过低温诱导后,球等鞭金藻的抗氧化酶系统和抗氧化的还原性物质(GSH)水平均呈现先增加后降低的趋势,且酶活性以及含量均高于对照组,此结果与他人的实验结果相符 [16-21]。短时间低温条件下,这些酶的活性和抗氧化物质含量迅速增加,通过协同作用减轻由于ROS含量增加所引起的脂质过氧化,维持细胞的正常代谢。随着诱导时间的延长,抗氧化物质能量逐渐减小,酶活性逐渐下降,引起脂质过氧化作用。因此,过量的ROS较长时间地作用于细胞,对细胞而言是一种伤害。因此,当在恰当的低温条件下作用适当的时间时,一方面可以诱导细胞短时间内产生ROS,另一方面ROS作用于逆境信号,激活机体的防御响应,同时通过提高抗氧化酶的活性和还原性物质的含量来消除ROS对机体自身的不良影响。已有实验表明,适当的低温可以促进多不饱和脂肪酸的积累 [22-23]。但长时间的低温诱导会导致ROS的过度积累,使多不饱和脂肪酸的双键发生过氧化作用 [24],产生MDA。本实验结果同样显示,球等鞭金藻经过18 ℃诱导24 h后,其细胞内DHA水平比对照组提高了0.06 mg/g,延长诱导时间或是降低诱导温度均会导致DHA含量下降,这也与他人的研究结果相似 [25]。
现如今关于ROS、抗氧化酶以及DHA对低温的防御机理有两种理论:1)低温诱导引起ROS水平爆发,抗氧化系统进行主动防御,适量的ROS作为信号分子引起相关去饱和酶基因的表达,提高了脂肪酸的不饱和度,恢复细胞膜脂质的流动性,以保持其正常的生理功能,提高对低温的耐受能力;2)DHA作为非酶促小分子抗氧化物质,与抗氧化保护酶系统共同作用,清除低温诱导产生的ROS [26-27]。在受到低温诱导时,细胞膜首先受到伤害,其通透性下降,并发生膜相变,同时引起ROS水平的爆发,抗氧化系统在短时间内可以进行主动防御,消除ROS过量积累引起的伤害,适量ROS的积累可以作为信号分子诱导细胞防御基因的表达,激活信号通对转录组进行重新修饰 [28],使机体脂类代谢、次生代谢、激素合成及代谢等相关基因的表达有明显改变 [29-30],保证机体对低温的适应性,促进次生代谢产物的积累。但是当诱导时间过长时,ROS的产生量过多,且抗氧化酶活性下降,会造成次生代谢产物的积累下降,同时MDA含量增加。
本实验结果表明,球等鞭金藻细胞内抗氧化酶的活性与温度成负相关,随着诱导时间的延长,酶的活性呈现先升高后降低的趋势,温度越低,MDA越早出现。ROS水平爆发最早出现在15 ℃和18 ℃诱导16 h时,18 ℃诱导20 h有(14.74±0.58)%的细胞发生ROS水平爆发,与对照组比较均具有显著差异(P<0.05)。18 ℃诱导24 h的球等鞭金藻DHA产量比24 ℃诱导24 h高0.06 mg/g。
适当的低温环境可以作为诱导子引起球等鞭金藻的ROS相关酶活性的升高,ROS的适量积累可促进次生代谢产物合成。本研究为提高球等鞭金藻细胞DHA产量和利用球等鞭金藻产业化生产DHA提供了参考依据。
参考文献:
[1] 周筱娟. 低温诱导的植物抗冻基因研究进展[J]. 绍兴文理学院学报(自然科学版), 2004, 24(9): 65-69. DOI:10.3969/j.issn.1008-293X.2004.09.017.
[2] 宰学明, 吴国荣, 陆长梅, 等. 低温预处理对大豆萌芽活力及其活性氧代谢的影响[J]. 大豆科学, 2001, 20(3): 163-166. DOI:10.3969/ j.issn.1000-9841.2001.03.002.
[3] 朱素琴. 高盐/低温胁迫下水稻叶细胞内ASC的氧化还原状态和外源ABA的作用研究[D]. 扬州: 扬州大学, 2011: 12.
[4] WINSTON S W, DIGIULIO R T. Prooxidant and antioxidant mechanisms in aquatic organisms[J]. Aquatic Toxicology, 1991, 19(2): 137-161. DOI:10.1016/0166-445X(91)90033-6.
[5] YOSHIOKA H, ASAI S, YOSHIOKA M, et al. Molecular mechanisms of generation for nitric oxide and reactive oxygen species, and role of the radical burst in plant immunity[J]. Molecules and Cells, 2009, 28(4): 321-329. DOI:10.1007/s10059-009-0156-2.
[6] TAMAS L, MISTRIK I, HUTTOVA J, et al. Role of reactive oxygen species generating enzymes and hydrogen peroxide during cadmium mercury and osmotic stresses in barley root tip[J]. Planta, 2010, 231(2): 221-231. DOI:10.1007/s00425-009-1042-z.
[7] PU G B, MA D M, CHEN J L, et al. Salicylic acid activates artemisinin biosynthesis in Artemisia annua L.[J]. Plant Cell Reports, 2009, 28(7): 1127-1135. DOI:10.1007/s00299-009-0713-3.
[8] ZHAO J, HU Q, GUO Y Q, et al. Elicitor-induced indole alkaloid biosynthesis in Catharanthus roseus cell cultures is related to Ca 2+influx and the oxidative burst[J]. Plant Science, 2001, 161(3): 423-431. DOI:10.1016/S0168-9452(01)00422-8.
[9] 林武杰, 吴云辉. 海洋微藻多不饱和脂肪酸研究进展[J]. 福建水产, 2013, 35(1): 78-82. DOI:10.3969/j.issn.1006-5601.2013.01.014.
[10] 赵培, 王雪青, 陈庆森, 等. Zn 2+对球等鞭金藻3011细胞膜电位和膜通透性的影响[J]. 食品科学, 2012, 33(5): 66-70.
[11] 赵培, 王雪青, 彭博丽, 等. 荧光分析法检测金藻对Zn 2+的利用[J]. 食品研究与开发, 2011, 32(8): 87-90. DOI:10.3969/ j.issn.1005-6521.2011.08.027.
[12] 赵培, 王雪青, 魏丹, 等. 赤霉素对球等鞭金藻3011生物量、细胞形态与不同生长时期群体细胞活性的影响[J]. 环境与健康杂志, 2011, 28(5): 383-386.
[13] 王海波, 黄雪梅, 张昭其. 植物逆境胁迫中活性氧和钙信号的关系[J].北方园艺, 2010(22): 189-194.
[14] 张怡, 路铁钢. 植物中的活性氧研究概述[J]. 生物技术进展, 2011, 1(4): 242-248.
[15] ZHOU D, SHAO L, SPITZ D R. Reactive oxygen species in normal and tumor stem cells[J]. Advances in Cancer Research, 2014, 122: 1-67. DOI:10.1016/B978-0-12-420117-0.00001-3.
[16] 毛永强. 低温下胁迫螺旋藻(节旋藻)几种氧化还原酶的研究[D]. 呼和浩特: 内蒙古师范大学, 2007: 3-17.
[17] 刘娟妮, 王雪青, 庞广昌. 温度和光照对极大螺旋藻多糖含量和SOD酶活力的影响[J]. 食品工业科技, 2008, 29(9): 132-134.
[18] RADY A A, EI-SHEEKH M M, MATKOVICS B. Temperature shift induced changes in the antioxidant enzyme system of Cyanobacterium ynechocystis PCC 6803[J]. International Journal of Biochemistry, 1994, 26(3): 433-435. DOI:10.1016/0020-711X(94)90064-7.
[19] 阚光锋. 南极冰藻Chlamydomona sp. L4的逆境适应性及其抗逆蛋白质组学的研究[D]. 青岛: 中国海洋大学, 2005: 26-33.
[20] 丁燏, 缪锦来, 王全富, 等. 温度对南极衣藻ICE-L(Chlamydomonas sp. ICE-L)谷胱甘肽含量及其相关酶活性的影响[J]. 海洋与湖沼, 2006, 37(2): 154-161. DOI:10.3321/j.issn:0029-814X.2006.02.009.
[21] 夏利花, 何剑锋, 高岩, 等. 三种北极微藻对不同温度的适应性研究[J].极地研究, 2009, 21(4): 279-287.
[22] 郭兵, 龚阳, 万霞, 等. 光强和温度对球等鞭金藻(Isochrysis sphaerica)生长及其脂肪酸的影响[J]. 中国油料作物学报, 2011, 33(3): 295-301.
[23] CONVERTI A, CASAZZA A A, ORTIZ E Y, et al. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production[J]. Chemical Engineering and Processing: Process Intensification, 2009, 48(6): 1146-1151. DOI:10.1016/ j.cep.2009.03.006.
[24] CAI Fang, DUPERTUIS Y M, PICHARD C. Role of polyunsaturated fatty acids and lipid peroxidation on colorectal cancer risk and treatments[J]. Current Opinion in Clinical Nutrition & Metabolic Care, 2012, 15(2): 99-106. DOI:10.1097/MCO.0b013e32834feab4.
[25] 蒋汉明, 翟静, 张媛英, 等. 温度对海洋微藻生长及脂肪酸组成的影响[J]. 食品研究与开发, 2005, 26(6): 9-12. DOI:10.3969/ j.issn.1005-6521.2005.06.003.
[26] FISARAKIS I, CHARTZOULAKIS K, STAVRAKAS D. Response of Sultana vines (V. vinifera L.) on six rootstocks to NaCl salinity exposure and recovery[J]. Agricultural Water Management, 2001, 51(1): 13-27. DOI:10.1016/S0378-3774(01)00115-9.
[27] 范博. 低温胁迫下ABA诱导冬小麦抗氧化防护系统的研究[D]. 哈尔滨: 东北农业大学, 2012: 6.
[28] 程艳丽, 宋纯鹏. 植物细胞H 2O 2的信号转导途径[J]. 中国科学: 生命科学, 2005, 35(6): 480-489. DOI:10.3321/ j.issn:1006-9259.2005.06.001.
[29] GECHEV T, WILLEKENS H, van MONTAGU M, et al. Different responses of tobacco antioxidant enzymes to light and chilling stress[J]. Journal of Plant Physiology, 2003, 160(5): 509-515. DOI:10.1078/0176-1617-00753.
[30] SUZUKI N, SEJIMA H, TAM R, et al. Identification of the MBF1 heat-response regulon of Arabidopsis thaliana[J]. Plant Journal, 2011, 66(5): 844-851. DOI:10.1111/j.1365-313X.2011.04550.x.
Effect of Low Environmental Temperature on Antioxidant System and DHA Content in Isochrysis galbana 3011
WANG Ting, ZHAO Pei, WANG Xueqing*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:Effects of low environmental temperature on the activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT), and the contents of glutathione peroxidase (GSH), malondialdehyde (MDA), docosahexaenoic acid (DHA) and reactive oxygen species (ROS) in Isochrysis galbana 3011 were investigated for exploring the relationship among antioxidant enzyme activities, ROS levels and DHA contents at different temperatures. The enzyme activities were determined by corresponding kits. ROS levels were detected by flow cytometry and inverted fluorescence microscope, and DHA contents were determined by gas chromatography (GC). The results showed that activities of SOD, CAT and POD increased firstly and then decreased with increasing culture time at 15, 18 and 21 ℃. Lower temperature could result in earlier and higher enzyme activity peaks followed by a faster decline. The profile of GSH was similar to that of antioxidant enzyme activities, while content of MDA increased continuously. ROS levels showed a complex change with declining temperature, and ROS burst was appeared after induction for 16 h at 15 and 18 ℃, with maximum values of (14.11 ± 0.11)% and (14.74 ± 0.58)% at 20 h, respectively (P < 0.05). DHA was 0.105 mg/g at 18 ℃ for 24 h, which was higher than that at 24 ℃ for 24 h by 0.06 mg/g. Therefore, low environmental temperature can improve the levels of metabolic products by activating microalgae defense responses, increasing ROS-related enzyme activities, ROS levels and DHA contents.
Key words:Isochrysis galbana 3011; antioxidant; low temperature; reactive oxygen species (ROS); docosahexaenoic acid
DOI:10.7506/spkx1002-6630-201601023
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2016)01-0126-07
引文格式:
王婷, 赵培, 王雪青. 低温环境对球等鞭金藻3011抗氧化系统和二十二碳六烯酸产量的影响[J]. 食品科学, 2016, 37(1): 126-132.
DOI:10.7506/spkx1002-6630-201601023. http://www.spkx.net.cn
WANG Ting, ZHAO Pei, WANG Xueqing. Effect of low environmental temperature on antioxidant system and DHA content in Isochrysis galbana 3011[J]. Food Science, 2016, 37(1): 126-132. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201601023. http://www.spkx.net.cn
收稿日期:2015-02-11
基金项目:天津市高等学校科技发展基金计划项目(20120603);国家自然科学基金面上项目(31270050; 31071522;31171674)
作者简介:王婷(1989—),女,硕士研究生,主要从事微藻生理生化研究。E-mail:xuantingqian@aliyun.com
*通信作者:王雪青(1964—),女,教授,博士,主要从事天然活性物质研究。E-mail:wxqing@tjcu.edu.cn