邱理红 1,王占洋 1,李雅娟 1,佀营营 2,周 慧 1,韩 欢 2,许 波 2,李 刚 2,谢建新 1,李 忌 2,王振华 2,*
(1.石河子大学药学院,新疆 石河子 832005;2.烟台大学生命科学学院,线粒体与健康衰老研究中心,山东 烟台 264005)
摘 要:目的:考察异甘草素对3 T3-L1前脂肪细胞分化的影响,探究其作用机制。方法:采用3T3-L1前脂肪细胞,利用磺酰罗丹明B(sulforhodamine B,SRB)法检测异甘草素对3T3-L1前脂肪细胞增殖的影响,采用传统的鸡尾酒法诱导3T3-L1细胞分化为脂肪细胞,利用油红O染色法检测分化细胞脂滴形成;采用实时荧光定量逆转录聚合酶链式反应方法,检测细胞CCAAT增强子结合蛋白(CCAAT-enhancer-binding proteins,C/EBP)亚型C/EBPα、C/EBPβ、脂肪酸合成酶(f atty acid synthetase,FAS)、脂肪分化相关蛋白adipophilin、过氧化物酶体增殖物激活受体γ(peroxisome proliferators activated receptor γ,PPARγ)、腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)的mRNA表达水平,Western blotting法检测AMPK蛋白磷酸化水平。结果:异甘草素可浓度依赖性地抑制3T3-L1细胞增殖,并明显抑制分化细胞内脂滴形成,同时抑制了细胞分化相关基因C/EBPα、C/EBPβ、FAS、adipophilin、PPARγ mRNA的表达,AMPK mRNA的表达未受影响,但异甘草素处理明显上调了AMPK蛋白的磷酸化水平。结论:异甘草素可抑制3T3-L1前脂肪细胞向脂肪细胞分化,其机制可能与活化AMPK信号通路相关。
关键词:异甘草素;3T3-L1前脂肪细胞;分化;脂质生成;腺苷酸活化蛋白激酶
http://www.spkx.net.cn
脂肪组织是人体重要的储能组织,如果脂肪细胞增殖分化异常,将诱发代谢综合征、胰岛素抵抗和心脑血管疾病等发生 [1-4],干预脂肪细胞增殖和分化是防治上述疾病的关键策略。脂肪合成包括前脂肪细胞增殖和分化为成熟脂肪细胞两个阶段,细胞增殖已被证明是脂肪合成的必需条件 [5],而细胞分化同时也成为人们研究的热点。
传统中药甘草(Glycyrrhiza uralensis Fisch)具有广泛的药理作用,也是重要的药食同源植物之一。已有研究表明甘草提取物可抑制绵羊皮下脂肪沉积 [6],提示甘草具有减肥作用。也有研究报道甘草总黄酮对2型糖尿病大鼠糖脂代谢异常产生了有益的调节作用 [7]。但目前甘草调控糖脂代谢的确切物质基础和活性机制仍未被揭示。
异甘草素(isoliquiritigenin,ISL)是甘草黄酮类化合物的一种,难溶于水,易溶于极性小的溶剂,存在于豆科植物甘草的根 [8],鹰嘴豆的幼苗,红芪、黄芪的根 [9],串果藤 [10]、香殊兰的球茎 [11]等中。异甘草素具有诱导肿瘤细胞分化 [12]、抗氧化 [13]等广泛活性,但尚未见其对脂代谢调控的报道,本研究考察异甘草素对3T3-L1前脂肪细胞分化为脂肪细胞的调控作用,并初步探讨其分子机制,以期为甘草对糖脂代谢调控的活性物质基础研究提供参考。
1.1 材料与试剂
3T3-L1前脂肪细胞,购自中国典型培养物保藏中心,由烟台大学线粒体与健康衰老研究中心传代保存,复苏后10 代以内细胞用于实验。
异甘草素、DMEM高糖完全培养基、磺酰罗丹明B(sulforhodamine B,SRB)、二甲基亚砜(dimethyl sulfoxide,DMSO)、异丁基甲基黄嘌呤(isobutylmethylxanthine,IBMX)、地塞米松、油红O美国Sigma公司;生物合成人胰岛素注射液 丹麦诺和诺德公司;逆转录试剂盒 郑州久是生物技术有限责任公司;兔抗T172磷酸化腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)(p-AMPK)、总AMPK(t-AMPK)抗体 美国Cell Signaling公司;反转录聚合酶链式反应(reverse transcript polymerase chain reaction,RT-PCR)基因表达测定引物由生工生物工程(上海)股份有限公司设计合成。
1.2 仪器与设备
SpectraMax Paradigm型多功能酶标仪 美国美谷分子仪器有限公司;DYCZ-24DN型电泳槽电泳仪 北京六一仪器厂;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;Tanon 5200 Multi型荧光倒置显微镜 麦克奥迪实业集团有限公司;StepOne实时荧光定量PCR仪 美国Life Technologies公司。
1.3 方法
1.3.1 “鸡尾酒法”诱导3T3-L1前脂肪细胞向脂肪细胞分化
参考文献:[14]方法,将3T3-L1前脂肪细胞用含10%小牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM高糖完全培养基,于37 ℃、5% CO 2条件下培养,待细胞生长至对数期,胰蛋白酶消化后,按6×10 4个/mL接种于6 孔板。待细胞生长完全融合,发生接触抑制后48 h,即为第0天,换诱导分化液1(含1 μmol/L地塞米松、500 μmol/L IBMX、10 μg/mL胰岛素的完全培养基);继续培养48 h后,换以含10 μg/mL胰岛素的完全培养基继续培养48 h,换为正常完全培养基培养,隔2 d换液一次,一般至第8天90%以上细胞都会有脂滴形成,此时诱导完毕。
1.3.2 SRB法检测异甘草素对3T3-L1细胞增殖活性的影响
取对数生长期的3T3-L1细胞,按1×10 5个/mL的密度接种于96 孔板中,每孔加入细胞悬液100 μL,置于CO 2培养箱中孵育12 h,换以含不同浓度(2.0、6.0、20.0、50.0、100.0 μmol/L)异甘草素的完全培养基,每组设6 个平行复孔,另设不含药物的完全培养基作为空白对照组(0.0 μmol/L),继续培养48 h。随后参考文献[15]方法,采用SRB法检测不同浓度异甘草素对3T3-L1细胞增殖的影响。
1.3.3 油红O染色法检测3T3-L1细胞分化程度和细胞内脂质含量
参考文献[16-17],在诱导3T3-L1细胞分化的同时,于诱导培养基中加入不同浓度(2.0、6.0、20.0 μmol/L)的异甘草素,连续处理8 d后,细胞用4%的多聚甲醛固定30 min后,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3 次,加油红O染色1 h,再加入70%乙醇浸洗1 min,PBS洗2 次,加入苏木素染色细胞核5 min,70%乙醇浸洗1 min,PBS洗3 次,封片后在显微镜下观察脂滴形成情况并拍照。随后每孔加入150 μL异丙醇,溶解细胞内脂滴结合的油红O染料,于酶标仪上测定490 nm波长处的光密度(OD)值,以OD 490 nm定量评价细胞内的脂质含量,判定异甘草素对3T3-L1细胞分化的影响。
1.3.4 异甘草素对3T3-L1前脂肪细胞分化相关基因表达的检测
将3T3-L1前脂肪细胞按照1.3.3节方法进行分化加药处理,在用异甘草素处理8 d后用Trizol试剂盒提取总RNA,并用反转录试剂盒将RNA转录成cDNA。放于-80 ℃保存。用于实时荧光定量PCR的相关基因引物序列见表1 [18-19]。
表1 实时荧光定量RT-PCR引物序列
Table 1 Primer sequences for RT-PCR

注:C/EBPα、C/EBPβ均为CCAAT增强子结合蛋白(CCAAT-enhancerbinding proteins,C/EBP)的亚型;FAS.脂肪酸合成酶(fatty acid synthetase);PPARγ.过氧化物酶体增殖物激活受体γ(peroxisome proliferators activated receptor γ);AMPK. 腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase)。
基因引物序列(5’→3’)β-actin正向:GTCCCTCACCCTCCCAAAAG反向:GTCGCCTCAACACCTCAACCC C/EBPα正向:TTACAACAGGCCAGGTTTCC反向:CACAGGGATGGATCGATTGT C/EBPβ正向:CGCCCGCCGCCTTTAGAC反向:CGCTCGTGCTCGCCAATGG FAS正向:AGAGGCTTGTGCTGACTTCC反向:GTGGCTTCGGCGATGAGAG adipophilin正向:AGTGCCCTGCCCATCATCC反向:GTAGTCGTCACCATCCTTCG PPARγ正向:CTTGTGAAGGTGCAAGGGT反向:ATACAAATGCTTTGCCAGGG AMPK正向:AGCCAAATCAGGGACTGCTA反向:GAGGGAGGTGACAGATGAGG
1.3.5 Western blotting法检测异甘草素作用后AMPK磷酸化蛋白的表达
3T3-L1前脂肪细胞按照1.3.3节方法进行分化加药处理,在用异甘草素处理8 d后提取蛋白质,二喹啉甲酸(bicinchoninic acid,BCA)试剂盒检测蛋白浓度,-80 ℃保存。取样品蛋白进行变性处理,用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分离胶、5%的浓缩胶分离蛋白,然后转移至硝酸纤维素膜上,用5%牛血清白蛋白(bovine serum albumin,BSA)封闭2 h,用1∶1 000稀释的兔抗p-AMPK抗体或t-AMPK在4 ℃条件下孵育过夜,TBST(Tris buffered saline with Tween)洗3 次,每次20 min,再用1∶2 000稀释的辣根过氧化物酶标记的二抗室温孵育2 h,TBST洗3 次,每次10 min,此后用ECL发光显色试剂盒显影成像。
1.4 统计学处理
所有数据用SPSS 16.0统计软件进行统计分析,两组间比较采用独立样本t检验,P<0.05、P<0.01表示具有统计学差异。
2.1 异甘草素对3T3-L1前脂肪细胞增殖的影响
如图1所示,不同浓度的异甘草素(2.0~100.0 μmol/L)与3T3-L1前脂肪细胞共孵育48 h后,可浓度依赖性地抑制3T3-L1细胞的增殖。20.0 μmol/L的异甘草素即可明显抑制细胞增殖(P<0.01),但细胞形态正常,未见死亡脱落细胞;当异甘草素浓度达到50.0 μmol/L时,可见少量死亡脱落细胞;100.0 μmol/L异甘草素处理后,几乎全部细胞脱落死亡。后续实验考察了未造成细胞死亡的不同浓度异甘草素(2.0、6.0、20.0 μmol/L)对3T3-L1前脂肪细胞分化和脂质形成的影响。

图1 异甘草素对3T3-L1细胞增殖的影响(x±s,n=33)
Fig.1 Effect of isoliquiritigenin on the proliferation of 3T3-L1 preadipocytes (x± s, n = 3)
**.与空白对照组(0 μmol/L)比较,差异极显著(P<0.01)。下同。
2.2 异甘草素对3T3-L1分化细胞脂质形成的影响
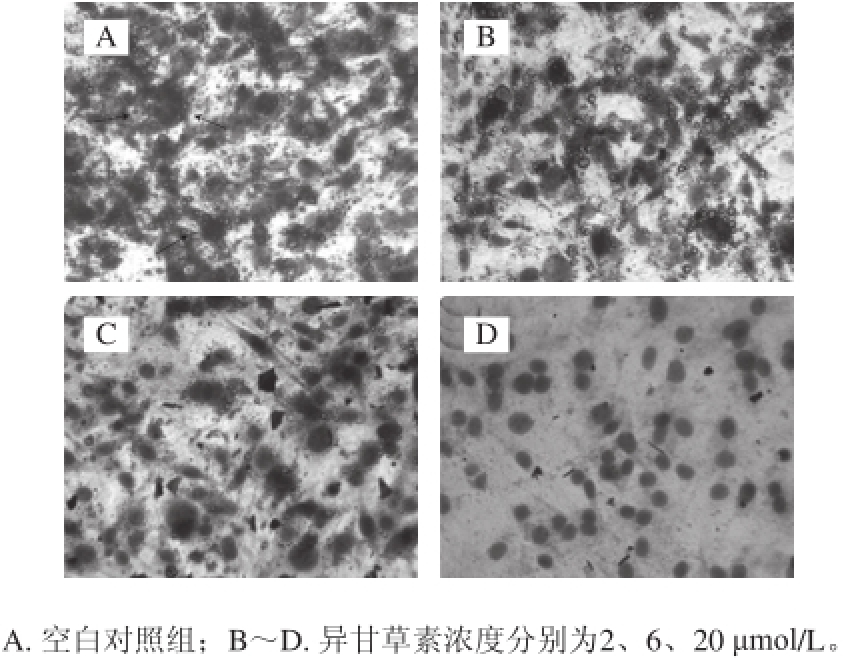
图2 异甘草素对3T3-L1分化脂肪细胞脂滴形成的影响(油红O和苏木素染色,200×)200
Fig.2 Effect of isoliquiritigenin on the formation of lipid droplets (oil red O and hematoxylin staining, 200 ×)
3T3-L1细胞经诱导分化及不同浓度的异甘草素作用后,用油红O染色,显微镜下拍照观察。如图2A所示,空白对照组细胞内形成较大脂滴,且呈戒环样结构,表明3T3-L1细胞已分化为成熟的脂肪细胞。在诱导分化过程中加入不同浓度异甘草素后,细胞内脂滴数量明显减少,且呈浓度依赖性(图2B ~2D)。采用异丙醇溶解油红O后测定其OD 490 nm,结果表明 异甘草素可浓度依赖性地降低细胞内脂质含量(图3),即异甘草素抑制了3T3-L1前脂肪细胞的分化。
2.3 异甘草素对3T3-L1前脂肪细胞分化相关基因表达的影响
为进一步探讨异甘草素对3T3-L1前脂肪细胞分化调控的作用机制,采用实时荧光定量RT-PCR检测异甘草素对3T3-L1脂肪细胞分化相关基因表达的调控作用。如图4所示,首先检测了两个重要的3T3-L1前脂肪细胞分化转录因子C/EBPα和C/EBPβ基因表达水平,与空白对照组相比,异甘草素可浓度依赖性地下调C/EBPα和C/EBPβ基因的表达;FAS是脂肪细胞脂质合成的关键酶,于脂肪细胞中高表达,脂肪细胞分化成熟也会伴随着脂肪分化相关蛋白adipophilin表达的增加,PPARγ基因在3T3-L1前脂肪细胞中表达量较低,而当3T3-L1前脂肪细胞分化成熟时,其表达水平就会增加;与空白对照组相比,异甘草素亦可浓度依赖性地下调FAS、adipophilin和PPARγ基因的表达,AMPK是细胞能量的感受器,在调控糖脂代谢和转化中起关键作用,本研究未观察到甘草素对3T3-L1分化脂肪细胞AMPK基因表达有显著影响。
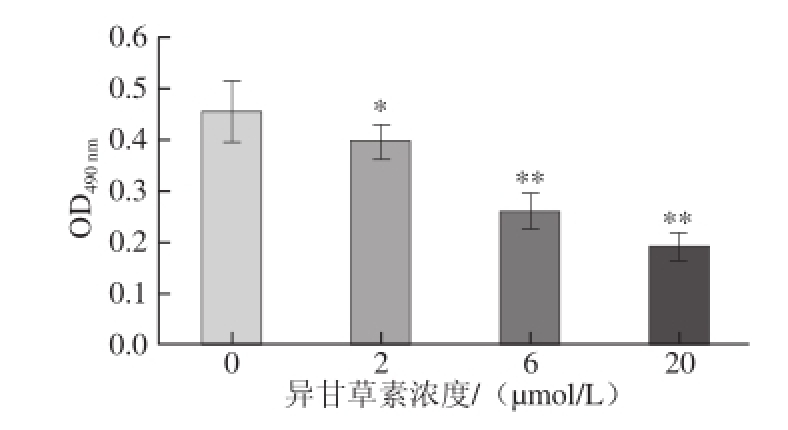
图3 异甘草素对3T3-L1分化脂肪细胞脂质含量的影响(x±s,n=33)
Fig.3 Effect of isoliquiritigenin on the lipid content in 3T3-L1 differentiated adipocytes (x± s, n = 3)
*.与空白对照组(0 μmol/L)比较,差异显著(P<0.05)。下同。
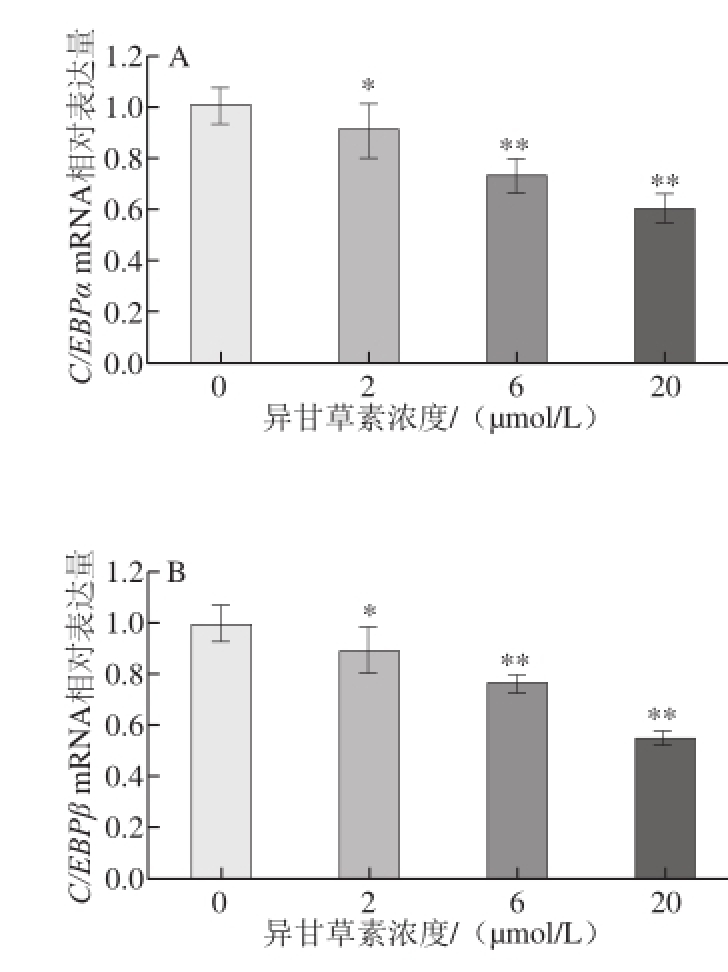
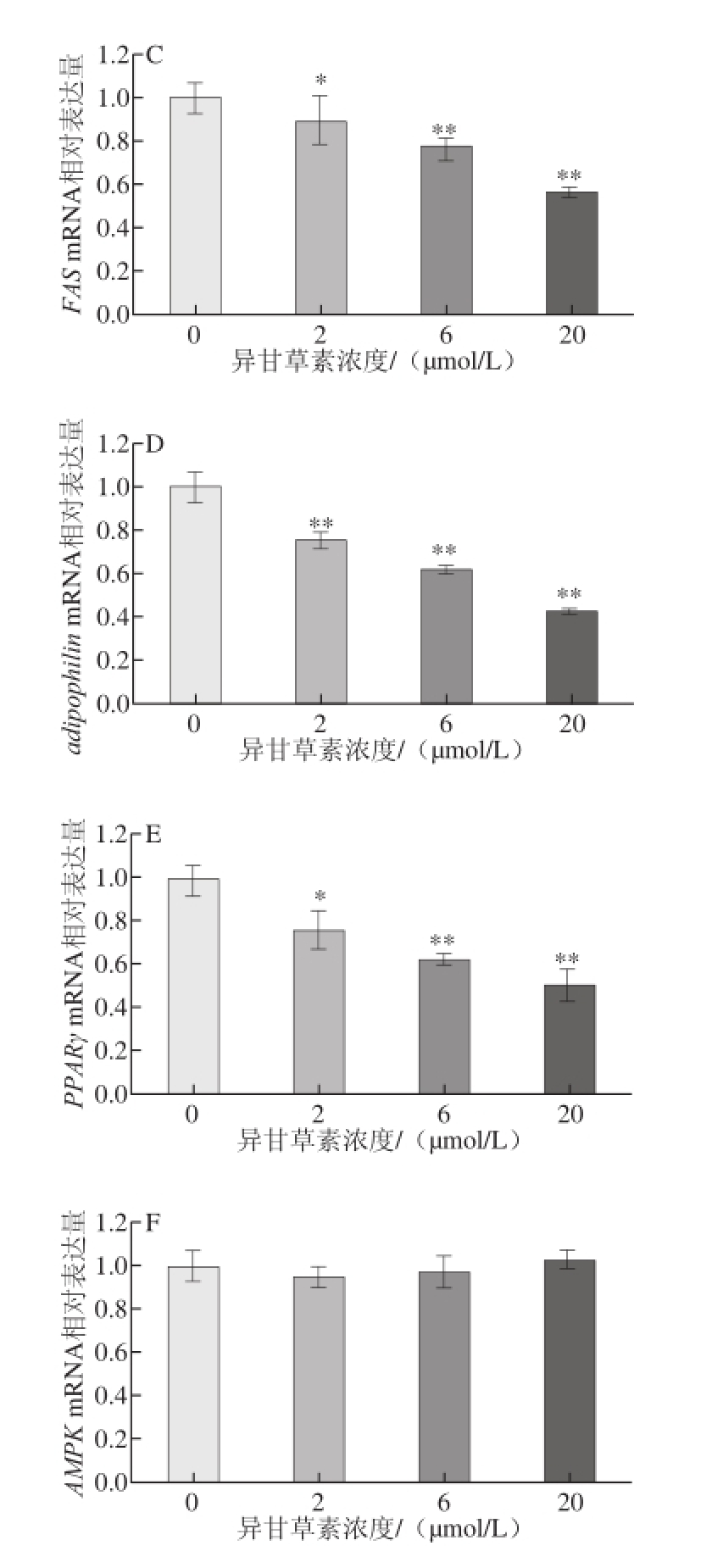
图4 异甘草素对3T3-L1细胞分化相关基因表达的影响(x ±s,n=33)
Fig.4 Modulating effect of isol iquiritigenin on the differentiationrelated gene expression in 3T3-L1 cells (x ± s, n = 3)
2.4 异甘草素对3T3-L1分化脂肪细胞AMPK蛋白磷酸化水平的影响
进一步采用Western blotting法检测异甘草素对3T3-L1分化脂肪细胞内AMPK蛋白磷酸化水平的影响,结果表明异甘草素可浓度依赖性地上调AMPK蛋白磷酸化水平(图5、6)。本研究未发现异甘草素促进AMPK基因转录,但明显上调了AMPK蛋白磷酸化水平,Choi等 [20]在研究异甘草素对细胞氧化胁迫保护作用时发现,异甘草素可通过活化AMPK保护细胞线粒体免受氧化损伤。这表明AMPK信号通路活化可能是异甘草素抑制3T3-L1脂肪细胞分化的深层次机制,但也有可能是通过活化AMPK促进了脂质的降解,仍需进一步研究确定。
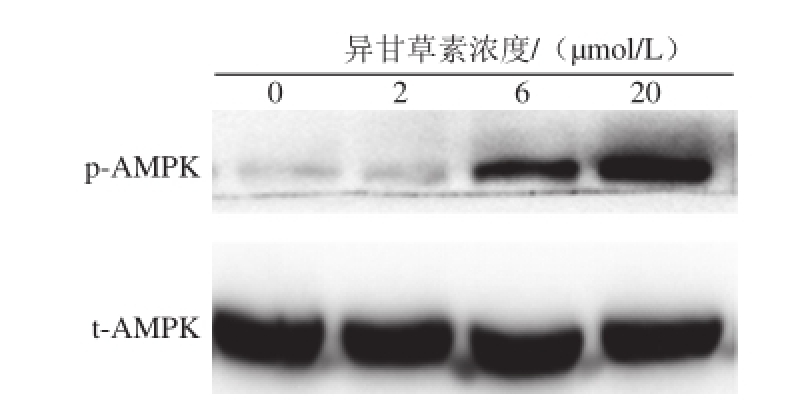
图5 异甘草素对3T3-L1细胞磷酸化AMPK(p-AMPK)和总AMMPPKK(t-AMPK)表达的影响
Fig.5 Effect of isoliquiritigenin on the expression of phosphorylated AMPK (p-AMPK) and total AMPK (t-AMPK) in 3T3-L1 cells
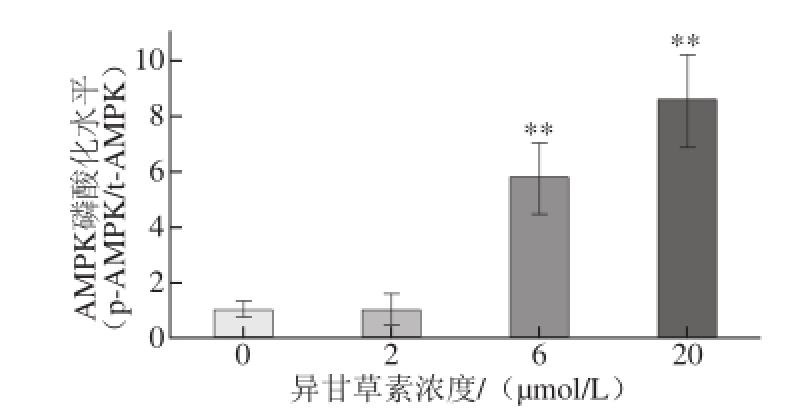
图6 异甘草素对3T3-L1细胞AMPK蛋白磷酸化水平的影响
Fig.6 Protein expression levels of p-AMPK analyzed by Western blotting
C/EBPα、C/EBPβ是增强子结合蛋白家族的重要成员 [21-22],参与前脂肪细胞分化的调控,在3T3-L1前脂肪细胞分化早期,C/EBPβ高度表达,而后C/EBPβ激活3T3-L1前脂肪细胞分化的两个主要调控基因PPARγ和C/EBPα,协同完成成熟脂肪细胞的脂肪表型。PPARγ是配体激活转录因子核受体超家族的成员之一,是脂肪细胞分化所必须的调控因子 [23],研究表明PPARγ和C/EBPα相互交叉调节它们的基因表达,在PPARγ存在的条件下,异位表达成纤维细胞的C/EBPα才能诱导成脂化发生 [24],相应地,在缺乏C/EBPα的情况下,异位表达小鼠胚胎成纤维细胞的PPARγ可诱导成脂化发生,而当不表达PPARγ时,C/EBPα不能促使成脂化发生 [25],同时PPARγ能够刺激前脂肪细胞分化为成熟脂肪细胞,且与成熟脂肪细胞内脂肪形成密切相关。也有研究表明 [26]脂肪细胞分化与脂肪酸合成酶基因FAS有关,当脂肪细胞分化时,脂滴增多,即FAS表达增加,脂肪细胞的分化成熟也与脂肪细胞分化蛋白adipophilin的表达有关,分化成熟时adipophilin表达增加。Kim等 [27]也发现异甘草素可抑制肝细胞脂肪合成和脂肪变性,与其抑制肝细胞内包括FAS在内的脂质合成相关酶的表达有关。AMPK是细胞糖脂代谢的关键调控因子,其活化可增强各组织的胰岛素敏感性,促进能量生成(葡萄糖输运、脂肪酸氧化),抑制能量消耗(脂质合成、蛋白质合成和糖异生),可以抑制脂肪细胞内脂肪酸的释放,促进其降解,从而对代谢综合征、糖尿病等起到治疗作用 [28]。AMPK属于丝/苏氨酸蛋白激酶家族成员,AMPK在上游信号分子作用下,其α亚基Thr172位点发生磷酸化而被激活,激活的AMPK通过抑制脂肪细胞分化过程中的关键分子而抑制脂肪细胞的分化。研究表明AMPK的激活剂A-769662可下调过氧化物增殖体受体PPARγ、C/EBPα、脂肪酸合成酶等分化转录因子的表达,从而抑制脂肪细胞的分化 [29]。
脂肪细胞分化功能失常将会导致脂质堆积,引起肥胖、动脉粥样硬化、脂肪肝、糖尿病等疾病的发生和发展,抑制前脂肪细胞的增殖和分化有望成为防治多种疾病的策略之一。甘草是重要的药食同源资源,应用广泛,近来报道表明其对脂代谢有一定调控作用,但其作用的物质基础和确切机制仍未阐明。3T3-L1前脂肪细胞是国际通用的体外研究脂肪细胞分化的细胞系,本实验选用“鸡尾酒”法诱导出3T3-L1细胞分化为典型脂肪细胞,细胞内形成大量脂滴,脂肪细胞标志性基因C/EBPα、C/EBPβ、FAS、adipophilin高表达。诱导分化同时以异甘草素处理3T3-L1细胞,细胞内的脂滴形成被明显抑制,与脂质合成密切相关的基因C/EBPα、C/EBPβ、FAS、adipophilin、PPARγ的表达水平也明显下调,充分表明异甘草素抑制了3T3-L1前脂肪细胞向脂肪细胞的分化。
参考文献:
[1] HUBERT H B. The importance of obesity in the development of coronary risk factors and disease: the epidemiologic evidence[J]. Annual Review of Public Health, 1986, 7(1): 493-502. DOI:10.1146/ annurev.pu.07.050186.002425.
[2] 陈光亮, 李莉. 盐酸西布曲明对营养性肥胖大鼠的减肥作用[J].中国临床药理学与治疗学, 2003, 8(1): 55-58. DOI:10.3969/ j.issn.1009-2501.2003.01.014.
[3] ROSENBERG D E, JABBOUR S A, GOLDSTEIN B J. Insulin resistance, diabetes and cardiovascular risk: approaches to treatment[J]. Diabetes, Obesity and Metabolism, 2005, 7(6): 642-653. DOI:10.1111/ j.1463-1326.2004.00446.x .
[4] van ITALLIE T B. Health implications of overweight and obesity in the United States[J]. Annals of Internal Medicine, 1985, 103(6): 983-988. DOI:10.7326/0003-4819-103-6-983.
[5] ZHANG J W, TANG Q Q, VINSON C, et al. Dominant-negative C/EBP disrupts mitotic clonal expansion and differentiation of 3T3-L1 preadipocytes[J]. Proceedings of the National Academy of Sciences, 2004, 101(1): 43-47. DOI:10.1073/pnas.0307229101.
[6] 常彦飞, 罗海玲, 张玉伟, 等. 甘草提取物对绵羊皮下脂肪沉积与代谢相关酶活性的影响[J]. 中国畜牧兽医, 2013, 40(11): 115-120.
[7] 赵海燕, 王勇, 马永平, 等. 甘草黄酮对2型糖尿病大鼠高血糖, 高血脂的抑制作用[J]. 中国现代医学杂志, 2010 (17): 2573-2578.
[8] CHIN Y W, JUNG H A, LIU Y, et al. Anti-oxidant constituents of the roots and stolons of licorice (Glycyrrhiza glabra)[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4691-4697. DOI:10.1021/jf0703553.
[9] ZHAO J, YU Q T, LI P, et al. Determination of nine active components in Radix Hedysari and Radix Astragali using capillary HPLC with diode array detection and MS detection[J]. Journal of Separation Science, 2008, 31(2): 255-261. DOI:10.1002/jssc.200700379.
[10] PAN X, KONG L D, ZHANG Y, et al. In vitro inhibition of rat monoamine oxidase by liquiritigenin and isoliquiritigenin isolated from Sinofranchetia chinensis[J]. Acta Pharmacologica Sinica, 2000, 21(10): 949-953.
[11] RAMADAN M A, KAMEL M S, OHTANI K, et al. Minor phenolics from Crinum bulbispermum bulbs[J]. Phytochemistry, 2000, 54(8): 891-896. DOI:10.1016/S0031-9422(00)00184-9.
[12] LI D, WANG Z, CHEN H, et al. Isoliquiritigenin induces monocytic differentiation of HL-60 cells[J]. Free Radical Biology and Medicine, 2009, 46(6): 731-736. DOI:10.1016/j.freeradbiomed.2008.11.011.
[13] 张鑫, 杨英杰, 吕庆章. 4种甘草黄酮类化合物抗氧化活性的密度泛函理论研究[J]. 计算机与应用化学, 2012, 29(6): 656-660. DOI:10.3969/j.issn.1001-4160.2012.06.005.
[14] MA C, WANG J, CHU H, et al. Purification and characterization of aporphine alkaloids from leaves of Nelumbo nucifera Gaertn and their effects on glucose consumption in 3T3-L1 adipocytes[J]. International Journal of Molecular Sciences, 2014, 15(3): 3481-3494. DOI:10.3390/ ijms15033481.
[15] 孙超, 甘露, 张梅, 等. 丹参素对低氧低糖损伤神经细胞的影响[J]. 时珍国医国药, 2010, 21(4): 912-914. DOI:10.3969/ j.issn.1008-0805.2010.04.070.
[16] MAEDA H, HOSOKAWA M, SASHIMA T, et al. Fucoxanthin and its metabolite, fucoxanthinol, suppress adipocyte differentiation in 3T3-L1 cells[J]. International Journal of Molecular Medicine, 2006, 18(1): 147-152. DOI:10.3892/ijmm.18.1.147.
[17] DALLAS C, GERBI A, TENCA G, et al. Lipolytic effect of a polyphenolic citrus dry extract of red orange, grapefruit, orange (SINETROL) in human body fat adipocytes. Mechanism of action by inhibition of cAMP-phosphodiesterase (PDE)[J]. Phytomedicine, 2008, 15(10): 783-792. DOI:10.1016/j.phymed.2008.05.006.
[18] HSIEH T J, HSIEH P C, WU M T, et al. Betel nut extract and arecoline block insulin signaling and lipid storage in 3T3-L1 adipocytes[J]. Cell Biology and Toxicology, 2011, 27(6): 397-411. DOI:10.1007/s10565-011-9195-5.
[19] HSU H F, TSOU T C, CHAO H R, et al. Effects of arecoline on adipogenesis, lipolysis, and glucose uptake of adipocytes: a possible role of betel-quid chewing in metabolic syndrome[J]. Toxicology and Applied Pharmacology, 2010, 245(3): 370-377. DOI:10.1016/ j.taap.2010.04.008.
[20] CHOI S H, KIM Y W, KIM S G. AMPK-mediated GSK3β inhibition by isoliquiritigenin contributes to protecting mitochondria against ironcatalyzed oxidative stress[J]. Biochemical Pharmacology, 2010, 79(9): 1352-1362. DOI:10.1016/j.bcp.2009.12.011.
[21] 姚焰础, 高民. 脂肪细胞分化的转录因子及转录调控[J]. 中国畜牧杂志, 2008, 44(5): 50-54.
[22] DARLINGTON G J, ROSS S E, MACDOUGALD O A. The role of C/EBP genes in adipocyte differentiation[J]. Journal of Biological Chemistry, 1998, 273(46): 30057-30060. DOI:10.1074/ jbc.273.46.30057.
[23] KAJIMURA S, SEALE P, TOMARU T, et al. Regulation of the brown and white fat gene programs through a PRDM16/CtBP transcriptional complex[J]. Genes & Development, 2008, 22(10): 1397-1409. DOI:10.1101/gad.1666108.
[24] FREYTAG S O, PAIELLI D L, GILBERT J D. Ectopic expression of the CCAAT/enhancer-binding protein alpha promotes the adipogenic program in a variety of mouse fibroblastic cells[J]. Genes & Development, 1994, 8(14): 1654-1663. DOI:10.1101/gad.8.14.1654.
[25] ROSEN E D, HSU C H, WANG X, et al. C/EBPα induces adipogenesis through PPARγ: a unified pathway[J]. Genes & Development, 2002, 16(1): 22-26. DOI:10.1101/gad.948702.
[26] ROSEN E D, SPIEGELMAN B M. Molecular regulation of adipogenesis[J]. Annual Review of Cell and Developmental Biology, 2000, 16(1): 145-171. DOI:10.1146/annurev.cellbio.16.1.145.
[27] KIM Y M, KIM T H, KIM Y W, et al. Inhibition of liver X receptorα-dependent hepatic steatosis by isoliquiritigenin, a licorice antioxidant flavonoid, as mediated by JNK1 inhibition[J]. Free Radical Biology and Medicine, 2010, 49(11): 1722-1734. DOI:10.1016/ j.freeradbiomed.2010.09.001.
[28] DAVAL M, FOUFELLE F, FERRÉ P. Functions of AMP-activated protein kinase in adipose tissue[J]. Journal of Physiology, 2006, 574(1): 55-62. DOI:10.1113/jphysiol.2006.111484.
[29] ZHOU Y, WANG D, ZHU Q, et al. Inhibitory effects of A-769662, a novel activator of AMP-activated protein kinase, on 3T3-L1 adipogenesis[J]. Biological and Pharmaceutical Bulletin, 2009, 32(6): 993-998. DOI:10.1248/bpb.32.993.
Isoliquiritigenin Inhibits the Differentiation of 3T3-L1 Preadipocytes
QIU Lihong
1, WANG Zhanyang
1, LI Yajuan
1, SI Yingying
2, ZHOU Hui
1, HAN Huan
2, XU Bo
2, LI Gang
2, XIE Jianxin
1, LI Ji
2, WANG Zhenhua
2,*
(1. School of Pharmacy, Shihezi University, Shihezi 832005, China; 2. Center of Mitochondria and Healthy Aging, College of Life Sciences, Yantai University, Yantai 264005, China)
Abstract:Objective: To investigate the potential effects and underlying mechanisms of isoliquiritigen in on the differentiation of 3T3-L1 preadipocytes. Methods: The SRB assay was used to evaluate the effects of isoliquiritigenin on the proliferation of 3T3-L1 preadipocytes. The differentiation of 3T3-L1 cells was induced by cocktail reagents. The formation of lipid droplets in the differentiated adipocytes was observed after oil red O staining and quantified by colorimetry. The expression of CCAAT-enhancer-binding proteins (C/EBP)-α and-β, fatty acid synthetase (FAS), adipophilin, peroxisome proliferators activated receptor γ (PPARγ) and adenosine monophosphate activated protein kinase (AMPK) genes was measured by quantity real-time reverse transcript polymerase chain reaction (qRT-PCR). The phosphorylation of AMPK protein was detected by Western blotting. Results: Isoliquiritigenin inhibited the proliferation of 3T3-L1 preadipocytes in a concentration-dependent manner. The isoliquiritigenin treatment significantly decreased the formation of lipid droplets in differentiated adipocytes. Furthermore, isoliquiritigenin down-regulated the mRNA expression of C/EBPα, C/EBPβ, FAS, adipophilin, and PPARγ genes. On the other hand, isoliquiritigenin had no obvious effects on the mRNA expression of AMPK gene, but up-regulated the phosphorylation of AMPK. Conclusion: Isoliquiritigenin could inhibit the proliferation and differentiation of 3T3-L1 preadipocytes due to the activation of AMPK signal pathway.
Key words:isoliquiritigenin; 3T3-L1 preadipocytes; differentiation; lipogenesis; adenosine monophosphate activated protein kinase (AMPK)
DOI:10.7506/spkx1002-6630-201601028
中图分类号:R966
文献标志码:A
文章编号:1002-6630(2016)01-0157-06
引文格式:
邱理红, 王占洋, 李雅娟, 等. 异甘草素对3T3-L1前脂肪细胞分化的抑制作用[J]. 食品科学, 2016, 37(1): 157-162.
DOI:10.7506/spkx1002-6630-201601028. http://www.spkx.net.cn
QIU Lihong, WANG Zhanyang, LI Yajuan, et al. Isoliquiritigenin inhibits the differentiation of 3T3-L1 preadipocytes[J]. Food Science, 2016, 37(1): 157-162. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601028.
收稿日期:2015-03-09
基金项目:国家自然科学基金面上项目(11175222);石河子大学重大科技攻关计划项目(gxjs2012-zdgg02);
山东省泰山学者建设工程专项(tshw201502046);山东省科技发展计划项目(2014GHY115010)
作者简介:邱理红(1988—),女,硕士研究生,研究方向为分子药理学。E-mail:qiulihonglinhong@163.com
*通信作者:王振华(1973—),男,副教授,博士,研究方向为自由基生物医学。E-mail:zhenhuawang@tom.com