周广亮,丛 贺,全吉淑,沈明花 *
(延边大学医学院,吉林 延吉 133000)
摘 要:目的:探讨榆干离褶伞(Lyophyllum ulmarium,L.u)溶栓酶对H 2O 2诱导人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)损伤的保护作用。方法:用H 2O 2诱导HUVEC氧化损伤,采用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法观察细胞存活率;用流式细胞仪检测细胞线粒体跨膜电位(Δ Ψ m)和总活性氧(reactive oxygen species,ROS)水平;Western blotting法检测Caspase-8、Caspase-9、Caspase-3等蛋白的表达水平。结果:L.u溶栓酶可显著提高HUVEC的存活率,明显抑制H 2O 2诱导的细胞内ROS生成和线粒体跨膜电位的下降,并能降低Caspase-8、Caspase-9和Caspase-3的表达水平。结论:L.u溶栓酶对氧化应激损伤的HUVEC有保护作用,其机制可能与抑制细胞凋亡有关。
关键词:榆干离褶伞;溶栓酶;人脐静脉内皮细胞;线粒体跨膜电位;活性氧;凋亡
血栓症是一类严重危害人类健康的心血管疾病。近年来,随着人们生活习惯及饮食文化的改变,其发病率逐年上升且趋于年轻化。因此,对血栓症的预防及治疗越来越受到人们的关注。血栓的形成与诸多因素有关,如血管内膜损伤、血小板功能异常、血液黏度改变、凝血和纤溶系统功能异常等。其中,血管内皮细胞的损伤与血栓形成密切相关。多种氧化应激均可诱导内皮细胞的功能损伤和凋亡。
榆干离褶伞(Lyophyllum ulmarium,L.u),又名大榆蘑,主要分布在我国河北、吉林、黑龙江、河南、甘肃、青海等省。在前期研究中,本课题组从L.u菌丝体中分离纯化了分子质量为50 kD的溶栓酶,并进行了特性分析 [1],结果表明L.u发酵液具有抗氧化 [2]、保肝 [3]、溶栓 [4]和保护血管内皮细胞 [5]等功效。本研究通过建立H 2O 2诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)损伤模型,观察L.u溶栓酶对人脐静脉内皮细胞的保护作用,以阐明其溶栓机制。
1.1 材料与细胞株
L.u溶栓酶,延边大学生物化学实验室提供 [1]。
HUVEC购自北京宏宝达生物科技有限公司。
1.2 试剂
四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、罗丹明123、双氢罗丹明123 美国Sigma公司;澳洲胎牛血清、DMEM培养基 美国Gibco公司;兔抗Caspase-8、Caspase-3和Caspase-9抗体 美国Santa Cruz公司。
1.3 仪器与设备
倒置显微镜 日本日立公司;酶标仪 日本岛津公司;流式细胞仪 美国Beckman公司。
1.4 方法
1.4.1 细胞培养
在37 ℃、5% CO 2条件下,将HUVEC常规培养于含10%胎牛血清的DMEM培养液中。
1.4.2 L.u溶栓酶对氧化损伤HUVEC存活率的影响
将培养的HUVEC密度调整为5×10 4个/mL,接种到96 孔板中,每孔200 μL。分为正常组、模型组和L.u溶栓酶低(0.28 μg/mL)、中(1.12 μg/mL)、高(4.48 μg/mL)剂量组,每组设8 个复孔。L.u溶栓酶低、中、高剂量组的HUVEC以L.u溶栓酶分别预处理12、24、48 h,正常组和模型组以无血清培养基代替L.u溶栓酶。每组细胞各培养12、24、48 h后,模型组和L.u溶栓酶各剂量组加入终浓度为200 μmol/L的H 2O 2,继续培养4 h。每孔各加入预先配制的MTT溶液20 μL,在37 ℃孵育4 h。吸去每孔培养液,各加入150 μL DMSO,振荡5 min后在490 nm波长处测定各孔吸光度(A 490 nm),按照下式计算HUVEC存活率。
1.4.3 总活性氧(reactive oxygen species,ROS)含量的测定
实验分组同1.4.2节。L.u溶栓酶各剂量组细胞分别以低、中、高剂量的L.u溶栓酶预处理24 h,正常组和模型组以无血清培养基代替L.u溶栓酶。24 h后,模型组和L.u溶栓酶各剂量组分别加入终浓度为200 μmol/L的H 2O 2继续培养4 h。用胰蛋白酶消化HUVEC,收集1×10 6个细胞用200 μL磷酸盐缓冲液(phosphate buffered saline,PBS)重悬,加入1 μmol/L的双氢罗丹明123,在培养箱避光孵育45 min。以PBS漂洗两次,重悬后用流式细胞仪检测分析细胞的荧光强度值,该值代表细胞ROS水平,实验结果为3 次平行实验的平均值。
1.4.4 细胞线粒体跨膜电位(ΔΨ m)的检测
实验分组及处理、收集细胞过程同1.4.3节。以10 μg/mL的罗丹明123染液代替1 μmol/L的双氢罗丹明123。用流式细胞仪检测细胞的荧光强度值,该值代表细胞的ΔΨ m,实验结果为3 次平行实验的平均值。
1.4.5 Western blotting法检测Caspase-3、Caspase-8、Caspase-9蛋白表达水平
实验分组同1.4.2节。L.u溶栓酶各剂量组以不同剂量的L.u溶栓酶预处理24 h,正常组和模型组以无血清培养基代替L.u溶栓酶。培养24 h后,除正常组外,其他各组加入终浓度为200 μmol/L的H 2O 2,继续培养4 h。分别收集各组细胞,提取总蛋白,进行电泳、转膜、加抗体、显影及定影。
1.5 统计学分析
实验数据用±s表示,用SPSS统计软件对数据进行处理,组间比较采用t检验,多组比较进行单因素方差分析。
2.1 L.u溶栓酶对HUVEC存活率的影响
表1 L.u溶栓酶对HUVEC存活率的影响
Table 1 Effect of fibrinolytic enzyme from L.u on cell viability

注:*.与正常组相比,差异显著(P<0.05);**.与正常组相比,差异极显著(P<0.01);#.与模型组相比,差异显著(P<0.05);##.与模型组相比,差异极显著(P<0.01)。
12 h24 h48 h组别AHUVECAHUVECAHUVEC 490 nm存活率/% 490 nm存活率/% 490 nm存活率/%正常组0.493±0.035100.000.497±0.060100.000.593±0.034100.00模型组0.312±0.02546.53**0.341±0.02854.63**0.394±0.04054.73** L.u溶栓酶低剂量组0.328±0.02551.33**0.410±0.016 74.56** ##0.455±0.03168.56** L.u溶栓酶中剂量组0.447±0.04286.28* ##0.432±0.01680.94* ##0.479±0.02673.97** ##L.u溶栓酶高剂量组0.454±0.02588.53* ##0.472±0.01592.86 ##0.487±0.02775.74** ##
如表1所示,各时间段内模型组的HUVEC存活率明显低于正常组(P<0.01),而L.u溶栓酶各剂量组的HUVEC存活率逐渐升高,L.u溶栓酶中、高剂量组的HUVEC存活率极显著高于模型组(P<0.01),以上结果说明L.u溶栓酶对H 2O 2致HUVEC氧化损伤有保护作用。
2.2 L.u溶栓酶对HUVEC总活性氧(ROS)水平的影响
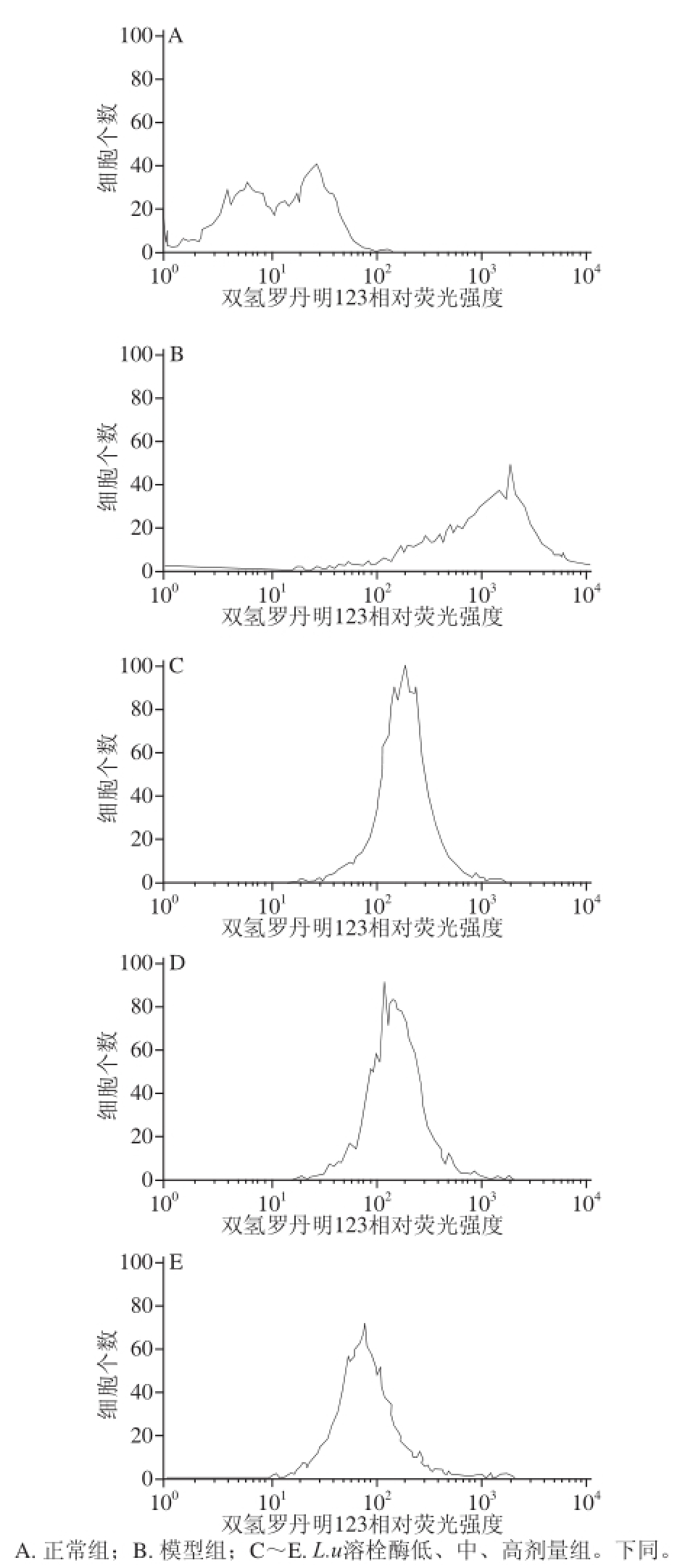
图1 1 L.uL.u溶栓酶对HUVEC内ROS含量的影响
Fig.1 Effect of fibrinolytic enzyme from L.u on intracellular ROS level
如图1所示,正常组的相对荧光强度值为16.49,即双氢罗丹明123氧化生成的罗丹明123含量很低,表明细胞内的ROS水平较低;模型组细胞相对荧光强度值为1 322.40,与正常组相比极显著升高(P<0.01)。而L.u溶栓酶低、中、高剂量组的相对荧光强度值分别为190.90、164.37、90.57,与模型组相比明显减少(P<0.01),并随着L.u溶栓酶剂量的增加呈下降趋势,这就表明L.u溶栓酶可使氧化损伤的HUVEC内ROS水平下降。
2.3 L.u溶栓酶对HUVEC内Δ Ψ m的影响
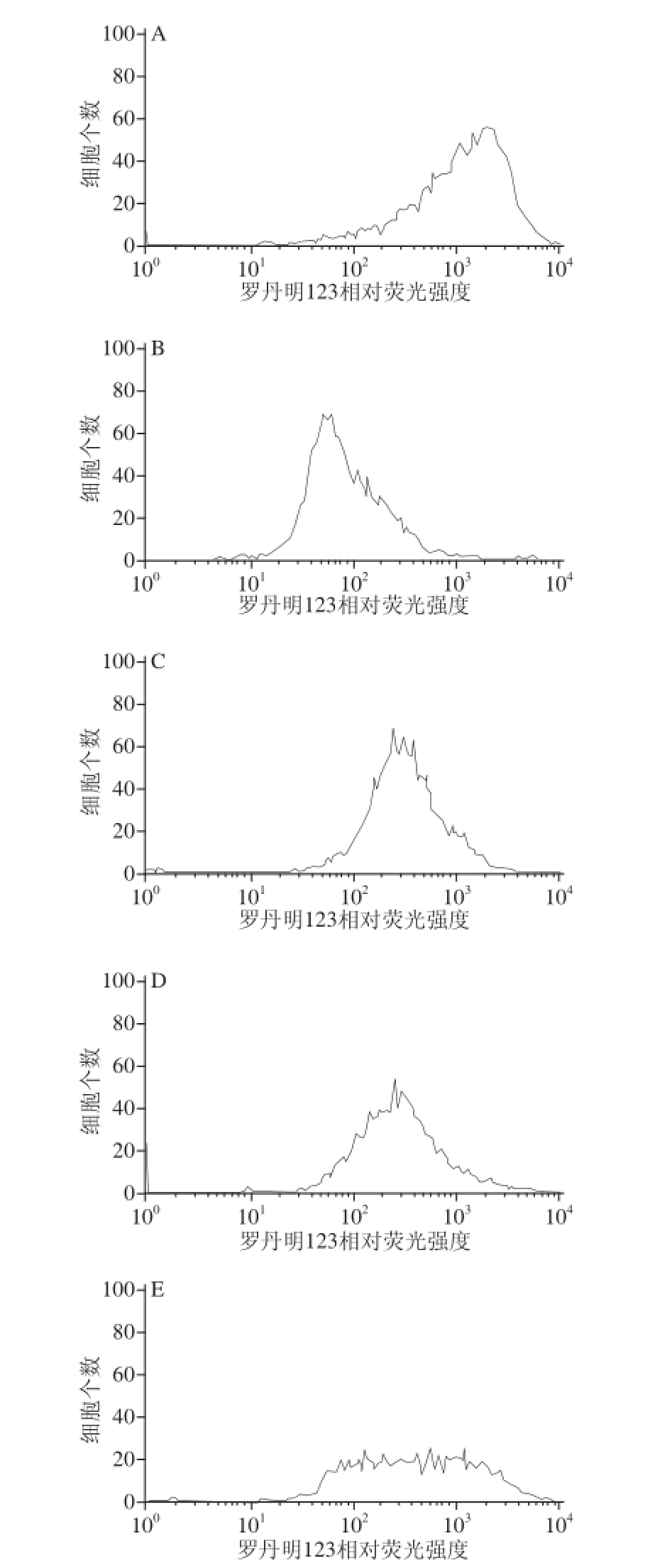
图2 2 L.uL.u溶栓酶对HUVEC内ΔVEC Ψ
m的影响
Fig.2 Effect of fibrinolytic enzyme from L.u on mitochondrial Δ Ψ
min HUVEC
如图2所示,正常组的相对荧光强度值为1 439.43,模型组相对荧光强度值为105.33,与正常组相比明显降低,并具有统计学意义(P<0.01)。这就说明H 2O 2作用以后HUVEC内ΔΨ m极显著降低。而L.u溶栓酶低、中、高剂量组的相对荧光强度值分别为375.47、333.09、702.67,与模型组相比明显升高(P<0.01),并随着L.u溶栓酶剂量的增加呈升高趋势。
2.4 L.u溶栓酶对HUVEC内Caspase-3、Caspase-8、Caspase-9蛋白表达水平的影响
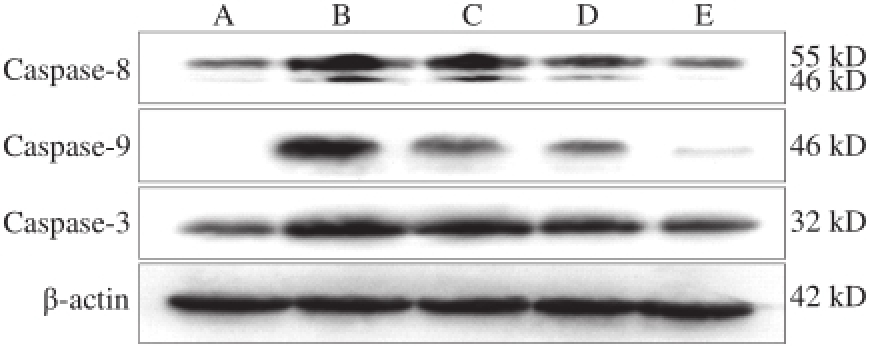
图3 3 L.uL.u溶栓酶对HUVEC内Caspase-8、Caspase-9、Caspase-3蛋白表-3达水平的影响
Fig.3 Effect of fibrinolytic enzyme from L.u on the expression of Caspase-8, Caspase-9 and Caspase-3
如图3所示,与正常组相比,模型组HUVEC内Caspase-3、Caspase-8、Caspase-9的表达量均增加,与模型组相比,L.u溶栓酶低、中、高剂量组HUVEC内Caspase-3、Caspase-8、Caspase-9蛋白表达量减少,并随着L.u溶栓酶剂量的增加而减少。
血管内皮细胞的结构、功能紊乱与氧化应激密切相关 [6]。本实验中以H 2O 2诱导HUVEC氧化应激损伤模型,观察了L.u溶栓酶对HUVEC存活率、ROS水平、Δ Ψ m以及凋亡相关蛋白表达量的影响。结果显示,L.u溶栓酶对HUVEC有保护作用,这可能与其抑制ROS的产生、提高Δ Ψ m以及抑制凋亡有关。
H 2O 2作为一种氧化应激刺激,作用于细胞以后产生ROS [7]。ROS水平升高是引起内皮细胞功能损伤的主要原因 [8]。过度产生的ROS影响细胞的膜性结构和功能,造成细胞膜的脂质过氧化、蛋白质变性 [9]等,继而改变细胞膜通透性。线粒体是ROS产生的主要场所之一 [10-11],也是氧化磷酸化进行的部位 [12-13]。细胞内高水平的ROS可破坏线粒体膜性结构,开放线粒体内外膜交界处的渗透性转换通道会导致线粒体跨膜电位下降,氧化磷酸化受阻,使细胞受损或死亡。本实验中,模型组HUVEC内的ROS水平远远高于正常组,而Δ Ψ m和细胞存活率显著低于正常组。以L.u溶栓酶预保护后,HUVEC内ROS水平明显降低,Δ Ψ m和细胞存活率升高,这就提示L.u溶栓酶可清除ROS或者抑制ROS产生,致使线粒体膜免受自由基的攻击,保护线粒体,防止Δ Ψ m的下降,保障氧化磷酸化顺利进行,从而提高细胞存活率。本课题组在前期研究中发现L.u具有抗氧化作用 [2],同样也支持了本实验的结果。
线粒体在细胞凋亡中处于核心地位 [14-15]。有文献报道,ROS可引起Δ Ψ m的下降 [16-18],而这种Δ Ψ m下降被认为是细胞凋亡级联反应过程中最早发生的事件 [19]。研究证实H 2O 2主要通过激活经典的线粒体途径诱导细胞凋亡 [20]。Δ Ψ m的下降及通透性的改变使细胞色素c从线粒体中释放至胞浆中,胞浆中的细胞色素c通过与凋亡相关因子Apaf-1结合,从而激活Caspase-9,继而激活其下游的Caspase-3而诱导细胞凋亡 [21-23]。H 2O 2可引起线粒体膜的损伤,造成线粒体膜通透性增高,细胞色素c从线粒体释放到胞浆,从而触发Caspase家族介导的细胞凋亡。Caspase家族的活化是细胞凋亡的典型特征 [24]。本实验结果显示,模型组的Caspase-8、Caspase-9和Caspase-3表达量明显高于正常组,表明H 2O 2主要通过激活代表死亡受体通路的Caspase-8和代表线粒体通路的Caspase-9以及下游的Caspase-3表达引起细胞凋亡,这与H 2O 2引起心肌细胞发生凋亡的机制相一致 [25]。本课题组在前期研究中发现,在与本实验相同的条件下,相同浓度的H 2O 2可引起血管内皮细胞的凋亡 [5]。本研究虽然没有进行H 2O 2诱导细胞凋亡率的检测,但根据先前研究结果认为,模型组中至少一部分细胞是通过凋亡途径死亡的。与模型组相比,L.u溶栓酶各剂量组HUVEC内的Caspase-8、Caspase-9和Caspase-3表达量减少,这就提示L.u溶栓酶通过两种不同的凋亡途径抑制HUVEC凋亡,从而提高细胞存活率,这也是其保护HUVEC的重要途径之一。
综上所述,L.u溶栓酶对H 2O 2所致的HUVEC氧化应激有保护作用,这可能是其发挥溶栓或抗栓作用的机制之一。
参考文献:
[1] 沈明花, 金成俊. 榆干离褶伞溶栓酶的纯化及酶学性质研究[J]. 食品与发酵工业, 2007, 33(8): 45-47.
[2] 孙权, 沈玉秀, 沈明花. 榆干离褶伞发酵液体外抗氧化性能研究[J].食品科技, 2010, 35(1): 223-225.
[3] 金梅花, 沈玉秀, 沈明花. 榆干离褶伞发酵液对急性肝损伤的保护作用[J]. 食品科技, 2010, 35(4): 77-80.
[4] 沈明花, 彭瀛, 宋晓琳. 榆干离褶伞发酵液的溶栓作用与降血脂作用研究[J]. 食品与发酵工业, 2011, 37(10): 28-30.
[5] 彭灜, 周广亮, 沈明花. 榆干离褶伞发酵液对血管内皮细胞的保护作用[J]. 食品与生物技术学报, 2014, 33(2): 177-180. DOI:10.3969/ j.issn.1673-1689.2014.02.011.
[6] ROSS R. Atherosclerosis-an inflammatory disease[J]. New England Journal of Medicine, 1999, 340(2): 115-126. DOI:10.1056/ NEJM199901143400207.
[7] 高小清, 张磊, 刘明, 等. HSF1对氧化应激诱导内皮细胞凋亡的保护作用的机制研究[J]. 中国分子心脏病学杂志, 2010, 11(3): 162-165.
[8] 范俊, 杨成明, 连继勤, 等. 血管紧张素Ⅱ升高血管内皮细胞中ROS水平并激活自噬通路[J]. 中国病理生理杂志, 2012, 28(7): 1166-1171. DOI:10.3969/j.issn.1000-4718.2012.07.003.
[9] 顾伟, 范昕建, 吴疆, 等. 胡黄连苷Ⅱ对H 2O 2损伤L-02细胞的保护作用[J]. 世界华人消化杂志, 2008, 16(29): 3274-3278. DOI:10.3969/ j.issn.1009-3079.2008.29.005.
[10] 廖日滔, 郭静科, 李冰洁, 等. 自由基相关细胞信号传导的研究进展[J].中国细胞生物学学报, 2014, 36(11): 1573-1583.
[11] 纪元, 龙建纲, 刘健康, 等. 自噬发生中的ROS调节机制[J]. 中国生物化学与分子生物学报, 2014, 30(4): 321-327.
[12] 曾慧兰, 韩新爱, 古晨, 等. 6-姜酚诱导白血病细胞凋亡中细胞内活性氧及线粒体跨膜电位的改变[J]. 中草药, 2010, 33(4): 584-587.
[13] 高培国, 强辉, 凌鸣. 葛根素对过氧化氢诱导的血管内皮细胞损伤的保护作用[J]. 西安交通大学学报: 医学版, 2012, 33(2): 245-248. DOI:10.3969/j.issn.1671-8259.2012.02.028.
[14] 吴萍, 陈思, 程文晋, 等. 线粒体凋亡途径参与TRAIL诱导胃腺癌细胞凋亡[J]. 安徽医科大学学报, 2007, 42(6): 599-602. DOI:10.3969/ j.issn.1000-1492.2007.06.002.
[15] 王瑜, 李晓佳, 樊官伟, 等. 中药有效组分抑制心肌细胞凋亡调控通路研究进展[J]. 辽宁中医杂志, 2011, 38(12): 2487-2489.
[16] SANDERSON T H, REYNOLDS C A, KUMAR R, et al. Molecular mechanisms of ischemia-reperfusion injury in brain: pivotal role of the mitochondrial membrane potential in reactive oxygen species generation[J]. Molecular Neurobiology, 2013, 47(1): 9-23. DOI:10.1007/s12035-012-8344-z.
[17] LIU S Y, CHEN C L, YANG T T, et al. Albumin prevents reactive oxygen spe cies-induced mitochondrial damage, autophagy, and apoptosis during serum starvation[J]. Apoptosis, 2012, 17(11): 1156-1169. DOI:10.1007/s10495-012-0758-6.
[18] LIANG D, ZHOU Q, ZHANG J, et al. A novel chenodeoxycholic acid-verticinone ester induces apoptosis and cell cycle arrest in HepG2 cells[J]. Steroids, 2012, 77(13): 1381-1390. DOI:10.1016/ j.steroids.2012.08.013.
[19] 王超云, 张树平, 许勇, 等. 红花黄色素B对AngⅡ诱导内皮细胞线粒体损伤的保护作用[J]. 药学学报, 2012, 47(6): 811-815.
[20] 郝旭亮. 罗布麻总黄酮抗血栓作用物质基础及抗人脐静脉血管内皮细胞凋亡作用机理研究[D]. 太原: 山西医科大学, 2009: 79-92. DOI:10.7666/d.y1458012.
[21] FULDA S. Cell death in hematological tumors[J]. Apoptosis, 2009, 14(4): 409-423. DOI:10.1007/s10495-008-0306-6.
[22] ESKES R, DESAGHER S, ANTONSSON B, et al. Bid induces the oligomerization and insertion of Bax into the outer mitochondrial membrane[J]. Molecular and Cellular Biology, 2000, 20(3): 929-35. DOI:10.1128/mcb.20.3.929-935.2000 .
[23] 冯阳, 刘建军, 黄钢. 线粒体膜通透性转换孔结构与功能研究进展[J].上海交通大学学报(医学版), 2012, 32(3): 356-360. DOI:10.3969/ j.issn.1674-8115.2012.03.026.
[24] 刁增艳, 王翠兰, 谭东, 等. 氨甲酰基促红素的制备及其对过氧化氢损伤的SH-SY5Y细胞保护作用的观察[J]. 山东大学学报(医学版), 2011, 49(9): 6-12. DOI:10.7666/d.y2045524.
[25] 肖卫民, 蒋碧梅, 石永忠, 等. 过氧化氢通过线粒体通路和死亡受体通路诱导心肌细胞凋亡[J]. 中国动脉硬化杂志, 2003, 11(3): 185-188. DOI:10.3969/j.issn.1007-3949.2003.03.001.
Protective Effect of Fibrinolytic Enzyme from Lyophyllum ulmarium on Vascular Endothelial Cells Injury Induced by Oxidative Str ess
ZHOU Guangliang, CONG He, QUAN Jishu, SHEN Minghua
*
(Medical College, Yanbian University, Yanji 133000, China)
Abstract:Objective: To observe the protective effect of fibrinolytic enzyme fro m Lyophyllum ulmarium (L.u) on H 2O 2-induced oxidative damage of human umbilical vein endothelial cells (HUVECs). Methods: H 2O 2was used to induce the oxidative injury model of HUVECs. The survival rate of HUVECs was determined by MTT assay. The mitochondrial transmembrane potenti al (ΔΨ m) and reactive oxy gen species (ROS) of HUVECs were detected by flow cytometry. The expression of Caspase-8, Caspase-9 and Caspase-3 protei ns was detected by Western blotting. Results: L.u could increase t he survival rate of endothelial cells, inhibit intracellular ROS production and mitochondrial transmembrane potential reduction in HUVECs, and down-regulate the expression of Caspase-8, Caspase-9 and Caspase-3 proteins. Conclusion: The fibrinolytic enzyme from Lyophyllum ulmarium has protective effect on vascular endothelial cells due to the inhibition of apoptosis.
Key words:Lyophyllum ulmarium; fibrinolytic enzyme; human umbilical vein endothelial cell; mitochondrial transmembrane potential; reactive oxygen species; apoptosis
DOI:10.7506/spkx1002-6630-201601030
中图分类号:R282.75
文献标志码:A
文章编号:1002-6630(2016)01-0171-05
引文格式:
周广亮, 丛贺, 全吉淑, 等. 榆干离褶伞溶栓酶对氧化应激损伤人脐静脉内皮细胞的保护作用[J]. 食品科学, 2016, 37(1): 171-175. DOI:10.7506/spkx1002-6630-201601030. http://www.spkx.net.cn
ZHOU Guangliang, CONG He, QUAN Jishu, et al. Protective effect of fibrinolytic enzyme from Lyophyllum ulmarium on vascular endothelial cells injury induced by oxidative stress[J]. Food Science, 2016, 37(1): 171-175. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601030. http://www.spkx.net.cn
收稿日期:2015-03-11
基金项目:国家自然科学基金面上项目(30760150;81360088)
作者简介:周广亮(1987—),男,实验师,硕士,主要从事天然物质活性研究。E-mail:nigel_@163.com
*通信作者:沈明花(1970—),女,副教授,博士,主要从事食用菌生物活性研究。E-mail:sdjjch@ybu.edu.cn