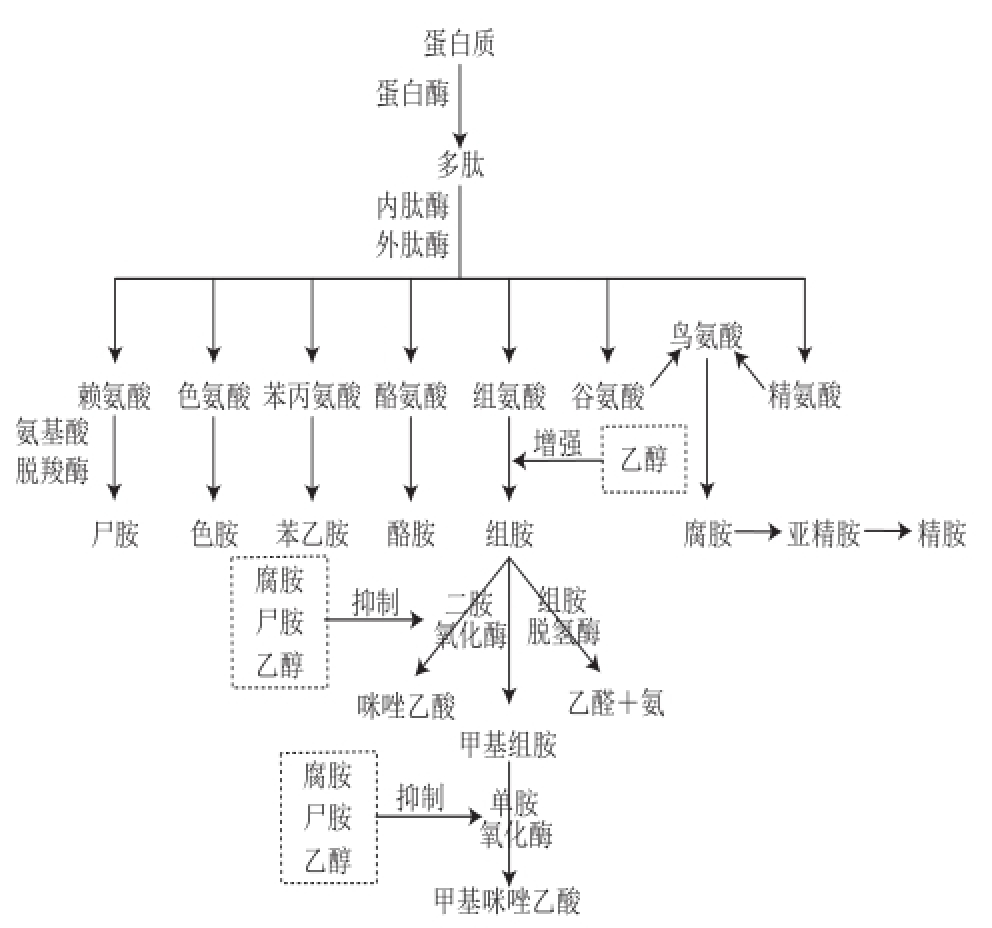
图1 生物胺的形成及组胺的分解
Fig.1 Formation of biogenic amines and degradation of histamine
王光强 1,2,俞剑燊 2,3,胡 健 2,3,曹利瑞 1,夏永军 1,2,艾连中 1,2,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.上海黄酒工程技术研究中心,上海 200093;3.上海金枫酒业股份有限公司,上海 200063)
摘 要:生物胺是一类具有生物活性、含氨基的低分子质量化合物。大多数食品中都含有生物胺,这些生物胺主要由微生物氨基酸脱羧酶作用于氨基酸脱羧而生成。适量生物胺可促进人体的正常生理活动,而过量摄入会产生不良反应。微生物在不同食品中的分布不尽相同,这导致在不同食品中生物胺种类和数量的差异。本文详细综述不同食品中生物胺的来源、产生机理、针对性的防治措施及其检测方法,为生产安全食品、降低食品中生物胺的含量提供解决方案。
关键词:生物胺;微生物;产生机理;防治措施
生物胺(biogenic amine,BA)是一类具有生物活性、含氨基的低分子质量有机化合物的总称。它们广泛存在于食品中,也是合成荷尔蒙、生物碱、核苷酸、蛋白质和芳香类化合物等的前体物质。适量摄入生物胺能促进生长、增强代谢活力、增强免疫力和清除自由基等,但是过量摄入生物胺则会引起头疼、腹部痉挛、呕吐等不良生理反应。其潜在的毒性作用和对食品鲜度的指示作用已引起了大量研究者的关注。目前,对生物胺的安全性、分析检测、形成及控制均有较深入的研究。本文将详细综述食品生物胺的研究进展。
根据生物胺的结构可将其分为三部分:腐胺(putrescine)、尸胺(cadaverine)、精胺(spermine)、亚精胺(spermidine)等脂肪族胺;酪胺(tyramine)、苯乙胺(phenylethylamine)等芳香族胺;组胺(histamine)、色胺(tryptamine)等杂环胺 [1]。按组成成分又可以将生物胺分为单胺和多胺,前者包括组胺、酪胺、尸胺、腐胺、色胺、苯乙胺等,精胺和亚精胺是多胺。
生物胺是生物体内正常的活性成分,在体内起着重要的生理作用。精胺、亚精胺、腐胺和尸胺是生物体内细胞重要的组成部分,在调节DNA、RNA和蛋白质合成及生物膜稳定性方面起着重要的作用,另外精胺对小肠也具有调节作用;色胺能调节血压;苯乙胺可以调节去甲肾上腺素水平和增加血压;酪胺具有显著的抗氧化作用,可以增加心率、血压和血糖浓度等 [2-3];组胺是另一种重要的生物胺,其参与局部免疫反应以及调节肠道生理功能,并参与炎症反应,另外组胺能调节白血细胞和一些蛋白质的数量,组胺还作为神经递质行使功能。已知组胺在人体内具有23 种不同的生理功能 [4-9],而且不断有其新功能的报道 [10]。这些生物胺的生物功能一般认为是建立在DNA、RNA、蛋白质以及膜成分等多种分子之间静电反应及相互结合的基础上,因此生物胺的数量至关重要。

图1 生物胺的形成及组胺的分解
Fig.1 Formation of biogenic amines and degradation of histamine
适量的生物胺有利于人体的健康,但是过量的生物胺会使人体中毒,导致严重的后果,会引起头疼、血压变化、呼吸紊乱、心悸、呕吐等严重反应 [2,11]。组胺是生物胺中毒性最大的,过量的组胺会导致头疼、消化障碍及血压异常,甚至会引起神经性毒性 [12]。酪胺的毒性次之,过量也会引起头痛和高血压等反应。尸胺和腐胺的自身毒性较小,但是能抑制组胺和酪胺相关代谢酶的活性,而增加组胺和酪胺的数量,从而增强人体的不适症状 [13](图1)。另外,腐胺、尸胺、精胺和亚精胺能够与亚硝酸盐反应产生致癌物质亚硝基胺 [2]。
虽然过量的生物胺会引起人体中毒,但目前很难确定一个标准量来衡量生物胺的毒性。主要原因如下:1)生物胺的种类很多,毒性不一,很难用总生物胺量确定其毒性;2)各种生物胺之间可以相互转化,而且在人体内有复杂的生物胺代谢途径,人体细胞本身不但合成各种生物胺而且贮存生物胺,人体吸收外源生物胺后,很难确定其去向 [4,14];3)生物胺的毒性受很多因素影响,例如其他生物胺、胺类氧化酶的存在等,因此很难给出特定生物胺的毒性衡量标准;4)不同人群对生物胺的反应不同,生物胺敏感人群耐受剂量更低,而人体肠道的不同解毒能力也影响中毒剂量。但根据研究发现口服8~40 mg的组胺,会导致轻微中毒;40~100 mg会产生中等中毒症状,口服超过100 mg会产生严重中毒症状 [15]。口服酪胺超过100 mg会引起偏头痛,超过1 080 mg会引起严重中毒 [16]。而3 mg的苯乙胺就能导致偏头疼 [17]。目前虽然制定食品中的生物胺标准十分困难,但部分国家已经尝试根据不同食品的特性给出生物胺的限量标准(表1)。美国规定水产品中组胺含量不得超过50 mg/kg [18];欧盟规定食品中组胺含量不得超过100 mg/kg,酪胺含量不得超过100~800 mg/kg [19];我国规定鲐鱼中组胺含量不得超过1 000 mg/kg,其他海产鱼类中不超过300 mg/kg [20]。由于乙醇会加强生物胺的毒性 [21](图1),因此生物胺在酒类中的限量标准要严于普通食品(表1)。澳大利亚和瑞士规定葡萄酒中的组胺含量不得高于10 mg/L,法国规定不得高于8 mg/L,荷兰规定不得高于3.5 mg/L,而德国更加严格,规定不得高于2 mg/L [21]。我国并没有规定酒类中的生物胺含量的限量标准。但我国葡萄酒中组胺的最高含量可达10.51 mg/L,总生物胺含量在6.34~39.05 mg/L之间 [22];而我国传统酒类黄酒中生物胺的平均含量高达115 mg/L [23],黄酒中组胺的含量在5.02~78.50 mg/L之间 [24],这远高于生物胺(组胺)在葡萄酒中的含量。因此探究生物胺的来源,根据其来源制定生物胺的控制策略,从而提高食品尤其是传统发酵食品或者酒类的安全水平,增强其市场竞争力。
表1 不同国家及地区生物胺的限量标准
Table 1 Limits of biogenic amines in different countries
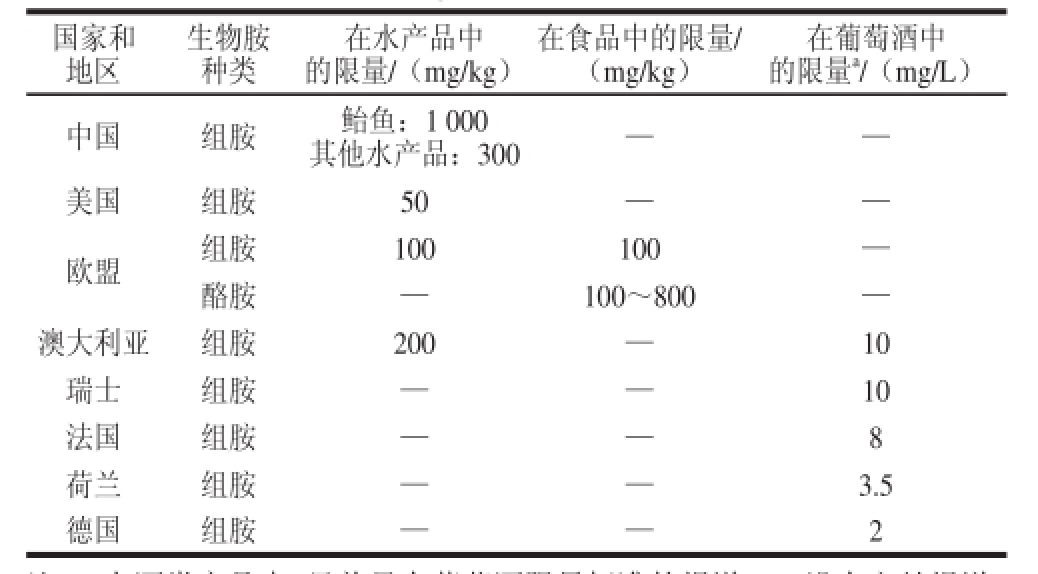
注:a.在酒类产品中,目前只有葡萄酒限量标准的报道;—.没有文献报道。
在葡萄酒中的限量 a/(mg/L)中国组胺鲐鱼:1 000其他水产品:300——美国组胺50——欧盟组胺100100—酪胺—100~800—澳大利亚组胺200—10瑞士组胺——10法国组胺——8荷兰组胺——3.5德国组胺——2国家和地区生物胺种类在水产品中的限量/(mg/kg)在食品中的限量/(mg/kg)
2.1 生物胺的形成
生物胺的前体物质一般是氨基酸,氨基酸通过相应的氨基酸脱羧酶代谢形成生物胺。食品中生物胺的形成一般需要3 个前提条件:1)食品中存在游离氨基酸;2)存在产脱羧酶的微生物及微生物存活繁殖的条件;3)有脱羧酶发挥活性的条件 [1]。
虽然并非所有的微生物都产生氨基酸脱羧酶,但具有此种活性的细菌种群及其在食品微生物的比例并不少。目前在乳杆菌属、片球菌属、乳球菌属、链球菌属、肠球菌属、梭菌属、克雷伯氏菌属、埃希氏菌属、变形菌属、假单胞菌属、沙丁氏菌属、链球菌属等菌属中均发现含有氨基酸脱羧酶的基因 [22,25-26]。人们最关注的是毒性最强的两种生物胺:组氨酸脱羧酶脱羧组氨酸而形成的组胺,以及酪氨酸经酪氨酸脱羧酶水解形成的酪胺(图1)。另外引起人们重视的是能与亚硝酸盐反应产生致癌物质的腐胺、尸胺、精胺和亚精胺 [2],而且腐胺、尸胺还能通过抑制生物胺分解酶的活性 [13]而增加组胺和酪胺的数量和毒性。尸胺是赖氨酸在酪氨酸脱羧酶的作用下脱羧的产物,但腐胺、精胺和亚精胺的形成过程相对复杂,是多步反应。首先精氨酸在精氨酸酶的作用下转化成鸟氨酸,部分细菌也能把谷氨酸转化成鸟氨酸,鸟氨酸被鸟氨酸脱羧酶分解为腐胺,腐胺在亚精胺合成酶的催化下形成亚精胺,亚精胺在精胺合成酶的作用下形成精胺 [27-28](图1)。组胺可被两种不同的氧化酶分解,一种是由二胺氧化酶氧化为咪唑乙酸,另一种首先被组胺甲基转移酶转化成甲基化组胺,进一步被单胺氧化酶氧化为甲基咪唑乙酸 [29]。而腐胺和尸胺对单胺氧化酶和二胺氧化酶都有抑制作用 [13],导致组胺和酪胺数量变多而毒性增强。虽然在各种食品中生物胺的生成和降解机理相似,但由于食品中游离氨基酸的种类及微生物的不同,导致各种食品中生物胺的种类和数量不同。
肉制品本身含有丰富的蛋白质,经降解后形成大量的生物胺前体物质氨基酸,经污染的微生物分解后,很容易导致生物胺的过量积累。通过研究发现牛肉在4 ℃贮存9 d时各种生物胺含量均低于30 mg/kg,而到达36 d时,尸胺和酪胺的含量大于120 mg/kg;鸡肉在贮存7 d后尸胺含量达到50 mg/kg,而其余生物胺在36 d时仍低于40 mg/kg [30]。Trevino等 [31]也发现在发酵牛肉香肠中以酪胺和腐胺为主,后期也会检测到组胺、尸胺等的存在。在冷藏的牛肉中酪胺也可能达到具有危害的水平 [32]。一般认为在肉及其制品中酪胺、腐胺和尸胺的含量较高,是主要的生物胺。这些生物胺主要由乳酸菌、肠杆菌、假单胞菌产生,其中肠杆菌具有较高的赖氨酸和鸟氨酸脱羧酶活性,会产生较高浓度的尸胺和腐胺 [33]。王新新等 [34]从冷藏兔肉中分离出嗜冷菌沙雷氏菌B25,此菌株也能产生高浓度的腐胺、尸胺和苯乙胺。由于尸胺和腐胺会散发出恶臭气味,所以也是常用来监控肉制品鲜度质量的指标 [35-36]。
以鱼制品为代表的水产品最容易导致生物胺中毒。这主要是由于鱼制品中含有丰富且极易被降解的蛋白质,再加上鱼制品极适宜微生物生长繁殖,大量各种微生物的生长极易造成鱼肉制品中生物胺含量超标且种类复杂,在鱼肉制品中可以检测到组胺、酪胺、尸胺、腐胺、精胺和亚精胺等,但常以组胺、尸胺和腐胺的含量来衡量水产品安全与质量 [37]。目前,各国和地区也已经制定了鱼类产品中组胺含量的限量标准(表1)。美国规定鱼类产品中的组胺含量不得超过50 mg/kg;欧盟规定水产品及其制品中组胺的含量不得超过100 mg/kg;澳大利亚的限量标准是200 mg/kg;我国规定鲐鱼类中组胺的限量标准为1 000 mg/kg,其他鱼类为300 mg/kg。经研究发现,腐胺含量与鲤鱼肉腐败程度具有相关性 [38],因此腐胺一般用作鲤鱼类产品腐败程度的指示剂。尸胺是鱼类产品初期腐败检测到的主要生物胺,Ruiz-Capillas等 [39]通过研究发现鳕鱼的新鲜度与尸胺和亚精胺含量成负相关,进一步研究发现在冰藏过程中,鳕鱼中尸胺含量显著增加,而组胺和酪胺含量却没有明显的变化,他们认为尸胺含量可以作为鳕鱼新鲜度的指标。鱼类制品中生物胺主要是由在加工、运输和贮藏过程中污染的微生物产生的。大量研究表明鱼类制品的生物胺主要由摩根菌属(Morganella)和肠杆菌(enteric bacteria)产生 [40-42]。Morganella属中的一些细菌如Morganella morganii和Morganella psychrotolerans主要产生组胺 [43-44]。发光细菌在一些鱼产品中也能产生组胺 [45]。而肠杆菌主要负责产生尸胺和腐胺,很少产生组胺 [46]。
酒类产品中的生物胺也是人们关注的一个重点。酒类生物胺的含量一般不像在鱼类制品中那样高,但是由于酒精体积分数在低于10%范围内时可以增加脱羧酶活性 [47],而且乙醇还是胺类氧化酶的抑制剂 [21](图1),体积分数12%的乙醇可以抑制91%的胺类氧化酶活性 [48],这会增强人体对生物胺的易感性和提高生物胺的毒性,因此生物胺在酒类中的限量标准比普通食品中严格(表1)。欧洲各国规定组胺在葡萄酒中的限量标准均低于10 mg/L之间,德国规定最为严格,不得高于2 mg/L [21]。而我国在酒类产品中并没有相关的限量标准。目前研究最为清楚的是葡萄酒中的生物胺:在制作葡萄酒的过程中,酒精发酵结束后,需要进一步进行苹果酸-乳酸发酵,很多研究认为乳酸菌为了在此极酸的环境中存活,会产生生物胺以中和酸性环境。在葡萄酒中可以测出多达20 种生物胺,以组胺、酪胺及腐胺为主 [49],主要由乳酸菌提供氨基酸脱羧酶。由于葡萄品种、产区和酿造工艺等不同,葡萄酒中生物胺的含量差异很大。希腊产葡萄酒中组胺含量在0.250~2.626 mg/L之间,酪胺含量在0~1.583 mg/L之间,腐胺含量在0.528~3.148 mg/L之间 [50];西班牙19 种葡萄酒中组胺含量在0~4.74 mg/L之间,酪胺含量在0~5.91 mg/L之间,腐胺含量在1.48~19.10 mg/L之间 [51];土耳其红葡萄酒中组胺含量在0~1.965 mg/L之间,酪胺含量在0~0.229 mg/L之间,腐胺含量也在5.920 mg/L之下 [52]。而我国38 个葡萄酒样品组胺含量在0~10.51 mg/L之间,酪胺含量在0~19.13 mg/L之间,腐胺含量含量在0.22~19.01 mg/L之间,总生物胺含量在0.35~31.46 mg/L之间,平均含量为8.92 mg/L [22]。按照瑞士限量标准(10 mg/L),97.4%(37/38)的国产葡萄酒样品合格,按照德国限量标准(2 mg/L),78.9%(30/38)的样品合格。从生物胺的角度来看,我国葡萄酒行业还需要做大量工作以降低以组胺为代表的生物胺含量。与葡萄酒相比,对黄酒中生物胺含量的研究相对较少,也没有国家制定黄酒中生物胺的限量标准。由于黄酒发酵的原料、菌株、工艺等的不同,研究者测得黄酒中生物胺含量差别极大,但总体而言与葡萄酒相比,黄酒中生物胺的含量高的多。Lu Yongmei等 [24]研究我国4 个黄酒主产区14 个黄酒样品中生物胺的含量时,发现组胺含量在5.02~78.5 mg/L之间,酪胺含量范围为0~100.8 mg/L,尸胺含量范围为0~121 mg/L,总生物胺含量在39.3~241 mg/L之间,平均生物胺含量为107 mg/L,这远高于我国葡萄酒中总生物胺的平均含量;14 个样品中,仅4 个样品中的组胺含量低于10 mg/L,3 个样品的生物胺含量高于40 mg/L [24],这也远高于葡萄酒中组胺的含量。但在其他研究中发现生物胺在黄酒中的含量却低得多。栾同青 [53]研究黄酒酿造过程中生物胺含量的变化时发现生物胺水平总体呈增长趋势,终产品中组胺含量为8.93 mg/L,酪胺含量为21.61 mg/L,腐胺含量为27.35 mg/L,总生物胺含量为57.88 mg/L,而且生物胺的含量并不随贮藏时间的延长而增加。张敬等 [54]分析12 个不同企业、不同工艺黄酒样品中生物胺含量,发现生物胺含量在18.603~140.010 mg/L之间,平均含量为78.304 mg/L,高于葡萄酒中生物胺的含量;组胺含量范围为1.914~10.725 mg/L之间,平均含量为6.173 mg/L,超过了德国、荷兰等国对葡萄酒组胺含量的限量标准,与法国组胺在葡萄酒中限量标准8 mg/L相比,12 个样品中3 个样品组胺含量超过了此标准。作为中国传统产品的黄酒,近年来已经得到长足的发展,但国际市场占有率极低,因此,降低黄酒中生物胺水平、提高黄酒安全水平,是其打入国际市场的关键。
酱油是我国传统的发酵食品,也是我国消费量极高的发酵产品。部分学者已经研究了酱油中生物胺的含量,邹阳等 [55]测定10 种市售酱油中生物胺含量,发现酪胺含量最高可达650 mg/L,腐胺含量最高达555 mg/L,苯乙胺含量在340 mg/L以下,组胺含量可达228 mg/L。李志军 [22]测定酱油中酪胺的含量最高达1 031 mg/kg,苯乙胺含量可达572 mg/kg,腐胺含量在277 mg/kg以下,组胺含量最高为209 mg/kg。虽然各研究者测得的数据不尽相同,但可以发现酪胺、腐胺和苯乙胺是酱油中主要的生物胺。目前国内外均未有酱油中生物胺的限量标准,但由于酱油中不含有乙醇,因此不能参考葡萄酒中生物胺的限量标准。以普通食品中生物胺的限量标准为参照,但考虑到酱油主要作为鲜味剂和咸味剂使用,平均每日摄入量很低,每日从酱油中摄入的组胺、酪胺等生物胺都远低于食品中的限量标准。另外考虑到酱油中主要生物胺是毒性较低的酪胺、腐胺和苯乙胺,因此食用酱油不会导致由生物胺引起的不适反应。
2.2 生物胺的控制
目前主要通过控制生物胺形成的3 个要素及增加生物胺的降解来控制食品中生物胺的水平。具体方法如下:1)控制食品中游离氨基酸的含量;2)控制产氨基酸脱羧酶的微生物的生长;3)控制氨基酸脱羧酶的活性;4)增强生物胺的降解水平。
2.2.1 控制食品中游离氨基酸含量
氨基酸是生物胺形成的原料,无氨基酸和蛋白质的食品中是不含有生物胺的,而游离氨基酸丰富的食品中生物胺含量往往也较高 [1],黄酒就是典型的例子,黄酒中含有的丰富氨基酸是其生物胺含量比其他酒类高的一个主要原因。从生化角度出发,通过控制反应的底物——游离氨基酸可以降低反应产物——生物胺的数量。在啤酒酿造过程中,通过调整品种、工艺和酵母菌种等,可以限定麦汁中的氨基酸含量,也可以在主发酵阶段调整可同化氮的数量,以利于酵母对氨基酸的吸收,从而降低氨基酸的总体水平,通过以上措施可以限制啤酒中生物胺的含量 [22]。但氨基酸是食品价值重要的一部分,在食品风味、功能及营养价值方面起着重要作用。虽然降低氨基酸含量能减少生物胺的含量,但对食品业会产生不利影响,因此很少采用此策略控制食品中生物胺的含量。
2.2.2 控制产氨基酸脱羧酶微生物的生长
产氨基酸脱羧酶微生物参与是形成生物胺的前提条件,因此可以通过无氨基酸脱羧酶微生物发酵或者控制产氨基酸脱羧酶微生物的生长而降低食品中生物胺的含量,这也是目前控制生物胺含量最有效的方法之一。
Morganella morganii是一株产组氨酸脱羧酶的菌株,它能把组氨酸转化成组胺,当把它接种到牛肉上时,牛肉中的组胺含量可达595 mg/kg,而没被接种此菌的牛肉中组胺含量仅为8.26 mg/kg [56]。当强化接种不产生物胺的肠膜明串珠菌51-5D发酵香肠时,可有效降低发酵香肠中生物胺的含量 [57]。当接种一些优良的酒酒球菌(Oenococcus oeni)菌株,其中包括不产氨基酸脱羧酶的菌株进行苹果酸-乳酸发酵时,酿造后的葡萄酒生物胺含量显著降低,而进行自然苹果酸-乳酸发酵制得的葡萄酒生物胺含量却极高。一种可能原因是接种的菌株抑制并消除了葡萄酒中的自然菌群,而这些自然菌群能转化形成生物胺。另一种解释是接种的菌株可能能够降解自然菌群产生的生物胺,而且能降解生物胺的菌株均不含氨基酸脱羧酶基因 [58-59]。通过添加不产生物胺的Lactobacillus plantarum ZY40和Saccharomyces cerevisiae JM19 [60]、Lactobacillus sakei [61-62]、Lactobacillus plantarum BCC 9546 [63]等菌株发酵香肠制品,香肠中生物胺的含量明显降低。Lu Shiling等 [64]通过不同的菌株组合筛选出能有效抑制原生菌的发酵剂,利用此发酵剂发酵香肠能有效抑制生物胺的积累。另外从发酵食品的原发酵菌中筛选出优良的菌株,这些菌株生长迅速且不产生物胺,利用这些菌种接种发酵食品,此类菌株很快成为优势菌株,发酵食品中的生物胺含量也大大降低 [65]。筛选无氨基酸脱羧酶活性、能快速生长的优良菌株作为发酵剂进行发酵制得产品,这被认为是目前最有效的控制发酵食品中生物胺含量的方法 [66-68],尤其是对于香肠、葡萄酒、啤酒等发酵产品,但对于像黄酒等混菌复杂发酵体系,接种发酵时需要考虑对产品本身质量的影响,因此目前为止还没有利用此法控制黄酒中生物胺含量的研究。
由于生物胺是由含氨基酸脱羧酶的微生物产生,因此在理论上一切控制微生物生长的措施,例如真空包装、低温、pH值、高渗处理等,均能降低食品中生物胺的含量。一般通过控制微生物的生长来降低普通食品中的生物胺含量,但由于在不同食品中产氨基酸脱羧酶微生物的不同,不同的处理措施产生的结果也大不相同。
肉制品中的生物胺主要由乳酸菌、肠杆菌、假单胞菌产生。当真空包装肉制品时,肠杆菌和假单胞菌受到抑制,但乳酸菌能够在此条件下增殖,酪胺会积累到有危害的水平 [69]。而冷藏贮存的牛肉制品在腐败之前酪胺也可达到有害的水平,这主要由一些耐低温的肠杆菌及假单胞菌产生 [32]。单纯从生物胺的控制角度出发,真空冷冻贮藏肉制品是最佳的选择。鱼类制品在0 ℃贮存10 d仅检测到少量组胺的产生,但10 ℃贮存5 d后,组胺含量达到1 000 mg/kg [70]。郝淑贤等 [71]从鲭鱼中分离出7 株产生物胺的菌株,这7 株菌在4 ℃几乎不生长(OD 605 nm均低于0.03),而在35 ℃时这些菌株生长迅速,OD 605 nm可达到2.0,因此冷冻贮存能抑制产生物胺菌株的生长。而真空包装在降低鱼制品中生物胺含量方面作用有限 [22],这可能由于鱼类制品主要的生物胺产生菌——摩根菌是兼性厌氧菌但不耐低温。因此,在控制生物胺方面,冷冻贮存鱼制品比真空包装有效的多。另外,抑制微生物生长的其他方法,包括辐照、添加杀菌剂、静水压力等,均能降低食品中生物胺的含量 [72],但一般并不会应用到普通食品处理中。酿造酒类产品中的生物胺主要由乳酸菌在酿造过程中脱羧氨基酸形成。在封装后的运输及贮存过程中生物胺的含量并没有显著变化。应用优良的发酵菌株是降低生物胺含量最有效的方式,但降低酿造酒中产生物胺微生物(主要是乳酸菌)的数量也可以降低酒中生物胺含量。在葡萄酒的酿造过程中主要采取以下措施控制乳酸菌的数量:1)添加以富马酸、二氧化硫为主的化学抑制剂;2)在苹果酸-乳酸发酵接受后,就进行瞬时高温灭菌,或者倒罐,尽早除去乳酸菌;3)添加乳酸链球菌素、片球菌素等细菌素,抑制乳酸菌的生长;4)添加溶菌酶 [73]。由于黄酒是一个复杂的混合菌发酵过程,乳酸菌在发酵过程中也起着极其重要的作用,而且对黄酒发酵机理的了解并不透彻,因此目前尚无通过控制乳酸菌生长而降低黄酒中生物胺含量方面的研究报道。
2.2.3 控制氨基酸脱羧酶的活性
氨基酸脱羧酶直接作用于氨基酸,并将其脱羧形成相应的生物胺。因此一切能影响氨基酸脱羧酶活性的因素均可以用来控制生物胺的含量。影响氨基酸脱羧酶活性的主要因素为pH值、温度及含盐度等,因此可以通过改变这些因素而控制生物胺的含量。
在酸性条件时,鲭鱼体内酪胺含量会增加 [74];葡萄酒中的组胺含量也会增加 [75];这是由于氨基酸脱羧酶发挥活性的最佳pH值位于酸性环境,氨基酸脱羧酶活性的增加会导致生物胺含量的增加。温度不仅能影响微生物的生长,也能改变脱羧酶的活性。在10 ℃以上时,不但产胺微生物能快速增长,而且氨基酸脱羧酶的活性也较高。10 ℃贮存的鲭鱼和鲱鱼体内生物胺含量是2 ℃贮存时的20 倍 [2]。在腌制食品中,组胺很少被检测到,这是因为高盐环境会抑制组氨酸脱羧酶活性,组胺在此条件下几乎无法产生 [76-77]。高盐度也能强烈抑制生物胺在草鱼鱼片中的积累,可以有效延长贮藏期 [78]。魏延玲等 [79]研究发现用KCl部分替代NaCl腌制鲈鱼可以显著降低产品中生物胺的含量,此方法不仅没有改变腌制鲈鱼的感官品质,还降低了人体对钠盐的吸收,增加了钾盐的吸收。但由于pH值、含盐量等一般是食品本身的特性,改变这些特性将会影响食品的品质和感官特性,因此利用此方法控制生物胺含量的研究并不是很多。
2.2.4 增强生物胺的降解水平
为减少生物胺在食品中的含量,除控制生物胺的合成因素外,还可以加强降解已经存在的生物胺,使生物胺处在一个较低水平。胺氧化酶分为单胺氧化酶和二胺氧化酶,它们能把生物胺降解生成乙醛、氨和过氧化氢。马宇霞等 [80]从44 种熏马肠样品中筛选出6 株具有生物胺氧化酶活性的菌株,经高效液相色谱(high performance liquid chromatography,HPLC)验证,这些菌株对生物胺具有较强的氧化能力,把这些菌株作为发酵剂加入熏马肠中,在发酵过程中,这些菌株对组胺、酪胺、尸胺、腐胺、色胺和苯乙胺均有较强的抑制作用,减少程度均在40%以上,这为发酵安全的肉制品提供了新途径 [81]。Zaman等 [82]从鱼酱中分离出具有胺类氧化酶活性的Staphylococcus carnosus FS19和Bacillus amyloliquefaciens FS05菌株,并分别利用这两株菌株接种发酵鱼酱,制得的鱼酱中组胺含量分别降低了27.7%和15.4%,总生物胺含量分别降低了15.9%和12.5%。Leuschner [83]和Martuscelli [84]等都筛选出了一批具有胺氧化酶活性的菌株,而且部分菌株能完全降解食品中的组胺,对酪胺的降解水平也超过60%以上。另外从鱼酱中分离到的沙克乳杆菌(Lactobacillus sakei)能有效分解组胺 [85]。杨利昆等 [86]从天然发酵鱼露中筛选出10 株具有生物胺降解活性的微生物,其中奥默柯达酵母M8菌株具有最高活性,其在食盐质量分数为25%的条件下降解活性最高,降解组胺和酪胺的比率分别可达64.4%和72.4%。将这些具有胺氧化酶活性的菌株作为优势菌株强化发酵或者直接作为起始发酵剂应用于发酵食品,可以有效降低食品中生物胺的水平。
但具有胺氧化酶活性的菌株并不适合用于发酵酒类产品,这是因为乙醇可以有效抑制胺氧化酶的活性 [21]。因此需要寻找新型的、能降解生物胺的微生物。Tapingkae等 [87]从高盐发酵的鱼产品中筛选出4 株能降解组胺的极端嗜盐古细菌,其中Natrinema gari HDS3-1活性最高,经进一步研究发现发挥降解作用的是组胺脱氢酶(histamine dehydrogenase),但需要1-甲氧基-5-甲基酚嗪硫酸甲酯盐(1-methoxy-5-methylphenazinium methylsulfate,mPMS)作为电子载体。但此酶需在3.5~5.0 mol/L NaCl存在的条件下才能发挥最适活性,因此此类菌株能应用到实际发酵中。另外,相继从绿脓假单胞菌、弗式柠檬酸杆菌、Nocardioides simplex中发现了胺类脱氢酶 [25],虽然目前这些菌株并没有应用于发酵食品,但这些菌株的发现为降低食品中的生物胺水平提供了一个崭新的方向。目前应尽快从乳酸菌中筛选出具有胺类脱氢酶活性的菌株,为降低酒类饮品中生物胺水平提供新的途径。
生物胺本身为小分子物质,且大部分在可见和紫外光波长范围内无明显吸收,也没有荧光成分,因此在检测前需要进行处理使其衍生化后再用仪器分析。生物胺检测技术的研究在国内外已经开展多年,目前生物胺的检测方法极其多样化,灵敏度、精密度也各不相同,李志军 [22]和陆永梅 [57]已经系统地研究了生物胺的检测方法,另外我国也制定了测定食品中生物胺含量的国家标准 [88]。另外也有关于生物胺检测的专题综述 [89-90],在此,我们重点介绍生物胺含量测定的主要方法,尤其是一些新方法的特点。
HPLC因其分析速度快、灵敏度高、精确度高并能同时分析多个化合物被广泛应用于分析检测各类化合物,也是测定生物胺的最常用方式。由于大部分生物胺没有荧光和紫外发色基团,因此需经衍生化后才能测量。常用的衍生化试剂为邻苯二醛(o-phthalaldehyde,OPA)、丹磺酰氯(dansyl chloride,Dns-Cl)、二硝基苯甲酰氯(dinitro benzoyl chloride,DABS-Cl)、苯甲酰氯(benzoyl chloride)等。OPA的优点是反应迅速、耗时少、灵敏度高,但其衍生物不稳定,且只能与初级生物胺反应。DABS-Cl稳定性最好,其生物胺衍生物在-20 ℃可稳定贮存1 a以上,另外其衍生操作也相对简单,但需要除去多余试剂,灵敏度不高。Dns-Cl是生物胺HPLC检测中应用最多的衍生试剂,其衍生操作简单、衍生物稳定性好且检测范围更广。利用Dns-Cl衍生化并快速方便地分析奶酪中的生物胺,可大大缩短分析时间及成本 [91]。董伟峰等 [92]研究发现Dns-Cl衍生物在-20 ℃避光保存前6 个月无太大变化,6 个月后色胺和精胺迅速分解。胡家伟等 [93]利用Dns-Cl柱前衍生化法建立了水产品中组胺的检测方法,发现此方法快速准确、灵敏度高、重复性好。目前,我国国标规定生物胺检测方法也是利用Dns-Cl进行衍生化处理 [88]。虽然Dns-Cl柱前衍生化法应用已十分广泛,稳定性也很好,但毕竟增加了一个过程且耗时耗力。目前已经利用串联质谱技术测定肉中的生物胺水平,此方法最大的特色是不需要衍生化,HPLC分离后直接利用串联质谱检测,灵敏度高而且操作十分简单,目前已经可以同时测定10 种未衍生化的生物胺 [94]。
毛细管电泳也可以直接对生物胺进行分析而并不需要衍生化处理。以UV为检测器,利用毛细管区带电泳技术无需衍生化就能区分6 种生物胺 [95],结合电导检测可同时检测8 种生物胺 [96]。当以荧光异硫氰酸酯为衍生剂时,8 种生物胺的检测限可达10 -8mol/L [97]。Chiu等 [98]已经详细综述了利用毛细管电泳检测生物胺的策略、步骤及发展,在此不再介绍。
另一种较新颖的方法是生物传感器法,此方法是利用酶、抗原、抗体等物质作为传感器的探针,与样品中的生物胺发生特异性反应,通过转换器后检测信号的变化,从而对生物胺进行定性和定量分析。目前较常用的方法是把胺氧化酶固定在探针上,当胺氧化酶催化脱去生物胺的氨基后形成过氧化氢,通过测定过氧化氢的量确定生物胺的含量。Draisci等 [99]利用此方法测定了8 种不同的生物胺,测定的线性范围为1×10 -6~5×10 -5mol/L,检测限为5×10 -7mol/L。Fiddes等 [100]利用射频识别(radio frequency identification,RFID)标签,以顺丁烯二酸酐为感测材料,成功检测了食品腐败过程中主要的5 种生物胺,原理是顺丁烯二酸酐与生物胺反应,通过检测电化学性质的变化来测定生物胺的含量。另一种相似的方法是酶联免疫法,此方法首先用生物胺免疫实验动物,制备特异性的单克隆抗体,利用这些特异性的抗体检测产品中的生物胺。此方法首先应用于鱼制品中组胺含量的检测,检测结果可在5 h内获得 [101]。现在依据酶联免疫法已经开发出快速半定量或定量检测鱼类制品中的组胺含量的试剂盒,组胺的抗体与组胺结构相似的酪胺和尸胺发生交互反应的比例在1%以内,可行度也在可接受的范围内 [102]。这类方法一般具有快速、灵敏的特点,但成本较高、不能反复使用,而且食品中成分复杂,可能会出现假阳性结果,因此,此类方法大部分仍处于实验室研制阶段,很少大规模应用于实际检测中。
由于微生物无处不在,几乎所有含蛋白质或氨基酸的食品中都含有生物胺。适量的生物胺有利于人体的正常生理活动,但生物胺的过量积累会导致人体产生不良反应。组胺是生物胺中毒性最大的,欧美等国家一般规定食品中组胺的含量不得超过100 mg/kg,而乙醇会增强生物胺的毒性,因此酒类产品中生物胺限量标准比普通食品严格的多,欧洲各国规定的组胺在酒中的限量标准均不高于10 mg/L,德国最为严格不得高于2 mg/L。而在我国发酵产品中,尤其传统的发酵酒产品中,生物胺的含量普遍偏高,因此应严格控制发酵产品中的生物胺含量。了解生物胺的产生机理是防止生物胺过量的前提,本文着重阐述了生物胺的形成机制及降低生物胺含量的方法。生物胺是由微生物产生的氨基酸脱羧酶脱羧氨基酸产生的,因此抑制微生物或脱羧酶活性是控制食品中生物胺含量的重要方式。对于传统食品,控制原料及加工环境、避免微生物的污染十分重要,还可以通过改变生产工艺,通过控制pH值、温度、含盐量等因素来抑制微生物生长或脱羧酶活性达到控制生物胺含量的目的。而对于发酵食品,筛选优良菌株用于发酵是最有效的控制生物胺的方式,这些优良菌株可以是不含氨基酸脱羧酶基因的菌株、有效分解生物胺的菌株或者能抑制含脱羧酶菌株生长的菌株。另外生物胺本身在可见和紫外光波长范围内无明显吸收,也没有荧光成分的小分子物质,其检测方法也是生物胺研究的另一个热点。本文综述了几种典型的生物胺测定方法及其特点。我们希望这篇综述能引起更多人对食品中生物胺的关注,尤其对于中国传统的发酵酒领域,希望有更多的研究者参与到生物胺的研究中。
参考文献:
[1] SANTOS M H S. Biogenic amines: their importance in foods[J]. International Journal of Food Microbiology, 1996, 29(2/3): 213-231. DOI:10.1016/0168-1605(95)00032-1.
[2] SHALABY A R. Significance of biogenic amines to food safety and human health[J]. Food Research International, 1996, 29(7): 675-690. DOI:10.1016/S0963-9969(96)00066-X.
[3] BROADLEY K J. The vascular effects of trace amines and amphetamines[J]. Pharmacology & Therapeutics, 2010, 125(3): 363-375. DOI:10.1016/j.pharmthera.2009.11.005.
[4] FALUS A, GROSMAN N, DARVAS Z. Histamine: biology and medical aspects[M]. Budapest: SpringMed, 2004: 1-105.
[5] BROWN R E, STEVENS D R, HAAS H L. The physiology of brain histamine[J]. Progress in Neurobiology, 2001, 63(6): 637-672. DOI:10.1016/S0301-0082(00)00039-3.
[6] YANANI K, TASHIRO M. The physiological and pathophysiological roles of neuronal histamine: an insight from human positron emission tomography studies[J]. Pharmacology & Therapeutics, 2007, 113(1): 1-15. DOI:10.1016/j.pharmthera.2006.06.008.
[7] ALVAREZ E O. The role of histamine on cognition[J]. Behavioural Brain Research, 2009, 199(2): 183-189. DOI:10.1016/ j.bbr.2008.12.010.
[8] CATALDI M, BORRIELLO F, GRANATA F, et al. Histamine receptors and antihistamines: from discovery to clinical applications[J]. Chemical Immunology and Allergy, 2014, 100: 214-226. DOI:10.1159/000358740.
[9] FALUS A, GILICZE A. Tumor formation and antitumor immunity; the overlooked significance of histamine[J]. Journal of Leukocyte Biology, 2014, 96(2): 225-231. DOI:10.1189/jlb.3RI0413-217RR.
[10] BENETTI F, FURINI C R, de CARVALHO MYSKIW J, et al. Histamine in the basolateral amygdala promotes inhibitory avoidance learning independently of hippocampus[J]. Proceedings of the National Academy of Sciences, 2015. DOI:10.1073/pnas.1506109112.
[11] GOMES M B, PIRES B A, FRACALANZZA S A, et al. The risk of biogenic amines in food[J]. Ciência & Saúde Coletiva, 2014, 19(4): 1123-1134. DOI:10.1590/1413-81232014194.18672012.
[12] 戴海斌. 组胺及其受体对NMDA受体介导的神经元毒性作用机制研究[D]. 杭州: 浙江大学, 2008: 12-32.
[13] HERNANDEZ-ORTE P, LAPENA A C, PENA-GALLEGO A, et al. Biogenic amine determination in wine fermented in oak barrels: factors affecting formation[J]. Food Research International, 2008, 41(7): 697-706. DOI:10.1016/j.foodres.2008.05.002.
[14] VARELA M, ALEXIOU G A, LIAKOPOULOU M, et al. Monoamine metabolites in ventricular CSF of children with posterior fossa tumors: correlation with tumor histology and cognitive functioning[J]. Journal of Neurosurgery: Pediatrics, 2014, 13(4): 375-379. DOI:10.3171/2014.1.PEDS13425.
[15] MAIJALA R, EEROLA S. Contaminant lactic acid bacteria of dry sausages produce histamine and tyramine[J]. Meat Science, 1993, 35(3): 387-395. DOI:10.1016/0309-1740(93)90043-H.
[16] ANLI R E, VURAL N, YILMAZ S, et al. The determination of biogenic amines in Turkish red wines[J]. Journal of Food Composition and Analysis, 2004, 17(1): 53-62. DOI:10.1016/S0889-1575(03)00104-2.
[17] SANDLER M, YOUDIM M B H, HANINGTON E. A phenylethylamine oxidising defect in migraine[J]. Nature, 1974, 250: 335-337. DOI:10.1038/250335a0.
[18] U.S. Food and Drug Administration. CPG Sec. 540.525 Decomposition and histamine raw, frozen tuna and mahi-Mahi; canned tuna; and related species, revised compliance policy guide, availability[A].
[19] European Commission (EC). Commision recommendation of 10 January 2003 concerning a coordinated programme for the official control of foodstuffs for 2003 (2003/10/EC)[A].
[20] 辽宁省食品卫生监督检验所, 上海市卫生监督所, 大连市卫生防疫站. GB 2733—2005 鲜、冻动物性水产品卫生标准[S]. 北京: 中国标准出版社, 2005.
[21] LEHTONEN P. Determination of amines and amino acids in wine: a review[J]. American Journal of Enology and Viticulture, 1996, 47(2): 127-133.
[22] 李志军. 食品中生物胺及其产生菌株检测方法研究[D]. 青岛: 中国海洋大学, 2007: 1-142.
[23] ZHONG J J, YE X Q, FANG Z X, et al. Determination of biogenic amines in semi-dry and semi-sweet Chinese rice wines from the Shaoxing region[J]. Food Control, 2012, 28(1): 151-156. DOI:10.1016/ j.foodcont.2012.05.011.
[24] LU Y M, LU X, CHEN X H, et al. A survey of biogenic amines in Chinese rice wines[J]. Food Chemistry, 2007, 100(4): 1424-1428. DOI:10.1016/j.foodchem.2005.11.035.
[25] 冯婷婷, 方芳, 杨娟, 等. 食品生物制造过程中生物胺的形成与消除[J]. 食品科学, 2013, 34(19): 360-366. DOI:10.7506/spkx1002-6630-201319074.
[26] LANDETE J M, de las RIVAS B, MARCOBAL A, et al. Molecular methods for the detection of biogenic amine-producing bacteria on foods[J]. International Journal of Food Microbiology, 2007, 117(3): 258-269. DOI:10.1016/j.ijfoodmicro.2007.05.001.
[27] ARENA M E, de NADRA M C M. Biogenic amine production by Lactobacillus[J]. Journal of Applied Microbiology, 2001, 90(2): 158-162. DOI:10.1046/j.1365-2672.2001.01223.x.
[28] COFFINO P. Regulation of cellular polyamines by antizyme[J]. Nature Reviews Molecular Cell Biology, 2001, 2(3): 188-194. DOI:10.1038/35056508.
[29] SEILER N. Catabolism of polyamines[J]. Amino Acids, 2004, 26(3): 217-233. DOI:10.1007/s00726-004-0070-z.
[30] VINCI G, ANTONELLI M L. Biogenic amine: quality index of freshness in red and white meat[J]. Food Control, 2002, 13(8): 519-524. DOI:10.1016/S0956-7135(02)00031-2.
[31] TREVINO E, BELL D, STEINHART H. Formation of biogenic amines during the maturity process of raw meat products, for example of cervelat sausage[J]. Food Chemistry, 1997, 60(3): 521-526. DOI:10.1016/S0308-8146(97)00021-6.
[32] SMITH T A. Amines in food[J]. Food Chemistry, 1981, 6(3): 169-200. DOI:10.1016/0308-8146(81)90008-X.
[33] RUIZ-CAPILLAS C, JIMENEZ-COLMENERO F. Biogenic amines in meat and meat products[J]. Critical Reviews in Food Science and Nutrition, 2005, 44(7/8): 489-499. DOI:10.1080/10408690490489341.
[34] 王新新, 刘芳, 王道营, 等. 冷藏兔肉中嗜冷菌的分离鉴定及其产生物胺的特性分析[J]. 食品科学, 2014, 35(19): 128-132. DOI:10.7506/ spkx1002-6630-201419027.
[35] HERNÁNDEZ-JOVER T, IZQUIERDO-PULIDO M, VECIANANOGUÉS M T, et al. Biogenic amine and polyamine contents in meat and meat products[J]. Journal of Agricultural and Food Chemistry, 1997, 45(6): 2098-2102. DOI: 10.1021/jf960790p.
[36] SIROCCHI V, CAPRIOLI G, CECCHINI C, et al. Biogenic amines as freshness index of meat wrapped in a new active packaging system formulated with essential oils of Rosmarinus officinalis[J]. International Journal of Food Sciences and Nutrition, 2013, 64(8): 921-928. DOI:10.3109/09637486.2013.809706.
[37] PRESTER L. Biogenic amines in fish, fish products and shellfish: a review[J]. Food Additives & Contaminants. Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2011, 28(11): 1547-1560. DOI:10.1080/19440049.2011.600728.
[38] KRIZEK M, PAVLICEK T, VACHA F. Formation of selected biogenic amines in carp meat[J]. Journal of the Science of Food and Agriculture, 2002, 82(9): 1088-1093. DOI:10.1002/jsfa.1154.
[39] RUIZ-CAPILLAS C, MORAL A. Effect of controlled atmospheres enriched with O 2in formation of biogenic amines in chilled hake (Merluccius merluccius L.)[J]. European Food Research and Technology, 2001, 212(5): 546-550. DOI:10.1007/s002170100287.
[40] BJORNSDOTTIR K, BOLTON G E, McClELLAN-GREEN P D, et al. Detection of gram-negative histamine-producing bacteria in fish: a comparative study[J]. Journal of Food Protection, 2009, 72(9): 1987-1991.
[41] BORRESEN T. Improving seafood products for the consumer[M]. Cambridge: Woodhead Publishing Limited, 2008: 50-178.
[42] VECIANA-NOGUES M T, BOVER-CID S, MARINE-FONT A, et al. Biogenic amine production by Morganella morganii and Klebsiella oxytoca in tuna[J]. European Food Research and Technology, 2004, 218(3): 284-288. DOI:10.1007/s00217-003-0860-7.
[43] FERRARIO C. Lactococcus garvieae and Morganella morganii: two bacterial models to study quality and safety of fish products[D]. Milan: Universita Degli Studi di Milano, 2012: 49-79.
[44] EMBORG J, DALGAARD P, AHRENS P. Morganella psychrotolerans sp. nov., a histamine-producing bacterium isolated from various seafoods[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(10): 2473-2479. DOI:10.1099/ ijs.0.64357-0.
[45] KANKI M, YODA T, ISHIBASHI M, et al. Photobacterium phosphoreum caused a histamine fish poisoning incident[J]. International Journal of Food Microbiology, 2004, 92(1): 79-87. DOI:10.1016/j.ijfoodmicro.2003.08.019.
[46] KIM M K, MAH J H, HWANG H J. Biogenic amine formation and bacterial contribution in fish, squid and shellfish[J]. Food Chemistry, 2009, 116(1): 87-95. DOI:10.1016/j.foodchem.2009.02.010.
[47] ROLLAN G C, COTON E, LONVAUD-FUNEL A. Histidine decarboxylase activity of Leuconostoc oenos 9204[J]. Food Microbiology, 1995, 12: 455-461. DOI:10.1016/S0740-0020(95)80130-8.
[48] GARCIA-RUIZ A, GONZALEZ-ROMPINELLI E M, BEGOÑA BARTOLOME B, et al. Potential of wine-associated lactic acid bacteria to degrade biogenic amines[J]. International Journal of Food Microbiology, 2011, 148(2): 115-120. DOI:10.1016/ j.ijfoodmicro.2011.05.009.
[49] SOUFLEROS E, MARIE-LYSE BARRIOS M L, BERTRAND A. Correlation between the content of biogenic amines and other wine compounds[J]. American Journal of Enology and Viticulture, 1998, 49(3): 266-278.
[50] LOUKOU Z, ZOTOU A. Determination of biogenic amines as dansyl derivatives in alcoholic beverages by high-performance liquid chromatography with fluorimetric detection and characterization of the dansylated amines by liquid chromatography-atmospheric pressure chemical ionization mass spectrometry[J]. Journal of Chromatography A, 2003, 996(1): 103-113. DOI:10.1016/S0021-9673(03)00558-2.
[51] ROMERO R, SÁNCHEZ-VIÑAS M, GÁZQUEZ D, et al. Characterization of selected Spanish table wine samples according to their biogenic amine content from liquid chromatographic determination[J]. Journal of Agricultural and Food Chemistry, 2002, 50(16): 4713-4717. DOI:10.1016/S0021-9673(03)00558-2.
[52] ANLI R E, VURAL N, YILMAZ S. The determination of biogenic amines in Turkish red wines[J]. Journal of Food Composition and Analysis, 2004, 17(1): 53-62. DOI:10.1016/S0889-1575(03)00104-2.
[53] 栾同青. 黄酒酿造过程生物胺变化规律及其产生菌株研究[D]. 济南: 齐鲁工业大学, 2013: 1-80.
[54] 张敬, 赵树欣, 薛洁, 等. 发酵型饮料酒中生物胺含量的调查与分析[J]. 食品与发酵工业, 2012, 38(6): 165-170. DOI:10.13995/ j.cnki.11-1802/ts.2012.06.037
[55] 邹阳, 赵谋明, 赵海锋. 高效液相色谱法同时测定酱油中的8种生物胺[J]. 现代食品科技, 2012, 28(5): 570-573. DOI:10.3969/ j.issn.1673-9078.2012.05.024.
[56] TEODOROVIC V, BUNCIC S, SMILJANIC D. A study of factors influencing histamine production in meat[J]. Fleischwirtsch, 1994, 74: 170-172.
[57] 陆永梅. 发酵食品中生物胺的检测与控制[D]. 南京: 南京农业大学, 2008: 1-40.
[58] LONVAUD-FUNEL A. Biogenic amines in wines: role of lactic acid bacteria[J]. FEMS Microbiology Letters, 2001, 199: 9-13. DOI:10.1111/j.1574-6968.2001.tb10643.x.
[59] MORENO-ARRIBAS V, TORLOIS S, JOYEUX A, et al. Isolation, properties and behavior of tyramine-producing lactic acid bacteria from wine[J]. Journal of Applied Microbiology, 2000, 88(4): 584-593. DOI:10.1046/j.1365-2672.2000.00997.x.
[60] NIE X, ZHANG Q, LIN S. Biogenic amine accumulation in silver carp sausage inoculated with Lactobacillus plantarum plus Saccharomyces cerevisiae[J]. Food Chemistry, 2004, 153: 432-436. DOI:10.1016/ j.foodchem.2013.12.093.
[61] BOVER-CID S, IZQUIERDO-PULIDO M, VIDAL-CAROU M C. Mixed starter cultures to control biogenic amine production in dry fermented sausages[J]. Journal of Food Protection, 2000, 63(11): 1555-1562.
[62] LATORRE-MORATALLA M L, BOVER-CID S, TALON R, et al. Strategies to reduce biogenic amine accumulation in traditional sausage manufacturing[J]. LWT-Food Science and Technology, 2010, 43(1): 20-25. DOI:10.1016/j.lwt.2009.06.018.
[63] TOSUKHOWONG A, VISESSANGUAN W, PUMPUANG L, et al. Biogenic amines formation in Nham, a Thai fermented sausage, and the reduction by commercial starter culture, Lactobacillus plantarum BCC 9546[J]. Food Chemistry, 2011, 129(3): 846-853. DOI:10.1016/ j.foodchem.2011.05.033.
[64] LU S L, XU X L, ZHOU G H, et al. Effect of starter cultures on microbial ecosystem and biogenic amines in fermented sausage[J]. Food Control, 2010, 21(4): 444-449. DOI:10.1016/ j.foodcont.2009.07.008.
[65] BAKA A M, PAPAVERGOU E J, PRAGALAKI T, et al. Effect of selected autochthonous starter cultures on processing and quality characteristics of Greek fermented sausages[J]. LWT-Food Science and Technology, 2011, 44(1): 54-61. DOI:10.1016/j.lwt.2010.05.019.
[66] AYHAN K, KOLSARICI N, OZKAN G A. The effects a starter culture on the formation of biogenic amines in Turkish soudjoucks[J]. Meat Science, 1999, 53(3): 183-188. DOI:10.1016/S0309-1740(99)00046-7.
[67] TALON R, LEROY S. Diversity and safety hazards of bacteria involved in meat fermentation[J]. Meat Science, 2011, 89(3): 303-309. DOI:10.1016/j.meatsci.2011.04.029.
[68] LATORRE-MORATALLA M L, BOVER-CID S, VECIANANOGUES M T, et al. Control of biogenic amines in fermented sausages: role of starter cultures[J]. Frontiers in Microbiology, 2012, 3: 169. DOI:10.3389/fmicb.2012.00169.
[69] NADON C A, ISMOND M A, HOLLEY R. Biogenic amines in vacuumpackaged and carbon dioxide-controlled atmosphere-packaged fresh pork stored at -1.50 ℃[J]. Journal of Food Protection, 2001, 64(2): 220-227.
[70] RODRIGUEZ-JEREZ J J, MORA-VENTURA M T, LOPEZSABATER E I, et al. Histidine, lysine and ornithine decarboxylase bacteria in Spanish salted semi-preserved anchovies[J]. Journal of Food Protection, 1994, 57(9): 784-787.
[71] 郝淑贤, 魏涯, 周婉君, 等. 鲭鱼生物胺生成菌的分离与鉴定[J]. 食品科学, 2015, 36(7): 97-100. DOI:10.7506/spkx1002-6630-201507018.
[72] NAILA A, FLINT S, FLETCHER G, et al. Control of biogenic amines in food: existing and emerging approaches[J]. Journal of Food Science, 2010, 75(7): R139-R150. DOI:10.1111/j.1750-3841.2010.01774.x.
[73] CARRETE R, VIDAL M T, BORDONS A, et al. Inhibitory effect of sulfur dioxide and other stress compounds in wine on the ATPase activity of Oenococcus oeni[J]. FEMS Microbiology Letters, 2002, 211(2): 155-159. DOI:10.1111/j.1574-6968.2002.tb11218.x.
[74] MENDESR. Biogenic amines[M]//REHBEINH, OEHLENSCHLÄGER J. Fishery products: quality, safety and authenticity. Oxford: Wiley-Blackwell, 2009: 42-59.
[75] POGORELSKI E. Studies on the formation of histamine in must and wines from elderberry fruit[J]. Journal of the Science of Food and Agriculture, 1992, 60(2): 239-244. DOI:10.1002/jsfa.2740600212.
[76] CHIN K D H, KOEHLER P E. Effect of salt concentration and incubation temperature on formation of histamine, phenethylamine, tryptamine and tyramine during Miso fermentation[J]. Journal of Food Protection, 1986, 49(6): 423-427.
[77] ROSEIRO C, SANTOS C, SOL M, et al. Prevalence of biogenic amines during ripening of a traditional dry fermented pork sausage and its relation to the amount of sodium chloride added[J]. Meat Science, 2006, 74(3): 557-563. DOI:10.1016/j.meatsci.2006.03.030.
[78] WANG H, LUO Y K, YIN X F, et al. Effects of salt concentration on biogenic amine formation and quality changes in grass carp (Ctenopharyngodon idellus) fillets stored at 4 and 20 ℃[J]. Journal of Food Protection, 2014, 77(5): 796-804.
[79] 魏延玲, 孟勇, 田甜, 等. KCl部分替代NaCl腌制对风干鲈鱼中生物胺的抑制作用[J]. 食品科学, 2014, 35(3): 90-95. DOI:10.7506/ spkx1002-6630-201403019.
[80] 马宇霞, 卢士玲, 李开雄, 等. 熏马肠中生物胺氧化酶菌株的筛选与鉴定[J]. 现代食品科技, 2014, 30(5): 49-55.
[81] 张惠超, 卢士玲, 马宇霞, 等. 熏马肠成熟过程中产生物胺氧化酶菌对生物胺作用的研究[J]. 现代食品科技, 2015, 31(6): 122-128. DOI:10.13982/j.mfst.1673-9078.2015.6.020.
[82] ZAMAN M Z, ABU BAKAR F, JINAP S, et al. Novel starter cultures to inhibit biogenic amines accumulation during fish sauce fermentation[J]. International Journal of Food Microbiology, 2011, 145(1): 84-91. DOI:10.1016/j.ijfoodmicro.2010.11.031.
[83] LEUSCHNER R G, HEIDEL M, HAMMES W P. Histamine and tyramine degradation by food fermenting microorganisms[J]. International Journal of Food Microbiology, 1998, 39(1/2): 1-10. DOI:10.1016/S0168-1605(97)00109-8.
[84] MARTUSCELLI M, CRUDELE M A, GARDINI F, et al. Biogenic amine formation and oxidation by Staphylococcus xylosus strains from artisanal fermented sausages[J]. Letters in Applied Microbiology, 2000, 31(3): 228-32. DOI:10.1046/j.1365-2672.2000.00796.x.
[85] HOUBEN J H, NOUT M J R, ENES DAPKEVICIUS M L N. Biogenic amine formation and degradation by potential fish silage starter microorganisms[J]. International Journal of Food Microbiology, 2000, 57(1): 107-114. DOI:10.1016/S0168-1605(00)00238-5.
[86] 杨利昆, 付湘晋, 胡叶碧, 等. 鱼露中生物胺降解菌的筛选及其特性[J].食品科学, 2012, 33(11): 158-162.
[87] TAPINGKAE W, TANASUPAWAT S, PARKIN K L, et al. Degradation of histamine by extremely halophilic archaea isolated from high salt-fermented fishery products[J]. Enzyme and Microbial Technology, 2010, 46(2): 92-99. DOI:10.1016/ j.enzmictec.2009.10.011.
[88] 中国疾病预防控制中心营养与食品安全所. GB/T 5009.208—2008食品中生物胺含量的测定[S]. 北京: 中国标准出版社, 2008.
[89] ONAL A. A review: current analytical methods for the determination of biogenic amines in foods[J]. Food Chemistry, 2007, 103(4): 1475-1486. DOI:10.1016/j.foodchem.2006.08.028.
[90] 王颖, 邱璠, 韩北忠, 等. 食品中的生物胺及其检测方法[J]. 中国酿造, 2011, 30(10): 1-5.
[91] INNOCENTE N, BIASUTTI M, PADOVESE M, et al. Determination of biogenic amines in cheese using HPLC technique and direct derivatization of acid extract[J]. Food Chemistry, 2007, 101(3): 1285-1289. DOI:10.1016/j.foodchem.2005.12.026.
[92] 董伟峰, 李宪臻, 林维宣. 丹磺酰氯作为生物胺柱前衍生试剂衍生化条件的研究[J]. 大连轻工业学院学报, 2005, 24(2): 115-118.
[93] 胡家伟, 高 榕, 曹敏杰, 等. 水产食品中组胺的丹磺酰氯柱前衍生反相高效液相色谱测定方法的建立及应用[J]. 食品科学, 2014, 35(8): 283-288. DOI:10.7506/spkx1002-6630-201408057.
[94] SIROCCHI V, CAPRIOLI G, RICCIUTELLI M, et al. Simultaneous determination of ten underivatized biogenic amines in meat by liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)[J]. Journal of Mass Spectrometry, 2014, 49(9): 819-825. DOI:10.1002/ jms.3418.
[95] LIN W, LIN C, LIN E. Capillary zone electrophoretic separation of biogenic amines: influence of organic modifier[J]. Journal of Chromatography A, 1996, 755(1): 142-146. DOI:10.1016/S0021-9673(96)00587-0.
[96] THREDGOLD L D, ELLIS A V, LENEHAN C E. Direct detection of histamine in fish flesh using microchip electrophoresis with capacitively coupled contactless conductivity detection[J]. Analytical Methods, 2015, 7: 1802-1808. DOI:10.1039/C4AY02866J.
[97] RODRIGUEZ I, LEE H K, LI S F Y. Separation of biogenic amines by micellar electrokinetic chromatography[J]. Journal of Chromatography A, 1996, 745(1/2): 255-262. DOI:10.1016/0021-9673(96)00422-0.
[98] CHIU T C, LIN Y W, HUANG Y F, et al. Analysis of biologically active amines by CE[J]. Electrophoresis, 2006, 27(23): 4792-4807. DOI:10.1002/elps.200600126.
[99] DRAISCI R, VOLPE G, LUCENTINI L, et al. Determination of biogenic amines with an electrochemical biosensor and its application to salted anchovies[J]. Food Chemistry, 1998, 62(2): 225-232. DOI:10.1016/S0308-8146(97)00167-2.
[100] FIDDES L K, CHANG J, YAN N. Electrochemical detection of biogenic amines during food spoilage using an integrated sensing RFID tag[J]. Sensors and Actuators B: Chemical, 2014, 202: 1298-1304. DOI:10.1016/j.snb.2014.05.106.
[101] SERRAR D, BREBANT R, BRUNEAU S, et al. The development of a monoclonal antibody-based ELISA for the determination of histamine in food: application to fishery products and comparison with the HPLC assay[J]. Food Chemistry, 1995, 54(1): 85-91. DOI:10.1016/0308-8146(95)92667-9.
[102] MANZ G, BOOLTINK E. Validation study of a HistaSure™ ELISA (Fast Track) for the determination of histamine in fish samples[J]. Journal of AOAC International, 2014, 97(6): 1601-1614. DOI:10.5740/ jaoacint.14-067.
Progress in Research on Biogenic Amines in Foods
WANG Guangqiang
1,2, YU Jianshen
2,3, HU Jian
2,3, CAO Lirui
1, XIA Yongjun
1,2, AI Lianzhong
1,2,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Shanghai Rice Wine Engineering Technology Research Center, Shanghai 200093, China; 3. Shanghai Jinfeng Wine Co. Ltd., Shanghai 200063, China)
Abstract:Biogenic amine is a biogenic substance with low molecular weight and amino groups. Most foods contain biogenic amines that are formed by decarboxylation of amino acids with microbial amino decarboxylases. The appropriate amount of biogenic amines is beneficial to human normal physiology, but the absorption at high concentration will cause undesirable physiological effects. The distribution of microorganisms in different foods is discrepant, leading to the differences in the types and quantities of biogenic amines in different foods. This article summarizes the sources of biogenic amines, the mechanism and control strategies for their formation and analytical methods for the detection of biogenic amines in different foods, aiming to provide reference for reducing the amount of biogenic amines in foods.
Key words:biogenic amine; microorganism; formation mechanism; control strategy
DOI:10.7506/spkx1002-6630-201601046
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)01-0269-10
引文格式:
王光强, 俞剑燊, 胡健, 等. 食品中生物胺的研究进展[J]. 食品科学, 2016, 37(1): 269-278. DOI:10.7506/spkx1002-6630-201601046. http://www.spkx.net.cn
WANG Guangqiang, YU Jianshen, HU Jian, et al. Progress in research on biogenic amines in foods[J]. Food Science, 2016, 37(1): 269-278. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601046. http://www.spkx.net.cn
收稿日期:2015-05-05
基金项目:农业科技成果转化资金项目(2013GB2C000153);上海市农业科技成果转化资金项目(133919N1000);
上海市研究生创新基金项目(JWCXSL1402);沪江基金研究基地专项(D15012)
作者简介:王光强(1985—),男,讲师,博士,研究方向为乳酸菌、发酵食品。E-mail:1015wanggq@163.com
*通信作者:艾连中(1976—),男,教授,博士,研究方向为食品微生物。E-mail:ailianzhong@163.com