表1 二次通用旋转试验因素水平
Table 1 Factors and levels used in quadratic general rotary design

X 3提取时间/min 1.6827423.4∶153.41 1 6020∶145 0 4015∶140 -12010∶135 -1.68266.6∶126.6水平因素X 1提取温度/℃X 2液料比(mL/g)
黄佳琦 1,杨士花 2,初雅洁 1,陶 亮 3,冯志祥 1,李华君 1,严 艳 1,李雪良 1,李永强 1,*
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.云南农业大学外语学院,云南 昆明 650201;3.云南农业大学植物保护学院,云南 昆明 650201)
摘 要:以老黑谷米为对象,在单因素试验的基础上,利用二次通用旋转试验设计,对老黑谷米色素的提取工艺进行了优化,并对色素的体外抗氧化活性进行了评价。结果表明:老黑谷米色素的最 佳提取溶剂为乙醇,在282 nm和342 nm处有最大吸收波长,初步定性为黄酮醇类物质;该色素的最佳提取条件为提取温度30 ℃、液料比20∶1(mL/g)、提取时间40 min;该色素具有较好的抗氧化活性,DPPH自由基清除能力为(3 512.56±26.28)μg阿魏酸/g,铁离子还原/抗氧化能力为(44.04±6.60)mmol Fe 2+/L,还原能力为(203.47±23.75)μg抗坏血酸/g,H 2O 2清除活性为(3 676.60±114.32)μg阿魏酸/g,ABTS +·清除能力为(2 778.70±262.90)μg Trolox/g。
关键词:老黑谷米;色素;二次通用旋转;提取;抗氧化活性
目前,色素作为食品添加剂或营养补充剂,广泛应用于化妆品、药品、饲料和其他领域。但是,由于大部分合成色素具有不同程度的毒性,对人类有一定的致癌作用,被越来越多的国家限制使用 [1-5]。天然色素来自天然物质,主要是由植物组织中提取,也包括来自动物和微生物的一些色素。植物色素主要包括花色苷、类胡萝卜素、甜菜素和叶绿素,可分为脂溶性色素和水溶性色素 [1,3,6-8]。虽然天然色素稳定性差,但是由于安全性高,具有一定的营养和药理作用,并且在着色时色调更能接近天然物质的颜色,因此开发利用动植物天然食用色素资源,日益受到人们的普遍重视 [1-8]。近年来,研究者对谷物、果蔬、微生物中色素的提取工艺、结构鉴定和生物学活性进行了大量研究 [2-17]。以水、乙醇、甲醇及丙酮等作为提取溶剂,采用微波、超声等辅助提取方法,利用二次通用旋转、响应面等试验设计对天然色素的提取工艺进行了优化,并利用比色法对黄烷醇、花色苷等进行了含量测定 [4,10-11,16-19];利用高效液相色谱-串联质谱、傅里叶红外光谱、核磁共振、液相色谱-质谱联用等方法对天然色素进行了结构鉴定 [2-3,8,17]。大量研究 [1-2,6,11-13,20]表明,天然色素具有抗氧化、抑菌、抗癌、抑制肥胖、紫外线防护、抗炎等作用。
1.1 材料与试剂
老黑谷米采自云南迪庆州维西县攀天阁乡皆菊村,磨粉后过50 目筛,避光于-80 ℃储存备用。
1,1-二苯基-2-苦基肼基(1,1-d i p h e n y l-2-p i c r y l h y d r a z y l,D P P H)、三吡啶基三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、六水三氯化铁(FeCl 3·6H 2O)、H 2O 2、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonate),ABTS)、七水硫酸亚铁(FeSO 4·7H 2O)、抗坏血酸 上海晶纯生化科技股份有限公司;Trolox 美国Sigma公司;阿魏酸、儿茶素 北京北纳创联生物技术研究院;其他试剂均为分析纯。
1.2 仪器与设备
JFS-13A旋风式粉碎磨 杭州钱江仪器设备有限公司;UV-1800CP紫外分光光度计 上海美谱达仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 最佳提取溶剂的选择和最大吸收波长的确定
准确称取9 份老黑谷米面粉各1 g(干质量),置于三角瓶中,分别加入10 mL体积分数1%盐酸-甲醇溶液、1%盐酸-乙醇溶液、1%盐酸溶液、60%甲醇溶液、甲醇、乙醇、丙酮、石油醚、蒸馏水,提取30 min后,分别用提取溶剂定容至50 mL,在200~1 000 nm波长范围内进行扫描,确定最佳提取溶剂和最大吸收波长。
1.3.2 单因素试验
以吸光度为指标,在不同条件下考察提取时间、提取温度、液料比和提取次数对老黑谷米色素提取效果的影响。提取时间分别为10、20、30、40、50 min,提取温度分别为30、40、50、60、70 ℃,液料比分别为5∶1、10∶1、15∶1、20∶1、25∶1(mL/g),提取次数分别为1、2、3、4 次。
1.3.3 二次通用旋转试验设计
在单因素试验的基础上,选择提取温度、液料比和提取时间3 个因素,采用二次通用旋转试验设计,进行三因素五水平试验,试验因素水平见表1。
表1 二次通用旋转试验因素水平
Table 1 Factors and levels used in quadratic general rotary design

X 3提取时间/min 1.6827423.4∶153.41 1 6020∶145 0 4015∶140 -12010∶135 -1.68266.6∶126.6水平因素X 1提取温度/℃X 2液料比(mL/g)
1.3.4 抗氧化能力测定
1.3.4.1 老黑谷米色素对DPPH自由基清除能力的测定 [6,20]
分别吸取0.5 mL色素粗提液,添加2 mL 0.19 mmol/L DPPH溶液,充分振摇后,室温条件下暗处放置10 min,然后在517 nm波长处比色测定,用乙醇替代色素溶液作为空白。用阿魏酸绘制标准曲线,建立回归方程为y=0.940 6x+28.698(线性范围为23.2~139.2 μg/mL,R 2=0.969),式中:y为DPPH自由基清除率;x为阿魏酸质量浓度/(μg/mL)。自由基清除能力表示为每克干燥样品中阿魏酸当量(μg阿魏酸/g)。
式中:A 0为DPPH溶液本身的吸光度(空白对照);A 1为样品或者阳性对照的DPPH溶液的吸光度。
1.3.4.2 老黑谷米色素对铁离子还原/抗氧化能力(ferric reducing antioxidant power,FRAP)的测定 [20-21]
FRAP溶液的配制:乙酸缓冲溶液(300 mmol/L,pH 3.6)、六水三氯化铁(20 mmol/L)和三吡啶基三嗪(10 mmol/L)以体积比10∶1∶1充分混匀。
吸取100 μL色素粗提液加入3 mL FRAP溶液充分混合,于37 ℃反应4 min,在593 nm波长处测定吸光度,用乙醇替代色素溶液作为空白。用硫酸亚铁绘制标准曲线,建立回归方程为y=6.24x+0.000 5(线性范围为0.2~1.2 mmol/L,R 2=0.998 4)。式中:y为吸光度;x为硫酸亚铁浓度/(mmol/L)。FRAP表示为每毫升色素提取液中Fe 2+浓度当量(mmol Fe 2+/L)。
1.3.4.3 老黑谷米色素对ABTS +·清除能力的测定 [20,22-24]
ABTS工作液的配制:将ABTS(7 mmol/L)和过硫酸钾(2.45 mmol/L)两种溶液等体积混合,于4 ℃条件下反应16 h,得到ABTS工作液。
吸取100 μL色素粗提液,加入3.8 mL ABTS工作液,室温条件下反应6 min,于734 nm波长处测定吸光度,用乙醇替代色素溶液作为空白。用Trolox绘制标准曲线,建立回归方程为y=5.382 7x+3.3472(线性范围为7.488~37.44 μg/mL,R 2=0.999 7),式中:y为ABTS +·清除率;x为Trolox质量浓度/(μg/mL)。自由基清除能力表示为每克干燥样品中Trolox当量(μg Trolox/g)。
式中:A 0为ABTS溶液本身的吸光度(空白对照);A 1为样品或者阳性对照的ABTS溶液的吸光度。
1.3.4.4 老黑谷米色素还原能力的测定 [23]
吸取1 mL色素粗提液,加入2.5 mL磷酸盐缓冲溶液(0.2 mol/L,pH 6.6),加入2.5 mL 1%铁氰化钾溶液,充分混匀后于50 ℃水浴反应20 min;再加入2.5 mL 10%三氯乙酸溶液,4 000×g离心10 min;吸取上清液1 mL,加入2.5 mL蒸馏水和0.5 mL 0.1% FeCl 3溶液,于700 nm波长处测定吸光度,用乙醇替代色素溶液作为空白。用抗坏血酸绘制标准曲线,建立回归方程为y=0.045 5x-0.115(线性范围为80~180 μg/mL,R 2=0.991 6),式中:y为吸光度;x为抗坏血酸质量浓度/(μg/mL)。还原能力表示为每克干燥样品中抗坏血酸当量(μg抗坏血酸/g)。
1.3.4.5 H 2O 2清除活性测定 [24]
吸取0.6 mL色素粗提液,加入0.9 mL H 2O 2(40 mmol/L),加入磷酸钠缓冲溶液(45 mmol/L,pH 7.4),30 ℃反应40 min,于230 nm波长处测定吸光度,用乙醇替代色素溶液作为空白。用阿魏酸绘制标准曲线,建立回归方程为:y=0.657 1x-11.119(线性范围为55~275 μg/mL,R 2=0.994 3),式中:y为H 2O 2清除率;x为阿魏酸质量浓度/(μg/mL)。自由基清除能力表示为每克干燥样品中阿魏酸当量(μg阿魏酸/g)。
式中:A 0为H 2O 2溶液本身的吸光度(空白对照);A 1为加有样品或者阳性对照的H 2O 2溶液的吸光度。
1.4 统计分析
利用DPS数据处理软件进行统计分析。
2.1 最佳提取溶剂的选择和最大吸收波长的确定
通过采用9 种不同溶剂对老黑谷米中的色素进行提取,并在200~1 000 nm范围内进行全波长扫描,在最大吸收波长测定其吸光度,发现在各种溶剂中,乙醇吸光度较大,提取效果较好,说明该色素为醇溶性色素。

图1 老黑谷米色素浸提液的吸收光谱
Fig.1 Absorption spectrum of pigments extracted from “Laoheigu” rice
由图1可看出,色素的乙醇提取液和石油醚提取液的吸收光谱在342 nm和282 nm处均有明显吸收峰,其中乙醇提取液吸光度最大。由文献[25]得知,黄酮醇在240~400 nm区域主要有两个吸收峰,带Ⅰ在300~380 nm有最大吸收峰,带Ⅱ在240~280 nm有最大吸收峰,结合该色素为醇溶性色素,说明该色素可能为黄酮醇类物质。如A环有氧取代,而B环没有氧取代的黄酮醇,其光谱具有一个强的带Ⅱ和一个弱的带Ⅰ。带Ⅰ的位置能够提供关于黄酮醇及其氧取代类型的信息。故选取乙醇作为最佳提取溶剂,342 nm作为测定该色素溶液的最大吸收波长。
2.2 单因素试验结果
2.2.1 提取时间对色素提取效果的影响
准确称取1 g(干质量)样品,在室温条件下分别用乙醇提取10、20、30、40、50 min,液料比10∶1、提取次数2 次,定容于50 mL容量瓶中,在342 nm波长处测定吸光度,结果见图2。

图2 提取时间对色素提取效果影响
Fig.2 Effect of extraction time on the extraction efficiency
由图2可见,随着提取时间的延长,色素溶液吸光度呈先上升后下降的趋势。可能提取时间过长,色素会发生降解,含量降低,从而导致色素溶液吸光度降低。所以选择提取时间为40 min。
2.2.2 提取温度对色素提取效果的影响
准确称取1 g(干质量)样品,分别用乙醇在30、40、50、60、70℃条件下进行提取,提取时间40 min、液料比10∶1、提取次数2 次,定容于50 mL容量瓶中,在342 nm波长处测定吸光度,结果见图3。

图3 提取温度对色素提取效果的影响
Fig.3 Effect of extraction temperature on the extraction efficiency
由图3可知,提取温度对老黑谷米色素提取效果具有一定的影响,随着温度的上升,吸光度呈现先上升后下降的趋势,在温度为40 ℃时吸光度最大,颜色也有明显变化,所以选择提取温度为40 ℃。
2.2.3 液料比对色素提取效果的影响
准确称取1 g(干质量)样品,分别加入5、10、15、20、25 mL乙醇进行提取,提取时间40 min、提取温度40 ℃、提取次数2次,定容至50 mL容量瓶中,在342 nm波长处测定吸光度,结果见图4。

图4 液料比对色素提取效果的影响
Fig.4 Effect of ratio of liquid to material on the extraction efficiency
由图4可知,随着液料比的上升,吸光度逐渐增大,当液料比大于15∶1(mL/g)时,吸光度变化不明显。料液比过小会造成提取不完全,料液比过大会降低溶剂利用率,造成溶剂和能源的浪费,提高生产成本并给后序的浓缩工序带来困难,所以选择液料比为15∶1(mL/g)。
2.2.4 提取次数对色素提取效果的影响
准确称取1 g(干质量)样品,用乙醇分别提取1、2、3、4 次,提取时间40 min、提取温度40 ℃、液料比15∶1(mL/g),定容至100 mL容量瓶,在342 nm波长处测定吸光度,结果见图5。

图5 提取次数对色素提取效果的影响
Fig.5 Effect of extraction number on the extraction efficiency
由图5可见,随着提取次数的增加,色素溶液吸光度呈增加趋势,当提取次数3 次后,吸光度增加不再明显。考虑到提取次数过多会浪费溶剂且延长提取周期,故选择提取次数3 次为宜。
2.3 二次通用旋转试验结果
2.3.1 二次通用旋转试验设计与结果
二次通用旋转试验方案及结果见表2。
表2 二次通用旋转试验方案及结果
Table 2 Experimental design and results of quadratic general rotary design
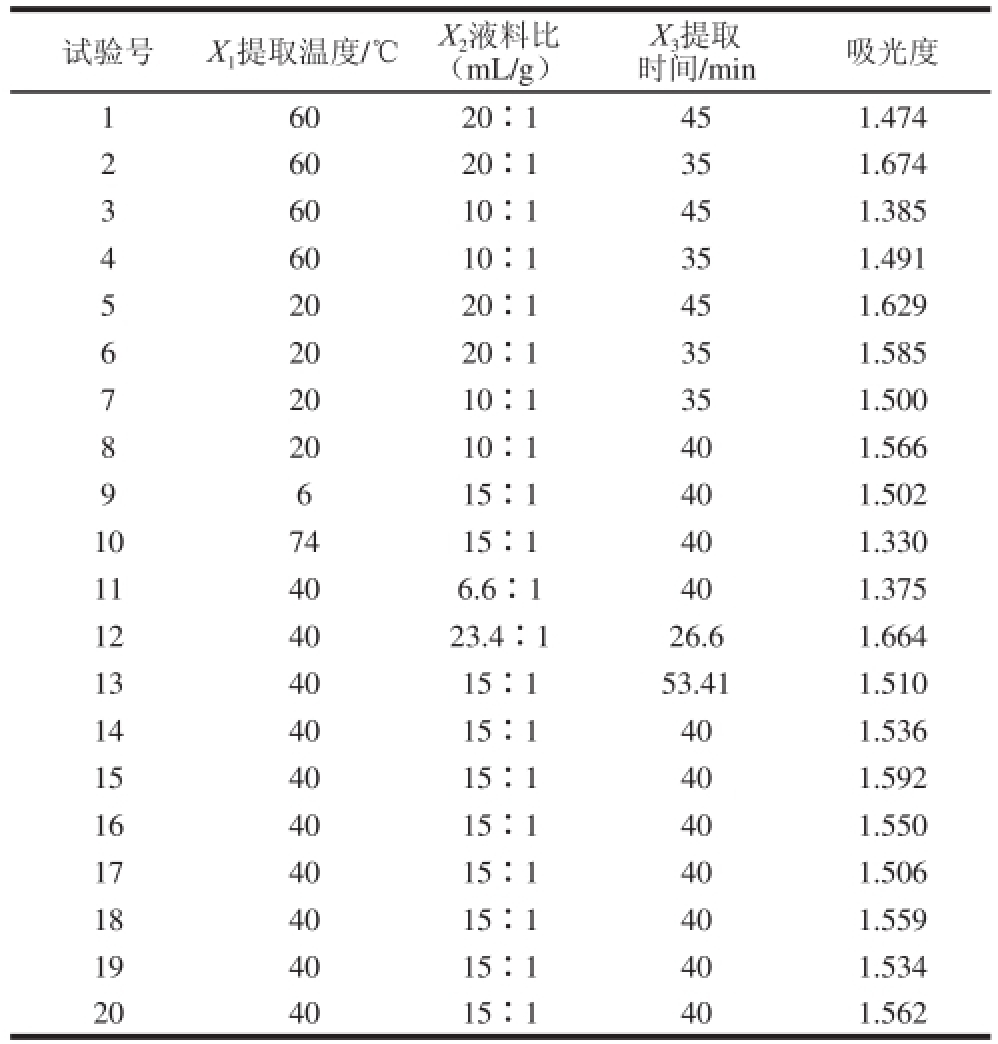
试验号X 1提取温度/℃X 2液料比(mL/g)X 3提取时间/min吸光度6020∶1451.474 2 6020∶1351.674 3 6010∶1451.385 4 6010∶1351.491 5 2020∶1451.629 6 2020∶1351.585 7 2010∶1351.500 8 2010∶1401.566 9 6 15∶1401.502 107415∶1401.330 11406.6∶1401.375 124023.4∶126.61.664 134015∶153.411.510 144015∶1401.536 154015∶1401.592 164015∶1401.550 174015∶1401.506 184015∶1401.559 194015∶1401.534 204015∶1401.562 1
2.3.2 数学模型的建立与检验
利用DPS软件对试验结果进行分析,得到二次回归模型为:Y=1.548 70-0.039 93X 1+0.066 34X 2-0.020 82X 3-0.035 79X 1 2+0.000 80X 2
2+0.002 04X 3
2+ 0.015 50X 1X 2-0.035 50X 1X 3+0.002 00X 2X 3。
根据试验结果进行方差分析,由表3可知,该回归模型达到显著水平(P<0.05),说明方程与实际情况拟合良好,能够反映色素提取效果与提取温度、液料比和提取时间的关系。
表3 回归方程方差分析表
Table 3 Analysis of variance of regression model
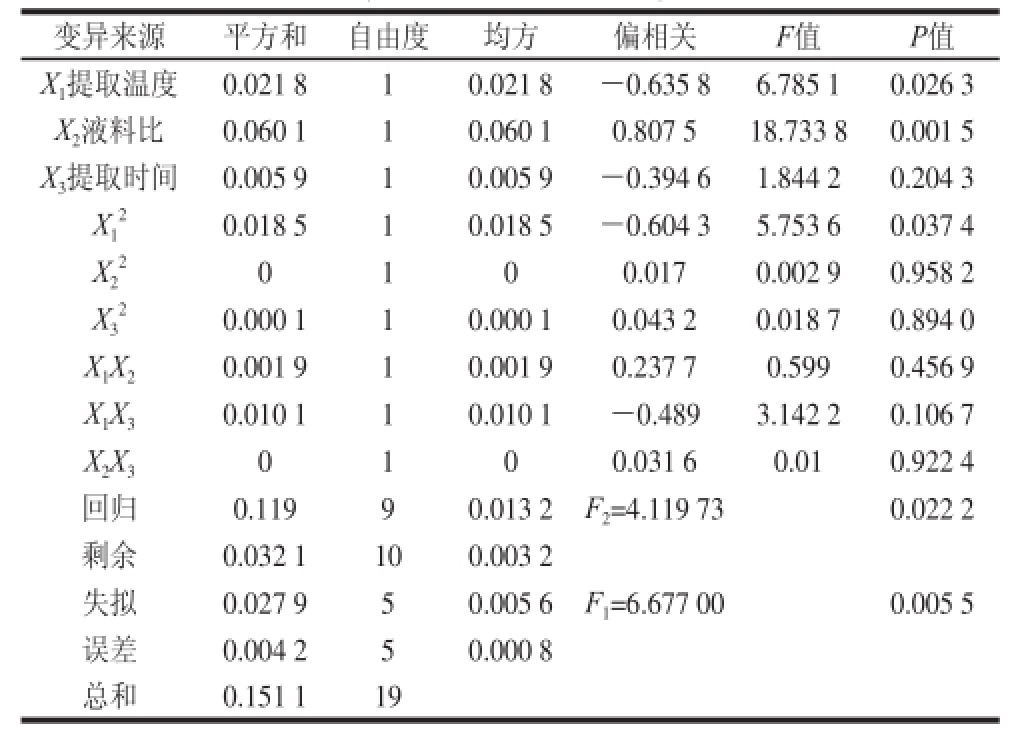
变异来源平方和自由度均方偏相关F值P值X 1提取温度0.021 810.021 8-0.635 86.785 10.026 3 X 2液料比0.060 110.060 10.807 518.733 80.001 5 X 3提取时间0.005 910.005 9-0.394 61.844 20.204 3 X 10.018 510.018 5-0.604 35.753 60.037 4 X2 2 0.000 110.000 10.043 20.018 70.894 0 X 1X 20.001 910.001 90.237 70.5990.456 9 X 1X 30.010 110.010 1-0.4893.142 20.106 7 X 2X 30100.031 60.010.922 4回归0.11990.013 2F 2=4.119 730.022 2剩余0.032 1100.003 2失拟0.027 950.005 6F 1=6.677 000.005 5误差0.004 250.000 8总和0.151 119 0100.0170.002 90.958 2 X3 22
2.3.3 变量轮换直接寻优
根据已建立的数学模型,在-1.682≤X i≤1.682(i= 1、2、3)范围内,每个因素取5 个水平(±1.682、±1、0),对5 3=125个方案进行统计寻优,在试验范围内可得吸光度的最高值为1.66,此时各因素取值为:X 1= -1,X 2=+1.682,X 3=-1.682,对应提取温度20 ℃、液料比23.4∶1(mL/g)、提取时间26.6 min。
2.3.4 频率分析及统计寻优
对不同设计水平条件下的组合进行模拟试验,以均值1.53为临界值,获得大于临界值的方案50个,各变量取值的频率分布见表4。
表4 优化提取方案中X
i取值频率分布表
Table 4 Frequency distribution of X
iin the extraction optimization scheme

X 1提取温度/℃X 2液料比(mL/g)X 3提取时间/min次数频率次数频率次数频率-1.68290.29060.2 -1110.3110100.2 0150.3150.2140.2 1190.2190.4210.2 1.682220220.4250.2加权均数-0.4361.0730标准误0.1320.0870.175 95%的置信区间-0.696~-0.1770.902~1.244-0.343~0.343提取条件26.08~36.4619.51∶1~21.22∶134.855~45.15因素水平
由表4可以看出,在95%的置信区间吸光度大于1.53的优化方案为:提取温度26.08~36.46 ℃、液料比19.51∶1~21.22∶1、提取时间38.285~45.15 min。为了贴近实际的工业化生产,可将优化方案定为:提取温度30 ℃、液料比20∶1(mL/g)、提取时间40 min。对此方案进行验证实验,色素溶液的吸光度为1.54,与优化方案的理论值1.53比较接近,进一步证实了方案的可靠性。
2.4 老黑谷米色素的抗氧化活性
由表5可见,老黑谷米色素具有较强的抗氧化能力。其中DPPH自由基清除能力为(3 512.56±26.28)μg阿魏酸/g,FRAP为(44.04±6.60)mmol Fe 2+/L,还原能力为(203.47±23.75)μg抗坏血酸/g,H 2O 2清除活性为(3 676.60±114.32)μg阿魏酸/g,ABTS +·清除能力为(2 778.70±262.90)μg Trolox/g。
表5 老黑谷米色素的抗氧化能力测定(以每克面粉计,干质量)
Table 5 Antioxidant capacity of pigments from
“Laoheigu”eigu rice ice (per g dry weight of flour)
注:数据为
 ,n=3。
,n=3。
ABTS +·清除能力/(μg Trolox/g)3 512.56±26.2844.04±6.60203.47±23.753 676.60±114.322 778.70±262.90 DPPH自由基清除能力/(μg阿魏酸/g)FRAP/(mmol Fe 2+/L)还原能力/(μg抗坏血酸/g)H 2O 2清除活性/(μg阿魏酸/g)
老黑谷米色素是一种醇溶性色素,乙醇提取效果最佳,在282 nm和342 nm处有最大吸收波长,初步定性为黄酮醇类物质。最佳提取工艺为:提取温度30 ℃、液料比20∶1(mL/g)、提取时间40 min。该色素具有较好的抗氧化活性,可作为功能性的天然色素进一步开发利用,也为老黑谷米的开发利用提供新思路。
参考文献:
[1] BOO H O, HWANG S J, BAE C S, et al. Extraction and characterization of some natural plant pigments[J]. Industrial Crops and Products, 2012, 40: 129-135. DOI:10.1016/j.indcrop.2012.02.042.
[2] JOAQUIN-CRUZ E, DUENAS M, GARCIA-CRUZ L, et al. Anthocyanin and phenolic characterization, chemical composition and antioxidant activity of chagalapoli (Ardisia compressa K.) fruit: a tropical source of natural pigments[J]. Food Research International, 2015, 70: 151-157. DOI:10.1016/j.foodres.2015.01.033.
[3] TAN M X, GAN D H, WEIL X, et al. Isolation and characterization of pigment from Cinnamomum burmannii’ peel[J]. Food Research International, 2011, 44: 2289-2294. DOI:10.1016/ j.foodres.2010.05.022.
[4] MARANA J P, PRIYA B, NIVETHA C V. Optimization of ultrasound-assisted extraction of natural pigments from Bougainvillea glabra flowers[J]. Industrial Crops and Products, 2015, 63: 182-189. DOI:10.1016/j.indcrop.2014.09.059.
[5] 李永强, 杨士花, 高斌, 等. 黄酮对杨梅花色苷的辅色作用[J]. 食品科学, 2011, 32(13): 37-39.
[6] ZHANG J F, HOU X, AHMAD H. Assessment of free radicals scavenging activity of seven natural pigments and protective effects in AAPH-challenged chicken erythrocytes[J]. Food Chemistry, 2014, 145: 57-65. DOI:10.1016/j.foodchem.2013.08.025.
[7] VENIL C K, ZAKARIA Z A, AHMAD W A. Bacterial pigments and their applications[J]. Process Biochemistry, 2013, 48: 1065-1079. DOI:10.1016/j.procbio.2013.06.006.
[8] KULANDAISAMY V C, AKMAR Z Z, USHA R, et al. Isolation and characterization of flexirubin type pigment from Chryseobacterium sp. UTM-3T[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3: 103-107. DOI:10.1016/j.bcab.2014.02.006.
[9] 杨晓娜, 徐玲, 赵昶灵, 等. 龙陵紫皮石斛色素的提取及其稳定性[J]. 食品科学, 2015, 36(9): 49-54. DOI:10.7506/spkx1002-6630-201509010.
[10] 李亚辉, 马艳弘, 黄开红, 等. 超声波辅助酶法提取黑莓酒渣中花色苷工艺优化及其生物活性[J]. 食品科学, 2015, 36(6): 63-68. DOI:10.7506/spkx1002-6630-201506012.
[11] 吕曼曼, 刘航, 苗修港, 等. 超声波辅助提取高粱全粉色素工艺及其体外抗氧化性分析[J]. 食品科学, 2014, 35(16): 39-45. DOI:10.7506/ spkx1002-6630-201516012.
[12] 陈钢, 黄立山, 徐静, 等. 黑莓花色苷的超声波提取与抗氧化性活性研究[J]. 食品科学, 2012, 33(24): 117-121. DOI:10.7506/spkx1002-6630-201224024.
[13] PANGESTUTI R, KIM S K. Biological activities and health benefit effects of natural pigments derived from marine algae[J]. Journal of Functional Foods, 2011, 3: 255-266. DOI:10.1016/j.jff.2011.07.001.
[14] BORGES G D S C, VIEIRA F G K, COPETTI C, et al. Optimization of the extraction of flavanols and anthocyanins from the fruit pulp of euterpe edulis using the response surface methodology[J]. Food Research International, 2011, 44: 708-715. DOI:10.1016/ j.foodres.2010.12.025.
[15] MARAN J P, PRIYA B, NIVETHA C V. Optimization of ultrasoundassisted extraction of natural pigments from Bougainvillea glabra flowers[J]. Industrial Crops and Products, 2015, 63: 182-189. DOI:10.1016/j.indcrop.2014.09.059.
[16] 李月嘉, 杨士花, 李永强, 等. 响应面法优化玉米花粉黄酮提取工艺的研究[J]. 食品与发酵科技, 2010, 48(3): 30-33. DOI:10.3969/ j.issn.1674-506X.2012.03-008.
[17] TAKAHAMA U, YAMAUCHI R, HIROTA S. Isolation and characterization of a cyanidin-catechin pigment from adzuki bean (Vigna angularis)[J]. Food Chemistry, 2013, 141: 282-288. DOI:10.1016/j.foodchem.2013.02.113.
[18] 李永强, 杨士花, 付晓萍, 等. 多酚对杨梅花色苷的辅色作用及稳定性的影响[J]. 食品与发酵科技, 2011, 37(4): 64-67.
[19] 李永强, 杨士花, 岳晓川, 等. 野生滇橄榄多酚提取工艺的优化[J]. 中国食物与营养, 2015, 21(1): 46-50. DOI:10.3969/ j.issn.1006-9577.2015.01.012.
[20] AK T, GULCIN I. Antioxidant and radical scavenging properties of curcumin[J]. Chemico-Biological Interactions, 2008, 174: 27-37. DOI:10.1016/j.cbi.2008.05.003.
[21] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239: 70-76. DOI:10.1016/ abio.1996.0292.
[22] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237. DOI:10.1016/S0891-5849(98)00315-3.
[23] CHANDRASEKARA A, SHAHIDI F. Content of insoluble bound phenolics in millets and their contribution to antioxidant capacity[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 6706-6714. DOI:10.1021/jf100868b.
[24] CHANDRASEKARA A, NACZK M, SHAHIDI F. Effect of processing on the antioxidant activity of millet grains[J]. Food Chemistry, 2012, 133: 1-9. DOI:10.1016/j.foodchem.2011.09.043.
[25] 徐任生, 周炳南. 黄酮体化合物鉴定手册[M]. 北京: 科学出版社, 1981.
Optimization of Extraction and Antioxidant Activities in Vitro of Pigments from the Grains of “Laoheigu” Rice
HUANG Jiaqi
1, YANG Shihua
2, CHU Yajie
1, TAO Liang
3, FENG Zhixiang
1, LI Huajun
1, YAN Yan
1, LI Xueliang
1, LI Yongqiang
1,*
(1. College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2. College of Foreign Languages, Yunnan Agricultural University, Kunming 650201, China; 3. College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China)
Abstract:The extraction process for pigments from the grains of “Laoheigu” rice, a red-grained rice variety grown in Pantiange town, Diqing prefecture, Yunnan province was optimized by quadratic general rotary design based on single factor experiments and the antioxidant activities in vitro of the extracted pigments were investigated. The results showed that the best extraction solvent for the pigments was determined as alcohol and the maximum absorption peaks appeared at 282 and 342 nm, suggesting that they were flavonol compounds. The optimum extraction conditions were as follows: extraction temperature, 30 ℃; liquid to material ratio, 20:1 (mL/g); and extraction time, 40 min. The pigments had potent antioxidant activities; DPPH radical scavenging activity was (3 512.56 ± 26.28) μg ferulic acid equivalents/g; ferric reducing antioxidant power (FRAP) was (44.04 ± 6.60) mmol Fe 2+equivalents/L; reducing power (RP) was (203.47 ± 23.75) μg ascorbic acid equivalents/g; hydrogen peroxide scavenging activity was (3 676.60 ± 114.32) μg ferulic acid equivalents/g, and 2,2’-azinobis (3-ethylbenzothiazoline-6-sulfonate) (ABTS) radical scavenging activity was (2 778.70 ± 262.90) μg Trolox equivalents/g.
Key words:“Laoheigu” rice; pigments; quadratic general rotary design; extraction; antioxidant activity
DOI:10.7506/spkx1002-6630-201602004
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)02-0019-06
引文格式:
黄佳琦, 杨士花, 初雅洁, 等. 老黑谷米色素的提取工艺优化及体外抗氧化活性分析[J]. 食品科学, 2016, 37(2): 19-24. DOI:10.7506/spkx1002-6630-201602004. http://w ww.spkx.net.cn
HUANG Jiaqi, YANG Shihua, CHU Yajie, et al. Optimization of extraction and antioxidant activities in vitro of pigments from the grains of “Laoheigu” rice[J]. Food Science, 2016, 37(2): 19-24. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201602004. http://www.spkx.net.cn
收稿日期:2015-06-02
基金项目:国家自然科学基金面上项目(31360378;31560428);云南省自然科学基金项目(2013FB042);云南省高校食品加工与安全控制重点实验室项目(201401);国家大学生创新创业训练计划项目(201510676001)
作者简介:黄佳琦(1993—),女,硕士研究生,研究方向为天然产物化学。E-mail:601017577@qq.com
*通信作者:李永强(1975—),男,副教授,博士,研究方向为食品科学。E-mail:Liyongqiang7512@163.com