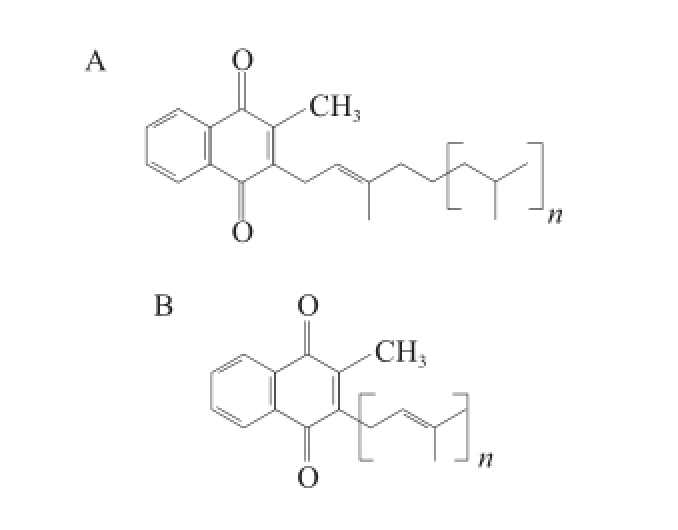
图1 叶绿醌(A)和甲基萘醌(B)分子结构
Fig.1 Chemical structures of phylloquinone and menaquinone
陈亚淑 1,汪 荣 1,谢笔钧 1,杨季芳 2,陈吉刚 2,孙智达 1,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.浙江万里 学院生物与环境学院,浙江 宁波 315100)
摘 要:利用酶的高效性和专一性破裂细菌细胞壁,实现对类胡萝卜素的温和提取并鉴定。以加酶量、酶解时间和料液比作为单因素进行正交试验,得出最优提取条件为:菌粉与溶菌酶配比1∶10(mg/mL)、酶解时间80 min、料液比1∶80(mg/mL),此条件下类胡萝卜素提取量为675 μg/g。采用液相色谱-质谱串联进行类胡萝卜素的结构鉴定,液相色谱-质谱条件为:色谱柱YMCC 30(4.6 mm×150 mm,5 μm)、检测波长450 nm、大气压力化学电离源、正离子模式、离子源温度230 ℃、充电电压2 000 V、质荷比扫描范围200~1 200,鉴定出分子式分别为C 51H 76O 2和C 51H 74O 2的2 种甲基萘醌类胡萝卜素。
关键词:类胡萝卜素;酶法提取;高效液相色谱;液相色谱-质谱;红球菌B7740
红球菌属是一类广泛分布于自然界的革兰氏阳性菌,在土壤、海底沉积物和食草动物中含量丰富,且多数为营腐生生活。红球菌属(Rhodococcus sp.)是在1891年由Zoof建立的,从建立至今,分类地位一直不确定。目前,红球菌归属于放线菌门(Actinobacteria),放线菌纲(A c t i n o b a c t e r i a),放线菌亚纲(Actinobacteridae),放线菌目(Actinomycetales),棒杆菌亚目(Croynebacterineae),诺卡氏菌科(Nocardiaceae),红球菌属(Rhodococcus) [1]。目前,国内外对红平红球菌的研究较多,主要集中在其生物降解能力研究和分子学研究。胡晓静 [2]研究了红平红球菌H-412在油中的生物脱硫途径和机理,Hibino等 [3]研究发现疏水性的紫红红球菌能很好地分散于有机溶剂中,有很好的生物转化活性,而一些放线菌、绿硫菌和光合细菌能够产生类胡萝卜素,红球菌属是放线菌中能产生类胡萝卜素的一个属 [4-5]。类胡萝卜素是广泛存在于自然界中的脂溶性色素,至今已发现了600多种。类胡萝卜素是由异戊二烯烃长链为主体衍生而来极性较小的色素 [6]。为了保证结构的稳定性,类胡萝卜素中的共轭碳碳双键处于反式构型,自然界中几乎所有的类胡萝卜素都是反式结构。光、热或酸、碱等因素会使类胡萝卜素的结构发生异构化,产生顺式构型的类胡萝卜素。
陈梅雪等 [6]分析了细菌细胞中类异戊二烯醌的结构,主要有2 种结构类型:萘醌和苯基醌,其中萘醌可进一步分为2 种类型:叶绿醌和甲基萘醌。见图1A,叶绿醌通常存在于植物的绿色部分,很少在细菌中存在;如图1B所示,甲基萘醌的通式为MK n(H m),其中:n表示侧链中异戊二烯单元的确定数目;m表示聚异戊二烯链中氢原子的饱和度(如MK 8或MK 8(H 2)等)。

图1 叶绿醌(A)和甲基萘醌(B)分子结构
Fig.1 Chemical structures of phylloquinone and menaquinone
类胡萝卜素的提取方法有很多种,不同的原料对应的方法不同。目前,已有的类胡萝卜素提取方法有酸热法、有机溶剂提取法、研磨法、酶法、超声波辅助萃取和超临界流体法等 [8-10]。酶法提取类胡萝卜素是近几年发展起来的生物提取技术。利用酶的高效性和专一性在短时间内破裂组织或细菌细胞壁,实现类胡萝卜素的温和提取。赵功玲等 [11]采用外加果胶酶及纤维素酶提取番茄中番茄红素,大大提高了提取速率和效率。
类胡萝卜素的结构鉴定常用的方法是紫外、质谱、核磁。由于类胡萝卜素含量低、不稳定、易降解和异构化限制了核磁共振在类胡萝卜素结构研究上的应用。早期,在高效液相色谱中主要用C 18反相色谱柱来分离物质,然而C 30反相色谱柱能够分离同分异构体的优点使其在类胡萝卜素的分析中越来越成为主流 [12]。目前,有很多研究者使用C 30反相色谱柱和大气压力化学电离源(atmospheric pressure chemical ionization,APCI)分析鉴定类胡萝卜素结构和种类,如Inbaraj等 [13]鉴定宁夏枸杞中类胡萝卜素结构,Kao等 [14]鉴定蒲公英中类胡萝卜素结构。
类胡萝卜素具有体内清除自由基、抗氧化、抗癌等多重生理作用 [15-19],在已有的600多种类胡萝卜素中有10多种已被多数国家批准使用于各个领域 [20]。本研究的原料是红球菌(Rhodococcus sp.)B7740,是研究者于2008年7—9月中国第3次北极科学考察期间,用Seabird911 Plus CTD 系统从北冰洋B77站点(146°49.28′W,76°58.08′N)25 m深的表层海水样品中分离得到 [21],宁波市微生物与环境工程重点实验室通过16S rDNA序列BLAST在线比对,判定该菌为红球菌属。经过实验室培养,得到的冻干菌粉呈橘红色。通过以往研究结果,推断红球菌B7740能够产生胞内色素类胡萝卜素,具有成为天然色素生产资源的潜力和工业化应用价值,本实验探究其类胡萝卜素产品的提取工艺以及组成,为实现红球菌B7740的工业潜力和价值提供参考。
1.1 材料与试剂
北极海洋红球菌(Rhodococcus sp.)B7740冻干菌粉由浙江万里学院提供;溶菌酶(20 000 U/mg)、醋酸锌、甲醇、乙醇、乙腈、丙酮、正己烷、二氯甲烷、色谱级甲醇、色谱级甲基叔丁基醚、0.22 μm有机滤膜、进样瓶、氢氧化钾、浓硫酸、三氯化锑、氯仿、无水硫酸钠、2,6-二叔丁基-4-甲基苯酚 国药集团化学试剂有限公司。
1.2 仪器与设备
WH-3微型涡旋混合仪 上海沪西分析仪器有限公司;EL-104电子天平 梅勒特-托利多仪器(上海)有限公司;WFZ UV-2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;DK-98-ⅡA型电热恒温水浴锅天津市泰斯特仪器有限公司;UV-1800紫外-可见分光光度计 美国Shimadzu公司;CR-30色度计 北京航轩科技发展有限公司;5810R台式低温离心机 德国Eppendorf公司;KQ-50DB型数控超声波清洗器 昆山市超声仪器有限公司;RE-3000旋转蒸发仪 上海亚荣生化仪器厂;2695高效液相色谱仪 美国Waters公司;1100 Series液相色谱-质谱联用仪 美国安捷伦公司;YMCC 30色谱柱 安赫科学仪器(上海)有限公司。
1.3 方法
1.3.1 类胡萝卜素提取工艺流程
1 mg/mL溶菌酶水溶液配制:称取0.1 g溶菌酶(20 000 U/mg)粉末,加水溶解,定容100 mL。
类胡萝卜素的提取工艺:称取0.1 g的红球菌B7740冻干菌粉置于离心管中,加入0.5~4 mL溶菌酶溶液,涡旋30 s混合,在37 ℃水浴中保持20~100 min,加入2 mL预冷饱和醋酸锌溶液,混匀,7 000 r/min离心10 min。除去上清液,加入5~9 mL甲醇与二氯甲烷(8∶2,V/V)混合均匀,7 000 r/min离心10 min。取出上清液,用甲醇与二氯甲烷(8∶2,V/V)定容至100 mL,测定吸光度A 450 nm并计算类胡萝卜素产量,且保留下层沉淀作2 次提取用。2 次提取是指在一次提取结束后,将下层沉淀重新溶剂在甲醇与二氯甲烷(8∶2,V/V)混合均匀,7 000 r/min离心10 min。取出上清液,用甲醇与二氯甲烷(8∶2,V/V)定容至100 mL,测定吸光度A 450 nm并计算类胡萝卜素产量,并保留下层沉淀作3 次提取用。3 次提取与2 次提取方法相同,3 次提取后B7740菌体基本无色。实验平行3 次,取平均值 [22]。
1.3.2 提取工艺最优参数的确定
选取加酶量、破壁时间和料液比做单因素试验,在试验结果的基础上设计正交试验,根据正交试验结果确定色素最优提取条件。选取菌粉-加酶量比作为单因素时,破壁时间1 h、料液比1∶50 (mg/mL);破壁时间作为单因素时,菌粉-加酶量比1∶10(mg/mL)、料液比1∶50(mg/mL);料液比作为单因素时,菌粉-加酶量比1∶10 (mg/mL)、破壁时间1 h。参考以上单因素试验的结果,如表1所示,选取菌粉-加酶量比(A)、破壁时间(B)、料液比(C)这3 个因素做三因素三水平正交试验,以色度测量表征类胡萝卜素提取量,根据分析结果和论证试验得出色素提取的最佳提取条件。
表1 正交试验因素水平
T
Table 1 Factors and their coded levels used in orthogonal array design

水平A菌粉-加酶量比(mg/mL)C料液比(mg/mL)1 1∶10401∶60 2 1∶20601∶70 3 1∶30801∶80 B破壁时间/min
1.3.3 色素中类胡萝卜素含量和提取率计算
色素提取液中类胡萝卜素含量按照文献[23]报道,按公式(1)计算:
式中:A为提取液在最大吸收波长处的吸光度;D为稀释的倍数;V为溶剂的体积/mL;w为菌粉的质量/g;0.16为类胡萝卜素摩尔消光系数。
细菌中类胡萝卜素的提取率参照黄德见 [24]的方法,见计算公式(2):
式中:A为提取液在最大吸收波长处的吸光度;V为提取剂体积/mL。
1.3.4 高效液相色谱条件
取10 mL红球菌B7740类胡萝卜素提取液,用氮气吹干溶剂,加入甲醇-甲基叔丁基醚(1∶1,V/V)混合液和0.1%的2,6-二叔丁基-4-甲基苯酚溶液,将溶液过0.22 μm的有机滤膜,装入进样瓶中备用。
液相色谱条件:e2695高效液相色谱,2998二极管阵列检测器,色谱柱YMCC 30(4.6 mm×150 mm,5 μm),进样量10 μL,柱温25 ℃,流速1 mL/min,检测波长450 nm。色谱分离程序参考文献[25]的方法稍有改动如下:梯度洗脱流动相A为甲醇,B为甲基叔丁基醚,分离程序为;0~30 min,A由95%变为70%,30~50 min,A由70%变为50%,平衡10 min。
1.3.5 液相色谱-质谱分析条件
1100 SeriesLC-MSD-Trap-XCT,色谱柱YMCC 30(4.6 mm×150 mm,5 μm),进样量10 μL,柱温25 ℃,检测波长450 nm。液相色谱分离程序如1.3.4节所述。液相色谱-质谱条件参考文献[26]的方法稍有改动如下:APCI离子源,正离子模式,离子源温度230 ℃,毛细管电压2 000 V,充电电压2 000 V,碰撞电压2 000 V,电晕电压4 V,干燥气流量7 L/min,温度330 ℃,雾化器电压10 psi,质荷比扫描范围200~1 200。
2.1 单因素试验结果
2.1.1 破壁时间对色素提取的影响
如图2所示,菌粉-加酶量比1∶10(mg/mL)、料液比1∶50(mg/mL),破壁时间在20~60 min之间时,随着时间的延长红球菌B7740类胡萝卜素的提取量增加。在60 min时细菌的细胞壁破裂完全,故红球菌B7740类胡萝卜素的提取量达到最大。随着破壁时间的进一步延长,由于类胡萝卜素对热敏感,温度易使类胡萝卜素氧化降解使产量降低,故60~100 min时间范围内红球菌B7740类胡萝卜素的提取量逐渐降低。由此选择40、60、80 min作为破壁时间正交试验的3 个因素水平。
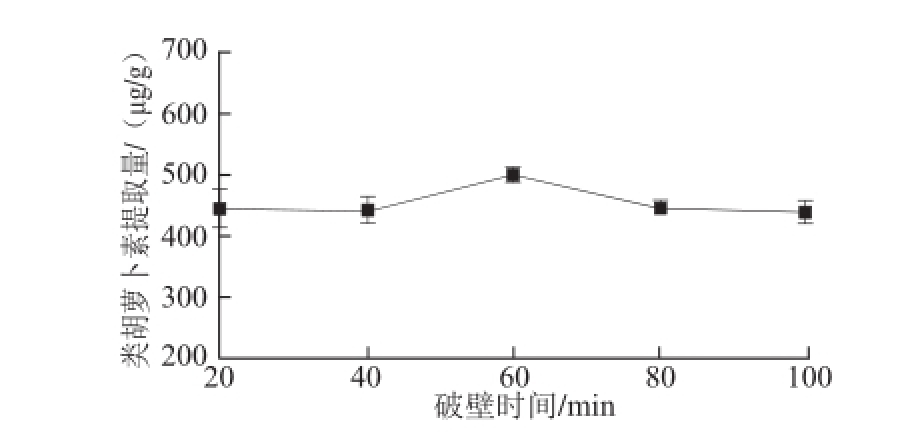
图2 不同破壁时间下提取物中类胡萝卜素的提取量
Fig.2 Effect of cell disruption time on the yield of carotenoids from Rhodococcus sp. B7740
2.1.2 加酶量对色素提取的影响

图3 不同加酶量条件下提取物中类胡萝卜素的提取量
Fig.3 Effect of lysozyme dose on the yield of carotenoids from Rhodococcus sp. B7740
溶菌酶能破裂革兰氏阳性菌红球菌B7740的细胞壁,在酶活和破壁时间一定的情况下,酶量决定细胞壁的破裂率。从图3可看出,破壁时间1 h、料液比1∶50 (mg/mL),在菌粉与加酶量的比例在1∶5~1∶20(mg/mL)之间时,随着加酶量的增加,细胞壁的破裂率增加,类胡萝卜素的提取量增加,在1∶20时细胞壁的破裂率达到最大,此时类胡萝卜素的提取量达到最大。此后,加酶量进一步增加,细胞壁的破裂率保持不变,故红球菌B7740类胡萝卜素的提取量变化不大。由此选择1∶10、1∶20、1∶30(mg/mL)作为菌粉-加酶量比正交试验的3 个因素水平。

图4 不同料液比条件下提取物中类胡萝卜素的提取量
Fig.4 Effect of material/solvent ratio on the yield of carotenoids from Rhodococcus sp. B7740
2.1.3 料液比对色素提取的影响以甲醇-二氯甲烷(8∶2,V/V)混合液作为提取溶剂、菌粉-加酶量比1∶10(mg/mL)、破壁时间1 h,随着溶剂体积的增加,红球菌B7740类胡萝卜素的提取量增加,如图4所示,当料液比达到1∶70时,提取量达到最大值。随后即使溶剂体积增加,但由于1∶70时细胞内类胡萝卜素几乎被提取出,故类胡萝卜素的提取量没有增加。由此选择1∶60、1∶70、1∶80 (mg/mL)作为料液比正交试验的3 个因素水平。
2.2 色素提取条件的正交试验结果
表2 正交试验设计与结果
Table 2 Results of orthogonal array experiments
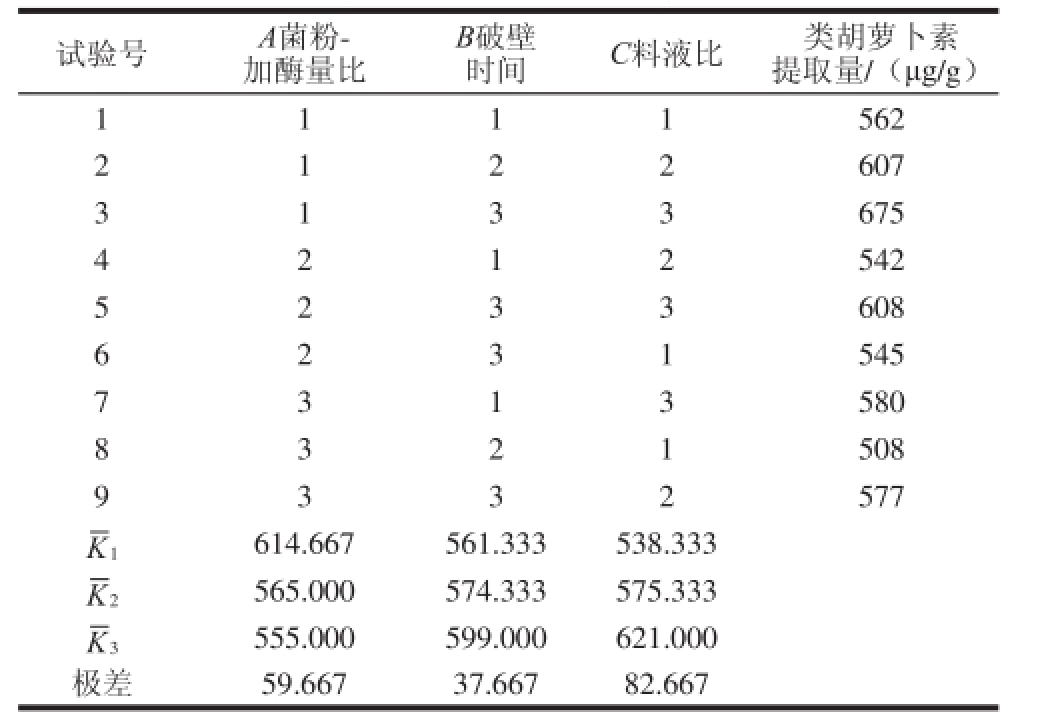
试验号A菌粉-加酶量比B破壁时间C料液比类胡萝卜素提取量/(μg/g)1 1 1 1 562 2 607 3 1 3 3 675 1 2 2 4 542 5 2 3 3 608 2 1 2 6 545 7 3 1 3 580 2 3 1 8 508 9 3 3 2 577 3 2 1 1 614.667561.333538.333 2 565.000574.333575.333 555.000599.000621.000极差59.66737.66782.667 3
根据单因素试验结果,选择表1中的因素和因素水平设计三因素三水平正交试验。根据表2正交试验结果可知,理论上红球菌B7740类胡萝卜素提取的最优条件是:菌粉与溶菌酶比1∶10(mg/mL)、溶菌酶破壁时间80 min、料液比1∶80(mg/mL),即正交试验中的试验3,此条件下类胡萝卜素提取量为675 μg/g。而且对提取量影响从大到小依次是料液比,菌粉与溶菌酶比和破壁时间。二次提取总提取率高于92%。
2.3 色素提取液的色度
表3 不同提取次数下提取液的色度
Table 3 Chrominance of extracts obtained at different extraction cycles
Table 3 Chrominance of extracts obtained at different extraction cycles
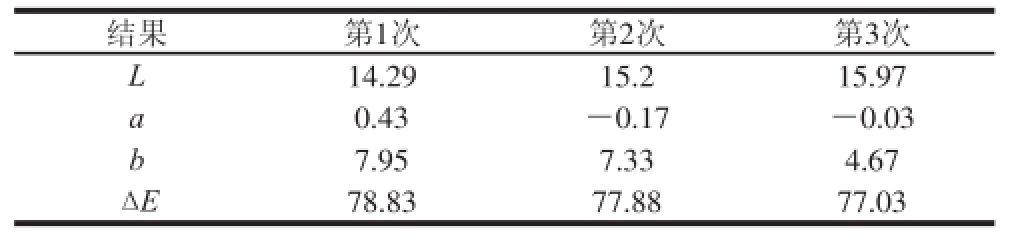
结果第1次第2次第3次L 14.2915.215.97 a 0.43-0.17-0.03 b 7.957.334.67 Δ E78.8377.8877.03
从表3可以看出,随着提取次数的增加,提取液的黄色变浅,这也说明提取出来的类胡萝卜素含量减少。
2.4 高效液相色谱分离色素
如图5所示,使用高效液相色谱和YMCC 30色谱柱能从提取液中分离得到22 种物质,每种物质在450 nm波长左右有3 个吸收峰,确定红球菌B7740产生的色素是类胡萝卜素。

图5 红球菌B7740类胡萝卜素提取液色谱图
Fig.5 HPLC of carotenoids in Rhodococcus sp. B7740
2.5 液相色谱-质谱分析色素
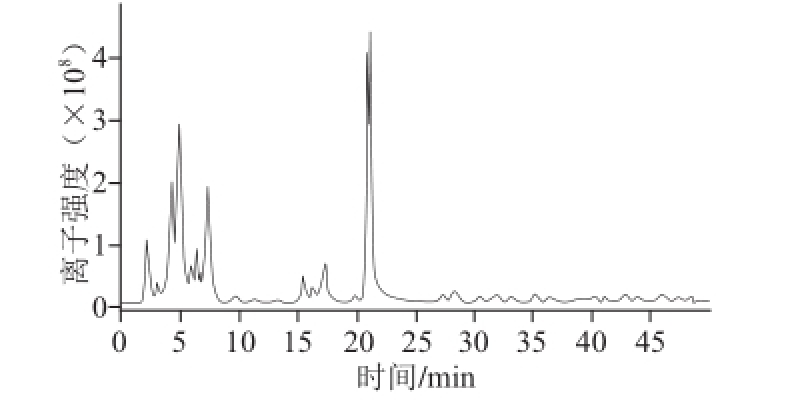
图6 红球菌B7740类胡萝卜素液相色谱-质谱的总离子流图
Fig.6 LC-MS total ion chromatogram of carotenoids from Rhodococcus sp. B7740
从图6可看出,用本实验的液相色谱-质谱条件,分别在15 min和21 min左右有类胡萝卜素被离子化并被检测到,且在21 min处的信号强度大于15 min处。
对图6保留时间15.5 min处峰的分析结果如图7所示。
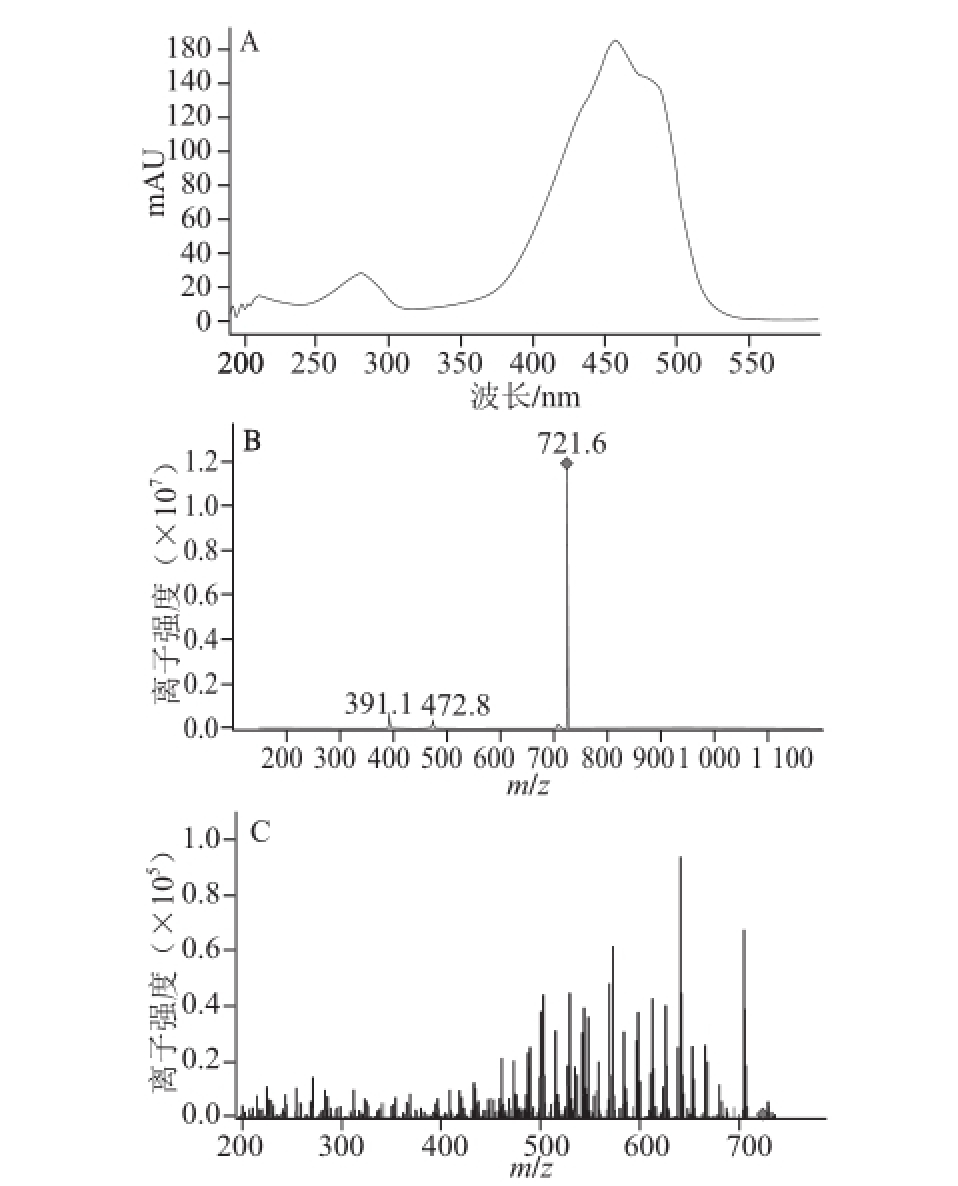
图7 15.5 min处峰的紫外吸收图(A)、一级质谱图谱(B)和二级质谱图谱(C)C
Fig.7 UV-visible absorption spectrum, primary mass spectrum and secondary mass spectrum of peak at 15.5 min
图7A保留时间15.5 min处的紫外吸收图中有2 个最大吸收峰,分别是450 nm和480 nm,另一个肩峰不太明显。图7B峰的一级质谱图谱中721.6是分子的加氢离子峰M+H,物质的相对分子质量是720.6。图7C峰的 二级质谱图谱显示了该分子的链断裂的规律。相应的碎片离子的质量数为703.4、679.5、665.3、639.3、625.4、611.3、597.2、571.2、543.3、529.3、515.8、503.2、461.1、433.3、409.3、369.2、313.0,断裂碎片的m/z分别为18、14、15、26、40、56、82、187,表示它们分别失去了一个H 2O,—CH 2—、—CH 3、—CH=CH—、—C 3H 4—、—C 6H 10、—C 12H 10O 2+H,具有典型的甲基萘醌异戊二烯断裂模式,通过与文献[6]的比对显示,该化合物具有典型的甲基萘醌异戊二烯结构,再与文献[27]比对,推断该化合物为甲基萘醌类类胡萝卜素,其化学分子式是C 51H 76O 2,聚异戊二烯链中的氢饱和度为4,简称MK 8(H 4),化学结构式如图8所示。

图8 2-甲基-3-四氢聚异戊二烯基-1,4--萘醌
Fig.8 Chemical structure of 2-methyl-3-tetrahydropolyisoprene-1,4-napthoquinone
对图6保留时间21.2 min处峰的分析结果如图9所示。

图9 21.2 min处峰的紫外吸收图(A)、一级质谱图谱(B)和二级质谱图谱(C)C
Fig.9 UV-visible absorption spectrum, primary mass spectrum and secondary mass spectrum of peak at 21.2 min
图9A在保留时间21.2 min峰的紫外吸收图中有3 个明显的最大吸收峰,即380、400 nm和430 nm。图9B的一级质谱图谱中719.6是加氢离子峰M+H,物质的相对分子质量是718.6。图9C中的二级质谱图谱显示该分子的链断裂规律与15.5 min处物质的断裂规律相同,这说明2 种物质结构相似且只比15.5 min处物质少2 个氢原子,其聚异戊二烯链中的氢饱和度为2。以上推断得出该物质为甲基萘醌类类胡萝卜素,其化学分子式是C 51H 74O 2,简称MK 8(H 4),化学结构如图10所示。
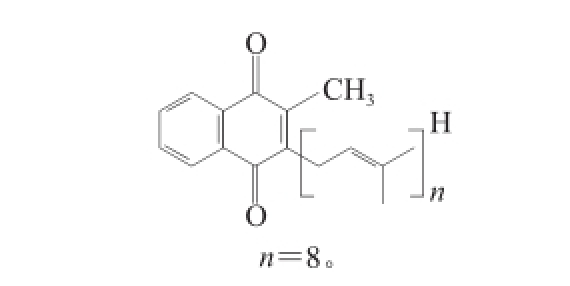
图10 2-甲基-3-二氢聚异戊二烯基-1,4--萘醌
Fig.10 Chemical structure of 2-methyl-3-dihydropolyisoprene-1,4-napthoquinone
在酶法提取的基础上优化提取条件,通过正交试验确定了最佳的色素提取条件为:菌粉与溶菌酶比1∶10(mg/mL)、溶菌酶破壁时间80 min、料液比1∶80(mg/mL)。通过色度测量对最优提取条件下提取液的颜色进行表征。
本实验通过液相色谱-质谱确定了2 种萘醌类类胡萝卜素,相对分子质量分别为718.6和720.6,化学分子式是C 51H 74O 2和C 51H 76O 2。这2 个物质都是类胡萝卜素的衍生物——甲基萘醌类类胡萝卜素,液相色谱-质谱结果中也没有发现β-胡萝卜素和叶黄素等常见类胡萝卜素的存在。这可能说明生长的极端环境使得北极海洋红球菌B7740细胞内产生的色素结构变得复杂,不再是共轭双烯与β-紫罗酮环的简单拼接,而是在类胡萝卜素的基础上衍生化。
参考文献:
[1] 陈伟军, 唐欣晙, 花日茂. 红球菌在环保领域的应用研究进展[J]. 环境科学与技术, 2009, 32(12): 162-164.
[2] 胡晓静. 红平红球菌(Rhodococcus erythropolis) H-412脱硫动力学研究[D]. 天津: 天津大学, 2010.
[3] HIBINO A, OHTAKE H. Use of hydrophobic bacterium Rhodococcus rhodochrous NBRC15564 expressed thermophilic alcohol dehydrogenases as whole-cell catalyst in solvent-free organic media[J]. Process Biochemistry, 2013, 48(5): 838-843. DOI:10.1016/ j.procbio.2013.03.022.
[4] SATOSHI I, KAORU S, MICHIO T. Carotenoid pigments of genus rhodococcus[J]. Microbiology and Immunology, 1989, 33(6): 503-508.
[5] TAO L, CHENG Q. Novel β-carotene ketolases from nonphotosynthetic bacteria for canthaxanthin synthesis[J]. Molecular Genetics and Genomics, 2004, 272: 530-537. DOI:10.1007/s00438-004-1083-8.
[6] 陈梅雪, 王菊思. 细菌细胞中类异戊二烯醌的分析[J]. 环境化学, 1996, 15(5): 467-475.
[7] 王永华, 梁世中. 类胡萝卜素的结构和生理功能研究[J]. 广州食品工业科技, 1999, 16(4): 1-4.
[8] 封琼. Deinococcus radiopugnans类胡萝卜素的提取纯化、特性和生物活性的研究[D]. 杭州: 浙江大学, 2013.
[9] 胡建中. 柑橘中类胡萝卜素的提取、分离、鉴定及其稳定性研究[D].武汉: 华中农业大学, 2006.
[10] 张志军, 江晓路, 牟海津, 等. 蛹虫草类胡萝卜素提取工艺的研究[J].食品科技, 2007, 32(4): 99-103.
[11] 赵功玲, 娄天军. 酶法提取番茄红素的工艺研究[J]. 食品工业科技, 2003, 24(4): 60-61.
[12] 丁靖, 惠柏棣. 食品中类胡萝卜素的HPLC分析[J]. 中国食品添加剂, 2010(4): 256-268.
[13] INBARAJ B S, LU H, HUNG C F, et al. Determination of carotenoids and their esters in fruits of Lycium barbarum Linnaeus by HPLCDAD-APCI-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(4): 812- 818. DOI:10.1016/j.jpba.2008.04.001.
[14] KAO T H, LOH C H, INBARAJ B S, et al. Determination of carotenoids in Taraxacum formosanum by HPLC-DAD-APCI-MS and preparation by column chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66: 144-153. DOI:10.1016/ j.jpba.2012.03.035.
[15] RAO A R, BASKARAN V, SARADA R, et al. In vivo bioavailability and antioxidant activity of carotenoids from microalgal biomass: a repeated dose study[J]. Food Research International, 2013, 54(1): 711-717. DOI:10.1016/j.foodres.2013.07.067.
[16] 孙玉敬, 乔丽萍, 钟烈洲, 等. 类胡萝卜素生物活性的研究进展[J].中国食品学报, 2012, 12(1): 160-164.
[17] 高玉云, 毕英佐, 谢青梅, 等. 类胡萝卜素的吸收代谢及其功能的研究进展[J]. 动物营养学报, 2010, 2(4): 823-829.
[18] 任丹丹, 彭光华, 王海滨, 等. 菹草类胡萝卜素体外抗氧化活性的研究[J]. 食品科学, 2005, 26(3): 228-231. DOI:10.3321/ j.issn:1002-6630.2005.03.059.
[19] 马少君. 柑橘皮类胡萝卜素提取、活性分析和应用研究[D]. 武汉:华中农业大学, 2012.
[20] 姜文侯, 单志萍, 孟妤. 微生物产生的类胡萝卜素及其工业化[J]. 食品与发酵工业, 1998, 25(3): 46-51.
[21] 张加蓉, 杨季芳, 陈福生. 一株分离自北极海水红球菌(Rhodococcus sp.) B7740的生长条件及其粗类胡萝卜素提取方法的优化[J]. 极地研究, 2012, 24(2): 168-176.
[22] KAISER P, GEYER R, SURMANN P, et al. LC-MS method for screening unknown microbial carotenoids and isoprenoid quinones[J]. Journal of Microbiological Methods, 2012, 88(1): 28-34. DOI:10.1016/ j.mimet.2011.10.001.
[23] 王岁楼, 张鑫, 张平之. 红酵母类胡萝卜素提取方法研究[J]. 食品与机械, 2000(6): 30-31.
[24] 黄德见. 一株烈梭隔援孢产黄色素的培养条件优化及黄色索性质研究[D]. 合肥: 安徽农业大学, 2009.
[25] ROJAS-GARBANZO C, PEREZ A M, BUSTOS-CARMONA J, et al. Identification and quantification of carotenoids by HPLC-DAD during the process of peach palm (Bactris gasipaes H.B.K.) flour[J]. Food Research International, 2011, 44: 2377-2384. DOI:10.1016/ j.foodres.2011.02.045.
[26] HSU B Y , PU Y S, INBARAJ B S, et al. An improved high performance liquid chromatography-diode array detectionmass spectrometry method for determination of carotenoids and their precursors phytoene and phytofluene in human serum[J]. Journal of Chromatography B, 2012, 899: 36-45. DOI:10.1016/ j.jchromb.2012.04.034.
[27] PHILIPP K, ROLAND G, PETER S, et al. LC-MS method for screening unknown microbial carotenoids and isoprenoid quinones[J]. Journal of Microbiological Methods, 2012, 88: 28-34. DOI:10.1016/ j.mimet.2011.10.001.
Optimization of Extraction of Carotenoids and Identification of Menaquinone Carotenoids from Rhodococcus sp. B7740
CHEN Yashu
1, WANG Rong
1, XIE Bijun
1, YANG Jifang
2, CHEN Jigang
2, SUN Zhida
1,*
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China; 2. College of Biological and Environmental Science, Zhejiang Wanli University, Ningbo 315100, China)
Abstract:The mild extraction of carotenoids from Rhodococcus sp. using lysozyme, which can break down the bacterial cell wall efficiently and specifically, was achieved. An orthogonal array design was employed to determine the optimal hydrolysis conditions as follows: bacterial cell powder/lysozyme ratio, 1:10 (mg/mL); hydrolysis time, 80 min; and solid/ liquid ratio, 1:80 (mg/mL). The extracted carotenoids were identified by liquid chromatography-mass spectrometry (LC-MS). The samples were separated on a YMCC 30column (4.6 mm × 150 mm, 5 μm) and detected at 450 nm. LC-MS conditions were set as follows: atmospheric-pressure chemical ionization (APCI) source, positive ion mode, ion source temperature of 230 ℃, charging voltage of 2 000 V and scanning range for mass-to-charge ratio of 200–1 200. The results showed that two kinds of carotenoids were identified and their chemical formulas were C 51H 76O 2and C 51H 74O 2, respectively.
Key words:carotenoid; enzymatic extraction method; high-performance liquid chromatography (HPLC); liquid chromatography-mass spectrometry (LC-MS); Rhodococcu sp. B7740
DOI:10.7506/spkx1002-6630-201602005
中图分类号:TS266.25
文献标志码:A
文章编号:1002-6630(2016)02-0025-06
引文格式:
陈亚淑, 汪荣, 谢笔钧, 等. 北极海洋红球菌(Rhodococcus sp.)B7740产类胡萝卜素的提取条件优化及甲基萘醌类类胡萝卜素鉴定[J]. 食品科学, 2016, 37(2): 25-30. DOI:10.7506/spkx1002-6630-201602005. http://www.spkx.net.cn
CHEN Yashu, WANG Rong, XIE Bijun, et al. Extraction of carotenoids and identification of menaquinone carotenoids from Rhodococcus sp. B7740[J]. Food Science, 2016, 37(2): 25-30. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602005. http://www.spkx.net.cn
收稿日期:2015-05-08
基金项目:公益性行业(海洋)科研专项(201405015-5)
作者简介:陈亚淑(1993—),女,硕士研究生,研究方向为天然产物化学。E-mail:489540930@qq.com
*通信作者:孙智达(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:sunzhida@mail.hzau.edu.cn